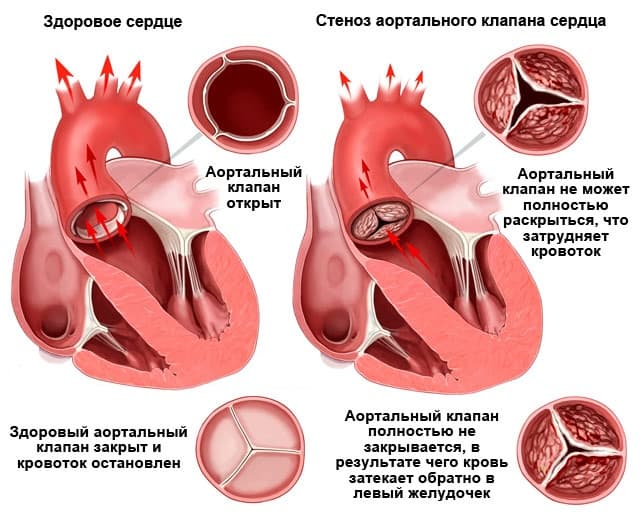
Фиброз стенок аорты и створок аортального клапана что это такое
Недостаточность или фиброз клапанов сердца: причины и помощь больному
Прогноз для больных
Течение болезни и ее влияние на продолжительность жизни зависит от степени стеноза или недостаточности клапанного аппарата. Незначительные изменения имеют благоприятный прогноз, а при тяжелых, сформировавшихся пороках сердца исход болезни зависит от времени проведения и успешности хирургического лечения.
Особенности проявления фиброза сердечных клапанов

Степень регургитации бывает легкой и тяжелой. Клиническая картина будет зависеть от выраженности патологии.
Поражение митрального клапана
Если уплотнены створки митрального клапана, то у больного со временем могут проявиться следующие симптомы фиброза:
Поражение аортального клапана

Классификация фиброза
Каждая форма патологии имеет свои особенности.
Если у митрального клапана створки уплотнены, то вовсе не обязательно, что это порок сердца. Фиброз является лишь патологическим изменением, происходящим под влиянием прочих факторов, а не диагнозом. Из-за него может развиться стеноз и клапанная недостаточность. Появление озвученных патологий требует срочного вмешательства врача. Воспринимать разрастание фиброзных тканей можно в роле субстрата для формирования порока сердечной мышцы. Однако заранее предположить его развитие маловероятно. Повышаются шансы на своевременное выявление проблемы за счет регулярного обследования.
Что это такое?

Под влиянием раздражающих факторов соединительная ткань становится более грубой, из-за чего перестает полноценно выполнять свои функции (сохранять гибкость створок). Со временем значительно сокращается число кровеносных сосудов, питающих клапан. Клетки, из которых он состоит, начинают умирать, замещаясь на фиброзную ткань. Она представляет собой одну из разновидностей соединительных тканей, которой характерна высокая прочность.
Фиброз створок митрального клапана
Фиброз створок митрального клапана сердца – довольно опасное и тяжелое состояние. Причины его возникновения очень разнообразны. Стоит рассмотреть их поподробнее.
Причины
Довольно часто данное заболевание появляется после того, как больной перенес инфаркт миокарда. Распространенной причиной являются и возрастные изменения организма человека. С годами изнашиваются ткани, органы. Ткани сердца, МК могут быть повреждены из-за гормональных изменений, стремительного замедления обмена веществ и т. д.
Фиброз митрального клапана может быть вызван и следующими причинами:
Данное заболевание при отсутствии своевременного вмешательства специалистов может перерасти в фиброз миокарда. Иначе он называется миокардиофиброз.
Аортальный стеноз: лечение, операция, пластика аортального клапана
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Этиология:
Отмечается тенденция к увеличению частоты инволюционных (дегенеративно-атеросклеротических) причин аортального стеноза, что привело к увеличению возрастных пациентов старше 60-65 лет, нуждающихся в хирургической коррекции аортального порока.
При врожденном или ревматическом поражении клапана отмечается длительный латентный период без клинических проявлений. Летальность и риск осложнений существенно увеличиваются с появлением симптомов заболевания. При стенокардии, обмороках и проявлениях сердечной недостаточности, обусловленной систолической дисфункцией левого желудочка средняя продолжительность жизни 5, 3 и 2года соответственно. При бессимптомном течении риск внезапной смерти невелик (даже при тяжелом аортальном стенозе), тогда как при наличии симптомов 15 – 20% больных умирают внезапно.
Скорость прогрессирования поражения аортального клапана:
Мерцательная аритмия, аортальная недостаточность (спонтанная или вызванная инфекционным эндокардитом), митральная недостаточность и острый инфаркт миокарда ускоряют декомпенсацию.
При неосложненном течении аортального стеноза характерная аускультативная картина: систолический шум в точке Боткина и на основании сердца справа, проводится на сосуды шеи, ослабление 2-го тона за счет аортального компонента. Интенсивность систолического шума может уменьшаться при развитии систолической дисфункции левого желудочка и не является критерием тяжести порока. Часто течение аортального стеноза осложняется патологией митрального клапана («митрализация»).
Диагностика аортального стеноза
Средний систолический градиент между аортой и ЛЖ на уровне аортального клапана менее 50 мм рт. ст. – гемодинамически малозначимый аортальный стеноз, 50 – 80 мм рт.ст. – умеренный аортальный стеноз, более 80 мм рт.ст. – резкий аортальный стеноз.
Показания к хирургическому лечению (протезированию) аортального стеноза
(Американская Ассоциация сердца, Американская коллегия кардиологов)
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
КЛАСС I
1. Протезирование аортального клапана показано симптомным пациентам с тяжелым аортальным стенозом (Уровень достоверности: B).
2. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции аорто-коронарного шунтирования (АКШ). (Уровень достоверности: С).
3. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции на аорте или других клапанах сердца. (Уровень достоверности: C).
4. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом и систолической дисфункцией ЛЖ (ФВ менее 50%). (Уровень достоверности: C).
КЛАСС IIА
Протезирование аортального клапана показано пациентам с умеренным аортальным стенозом, при операции АКШ, операции на аорте или других клапанах сердца. (Уровень достоверности: B).
КЛАСС IIБ
1. Протезирование аортального клапана показано асимптомным пациентам с тяжелым аортальным стенозом и патологическим ответом на нагрузку (например, развитие симптомов гипотензии). (Уровень достоверности: C).
2. Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).
4. Протезирование аортального клапана показано асимптомным пациентам с крайне тяжелым аортальным стенозом (площадь аортального клапана менее 0.6 cм2, средний градиент более 60 мм рт.ст. и скорость потока более 5.0 м/с), когда ожидаемая операционная летальность пациентов составляет менее 1.0%. (Уровень достоверности: C).
КЛАСС III
1. Протезирование аортального клапана не показано для предупреждения внезапной смерти у асимптомных пациентов с аортальным стенозом у кого нет ни одного показателя из списка рекомендаций Классов IIА/IIБ. (Уровень достоверности: B).
2. У возрастных пациентов с тяжелым, симптомным, кальцинированным аортальным стенозом протезирование аортального клапана является единственным эффективным методом лечения.
3. Молодые пациенты с врожденным или ревматическим аортальным стенозом могут быть кандидатами на вальвулотомию. Хотя нет единого мнения относительно оптимального срока проведения операции у асимптомных пациентов, для большинства пациентов можно разработать рациональные рекомендации.
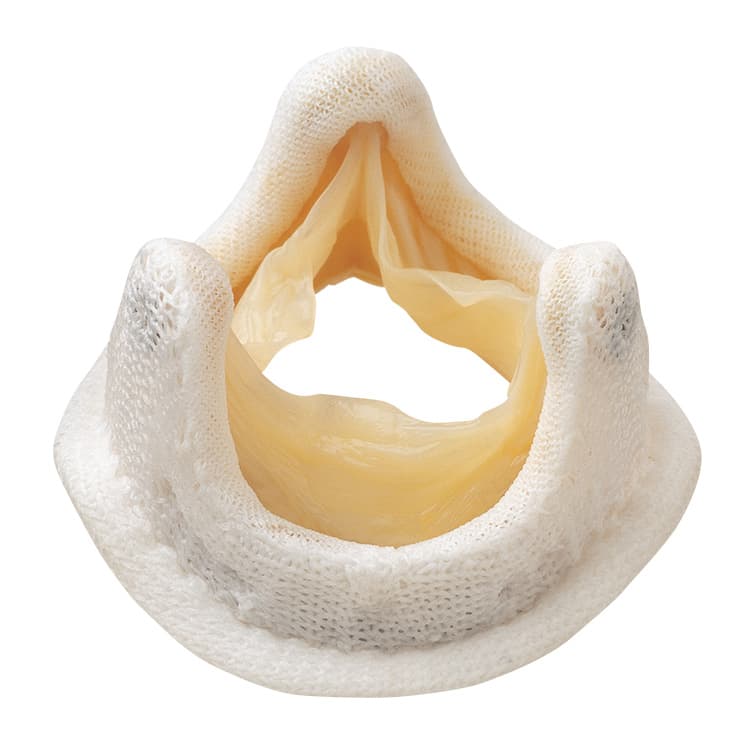
Протезирование аортального клапана
За последние годы в хирургическом лечении клапанов сердца наблюдался значительный прогресс. Усовершенствование техники (в т.ч. аппаратов искусственного кровообращения), разработка единых стандартов и протоколов как предоперационного обследования, так и хода операции позволили снизить риски периоперационных осложнений, сделав саму операцию на клапанном аппарате сердца более безопасной, чем отказ от операции и попытка жить с дисфункцией клапана.
Виды хирургического лечения: операции по замене клапана сердца
Принципиально существует два вида операции на клапанах сердца: протезирование искусственным или биологическим протезом и пластика собственного клапана. Вполне естественно, что собственный клапан человека после удачной реконструкции функционирует лучше, чем искусственный протез. Но в случае невозможности сохранения собственного клапана единственный выход – замена его на протез.
Виды клапанов, используемых при протезировании
При протезировании аортального клапана доступ к клапану осуществляется посредством рассечения аорты в восходящем отделе (поперечная аортотомия). После иссечения створок аортального клапана и тщательной декальцинации фиброзного кольца последнее прошивается П-образными швами. С целью предотвращения прорезывания фиброзного кольца швы укрепляют тефлоновыми прокладками. Для выбора размера имплантируемого протеза диаметр фиброзного кольца измеряют специальными калибраторами. Выбранный протез имплантируют в аортальную позицию путем прошивания его оплетки. После фиксации протеза оценивают подвижность запирательных элементов механического протеза или коаптацию створок биологического клапана. При отсутствии ограничений их подвижности рассеченную аорту герметизируют двумя рядами швов.
Фиброз стенок аорты и створок аортального клапана что это такое
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России, 440071, Пенза, Россия
ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН, Москва
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Анатомические особенности корня аорты с хирургических позиций
Журнал: Кардиология и сердечно-сосудистая хирургия. 2012;5(3): 4-8
Белов Ю. В., Комаров Р. Н., Россейкин Е. В., Винокуров И. А., Степаненко А. Б. Анатомические особенности корня аорты с хирургических позиций. Кардиология и сердечно-сосудистая хирургия. 2012;5(3):4-8.
Belov Iu V, Komarov R N, Rosseikin E V, Vinokurov I A, Stepanenko A B. Anatomic features of aortic root from surgical point of view. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2012;5(3):4-8.
РНЦХ им. акад. Б.В. Петровского РАМН
РНЦХ им. акад. Б.В. Петровского РАМН
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России, 440071, Пенза, Россия
ФГБУ «Российский научный центр хирургии им. акад. Б.В. Петровского» РАМН, Москва
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Проблема хирургического лечения заболеваний корня аорты (КА) изучается в нашей стране уже давно. Несмотря на то что более 40 лет назад акад. Е.Н. Мешалкин выполнил первую в России открытую аортальную комиссуротомию, она не перестает быть актуальной [3].
В литературе трудно найти полноценное описание анатомии КА, рассмотренной с точки зрения практикующего хирурга.
Цель настоящей работы — обобщение знаний в этой области с практическими советами и рекомендациями для хирургов.
Фиброзный каркас сердца
Фиброзные кольца митрального (МК) и аортального клапанов (АК) тесно связаны с фиброзным каркасом КА через мембранозную часть межжелудочковой перегородки (МЖП), формируя единый фиброзный каркас сердца. Если смотреть на плоскости, то получается, что трикуспидальный клапан (ТК) смещен немного к верхушке относительно МК, а АК вместе с окружающими его структурами как бы вклинен между ними, находясь в центре сердца (см. рис. 1 на цв. вклейке). 
КА прилегает непосредственно к стенке правого предсердия, на малом промежутке соприкасается с МЖП и «упирается» в правый желудочек (ПЖ). Выпуклость в МЖП, которая образуется за счет упора в нее КА, формирует передневерхнюю стенку ЛЖ (рис. 2, а на цветной вклейке). 
Корень аорты и створки аортального клапана
КА представляет собой выходной тракт ЛЖ, состоящий из поддерживающих структур для фиксации створок клапана и являющийся мостом между ЛЖ и аортой. Впервые термин «корень артерии» был использован Henle, вытеснив предыдущий термин «аортальное кольцо» [45]. Причиной тому послужило различие между функциональной и анатомической структурой КА.
При изучении КА как запирающего элемента выходного тракта ЛЖ были сделаны выводы о необходимости исследования этой структуры как единого анатомо-функционального комплекса [2, 4, 9, 16].
Для лучшего понимания этой структуры необходимо обозначить нижнюю и верхнюю границы КА, которые соответствуют области фиксации створок клапана и синотубулярному переходу. КА, таким образом, для простоты представляется как цилиндр, стенки которого сформированы синусами Вальсальвы [29] (см. рис. 2, б; 3 на цв. вклейке). 
До сих пор не существует единого мнения о том, как лучше всего рассматривать структуры КА [12], а еще больший вопрос вызывает наличие так называемого annulus, который трактуется по-разному [32, 42].
W. McAlpine [28] в 1975 г. высказал следующее мнение: «Annulus с латыни переводится как кольцо, т.е. окружность. В данном случае это слово может быть обращено только к фиброзному основанию АК и к клапану легочного ствола, которые в действительности составляют только сегмент, не круг, а овал. Термин «annulus» используется для определения четырех фиброзных структур, которые соединены четырьмя клапанами сердца».
Другой автор [16], изучая макро- и микропрепараты КА, описывает annulus как «границу между верхней и средней третью корня аорты» [16]. В то же время большинство хирургов считают, что annulus’ом следует называть фиброзные структуры, остающиеся после удаления створок АК [32, 46]. Еще одно мнение строится на выделении «виртуального» кольца, окружность которого образуется путем соединения самых проксимальных точек каждой створки [43] (см. рис. 3 на цв. вклейке). Таким образом, следует не пытаться выделить какой-то один «annulus», а использовать все предложенные «кольца» для установления более точного пространственного восприятия КА как цельной структуры сердца.
Для понимания функции КА необходимо разделять два функционально-анатомических перехода: первый — между ЛЖ и КА, второй — между КА и аортой соответственно.
Желудочко-аортальное соединение локализуется в области перехода мышечных структур желудочка в фиброзно-эластическую ткань КА. Однако этот переход не является кольцом, он имеет волнообразную форму, которая обусловлена способом крепления створок АК в этой области (см. рис. 4 на цв. вклейке). 
Область между креплением двух рядом лежащих створок, ограниченная снизу «виртуальным» кольцом, образует треугольники, которые называются треугольниками Генле (см. рис. 4 на цв. вклейке) [9]. Они являются фиброзно-мышечными компонентами КА, обеспечивающими единую геометрию структуры, и позволяют синусам Вальсальвы функционировать относительно независимо друг от друга [41].
Синотубулярное соединение — самая дистальная зона КА (см. рис. 2, б; 3 на цв. вклейке). Створки АК на этом уровне соединяются с целостной составляющей КА. Какое-либо расширение на этом уровне приводит к развитию недостаточности АК, а стеноз данной зоны называется надаортальным [40]. С анатомической точки зрения, синотубулярное соединение — выходное отверстие из КА.
Учитывая, что КА по форме напоминает не цилиндр, а луковицу, и то, что линия прикрепления створок не идет по геометрическому кольцу, а имеет коронообразную форму, при имплантации в позицию АК механического клапана его фиксируют к фиброзному кольцу, что закономерно ведет к деформации естественной формы КА, опосредованно влияя на биомеханику. При имплантации же бескаркасных графтов часть стежков прошивают за фиброзное кольцо, а часть фиксируют за миокард в области желудочко-аортального соединения, чтобы не деформировать биопротез, не имеющий жесткого каркаса [8].
В узком смысле под АК иногда понимают структуры фиброзного каркаса КА с включенными в него запирательными элементами — створками [37]. Створки АК состоят из тела (основной нагружаемой части), поверхности коаптации (смыкания) и основания [18]. Каждая створка имеет несколько складывающихся поверхностей, которые обращены к аорте, и гладкую поверхность, обращенную к желудочку. Утолщение треугольной формы в центральной части зоны коаптации носит название узелка Аранци.
Створки разделяют КА на под- и надклапанные компоненты КА. Подклапанные элементы по своей морфологической структуре схожи с желудочком, а надклапанные — с аортой. Стоит отметить, что сходство является переходным, т.е. гистологически отмечены только доминирующие морфологические структуры, но в каждой из этих областей имеются и противоположные структуры.
Створки АК являются запирающим элементом, который препятствует движению крови в обратном направлении. Морфологически они состоят из плотных пучков коллагена, что позволяет обеспечивать их функциональные свойства. Между желудочковой и аортальной поверхностью створок АК выделяют 5 слоев: желудочковый, радиальный губчатый, фиброзный и артериальный [24]. Артериальный слой содержит в большинстве случаев коллагеновые волокна, ориентированные в окружном направлении в виде пучков, тяжей и небольшого количества эластических волокон [35, 36], что позволяет створкам сжиматься во время уменьшения нагрузки [17]. В зоне коаптации коллагеновые волокна располагаются под углом 125° относительно стенки аорты [43], в теле — под углом 45° от фиброзного кольца. Такая ориентация пучков необходима для перераспределения нагрузки давлением во время диастолы со створок на синусы и фиброзный каркас [30].
В расслабленном состоянии структура створок находится в состоянии сокращения, а во время нагрузки происходит их распрямление. При достижении максимального выпрямления растяжимость створок сводится к нулю. Возможность растягиваться проявляется при минимальных нагрузках тока крови на створку [36].
Синусы Вальсальвы
Синусы Вальсальвы — расширенные участоки КА, ограниченные створками и синотубулярным соединением [33]. На уровне основания они разделены между собой треугольниками Генле. Основная их роль — перераспределение напряжения крови во время диастолы и установление равновесного положения створок в систолу [14].
Синусы Вальсальвы служат переходным звеном между желудочком и аортой, в результате чего в своей гистологической структуре несут оба начала. Мышечные элементы ЛЖ создают лишь опору основанию КА, в основном на уровне правого коронарного синуса.
Синусы Вальсальвы состоят только из интимы и медии в проксимальном отделе, на уровне синотубулярного соединения добавляется адвентиция. Внутренний слой синусов покрыт, как и сосуды, эндотелием. Средний слой имеет циркулярные соединительнотканные структуры (коллаген, эластин), а также гладкие мышечные клетки. Адвентиция состоит преимущественно из коллагена I типа [36].
В общей структуре стоит отметить, что медия синусов Вальсальвы утолщена за счет увеличения количества коллагеновых волокон. В то же время по направлению от желудочка к аорте отмечается увеличение количества эластических волокон и уменьшение коллагеновых. Такое изменение приводит к увеличению функциональных возможностей, так как коллаген «отвечает» за прочность и жесткость структуры, а эластин — за возможность растягиваться и «гасить» избыточное напряжение аорты во время систолы.
Существует три функционально идентичных синуса, при этом с анатомической точки зрения имеются их различия. От двух из них отходят коронарные артерии, по-этому они носят название левого и правого коронарных синусов, третий же принято называть некоронарным
(см. рис. 5 на цв. вклейке). 
Как отмечалось ранее, КА находится в центре сердца и связан со всеми его структурами (рис. 6). 
Треугольник, образованный левым коронарным и некоронарным синусами, является частью обширного участка на пути соединения АК и МК. При его удалении образуется окно, соединенное с поперечным синусом, который находится между задней поверхностью КА и передней стенкой левого предсердия [42]. Треугольник, образованный правым коронарным и некоронарным синусами, тесно связан с мембранозной частью МЖП. Его удаление создает окно между выходом из ЛЖ и правой стороной поперечного синуса. Третий треугольник, который разделяет два коронарных синуса, является наименее протяженным из трех. Чтобы обозначить место выхода при удалении этого треугольника, необходимо резецировать свободно стоящую мышечную часть выходного тракта ПЖ. При этом образуется «окно» между субаортальным участком выходного тракта ЛЖ и уровнем тканей, которые отделяют КА от легочной артерии.
Треугольники Генле являются фиброзными или фиброзно-мышечными компонентами КА и расположены между смежными сегментами фиброзного кольца и двумя створками АК [9]. Коллагеновые волокна располагаются в наружном слое этих структур, что обеспечивает поддерживающие свойства клапанного аппарата КА [7, 43].
Треугольник между левым коронарным и некоронарным синусами формирует часть аортомитральной занавески, которая гистологически представлена соединительной тканью и эквивалентна створкам МК. Треугольник между некоронарным и правым коронарными синусами соединяется с мембранозной частью МЖП, которая также состоит из соединительной ткани. Напротив, межкоронарный треугольник поддерживается как соединительной, так и мышечной тканью [10, 46]. Последние исследования показывают, что треугольники Генле обладают сложным цитоскелетом и имеют возможность сокращения за счет наличия вементина, десмина и гладких цепей α-миозина в своей структуре. Это способствует уменьшению нагрузки на КА и перераспределению ее на большую часть структур сердца [20].
Необходимо четко представлять пространственные взаимоотношения структур сердца с КА для понимая сути методик расширения «узкого» корня аорты (см. рис. 6). Фиброзное кольцо АК считается «узким» в случае, если его диаметр менее 21 мм, а площадь поверхности тела пациента более 1,7 м 2 [1, 27].
Наиболее часто применяемая методика расширения КА по Niсks (полезный периметр кольца АК увеличивается на 4,0—4,5 мм), предусматривающая рассечение КА через середину некоронарной створки до основания передней створки МК. Методика Manouguian предусматривает трансаннулярное рассечение через латеральную комиссуру и зону митрально-аортального контакта с переходом на начальную порцию передней створки МК, с возможным вскрытием крыши левого предсердия (метод позволяет расширить корень аорты на 7—8 мм). Наиболее агрессивная методика расширения КА — аортовентрикулопластика по Konno, т.е. продольное трансаннулярное рассечение КА и МЖП через выходной отдел ПЖ, что позволяет увеличить размер фиброзного кольца АК на 40—50% и имплантировать всем пациентам протезы более 21 мм [3].
Большое значение для хирургической практики имеет непрерывность митрально-аортального контакта. При декальцинации АК и передней створки МК может легко произойти перфорация последней. В данном случае можно ушить дефект передней створки МК нитью пролен 5/0.
К зоне митрально-аортального контакта прилежит участок мембранозной перегородки, фактически отделяющий на небольшом протяжении выходной тракт ЛЖ от полости правого предсердия и ПЖ. При наличии высоких перимембранозных дефектов МЖП небольшого диаметра они могут быть ушиты из трансаортального доступа несколькими П-образными швами на прокладках с выколом на фиброзное кольцо АК выше створок. Аналогично близость АК необходимо учитывать при операциях на МК. Так, при наложении швов на фиброзное кольцо МК в зоне его переднелатеральной комиссуры необходимо проявлять осторожность, чтобы не захватить в шов некоронарную створку АК, что приведет к ятрогенной аортальной недостаточности [8]. При значимой дилатации фиброзного кольца АК возможно протезирование МК трансаортальным доступом.
Взаимоотношение с проводящей системой сердца
Необходимо четко представлять взаимоотношение структур КА с проводящей системой сердца, потому что прошивание тканей в зоне прохождения пучка Гиса неминуемо приведет к нарушению ритма сердца.
Атриовентрикулярный узел расположен в стенке правого предсердия, немного дистальнее КА. Далее пучок Гиса идет к центральному фиброзному телу, располагающемуся на уровне треугольника, образованного правым коронарным и некоронарным синусами (см. рис. 5 на цв. вклейке) и формирующимся из соединения указанного треугольника с мембранозной частью МЖП. Дойдя до центрального фиброзного тела, пучок Гиса прободает его, в результате чего происходит изоляция проводящей системы. Находясь на передней поверхности гребня мышечной перегородки, пучок Гиса отдает ножки: левая веером раскидывается на стенке ЛЖ, в то время как правая проникает через мышечную перегородку и выходит на поверхности медиальнее папиллярных мышц.
При наложении швов на фиброзное кольцо, особенно после его декальцинации, с одной стороны, для надежности фиксации необходимо захватить в шов побольше тканей, а с другой стороны, возрастает риск травмы проводящих путей. Таким образом, становится понятной нецелесообразность наложения глубоких швов в зоне между правым коронарным и некоронарным синусами, а также грубой декальцинации в данной зоне. Подобные манипуляции могут привести к нарушению проводимости вплоть до полной поперечной блокады в послеоперационном периоде. В ряде ситуаций в зоне некоронарного синуса для надежной опоры протеза можно выводить фиксирующие клапан швы на наружную стенку аорты.
Двустворчатый клапан аорты
Распространенность двустворчатого АК в популяции составляет 1—2,5% [21]. Морфология створок АК может значительно разниться, они могут быть как одинаковыми, так и различаться [11].
В ряде случаев при формировании трех створок АК створки срастаются в эмбриогенезе и АК принимает вид двустворчатого. При этом чаще всего в ходе ревизии констатируют наличие трех нормально расположенных синусов Вальсальвы при наличии двух створок АК.
Формирование треугольников Генле также зависит от структуры створок и количества синусов Вальсальвы. При формировании двух створок АК высота треугольников Генле меньше, чем при ТК. Данное обстоятельство уменьшает подвижность створок [40]. Створки при аномалии называются передними и задними или левыми и правыми (в соответствии с их расположением). Переднезадние встречаются в 79% случаев, а коронарные артерии в таком случае отходят от одного (переднего) синуса [19]. При лево-правом расположении створок коронарные артерии отходят от обоих синусов.
В большинстве случаев двустворчатый АК не имеет специфических симптомов для человека, но по сравнению с нормальным трехстворчатым клапаном он чаще кальцинируется и приводит к формированию аневризм восходящей аорты [31].
По данным литературы можно констатировать, что двустворчатый АК служит одной из причин формирования аневризм и расслоений восходящей аорты. Остается нерешенным вопрос тактики хирурга при обнаружении двустворчатого АК интраоперационно, во время вмешательства по поводу аневризмы восходящей аорты. Если двустворчатый АК состоятелен и возраст больного на момент хирургического вмешательства старше 60 лет, логично сохранить нативный клапан, так как срок его службы будет больше ожидаемой продолжительности жизни пациента. Для пациентов моложе 50 лет вопрос о целесообразности сохранения двустворчатого АК либо его реимплантации в протез КА в настоящее время открыт.
Таким образом, КА является как бы центром сердца, находясь в тесной взаимосвязи с его структурами. Для планирования тактики операции и профилактики интраоперационных осложнений хирургу необходимо четко представлять особенности анатомии и синтопии КА. Дальнейшие наши исследования будут направлены на изучение анатомии КА в анатомическом театре с целью оптимизации хирургических технологий, используемых при патологии данной зоны.