Удельная теплота парообразования в чем измеряется в физике
Удельная теплота испарения и конденсации. Физические величины
Содержание:
Для поддержания кипения жидкости её необходимо нагревать – подводить тепловую энергию от огня или нагревательного прибора. Температура вещества и сосуда при этом не повышаются, вместо этого жидкость превращается в пар – переходит в газообразное состояние. (можно ссылку на агрегатные состояния вещества) Удельная теплота испарения – количество передаваемой системе энергии, необходимо для поддержания процесса. Зависит от жидкости, внешних условий, при которых она кипит, в первую очередь, давления.
Удельная теплоемкость парообразования
Величина показывает, сколько тепла необходимо жидкости для её преобразования в газообразное состояние. Измеряется в джоулях на килограмм вещества – Дж/кг.
По закону сохранения энергии, получается, что во время конденсации паров выделяется потраченное на испарение вещества количество энергии. Для подтверждения проводится опыт. В стакан с водой опускается трубка, соединённая со вторым сосудом, где подогревается вода. Пока по трубке в стакан поступает подогретый воздух, показатели термометра практически не изменяются.
Когда вследствие нагрева испаряется вода, пар попадает в трубку, где конденсируется с выделением теплоты, ведь показатели термометра растут. Получается, вода из пара превращается в жидкое состояние с выделением тепловой энергии.
Количество выделяемого тепла равняется внутренней энергии тела: Q = ΔU. Энергия колебания молекул пропорциональна температуре. Величина изменения энергии тела или жидкости равняется сумме изменению теплоты каждой молекулы или атома вещества. Отсюда удельную теплоту парообразования находят по выражению:
c = Q / mΔT, измеряется в Дж / кг*К. Показывает, сколько теплоты нужно для нагревания 1 кг вещества на 1 К.
Удельная теплота испарения указывается для жидкости при её постоянном объёме, ведь зависит от условий теплопередачи – работы, сопровождающей процесс испарения. Одинаковая энергия, переданная системе, по-разному изменит его внутреннюю энергию и, соответственно, температуру.
Обозначение удельной теплоты парообразования осуществляется буквой L. По значению величина прямо пропорциональна потраченной на трансформацию – изменение состояния вещества – энергии и обратно пропорциональна его массе:
В физике измеряется в Дж/кг, в химии сводится к количеству вещества – моль/кг.
Для закипающей при температуре 100 °C воды удельная теплота парообразования равняется 2260 Дж/кг.
Задача
1005 Дж тепловой энергии. Какое вещество нагревалось в колбе?
Теплота парообразования вычисляется по формуле: L= Q / m. Подставляем значения в готовую пропорцию и проводим вычисления.
L = 1005 / 1,2 = 837,5 Дж/кг. Воспользуемся таблицей удельной теплоты парообразования.
| Вещество | Температура кипения, С 0 | Удельная теплота парообразования/конденсации, кДж/кг |
| Вода | 100 | 2260 |
| Водород | -252,6 | 448 |
| Азот | -195,8 | 199 |
| Аммиак | -33,4 | 1370 |
| Диэтиловый спирт | 34,6 | 380 |
| Этиловый спирт | 78,4 | 837 |
| Ртуть | 357 | 282 |
В ней полученному значению соответствует этиловый спирт.
Удельная теплота парообразования и конденсации
Содержание
Твердые кристаллические вещества переходят в жидкое состояние посредством плавления. Чтобы расплавить вещество, необходимо сообщить ему некоторое количество теплоты. И, наоборот, при кристаллизации (переходе жидкости в твердое состояние) энергия выделяется в окружающую среду.
Проведем аналогию с переходом жидкости в пар. Этот переход может быть осуществлен двумя способами: испарением или кипением. Кипение является тем же испарением, но более интенсивным. Очевидно, что для того, чтобы происходил процесс кипения, жидкости необходимо сообщать какое-то количество теплоты. Это количество теплоты будет идти на образование пара.
В данном уроке мы познакомимся с новым определением – удельной теплотой парообразования и конденсации. Вы узнаете формулу для расчета количества теплоты, необходимого для парообразования жидкости и научитесь ею пользоваться.
Удельная теплота парообразования
Вы уже знаете, что кипение происходит при определенной для каждой жидкости температуре. Количество теплоты, которое потребуется сообщить этим жидкостям одинаковой массы для превращения их в пар тоже будет различно.
Удельная теплота парообразования некоторых жидкостей
В таблице 1 приведены экспериментально полученные величины удельной теплоты парообразования некоторых жидкостей.
| Вещество | $L, \frac<Дж><кг>$ |
| Вода | $2.3 \cdot 10^6$ |
| Аммиак (жидкий) | $1.4 \cdot 10^6$ |
| Спирт | $0.9 \cdot 10^6$ |
| Эфир | $0.4 \cdot 10^6$ |
| Ртуть | $0.3 \cdot 10^6$ |
| Воздух (жидкий) | $0.2 \cdot 10^6$ |
Таблица 1. Удельная теплота парообразования некоторых веществ (при температуре кипения и нормальном атмосферном давлении)
Обратите внимание, что удельная теплота парообразования показывает количество теплоты, необходимое для превращения жидкости, взятой при ее температуре кипения, в пар.
Удельная теплота конденсации
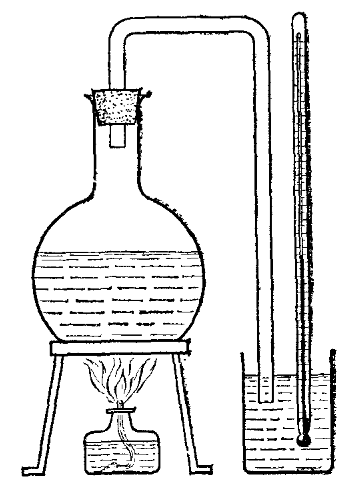
Нужно ли сообщать пару энергию при его конденсации? Давайте рассмотрим простой опыт (рисунок 1).
Нальем в сосуд воду и закроем его пробкой. Через пробку проведем трубку и направим ее на кусочек охлажденного стекла. Доведем воду до кипения с помощью горелки.
Пар, поднимающийся над кипящей водой, будет конденсироваться, соприкасаясь с холодным стеклом. Если мы дотронемся до стекла, то обнаружим, что оно очень сильно нагрелось.
Так энергия пара передается стеклу. В результате этой потери энергии пар конденсируется. Если бы температура стекла была равна температуре пара, то теплопередача бы не происходила, и конденсат не образовывался бы.
Это говорит о том, что при конденсации пар отдает, выделяет энергию.
Более точные опыты также показывают, что
Конденсируясь, пар отдает то количество энергии, которое пошло на его образование.
Это довольно большая энергия, поэтому человечество стремится ее использовать. Например, на крупных тепловых электростанциях паром, который уже прошел через турбины, нагревают воду. Ее, в свою очередь, используют для отопления зданий и бытовых нужд.
Расчет количества теплоты, необходимого для парообразования
Из этой формулы при расчетах мы можем выражать массу ($m = \frac
Примеры задач
Дано:
$m = 2 \space кг$
$t_1 = 20 \degree C$
$t_2 = 100 \degree C$
$c = 4200 \frac<Дж><кг \cdot \degree C>$
$L = 2.3 \cdot 10^6 \frac<Дж><кг>$
Показать решение и ответ
Решение:
$Q_1 = 4200 \frac<Дж> <кг \cdot \degree C>\cdot 2 \space кг \cdot (100 \degree C – 20 \degree C) = 8400 \frac<Дж> <\degree C>\cdot 80 \degree C = 672 \space 000 \space Дж \approx 0.7 \cdot 10^6 \space Дж$.
$Q_2 = 2.3 \cdot 10^6 \frac<Дж> <кг>\cdot 2 \space кг = 4.6 \cdot 10^6 \space Дж$.
Рассчитаем общее количество энергии, которое нам потребуется:
$Q = Q_1 + Q_2 = 0.7 \cdot 10^6 \space Дж + 4.6 \cdot 10^6 \space Дж = 5.3 \cdot 10^6 \space Дж$.
Дано:
$m = 2 \space кг$
$t_1 = 100 \degree C$
$t_2 = 0 \degree C$
$c = 4200 \frac<Дж><кг \cdot \degree C>$
$L = 2.3 \cdot 10^6 \frac<Дж><кг>$
Решение:
$Q_1 = Lm$.
$Q_1 = 2.3 \cdot 10^6 \frac<Дж> <кг>\cdot 2 \space кг = 4.6 \cdot 10^6 \space Дж$.
$Q_2 = cm (t_1 – t_2)$.
$Q_2 = 4200 \frac<Дж> <кг \cdot \degree C>\cdot 2 \space кг \cdot (100 \degree C – 0 \degree C) = 8400 \frac<Дж> <\degree C>\cdot 100 \degree C = 840 \space 000 \space Дж \approx 0.8 \cdot 10^6 \space Дж$.
$Q = 4.6 \cdot 10^6 \space Дж + 0.8 \cdot 10^6 \space Дж= 5.4 \cdot 10^6 \space Дж$.
Дано:
$V = 0.5 \space л$
$\rho = 1000 \frac<кг><м^3>$
$L = 2.3 \cdot 10^6 \frac<Дж><кг>$
СИ:
$0.5 \cdot 10^ <-3>\space м^3$
Посмотреть решение и ответ
Решение:
Массу мы можем выразить через плотность и объем:
$m = \rho V$.
Тогда наша формула примет вид:
$Q = L\rho V$.
$Q = 2.3 \cdot 10^6 \frac<Дж> <кг>\cdot 1000\frac<кг> <м^3>\cdot 0.5 \cdot 10^ <-3>\space м^3 = 2.3 \cdot 10^6 \frac<Дж> <кг>\cdot 0.5 \space кг = 1.15 \cdot 10^6 \space Дж$.
Удельная теплота парообразования – формула и таблица единиц
Если жидкость разогреть до температуры кипения, то начнется процесс парообразования. Молекулы жидкости, получив дополнительную энергию, отрываются от поверхности и переходят в газообразное состояние. Это явление называется парообразованием. Обратный процесс, когда молекулы пара, потеряют излишки энергии и снова перейдут в жидкое состояние, называется конденсацией.
Удельная теплота парообразования
Удельной теплотой парообразования называется физическая величина равная количеству тепла, которое необходимо потратить, чтобы превратить жидкость массой 1 кг в пар. Обозначают эту единицу латинской буквой L. Формула удельной теплоты парообразования выглядит так:
Q — количество тепла израсходованное на преобразование жидкости в пар, Дж;
m — масса жидкости, кг.
Значения L для разных веществ определяют экспериментально.
Зная L, можно вычислить количество тепла Q, которое необходимо сообщить телу массой m для его полного преобразования в пар:
Рис. 1. Переход жидкого состояния вещества в пар.
В каких единицах измеряется удельная теплота парообразования
Удельная теплота парообразования в СИ (Международная система ) измеряется в джоулях на килограмм, Дж/кг. Для некоторых задач применяется внесистемная единица измерения – килокалория на килограмм, ккал/кг. Напомним, что 1 ккал = 4,1868 Дж.
После достижения точки кипения (температуры кипения) температура не возрастает, хотя тепло непрерывно поступает. Это объясняется тем, что после закипания почти все тепло идет на создание пара — разрыв молекулярных связей и отрыв от поверхности жидкости.
Рис. 2. График зависимости температуры от времени нагрева
Удельная теплота парообразования некоторых веществ
Информацию о значениях удельной теплоты парообразования для конкретного вещества можно найти в технических справочниках или в их электронных версиях на интернет-ресурсах. Обычно они приводятся в виде такой таблицы “Удельная теплота парообразования, L”
Удельная теплота парообразования

Всего получено оценок: 120.
Всего получено оценок: 120.
Если жидкость разогреть до температуры кипения, то начнется процесс парообразования. Молекулы жидкости, получив дополнительную энергию, отрываются от поверхности и переходят в газообразное состояние. Это явление называется парообразованием. Обратный процесс, когда молекулы пара, потеряют излишки энергии и снова перейдут в жидкое состояние, называется конденсацией.
Удельная теплота парообразования
Удельной теплотой парообразования называется физическая величина равная количеству тепла, которое необходимо потратить, чтобы превратить жидкость массой 1 кг в пар. Обозначают эту единицу латинской буквой L. Формула удельной теплоты парообразования выглядит так:
Q — количество тепла израсходованное на преобразование жидкости в пар, Дж;
m — масса жидкости, кг.
Значения L для разных веществ определяют экспериментально.
Зная L, можно вычислить количество тепла Q, которое необходимо сообщить телу массой m для его полного преобразования в пар:
В каких единицах измеряется удельная теплота парообразования
Удельная теплота парообразования в СИ (Международная система ) измеряется в джоулях на килограмм, Дж/кг. Для некоторых задач применяется внесистемная единица измерения – килокалория на килограмм, ккал/кг. Напомним, что 1 ккал = 4,1868 Дж.
После достижения точки кипения (температуры кипения) температура не возрастает, хотя тепло непрерывно поступает. Это объясняется тем, что после закипания почти все тепло идет на создание пара — разрыв молекулярных связей и отрыв от поверхности жидкости.
Удельная теплота парообразования некоторых веществ
Информацию о значениях удельной теплоты парообразования для конкретного вещества можно найти в технических справочниках или в их электронных версиях на интернет-ресурсах. Обычно они приводятся в виде такой таблицы “Удельная теплота парообразования, L”
Удельная теплота парообразования — определение, формулы и способы применения
УТП — численная величина, характеризующая кипение и конденсацию. Она напрямую связана с зависимостью температуры кипения от давления. Необходимо полностью разобраться в особенностях протекания процесса выделения пара, чтобы понять, какой физический смысл имеет удельная теплота парообразования.
Процесс кипения
Кипение — одна из основных разновидностей интенсивного парообразования, происходящего при повышении температуры жидкости. Нагревание происходит не только на поверхности жидкостного вещества, но и внутри него. Выделившаяся теплота распределяется неравномерно:
В результате внутренняя энергия газообразного вещества становится намного больше внутренней энергии жидкости.
Сам процесс кипения представляет собой процедуру перехода жидкостного вещества в пар. Для наглядного описания нагревания вещества и его перехода из первого агрегатного состояния в другое используются графики функций. В течение перехода происходит испарение с преобразованием воздушных пузырьков. Размеры пузырьков определяются их собственной формой и местоположением. Если они образовались на дне сосуда, то их величина и единицы определяются смачиваемостью стенок этой ёмкости. Чем более неоднородна поверхность сосуда, тем больше размер пузырьков воздуха.
При превышении допустимых размеров пузырек начинается лопаться. Во время этого процесса образуются разрывы и завихрения. Жидкость, из которой состоит оболочка воздушного пузырька, направляется внутрь. Столбик жидкости выбрасывается вверх, создавая звуковые волны различной частоты. Они сопровождаются обильным шумом. Этот режим кипения именуется пузырьковым.
А также существует пленочный режим кипения. Он наступает при увеличении тепловых потоков до предельно допустимых значений. Вокруг стенок сосуда образуется сплошной слой пара, представляющий собой непрерывную плёнку. Она не способна проводить большое количество тепла. Вся температура скапливается вокруг неё, из-за чего происходит резкое повышение температуры. Подобный эффект можно наблюдать при попадании капель воды на раскалённую поверхность.
В некоторых случаях жидкость может переходить из одного режима кипения в другой. Это может произойти при резком изменении величины теплового потока, возникающего во время передачи внутренней энергии. Если он превысил критическую отметку, устанавливаемую индивидуально для каждого вещества, то пузырьковый режим образования пара автоматически сменяется на пленочный. Обратный процесс происходит при повторном понижении значений теплового потока. На скорость сменяемости режимов также влияет объём нагреваемой жидкости.
Особенности реакции
Процесс парообразования можно подробно рассмотреть на примере кипения воды. Для проведения опыта понадобится 1 л жидкости комнатной температуры. В самом начале эксперимента вода насыщена кислородом. Нагревание следует производить в чайнике или иной ёмкости похожего строения. Для поддержания кипения воды нужно постоянно подводить теплоту. Выделяют следующие стадии кипения:
Зависимость температуры от давления
Процесс парообразования других жидкостей происходят аналогично кипению воды. Единственным отличием являются разные показатели кипения вещества. Температура кипения прямо пропорциональна давлению (при увеличении давления она становится больше, при уменьшении она автоматически понижается). При решении физических задач градус кипения даётся при стандартном атмосферном давлении.
Зависимость температуры кипения от давления лежит в основе работы скороварок. Это приспособление увеличивает атмосферное давление для более быстрого приготовления. Обратный эффект можно наблюдать в горах. На большой высоте величина давления уменьшается в 2 раза, что затрудняет процедуру приготовления еды для альпинистов.
Различие температур кипения жидкостей активно используется при переработке нефти. В её состав входит огромное количество керосина, бензина, мазута и лигроина. При создании нефтепродуктов необходимо отделить компоненты друг от друга. Для этого сырое вещество начинают нагревать. При достижении температуры кипения одна из жидкостей начинает испаряться. Таким образом, отделив лишние элементы, можно сделать состав нефти однородным.
Процесс конденсации
При конденсации газообразное вещество переходит в жидкое состояние. Это явление возникает при условии, что температура вещества ниже температуры кипения. Во время конденсации выделяется столько же энергии, сколько и во время испарения. Примером этого процесса может служить:
Конденсация также может происходить как в плёночном, так и капельном виде. Она способна осуществляться и во время парообразования жидкости. Частицы пара при перемещении над поверхностью жидкости начинают лопаться и возвращаются в жидкое состояние. Если же молекулы пара не вступают в прямой контакт с жидким веществом, то конденсация происходит в результате охлаждения газа в верхних слоях атмосферы.
Капли конденсата начинают объединяться в небольшие скопления. Примером подобного явления является процесс образования облаков на небе.
Предназначение и применение
Важнейшей характеристикой процесса кипения и конденсации является удельная ТП. Она показывает количество теплоты, необходимое для превращения 1 кг жидкостного вещества в пар. Эта величина рассчитывается без учёта потерь теплоты. Теплоемкость измеряется путём определения количества теплоты, которое было затрачено за период нагревания жидкости до температуры кипения.
В современной физике она обозначается буквой L (лямбда). Измеряется эта характеристика в Дж/кг. В следующей таблице представлены значения удельной теплоты парообразования для основных жидкостей:
| Наименование вещества | Величина удельной теплоты образования пара Дж/кг | |
| Азот | 198000 | |
| Алюминий | 10900000 | |
| Аммиак | 1370000 | |
| Ацетон | 525000 | |
| Бензол | 394000 | |
| Вода | 225 000 | |
| Водород | 454000 | |
| Гелий | 20600 | |
| Двуокись серы | 390000 | |
| Диметилэфир | 467000 | |
| Диэтилэфир | 384000 | |
| Железо чистое | 6340000 | |
| Золото | 1650000 | |
| Кислород | 213000 | |
| Криптон | 108000 | |
| Медь | 4 790000 | |
| Метан | 510000 | |
| Метиловый спирт | 1 100000 | |
| Неон | 86300 | |
| Никель | 6480000 | |
| Олово | 2450000 | |
| Пентан | 360000 | |
| Пропиловый спирт | 750000 | |
| Ртуть | 285000 | |
| Свинец | 8 600000 | |
| Сера | 290000 | |
| Эфир | 4105 | |
| Углерод | 50000000 | |
| Фосфор | 400000 | |
Удельная теплота преобразования применяется в производственных масштабах. С её помощью происходит создание железных материалов и плавление железа. Когда этот металл находится в жидком состоянии, он обладает кристаллической решёткой. При ее помощи мастер определяет количество теплоты, требуемое для нагревания железа, не влияя на состояние её кристаллической решётки.
В нефтяном секторе также применяется теплота парообразования, характеризующая оборудование для переработки нефти.
В теоретической физике УТП используется преимущественно для решения задач на тепловые явления. Если в условии задания указано, что жидкость достигла своей температуры кипения, то можно найти величину количества теплоты. Согласно формуле, удельная теплота парообразования, умноженная на исходную массу вещества, будет равна количеству теплоты, которое выделилось во время кипения жидкости. В математическом виде формула записывается следующим образом: Q = L * m. Q — количество теплоты (Дж), L — удельная ТП (Дж/кг), m — масса жидкого вещества (кг).
Если в задаче рассматривается процесс конденсации, то для нахождения количества теплоты необходимо применить аналогичную формулу. Ответ записывается с противоположным знаком, но очень часто его не учитывают, указывая лишь модуль полученного числа.