одну чашку петри при методе дисков можно использовать для изучения чувствительности одного штамма к
Одну чашку петри при методе дисков можно использовать для изучения чувствительности одного штамма к
Метод серийных разведений в плотных средах во многом аналогичен методу разведений в жидких средах, но определение МБК требует более сложных манипуляций. Готовят двойные серийные разведения препарата от 1:10 000 до 1:320 000, затем вносят по 1 мл каждого разведения в пробирки, содержащие по 4 мл (или 9 мл) охлаждённого до 45 °С агара. Процедуру проводят одной пипеткой с перенесением препарата от меньшей концентрации к большей. Содержимое пробирок можно быстро внести в чашки Петри, либо пробирки «скашивают» до застывания агара. Затем агар засевают исследуемой стандартизированной тест-культурой (петлёй или специальным дозатором, засевающим чашку 36 видами различных микроорганизмов) и инкубируют 18-20 ч при 37 «С. После инкубации определяют МИК по отсутствию роста на чашках (пробирках), содержащих наименьшие концентрации препарата.
Диффузионные методы. Метод дисков.
Диффузионные методы менее точны, чем методы разведений, но более просты в исполнении и позволяют определять чувствительность к нескольким ЛС одновременно. Поэтому их чаще применяют на практике. Исходный метод. Чашки Петри заполняют питательной средой, соответствующей пищевым потребностям возбудителя, слоем в 4-5 мм.
После застывания агар подсушивают в термостате при 37 «С в течение 20 мин. Посев тест-культуры можно осуществлять внесением в полуостывший агар, но чаще микробную взвесь наслаивают на агар. После равномерного распределения по поверхности излишки взвеси удаляют, а чашки подсушивают в термостате. В агаре пробивают лунки и в каждую вносят по 0,1 мл раствора исследуемых препаратов, после чего инкубируют 18 ч при 37 °С (срок инкубации может варьировать в зависимости от скорости роста микроорганизма). Активность учитывают, измеряя диаметр зоны подавления роста для каждого препарата.
Метод дисков. В настоящее время вместо классического (исходного) метода повсеместно применяют модификацию, предложенную Кирби и Бауэром и признанную стандартным тестом. После посева тест-культуры на агар наносят диски из фильтровальной бумаги, пропитанные различными антимикробными препаратами (используют коммерческие образцы, содержащие известные концентрации). После инкубации при 37 «С в течение времени, необходимого для роста выделенного возбудителя, проводят определение диаметра зоны торможения роста. Размеры зон, полученные в опыте, сравнивают с величинами зон задержки роста, указанными в инструкциях, прилагаемых к дискам, после чего выделенные микроорганизмы относят к чувствительным, умеренно чувствительным или резистентным.
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ:
МЕТОДЫ, РЕЗУЛЬТАТЫ, ОЦЕНКА
Решедько Галина Константиновна,
к.м.н., ассистент кафедры клинической фармакологии
Смоленской государственной медицинской академии
214019, г.Смоленск, ул.Крупской, 28, а/я № 5.
Тел.: +7(0812) 61 13 01, 61 13 27, Факс: (0812) 61 12 94,
E-Mail: galina@antibiotic.ru
Содержание
Резюме
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
|
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
|
Методы определения чувствительности к антибиотикам
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
Интерпретация результатов определения чувствительности
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).
Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Чувствительные микроорганизмы (susceptible)
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro, и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
Резистентные микроорганизмы (resistant)
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Микроорганизмы c промежуточной резистентностью (intermediate)
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro, получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий
(Согласно Приказу Министерства здравоохранения СССР № 250 от 13.03.75 г. «Об унификации методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам».)
В клинической практике чувствительными к антибиотикам считают те микроорганизмы, на которые антибиотики оказывают бактериостатическое или бактерицидное действие.
При любом лабораторном исследовании критерием чувствительности микроорганизмов к антибиотикам является минимальная концентрация антибиотика, ингибирующая (задерживающая) рост возбудителя заболевания при стандартных условиях постановки опыта.
Для определения лекарственной чувствительности оптимальным является использование чистой культуры возбудителя. Выделять культуры микробов из организма для исследования на чувствительность следует до начала лечения антибиотиками, так как под их воздействием рост возбудителя заболевания может быть полностью угнетен. Чувствительность микроорганизмов к антибиотикам определяют методом диффузии в агар с применением стандартных дисков или методом серийных разведений в жидких и плотных питательных средах.
Методы определения
Метод дисков. Взвесь изучаемой культуры засевают «газоном» (см. главу 7). В качестве посевного материала можно использовать суточную бульонную культуру или 1 миллиардную микробную взвесь, приготовленную по оптическому стандарту мутности № 10 (см. ниже). Засеянные чашки подсушивают 30-40 мин при комнатной температуре. Затем на поверхность засеянного агара пинцетом накладывают бумажные диски, пропитанные растворами различных антибиотиков. Каждый диск слегка прижимают браншами пинцета, чтобы он плотно прилегал к поверхности агара. Диски накладывают на равном расстоянии друг от друга и на расстоянии 2 см от края чашки. Одну чашку можно использовать для изучения чувствительности одного штамма к 4-5 антибиотикам.
Засеянные чашки с нанесенными на них дисками помещают в термостат при 37° С на 18-24 ч. Чашки ставят вверх дном, чтобы избежать попадания конденсационной воды на поверхность посевов.
Учет результатов. Действие антибиотиков оценивают по феномену задержки роста вокруг диска (рис. 25). Диаметр зон задержки роста микробов вокруг дисков определяют с помощью линейки, включая диаметр самого диска. Между степенью чувствительности микроба к антибиотикам и величиной зоны отсутствия роста имеются следующие соотношения (табл. 10).
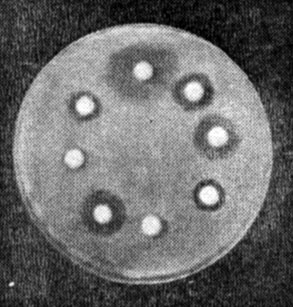
Рис. 25. Определение чувствительности бактерий к антибиотикам (метод дисков)

Таблица 10. Определение степени чувствительности микроорганизмов к антибиотикам по величине зоны отсутствия роста
В ответе указывают, какой чувствительностью обладает исследуемый штамм, а не размер зоны задержки роста.
* (Для тех видов микроорганизмов, которые не растут на мясопептонном агаре, как, например, стрептококки, пневмококки и другие, применяют агар с кровью или сывороткой.)
Метод серийных разведений в жидкой питательной среде. Этот метод является точным количественным методом, его применяют в научной работе и в особо важных случаях в лабораториях больниц и профилактических учреждений.
Для постановки опыта необходимо иметь чистую культуру испытуемого микроорганизма, основной раствор антибиотика, мясопептонный бульон на переваре Хоттингера, содержащий 1,2-1,4 г/л аминного азота.
Активность антибиотиков выражают в ЕД/мл или мкг/мл. Для приготовления основного раствора антибиотика используют антибиотики, имеющиеся в продаже с указанием количества их во флаконе.
Если на этикетке вместо количества единиц во флаконе дозировка указана в единицах массы, то следует иметь в виду, что 1 г активности для большей части антибиотиков соответствует 1 млн. ЕД. Из этого раствора и должны быть приготовлены требуемые разведения антибиотиков. Указания для приготовления основного раствора антибиотиков на примере пенициллина приведены в табл. 11.

Таблица 11. Получение основного раствора пенициллина
Готовят взвесь культуры микроорганизмов, выросшей на плотной питательной среде. Полученную взвесь сравнивают с оптическим стандартом мутности № 10 (см. ниже), а затем разводят стерильным изотоническим раствором натрия хлорида до 10 6 микробных тел в 1 мл. Для получения соответствующего разведения микробной взвеси готовят ряд последовательных десятикратных разведений (см. ниже).
Учет результатов проводят при наличии роста в контроле культуры и отсутствии роста в контроле среды. Затем отмечают последнюю пробирку с полной видимой задержкой роста микробов. Количество антибиотика в этой пробирке является минимальной ингибирующей концентрацией для испытуемого штамма и определяет степень его чувствительности к данному антибиотику. В ответе, выдаваемом лабораторией, указывают минимальную ингибирующую концентрацию.
Метод серийных разведений на плотной питательной среде. Готовят двукратные разведения антибиотика, как и при методе серийных разведений в жидкой питательной среде. Затем берут 1 часть каждого разведения антибиотика и 9 частей питательного агара, расплавленного и охлажденного до 42° С (из расчета 1 мл антибиотика + 9 мл МПА), хорошо перемешивают и наливают в чашки Петри.
Густоту (концентрацию) культуры определяют по оптическому стандарту мутности № 10 и разводят стерильным изотоническим раствором до 10 7 микробных тел в 1 мл. Бактериальной петлей наносят испытуемые культуры на поверхность питательного агара с антибиотиком. На одну чашку делают посев 20-25 штаммов. Засеянные чашки ставят в термостат при 37° С на 16-20 ч для большинства видов микроорганизмов. Чашка с питательным агаром без антибиотика, на которую наносят испытуемые культуры, является контрольной.
Учет результатов проводят при наличии роста в контрольной чашке, а минимальную ингибирующую концентрацию антибиотика определяют по последней чашке Петри, где отмечают полную задержку роста бактерий.
Метод дорожки по Флемингу. Метод применяют для определения спектра действия антибиотика. В чашке Петри с МПА стерильным скальпелем вырезают дорожку шириной 1 см и удаляют ее. Затем в пробирку с растопленным и охлажденным до 42-45° С мясопептонным агаром вносят определенную концентрацию раствора антибиотика. Содержимое пробирки перемешивают и выливают в дорожку так, чтобы жидкость не выходила за ее пределы. После застывания агара перпендикулярно к дорожке засевают петлей культуры нескольких исследуемых микроорганизмов. Посевы помещают в термостат на 18-24 ч.
Учет результатов. Чувствительные к препарату культуры начинают расти лишь на некотором расстоянии от дорожки, нечувствительные растут до самого края.
Методы определения чувствительности к антибиотикам
Лечение антибиотиками можно проводить двумя способами. Первый — этиотропный, когда выделен возбудитель и определена чувствительность его к антибактериальным агентам. Второй — эмпирический, основанный на знании природной резистентности, эпидемиологических данных и результатов чувствительности к антибиотикам в регионе или стационаре.
В обоих случаях определение чувствительности к антибиотикам — неотъемлемый элемент рациональной терапии. В этой статье massmedika расскажет о некоторых из них.
Методы определения чувствительности к антибиотикам
В основе большинства методов лежит определение минимальной подавляющей концентрации (МПК). МПК (иногда минимальная ингибирующая концентрация) — наименьшая концентрация антимикробного агента, которая в пробирке полностью подавляет видимый невооруженным глазом рост микроорганизмов. Измеряется МПК в мг/л или мкг/мл
Методы определения МПК
К методам определения МПК относятся:
Методы разведения
Ниже приведен алгоритм проведения метода разведения в бульоне.
Приготовление заданных разведений.
Готовится бульон, содержащий убывающее количество антибиотика,
также готовится контроль, не содержащий антибактериального агента.
Добавление бактериальной суспензии.
К каждому из разведений антибиотика добавляется определенное количество выделенных бактерий.
Инкубация в течение 1-й ночи
Анализ результатов.
Мутный бульон свидельствует о росте бактерий. Минимальное содержание антибиотика, где бульон будет свободен от роста бактерий, будет считаться МПК для данного штамма.
Процедура аналогичная для метода разведения в агаре. Метод микродилюции отличается от метода макродилюции объемом используемомого материала.
Диффузионные методы
Определение чувствительности диско-диффузионным методом предполагает следующие этапы:
Помещение бактерий
Помещение суспензии бактерии заданной концентрации (1-2 х 10 8 КОЕ/мл) в чашку Петри с агаром.
Помещение дисков с антибиотиками
Коммерческие диски, с нанесенным антибиотиком, помещаются в чашку Петри. Диски равномерно распределены по поверхности агара. Антибиотик начинает мгновенно распространяться из диска на поверхность чашки Петри, создавая градиент концентрации таким образом, что наибольшее содержание антибиотика находится возле диска.
Инкубация на сутки
Чашка Петри, содержащая питательную среду (агар), суспензию бактерии и диски с антибиотиками помещаются в термостат для инкубации на сутки при при t=35-37о
Анализ результатов
Оценка происходит путем измерения диаметра зоны вокруг диска, свободной от роста бактерий. Полученный результат сравнивают с стандартами для каждого антибиотика и конкретного штамма бактерии.
E-TEST

E-test — быстрый и простой метод, в то же время достаточно дорогой, так как для каждого антибиотика необходима отдельная полоска.
Другие методы определения чувствительности к антибиотикам
Механизм-специфические тесты
Наличие у бактерии определенного механизма резистентности может быть определено механизм-специфическими тестами. Например, наличие b-лактамаз можно определить в хромогенном тесте на цефалоспориназы ( Цефиназный диск от BD Microbiology Systems ).
Цефиназный диск будет полезен для определения резистентности к пенициллинам/цефалоспоринам у штаммов Neisseria gonorrhoeae, Staphylococcus, Haemophilus influenzae, энтерококков и некоторых аэробных бактерий. Метод не стоит использовать для выявления b-лактамаз широкого спектра.
Генетические методы
Так как резистентность закодирована в генах, некоторые методы генотипирования могут быть использованы для их выявления. Большинство из генетических методов являются высокочувствительными и быстрыми. Стоит однако помнить, что присутствие генов резистентности не всегда означает, что терапия будет неэффективна. Многое зависит от степени экспрессии гена резистентности.
Одну чашку петри при методе дисков можно использовать для изучения чувствительности одного штамма к
Методические указания по применению унифицированных методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам
1. Микробиологические исследования
1.1. Определение чувствительности микроорганизмов к химиотерапевтическим препаратам
Критерии чувствительности микроорганизмов к химиотерапевтическим препаратам
Успех химиотерапии во многом зависит от правильного выбора соответствующего лечебного препарата, для чего крайне важно располагать сведениями о чувствительности возбудителя болезни к избираемому для лечения препарату.
В клинической практике чувствительными к препарату считаются те микроорганизмы, на которые препарат в концентрации, достигаемой в очаге инфекции, оказывает бактериостатическое или бактерицидное действие. В соответствии с этим критерии чувствительности микроорганизмов зависят от концентрации лечебного препарата в очаге инфекции, величины максимальной терапевтической дозы препарата, его фармакокинетики и токсичности.
Мерой чувствительности микроорганизмов к химиотерапевтическим препаратам при постановке лабораторного теста является минимальная концентрация препарата, ингибирующая рост возбудителя заболевания при стандартных условиях постановки опыта. Деление микроорганизмов на устойчивые и чувствительные производится на основании соотношения минимальной ингибирующей рост микроба концентрации препарата, определенной в лабораторных условиях, концентрации этого же препарата, создаваемой в очаге инфекции при введении терапевтических доз. При соотношении
можно говорить о чувствительности микроорганизма к данному химиотерапевтическому препарату.
Для клинической практики целесообразно делить микроорганизмы по степени чувствительности к химиотерапевтическим препаратам условно на 4 группы:
Особенно важно определять чувствительность возбудителя заболевания к химиотерапевтическим препаратам:
— при процессах, вызванных микроорганизмами часто устойчивыми к лечебным препаратам;
— при затяжных инфекциях, когда сопротивляемость макроорганизма нарушена и выбор наиболее активного препарата играет особо важную роль;
— при применении препаратов, к которым во время лечения быстро развивается устойчивость (стрептомицин, рифампицин и некоторые другие.
В настоящее время предложены критерии чувствительности микроорганизмов только для некоторых антибиотиков (табл.1). Для других химиотерапевтических препаратов критерии чувствительности разрабатываются.
Классификация микроорганизмов по степени чувствительности к антибиотикам (МИК в мкг/мл или ед/мл)
Препараты тетрациклинового ряда
Взятие материала для выделения возбудителя заболевания и определения его чувствительности к лекарственным препаратам
Важным условием соответствия результатов определения чувствительности микроорганизмов к химиотерапевтическим препаратам и клинической эффективности последних является исследование чувствительности чистых культур истинных возбудителей инфекции, а не сопутствующей им микрофлоры. Поэтому при взятии материала для исследования следует соблюдать следующие правила:
1. Материал должен быть получен до начала антибактериальной терапии или через такой период после введения антибактериального препарата, который необходим для его элиминации из организма больного.
2. Материал для посева при определении чувствительности следует брать непосредственно из очага инфекции с соблюдением правил асептики (стерильными инструментами, в стерильную посуду и т.п.).
3. В тех случаях, когда взятие материала непосредственно из очага инфекции невозможно, но он сообщается с внешней средой, можно производить исследование соответствующего отделяемого: мочи при пиелонефрите, мокроты при воспалительных процессах в легких, отделяемого цервикального канала при сальпингоофоритах и т.д. Перед сбором материала для посева следует провести предварительную обработку антисептическими растворами доступных для этого полостей или поверхностей человеческого организма, по которым проходит исследуемый материал.
Например, при сборе мокроты больной должен утром до еды почистить зубы, прополоскать рот слабым раствором антисептика и затем откашлять мокроту в стерильную карманную плевательницу или прокипяченную баночку с крышкой. При этом больному надо объяснить, что он не должен собирать носоглоточную слизь и слюну, а должен стараться собрать только отделяемое дыхательных путей. Если мокрота отделяется плохо, больному следует накануне назначить отхаркивающее.
Мочу для посева после тщательного туалета наружных половых органов 0,5% раствором марганцевокислого калия берут стерильно катетером или получают ее при естественном мочеиспускании, отбросив первую небольшую порцию («первую струю»).
4. Посев материала, взятого у больного, производят на соответствующий набор питательных сред, необходимых для выделения чистых культур различных видов микроорганизмов. В смешанной культуре производить определение чувствительности к антибактериальным препаратам не следует, так как скорость роста различных микроорганизмов, присутствующих в ассоциациях, неодинакова и при подобном методе исследования определяется чувствительность к антибактериальным препаратам наиболее быстро растущих видов, не всегда являющихся возбудителями заболеваний. Кроме того, при определении чувствительности бактерий в смешанных культурах можно получить ложные результаты за счет микробного антагонизма, когда рост одной культуры может быть подавлен не антибактериальным действием препарата, а вследствие антагонистического влияния другой культуры.
5. Если в исследуемом материале находится несколько видов условнопатогенных микроорганизмов, необходимо выяснить, какой из них является ведущим в данном патологическом процессе.
6. Если выяснение истинного возбудителя не удается, или патологический процесс вызван микробной ассоциацией, исследуется раздельно чувствительность к антибактериальным препаратам всех членов, выделенных в чистой культуре.
7. В некоторых случаях, например, при раневой гнойной инфекции или термических осложненных ожогах, когда процесс вызывается ассоциацией микроорганизмов, практикуется определение чувствительности сразу всей ассоциации. Однако, эти данные надо рассматривать как сугубо ориентировочные, которые необходимо дополнить исследованием чувствительности раздельно у каждого из членов ассоциации.
8. В отдельных случаях определение чувствительности микроорганизмов к антибактериальным препаратам может проводиться при первичном посеве материала на питательные среды. Это возможно тогда, когда возбудитель находится в исследуемом материале и в достаточно большом количестве (например, в гное из закрытых очагов).
Выбор методов определения чувствительности микроорганизмов к химиотерапевтическим препаратам
Выбор метода зависит от цели исследования и возможностей лаборатории, выполняющей исследования.
Метод диффузии в агар с применением дисков следует расценивать как метод качественный. Благодаря простоте, скорости и легкости исполнения он является основным при определении чувствительности микроорганизмов к химиотерапевтическим препаратам практическими лабораториями.
Методом разведений в плотной питательной среде рациональнее пользоваться при необходимости исследовать одновременно большое количество культур, так как на чашку с плотной средой можно посеять одновременно несколько штаммов. Необходимо отметить также большую точность метода разведений в плотной среде, при котором определяется чувствительность к препарату большинства вариантов микробной популяции, в то время как при использовании жидкой среды определяется чувствительность наиболее устойчивых вариантов.
Ускоренные методы служат дополнением к основным вышеназванным методам.
Для облегчения сравнения полученных результатов и их правильной оценки необходимо при определении чувствительности микроорганизмов к химиотерапевтическим препаратам любым методом обеспечить наиболее стандартные условия постановки опыта.
1.1.1. Определение чувствительности микроорганизмов к антибиотикам методом диффузии в агар с применением бумажных дисков
1. Диски. Для исследования могут быть использованы только стандартные заводские диски. Во флаконах с дисками, пропитанными нестойкими к влаге антибиотиками, находится силикагель, который является хорошим влагоуловителем и показателем влажности во флаконе (при увлажнении силикагель меняет свою окраску с синей на розовую). Диски из флаконов, в которых силикагель окрашен в коричневый или розовый цвет, не используются. Диски хранят в сухом темном месте при температуре не выше 20°С. После вскрытия флакона дисками можно пользоваться не более месяца.
2. Питательные среды.
а) Среда на переваре Хоттингера с содержанием 120-140 мг% аминного азота, 1-2% агара, pH 7,2-7,4.
б) Казеиново-дрожжевая среда с таким же содержанием аминного азота и агара и значением pH.
в) Мясо-пептонная среда с таким же содержанием агара и pH.
В случае необходимости в среду может быть добавлено 5% крови или сыворотки, что отрицательного влияния на результаты анализа не оказывает.
В тех случаях, когда допускается постановка теста с испытуемым материалом (гной, раневое отделяемое и др.), последний наносят на поверхность питательного агара и равномерно растирают по поверхности среды стерильным шпателем. Одновременно исследуемый материал засевают для выделения чистой культуры и последующей постановки теста с чистой культурой. При монокультуре исследование можно не повторять.
Чашки подсушивают в течение 30-40 минут при комнатной температуре. Затем на поверхность засеянной среды пинцетом накладывают диски, пропитанные различными антибиотиками. В каждой чашке может быть испытано действие нескольких антибиотиков (до 5-6). Диски накладывают на поверхность агара плотно для тесного контакта со средой, следя за тем, чтобы не были положены 2 сцепленных между собой диска. Диски размещают на равном расстоянии один от другого и примерно на 2 см от края чашки. Чашки ставят в термостат перевернутыми кверху дном или вкладывают под крышку чашки кружок фильтровальной бумаги, чтобы избежать размывания газона конденсационной водой, и инкубируют при 37°С в течение 18-ти часов. Если исследуемый вид микроорганизмов растет медленно, инкубацию продлевают до 48-72 часов или более, в зависимости от появления роста в контроле.















Warning: Use of undefined constant expert_review_likes - assumed 'expert_review_likes' (this will throw an Error in a future version of PHP) in /var/www/www-ars1963/data/www/ck62.ru/wp-content/themes/colormag/comments.php on line 93