Физиологическая фиксация фдг в мочевом пузыре что это такое
ТЕОРЕТИЧЕСКИЕ И КЛИНИКОМЕТОДИЧЕСКИЕ АСПЕКТЫ ПОЗИТРОННОЙ ЭМИССИОННОЙ ТОМОГРАФИИ
Резюме. Рассмотрены теоретические аспекты и роль современного метода лучевой диагностики – позитронной эмиссионной томографии. Описаны преимущества комбинированных диагностических аппаратов ПЭТ-КТ. Приведены протокол исследования и показания для проведения позитронной эмиссионной томографии с 18F-фтордезоксиглюкозой в онкологической практике. Проанализирована интерпретация результатов исследований.
В мире интенсивно развиваются и широко внедряются в клиническую практику томографические методы клинической диагностики. Среди них важное место занимают методы эмиссионной компьютерной томографии – однофотонная эмиссионная компьютерная томография (ОФЭКТ) и позитронная эмиссионная томография (ПЭТ) [1, 2].
ПЭТ основана на метке молекул, ответственных за специфические метаболические процессы, ультракороткоживущими радионуклидами (позитронными излучателями), позволяющими получить количественное изображение метаболических изменений. ПЭТ предоставляет общую и регионарную информацию о метаболизме клеток. Это очень чувствительный неинвазивный метод для изучения биохимических и молекулярных процессов в живом организме, не меняющий его физических свойств. При различных заболеваниях в большинстве случаев нарушения метаболизма предшествуют морфологическим, отображаемым такими структурными методами визуализации, как ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ).
Наиболее часто используют радиофармпрепарат (РФП) 18 F-фтордезоксиглюкозу ( 18 F-ФДГ). Он удобен как с точки зрения задач, которые решает ПЭТ с помощью этого препарата, так ис точки зрения удобного периода полураспада (110 мин). Данный РФП можно синтезировать в центре, где есть медицинский циклотрон, а затем транспортировать в близлежащие клиники, где он отсутствует, но есть позитронные эмиссионные томографы. Это так называемая сателлитная схема работы ПЭТ-центров. Благодаря ей ПЭТ становится более доступной и экономичной. Метод имеет огромное значение в онкологии (свыше 80% всех исследований), кардиологии, неврологии [3–5].
Принцип метода. Метод ПЭТ основан на использовании свойства ядерной нестабильности изотопов с избытком протонов. При переходе ядра в стабильное состояние оно излучает позитрон, пробег которого заканчивается столкновением с орбитальным электроном и аннигиляцией, в результате чего воз-
никают 2 гамма-кванта, движущиеся в диаметрально противоположных направлениях и имеющие энергию 511 кэВ. Гамма-кванты можно зафиксировать с помощью системы детекторов. Если 2 диаметрально противоположные детектора одновременно зарегистрируют сигнал, то есть основания утверждать, что точка аннигиляции находится на линии, соединяющей детекторы. Подключив детекторы к электронной схеме совпадений, срабатывающей только при появлении сигналов от обоих детекторов, можно зафиксировать положение этой линии. Для определения координат позитронизлучающего источника коллиматоры не нужны. Данное свойство ПЭТ получило название «электронной коллимации». Благодаря этому чувствительность ПЭТ на 1–2 порядка выше по сравнению с ОФЭКТ. Такой выигрыш в чувствительности позволяет добиться большей статистической достоверности при реконструкции изображений.
Подготовка пациента и протокол исследования. При проведении ПЭТ очень важен анамнез, который собирает перед процедурой врач, проводящий и интерпретирующий исследование, желательно с заполнением формы. При этом указывается:
первичный диагноз, дата;
первичное лечение – операция, химиотерапия, лучевая терапия, даты проведения;
стадия заболевания, степень злокачественности опухоли;
доили послеоперационная химиотерапия (да, нет), даты проведения;
доили послеоперационная лучевая терапия (да, нет), даты проведения;
при наличии рецидива указывают, выполнялась ли операция или другое лечение;
жалобы, симптомы в настоящее время;
результаты предыдущих лучевых и других инструментальных исследований (рентгенография, УЗИ, сцинтиграфия, КТ, МРТ), даты проведения;
уровень опухолевых маркеров;
сопутствующие и перенесенные заболевания;
семейный анамнез (онкологический);
лечение в настоящее время;
клиническая информация, которую требуется получить при проведении ПЭТ.
Исследование выполняется натощак (минимум через 6 ч после приема пищи, лучше – через 12 ч). Внутривенное введение глюкозы осуществляется не позже чем за 6 ч до начала процедуры. Пациентам запрещено пить напитки с сахаром (только вода). Необходимо проверить уровень глюкозы в крови перед инъекцией 18 F-ФДГ. Исследование можно проводить, если уровень глюкозы в крови менее 10 ммоль/л. В противном случае выполнение процедуры откладывают до снижения уровня глюкозы до вышеуказанных цифр. Если снижения уровня глюкозы не достигнуто, исследование должно быть перенесено. Больным сахарным диабетом не назначать пероральные гипогликемические препараты или инсулин перед введением 18 F-ФДГ (инсулин вводится не позже чем за 2 ч до введения РФП). Инъекция 18 F-ФДГ производится в расслабленном положении на удобном кресле. После этого пациенту можно читать, но нельзя разговаривать, ходить, жевать. Следует избегать любой мышечной активности. 18 F-ФДГ вводят внутривенно из расчета 3,5–7 МБк/кг массы тела больного. Исследование выполняют через 60–90 мин после введения РФП. Рекомендуется прием фуросемида (20 мг одновременно с введением РФП). Обязательна гидратация организма: 750 мл воды (до и после введения РФП). Необходимо частое опорожнение мочевого пузыря, особенно непосредственно перед укладкой на пози-
тронный эмиссионный томограф.
Интеграция ПЭТ и КТ в один аппарат (ПЭТ-КТ). Целесообразно использование комбинированных (гибридных) аппаратов, обеспечивающих анатомическую привязку, качественную и быструю трансмиссионную корректировку изображений [4]. Клинические данные свидетельствуют, что ПЭТ-КТ имеет преимущества перед ПЭТ и КТ, проведенными отдельно.
Исследование производится натощак.
Прием пациентом растворимого йодированного контраста (1000 мл) за 1 ч до процедуры. Дополнительно – 200 мл контраста непосредственно перед исследованием для контрастирования желудка и двенадцатиперстной кишки.
Пациент находится в лежачем расслабленном положении минимум 20 мин.
Опорожнение мочевого пузыря непосредственно перед исследованием.
Низкодозная КТ (от головы до дна таза). Данные трансмиссионных измерений используются для коррекции ослабления.
КТ с контрастным усилением. КТ-протоколы должны быть приспособлены к конкретным задачам.
Совмещение изображений аппаратными методами и интерпретация результатов.
18 F-ФДГ и его поведение в организме. Повышенный захват 18 F-ФДГ используется для диагностики, стадирования и выявления остаточной опухоли, а также рецидивов. Накопление РФП тесно связано с количеством клеток опухоли. Снижение захвата 18 F-ФДГ в процессе терапии отражает степень гибели опухолевых клеток. Количественное отражение захвата 18 F-ФДГ служит ранним и чувствительным маркером тумороцидного эффекта химиотерапии. Как не все злокачественные опухоли активно накапливают 18 F-ФДГ (например, низкий захват или отсутствие захвата почечноклеточным раком, некоторыми гистологическими формами рака желудка, муцинозной карциномой, низкозлокачественными саркомами и др.), так и не все анатомические зоны легко исследовать с помощью данного РФП (например, поиск метастазов в головном мозгу). Отмечается повышенный захват 18 F-ФДГ в доброкачественных очагах и при воспалении (с участием макрофагов). Распределение 18 F-ФДГ в организме соответствует его энергорежимам. Захват и накопле-
ние в норме – в мышцах, печени, жировой ткани. Различают фоновый метаболизм 18 F-ФДГ (соот-
ношение опухоль/здоровая ткань); физиологический гиперметаболизм (например, физические упражнения); патофизиологический метаболизм (воспаление). Стандартизированный показатель накопления (СПН) характеризует захват РФП в опухоли, нор-
мализованный по дозе и массе тела пациента.
СПН = (активность с поправкой на распад/см 3 опухоли)/(введенная активность/масса тела пациента (г)).
Для определения СПН производят построение зон интереса на нескольких кадрах и вычисляют показатель с помощью специального программного обеспечения.
Как указывалось выше, ПЭТ чаще всего применяют в онкологии.
Показания для проведения ПЭТ с 18 F-ФДГ.
В онкологии ПЭТ применяют для: определения распространенности процесса; оценки степени злокачественности; оценки эффективности лечения; своевременная диагностика рецидивов; прогностический тест.
Показания к проведению исследований отдельных органов и систем в онкологической практике:
Опухоли головы и шеи: дифференциальная диагностика злокачественного и доброкачественного процесса; выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов; определение рецидива опухоли.
Опухоли щитовидной железы: дифференцированная карцинома — определение стадии опухоли; медуллярная карцинома — определение стадии опухоли. Опухоли неясной локализации (при выявленных отдаленных метастазах): локализация первичной
Рак легкого: немелкоклеточный рак – выявление метастазов в регионарные лимфоузлы, выявление отдаленных метастазов, определение рецидива опухоли; дифференциальная диагностика злокачественного и доброкачественного процесса при одиночном узле в легком.
Рак молочной железы: выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов; оценка эффективности терапии.
Рак пищевода и желудка: выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов.
Рак толстой кишки: выявление метастазов в регионарные лимфоузлы; выявление отдаленных метастазов; определение рецидива опухоли.
Рак поджелудочной железы: выявление отдаленных метастазов.
Лимфома (болезнь Ходжкина и неходжкинская лимфома): определение стадии заболевания; оценка эффективности терапии; определение рецидива. Меланома: выявление метастазов в регионарные лимфоузлы при индексе Бреслоу более 1,5 мм; выявление отдаленных метастазов при индексе Брес-
лоу более 1,5 мм; определение рецидива.
Опухоли костей и мягких тканей: дифференциальная диагностика доброкачественных и злокачественных опухолей; выявление отдаленных метастазов.
Опухоли мочеполовой системы: выявление отдаленных метастазов.
Опухоли головного мозга: уточнение опухолевого генеза очагового образования головного мозга; определение точных границ и размеров опухоли при неясных КТили МРТ-данных; определение степени злокачественности опухолей; выбор мишени для стереотаксической биопсии; оценка радикальности удаления опухоли; дифференциальная диагностика между продолженным ростом опухоли и лучевым поражением; мониторинг эффективности лучевого и химиолечения.
Анализ изображений. Большинство сложностей и ошибок ПЭТ-диагностики объясняются анатомической бедностью ПЭТ-изображений. Многие проблемы не возникают при применении ПЭТКТ, где имеет место надежное анатомическое сопоставление. Поэтому при интерпретации результатов ПЭТ-исследований необходимо иметь КТили МРТ-снимки для визуального сопоставления морфологической и функциональной информации. При визуальной оценке изображений полезно использовать простую 4-уровневую шкалу интенсивности накопления 18 F-ФДГ. Для этого отсечка цветовой шкалы устанавливается таким образом, чтобы изображение мозга выглядело черным, а фон – белым. Далее все очаги по степени выраженности гиперметаболизма подразделяются на 4 уровня: 1 – как в мягких тканях и неработающих мышцах; 2 – как в печени или чуть выше; 3 – между уровнем печени и мозга; 4 – как в мозге или выше. Очаги с уровнем 4 – первичная опухоль или мета-
стаз, 3 – скорее всего, первичная опухоль или метастаз (хотя возможен и очаг воспаления), 2 – скорее всего, очаг воспаления.
Для полуколичественного анализа используется стандартизированный показатель накопления, его позволяет рассчитывать программное обеспечение всех современных томографов. Также необходимо помнить и о локализациях физиологического накопления 18 F-ФДГ.
Физиологическое накопление 18 F-ФДГ.
Сердечно-сосудистая система. Даже при исследовании натощак у многих больных отмечается гомогенный или фрагментарный гиперметаболизм в миокарде, а иногда – малоинтенсивное накопление препарата в грудной аорте, что необходимо дифференцировать с воспалительными изменениями. Однако при наличии аортита степень накопления РФП все же должна быть выше. Время от времени отмечается физиологическое накопление препарата в артериях нижних конечностей. При начале сканирования ранее 30–40 мин после инъекции РФП существует вероятность определения накопления 18 F-ФДГ во многих крупных сосудах, обусловленного присутствием все еще большого количества радиоактивности в крови. Этой ошибки можно избежать, соблюдая протокол исследования.
Дыхательная система. Малоинтенсивные и часто двусторонние фокусы накопления препарата в корнях легких часто не означают метастазы в лимфоузлы, а являются результатом хронического бронхита, обычно у курильщиков. Однако именно подобные находки и представляют наибольшие диагностические трудности.
Мочеполовая система. Интенсивное накопление препарата отмечается в чашечно-лоханочной системе почек, мочеточниках, мочевом пузыре. По этой причине рекомендуется опорожнить мочевой пузырь перед исследованием, а сканирование начинать с области таза. Кроме того, необходимо помнить о возможности загрязнения паха радиоактивной мочой. Не всегда просто отдифференцировать точечную активность в мочеточнике от ретроперитонеального лимфоузла, а при анализе горячего пятна, прилежащего к мочевому пузырю, не следует забывать о возможности дивертикула мочевого пузыря.
Желудочно-кишечный тракт. Иногда отмечается накопление препарата в пищеводе, чаще в его дистальном отделе, что может быть обусловлено рефлюкс-эзофагитом, а также последствиями лучевой терапии. Часто возможны накопление в желудке, по-видимому, как результат перистальтической и мышечной активности. Однако наибольшие диагностические сложности представляет накопление препарата в кишечнике, особенно в толстом. Степень накопления может быть очень высокой, сравнимой с накоплением в злокачественной опухоли. Природа пока не ясна: перистальтика, высокая концентрация лейкоцитов в стенках кишечника, повы-
шенная секреция 18 F-ФДГ в стенку и просвет кишечника, различные воспалительные процессы. К сожалению, известные фармакологические или физиологические меры предотвращения такого накопления пока не эффективны, а отмечается это явление довольно часто. Требуется достаточный опыт, чтобы отдифференцировать физиологическое накопление в кишечнике от патологического очага. В некоторых случаях помогают отсроченные сканы, когда участки физиологического накопления через какой-то промежуток времени могут поменять локализацию.
Лимфатическая, кроветворная, эндокринная системы. Часто отмечается достаточно выраженное диффузное накопление препарата в пролиферирующем, активированном красном костном мозге у больных после химиотерапии. У детей и молодых пациентов можно видеть изображение тимуса, находящегося за грудиной и имеющего на аксиальных изображениях характерную V-образную форму. Неизмененные лимфоузлы не накапливают 18 F-ФДГ — накопление в них всегда соответствует патологическому очагу, но оно может быть вызвано как опухолевым процессом, так и воспалительным. Область, часто демонстрирующая высокий уровень метаболизма, обусловленный воспалением, – лимфатическое кольцо Вальдейера. Накопление в этой области расценивается как физиологическое, при необходимости дифференциации с опухолью принимается во внимание его симметричный характер.
Накопление 18 F-ФДГ в эндокринных органах
встречается редко. Щитовидная железа может иногда демонстрировать в норме умеренный гиперметаболизм. Если он не симметричный, то должен расцениваться как патологический очаг. Умеренно выраженное накопление РФП около гортани — достаточно частое явление, связанное с мышцами фонации. Анализ формы очагов накопления на аксиальных изображениях помогает отличить их от щитовидной железы. Яичники демонстрируют очень низкий уровень физиологического накопления (1-я степень), в отличие от яичек (2-я степень), где метаболизм в норме может быть выше. В молочных железах во время лактации уровень метаболизма бывает достаточ-
Околоушные слюнные железы могут характеризоваться очень высоким уровнем гиперметаболизма (3-я степень) без патологических изменений. Дифференциальная диагностика с опухолью основывается на однородном и равномерном характере накопления во всей железе, что редко бывает при опухоли.
Мышцы и суставы. Диффузное высокое накопление препарата в мышцах характерно для больных диабетом, поэтому важен контроль уровня сахара в крови перед исследованием. Очаговое накопление в работавшей незадолго до процедуры мышце может быть высоким (3-я степень) и послужить причиной диагностических ошибок. Именно поэтому важен отдых пациента перед исследованием и его правильная подго-
товка. Физиологический гиперметаболизм часто можно видеть в следующих мышцах: глазодвигательные; дна ротовой полости, в первую очередь подбородочноязычная, предохраняющая язык от западения у лежащего на спине человека; грудинно-ключично-сосцевидная; гортанные, участвующие в фонации.
Когда накопление РФП симметрично в обеих мышцах, их характерная анатомическая форма в сочетании с локализацией не создает трудностей в распознавании, но такое накопление отнюдь не правило: встречается и односторонний гиперметаболизм только в части мышцы.
Довольно часто отмечается накопление препарата в суставах. Оно может быть достаточно интенсивным (2-я степень), часто коррелирует с пожилым возрастом больных и, скорее всего, обусловлено воспалительными процессами.
Жировая и соединительная ткань. В настоящее время описано более 500 случаев интенсивного симметричного гиперметаболизма характерной формы и локализации в области шеи, плеч и вдоль позвоночника. До появления ПЭТ-КТ считалось, что это некая мышечная активность. И только точное сопоставление со структурными данными показало, что накопление РФП происходит в небольших островках жировой ткани, которую назвали «коричневый жир», или «американский жир». Этиология этого явления пока не известна. Такое накопление ни в коем случае нельзя путать с лимфоузлами, поскольку очень часто коричневый жир встречается у пациентов с лимфомами после нескольких курсов химиотерапии.
Головной мозг. В норме накопление 18 F-ФДГ в сером веществе головного мозга высокое, что делает крайне затруднительным верификацию горячих очагов на повышенном фоне. Кроме того, захват препарата метастазами при множественном поражении может варьировать у одного и того же больного, а также быть повышенным, сниженным или равным нормальной мозговой ткани. Многие исследователи отмечают сложности выявления метастазов в мозг и нередкие случаи диагностических ошибок. Лимитирующим фактором для чувствительности метода является разрешающая способность. Наиболее существенный недостаток ПЭТ с 18 F-ФДГ — недостаточная специфичность в результате близких значений скорости утилизации глюкозы в опухолях и некоторых незлокачественных образованиях
(воспалительных очагах и др.).
В клинической практике при использовании комбинированных аппаратов ПЭТ-КТ улучшается точность диагностики, особенно при применении высокоспецифических РФП (например, изотопов йода для поиска метастазов рака щитовидной железы и др.), когда отсутствует визуализация окружающих анатомических структур. При использовании комбинированных аппаратов можно с большей достоверностью провести контроль эффективности лечения, поскольку врач получает как морфологическую, так и функциональную информацию о состоянии регрессии опу-
холи и метастазов. При помощи ПЭТ-КТ выполняют минимальные интервенционные вмешательства, например биопсию гиперактивных лимфатических узлов, селективную биопсию жизнеспособных участков частично некротизированных опухолей и др. В этих условиях ПЭТ-КТ имеет особенную ценность при наличии большого количества морфологически видимых лимфатических узлов. Реконструированные данные ПЭТ-КТ могут использоваться при планировании лучевой терапии (топометричная подготовка пациентов, составление дозных анатомо-топографических карт). Анализируя изображения, врач получает комплексную информацию, благодаря чему повышается точность диагностики. Необходимо внедрять эти исследования в медицинскую практику для повышения эффективности диагностики злокачественных новообразований.
Коваль ГЮ, Мечев ДС, Сиваченко ТП та ін. Променева діагностика. / За заг ред: ГЮ Коваль / Київ: Медицина України, 2009; 1. 831 с.; 2. 679 с.
Радионуклидная диагностика. / Под ред: ЮБ Лишманова, ВИ Чернова / Томск: STT, 2004. 394 с.
Солодянникова ОИ, Сукач ГГ, Северин ЮП, Войт НЮ. Позитронная эмиссионная томография. Возможности клинического использования. В: Променева діагностика, променева терапія. Наук-практ конф «Актуальні питання використання сучасного рентгенологічного обладнання». Наукові статті та тези доповідей. Київ, 2007: 59–65.
Труфанов ГЕ, Рязанов ВВ, Дергунова НИ и др. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в онкологии. Санкт-Петербург: ЭЛБИСПб, 2005. 105 с.
Clinical Nuclear Medicine. / Eds: G Cook, M Maisey, K Britton, V Chengazy / London: Hodder Arnold, 2006. 915 p.
О радионуклидной ВИЗУАЛИЗАЦИИ (сцинтиграфии) для врача общей практики
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день.
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день. Он добавил радиоизотопный индикатор к несъеденной порции и с помощью детектора излучения доказал своей хозяйке, что дело обстояло именно так. Хозяйка выгнала молодого ученого из пансиона. Он же продолжал начатую работу, результатом которой стала Нобелевская премия за использование радионуклидов в качестве индикаторов в биологии Радионуклидная (радиоизотопная) диагностика охватывает все виды применения открытых радиоактивных веществ в диагностических и лечебных целях.
Клиническое применение радиоиндикаторов вошло в практику в 50-х годах. Развиваются методы, позволяющие детектировать наличие (радиометрия), кинетику (радиография) и распределение (сканирование) радиоиндикатора в исследуемом органе. Принципиально новый этап радиоизотопной визуализации связан с разработкой устройств широкого поля зрения (сцинтилляционные гамма-камеры) и метода визуализации — сцинтиграфии. Нередко термином «сцинтиграфия» обозначают исследования, проведенные с использованием как линейного сканера, так и сцинтиляционной гамма-камеры. С этим терминологическим стереотипом связано формирование неверных представлений о диагностических возможностях методов.
Сканирование и сцинтиграфия — это различные методы радиоизотопной визуализации. Сцинтиграфия существенно превосходит сканирование по объему и точности диагностической информации. Современные сцинтилляционные камеры представляют собой компьютеро-сцинтиграфические комплексы, позволяющие получать, хранить и обрабатывать изображения отдельного органа и всего тела в широком диапазоне сцинтиграфических режимов: статическом и динамическом, планарном и томографическом. Независимо от типа получаемого изображения оно всегда отражает специфическую функцию исследуемого органа. По сути, это картирование функционирующей ткани. Именно в функциональном аспекте заключается принципиальная отличительная особенность сцинтиграфии от других методов визуализации. Попытка взглянуть на результаты сцинтиграфии с анатомических или морфологических позиций — еще один ложный стереотип, влияющий на предполагаемую результативность метода.
Диагностическая направленность радиоизотопного исследования определяется используемым радиофармацевтическим препаратом (РФП). Что же такое РФП? Радиофармацевтический препарат — это химическое соединение с известными фармакологическими и фармакокинетическими характеристиками. От обычных фармацевтических средств он отличается не только радиоактивностью, но и еще одной важной особенностью — количество основного вещества настолько мало, что при введении в организм не вызывает побочных фармакологических эффектов (например, аллергических). Специфичность РФП по отношению к определенным морфофункциональным структурам определяет его органотропность. Понимание механизмов локализации РФП служит основой для адекватной интерпретации радионуклидных исследований. Введение РФП связано с небольшой дозой облучения, неспособной вызвать какие-либо неблагоприятные специфические эффекты. В этом случае принято говорить об опасности переоблучения, однако при этом не учитываются темпы развития современной радиофармацевтики.
Лучевая нагрузка определяется физическими характеристиками радиоиндикатора (период полураспада) и количеством введенного РФП. Сегодняшний день радионуклидной диагностики — использование короткоживущих радионуклидов. Наиболее популярным из них является технеций-99m (период полураспада — 6 часов). Этот искусственный радионуклид получают непосредственно перед исследованием из специальных устройств (генераторов) в форме пертехнетата и используют для приготовления различных РФП. Величины радиоактивности, вводимые для проведения одного сцинтиграфического исследования, создают уровни лучевой нагрузки в пределах 0,5-5% допустимой дозы. Важно подчеркнуть — длительность сцинтиграфического исследования, количество получаемых изображений или томографических срезов уже не влияют на «заданную» дозу облучения.
l Клиническое применение
Коротко остановимся на реальных диагностических возможностях наиболее распространенных («рутинных») сцинтиграфических исследований.
Визуализация костной системы (остеосцинтиграфия) — наиболее точный метод выявления участков нарушенного костного метаболизма. Остеотропные РФП (Тс-фосфонаты) обладают высоким сродством к кристаллам фосфата кальция, поэтому они связываются преимущественно с минеральным компонентом костной ткани. Уровень накопления РФП в различных типах костей и участках скелета обусловлен степенью остеобластической и метаболической активности, величиной кровотока, что необходимо учитывать при дифференциации нормального и патологического накопления РФП. В частности, повышенное накопление РФП наблюдается в метаэпифизарных отделах трубчатых костей, в областях с постоянной физической нагрузкой.
Заболевания костей сопровождаются патологической перестройкой костной ткани, реактивным или опухолевым костеобразованием — основными механизмами, обусловливающими изменение костного метаболизма и накопление остеотропных РФП в пораженных отделах. В зависимости от сочетания указанных процессов возрастает уровень накопления остеотропных РФП при опухолевых, воспалительных, дегенеративных, травматических заболеваниях.
Основная и наиболее ответственная задача остеосцинтиграфии — поиск метастатических и оценка распространенности опухолевых поражений скелета. Сцинтиграфическая манифестация патологии может проявиться на 3-12 месяцев раньше, чем появятся рентгенологические признаки. Связано это с тем, что локальное изменение обмена остеотропных РФП возникает на ранних фазах развития патологии, еще до появления не только рентгенологической, но и клинической симптоматики. По этой причине радионуклидное исследование обладает наибольшей эффективностью в до- и послеоперационном обследовании больных опухолями с высокой частотой метастазирования в кости (молочная железа, легкие, предстательная железа, почки).
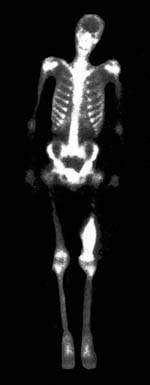 |
| Рисунок 1. Остеогенная саркома бедра. Обширная область высокого накопления РФП в дистальном отделе левого бедра |
Сцинтиграфическая манифестация метастатических поражений — множественные и реже одиночные локальные зоны высокого накопления РФП («горячие» очаги). Наиболее высокие концентрации РФП отмечаются в остеобластических и смешанных метастазах, низкие — в остеолитических. Ложноположительные ошибки чаще всего связаны с выраженными остеодистрофическими изменениями, а также с травматическими повреждениями ребер и позвоночника. Опухоли костей остеогенного происхождения отличаются наиболее высокой кумуляцией РФП. Например, остеогенная саркома отличается выраженной гиперфиксацией РФП не только в элементах самой опухоли, но и в окружающих мягких тканях за счет реактивной гиперемии (рис. 1). В опухолях неостеогенного происхождения накопление РФП более низкое. Однако практически не представляется возможным дифференцировать отдельные виды опухолей по степени накопления в них РФП. Некоторые опухоли, так же как и их метастазы, могут быть накоплением РФП. К таким опухолям относится, в частности, ретикулосаркома и множественная миелома. Визуализация почек (динамическая реносцинтиграфия) — простой и точный метод одновременной оценки функционального и анатомотопографического состояния мочевыводящей системы. В основу положена регистрация транспорта нефротропного РФП и последующий расчет параметров, объективизирующих два последовательных этапа.
Анализ сосудистой фазы (ангиофазы) направлен на оценку симметричности прохождения «болюса» по почечным артериям и относительных объемов крови, поступающих к каждой почке в единицу времени. Анализ паренхиматозной фазы предусматривает характеристику относительной функции почек (вклад в суммарную очистительную способность) и времени прохождения РФП через каждую почку или ее отделы. Клиническая интерпретация в значительной степени определяется механизмом элиминации РФП. В методах динамической визуализации могут быть использованы два вида РФП:
l гломерулотропные (производные ДТПА), практически полностью фильтруются клубочками и отражают состояние и скорость клубочковой фильтрации;
l тубулотропные (аналоги гиппурана) секретируются эпителием проксимальных канальцев и отражают состояние канальцевой секреции, а также эффективного почечного кровотока. Показания к исследованию включают урологическую и нефрологическую патологию, а также заболевания, где почки являются органами-мишенями.
При различных клинических ситуациях может меняться как форма кривых, так и их количественные характеристики. Следует, однако, подчеркнуть, что характер и величины изменений малоспецифичны для конкретной патологии и прежде всего отражают тяжесть патологического процесса. Наибольшая информативность реносцинтиграфии проявляется при дифференциации одно- или двустороннего поражения почек.
Ведущий признак, определяющий сторону поражения, — асимметрия амплитудно-временных характеристик ангионефросцинтиграмм. Асимметрия сосудистых параметров, и прежде всего выраженная разница времени поступления РФП в почечные артерии, — один из критериев стеноза почечной артерии. Симметричность изменений паренхиматозной функции более характерна, в частности, для гломерулонефрита; асимметрия — довольно постоянный признак пиелонефрита не только при одно-, но и при двустороннем процессе. Аналогичные изменения могут сопровождать различные варианты аномалий почек и верхних мочевых путей (нефроптоз, удвоение собирательной системы, гидронефроз).
В основе метода визуализации печени (гепатосцинтиграфии) лежит использование меченых коллоидов, которые после внутривенного введения фагоцитируются и распределяются в морфофункциональных структурах, содержащих клетки РЭС в соответствии с локальными значениями органного кровотока. В норме в печени локализуется более 90%, в селезенке — около 5%, а в костном мозге — менее 1% введенного радиоколлоида. В зависимости от характера и тяжести патологии эти соотношения меняются. Наиболее общим показанием к гепатосцинтиграфии является гепато- и/или спленомегалия неясного генеза. Основная задача исследования — дифференциация характера и уточнение тяжести поражения печени.
Диффузные заболевания печени манифестируются изменением размера и формы изображения, распределения радиоколлоида в печени и его внеорганного накопления, параметров фагоцитарной способности РЭС и печеночного кровотока. Следует подчеркнуть, что исследование не позволяет дифференцировать клинические или клинико-морфологические формы заболевания печени (например, хронический гепатит). Наибольшая информативность метода проявляется в возможности выявления синдрома портальной гипертензии (СПГ).
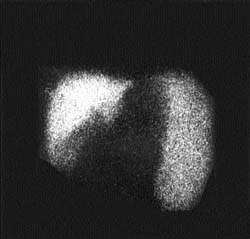 |
| Рисунок 2. Внепеченочная блокада портального кровообращения. Синдром портальной гипертензии манифестируется высоким захватом радиоколлоида увеличенной селезенкой |
Независимо от причин повышенного давления в системе воротной вены (внутри- или внепеченочные формы), сцинтиграфически СПГ манифестируется высоким захватом радиоколлоида и увеличенной селезенкой. Сочетание указанных признаков позволяет выявить СПГ с точностью до 98% (рис. 2). Очаговые поражения печени в зависимости от их распростаненности проявляются наличием одиночных или множественных дефектов накопления РФП в пределах одной или обеих долей печени (рис. 3). В практике нередко выявление участков, где отсутствует накопление РФП («холодные» очаги), прочно ассоциируют с объемными процессами, чаще всего опухолевого генеза. Это представление ложно. Достаточно широкий спектр заболеваний, связанных с вовлечением печени в патологический процесс, сцинтиграфически может манифестировать очаговыми изменениями как следствием локальных гемодинамических или функциональных нарушений (цирроз печени, амилоидоз, гистиоцитоз). Необходимо также помнить, что некоторые органные структуры (аномально расположенный желчный пузырь, молочная железа) могут «экранировать» изображение печени и формировать сцинтиграфический феномен «псевдоопухоли». Именно поэтому по характеру дефекта накопления РФП без учета клинической информации практически невозможно дифференцировать специфику очагового поражения.
A. | B.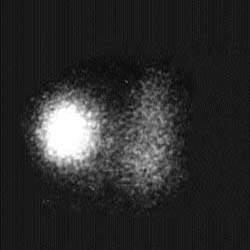 |
| Рисунок 3. Сцинтиграфические варианты узловых поражений щитовидной железы. «Холодный» узел нижнего отдела левой доли — коллоидная киста (А), «горячий» узел правой доли — тиреотоксическая аденома (Б) | |
Возможность выявления очаговой патологии зависит и от разрешающей способности гамма-камеры. Очаги менее 1 см, как правило, сцинтиграфически не манифестируются.
Визуализация желчевыделительной системы (гепатохолесцинтиграфия) основана на использовании серии гепатотропных РФП, аналогичных по своей фармакокинетике красителям (бромсульфалеин, вофавердин). После внутривенного введения они связываются с белками крови, поглощаются полигональными клетками печени и выводятся в составе желчи. Основным преимуществом гепатохолесцинтиграфии является непрерывность визуальной и количественной регистрации процесса кинетики РФП.
Визуальный анализ серии изображений позволяет выявить некоторые органические изменения желчных протоков (расширение), желчного пузыря (деформации), а также функциональные изменения двенадцатиперстной кишки.
Анализ кривых позволяет получить количественные критерии, характеризующие поглотительно-выделительную функцию печени, наполнение желчного пузыря, длительность латентного периода после желчегонного завтрака, скорость опорожнения желчного пузыря. Дискинезии желчного пузыря дифференцируются на основе изменения скорости его опорожнения (гипо- или гипермоторная дискинезия). Следует подчеркнуть, что точность радиологической оценки двигательной функции желчного пузыря превышает рентгенологическую или эхографическую. Это связано с тем, что при сравнении площадей изображения органа до и через фиксированное время после желчегонного завтрака практически невозможно учесть длительность латентного периода желчеотделения и выделить собственно фазу опорожнения желчного пузыря.
Гепатохолесцинтиграфия имеет ограниченное значение в диагностике воспалительной патологии и камней желчного пузыря. Первоочередная задача заключается в оценке тяжести нарушения проходимости шеечно-протоковой зоны и наполнения желчного пузыря. При полной обтурации пузырного протока возникает сцинтиграфический феномен «отключенного желчного пузыря».
Визуализация щитовидной железы (тиреосцинтиграфия) проводится с использованием Тс-пертехнетата и основывается на сходстве в поведении ионов йода и пертехнетата. Однако это сходство прослеживается только на начальной неорганической фазе внутритиреоидного транспорта. Пертехнетат, в отличие от йода, не переходит в органическую фазу, то есть не включается в состав тиреоидных гормонов. Эта особенность исключает возможность его использования при послеоперационном поиске метастазов рака щитовидной железы (последнее проводится только с радиоактивным йодом).
Узловые поражения щитовидной железы и дифференциальная диагностика выявленных клинически или эхографически узловых образований шеи — наиболее частое показание к тиреосцинтиграфии. Основная задача исследования — оценить степень функционирования узлов, идентифицировать солитарные или множественные образования, установить связь узлов с тиреоидной тканью. В зависимости от функциональной активности и степени накопления радиопертехнетата узлы традиционно разделяют на «горячие», «теплые» и «холодные». Однако такое деление относится только к их сцинтиграфической оценке.
Под термином «горячий» узел подразумевают ситуацию, когда РФП накапливается почти исключительно в области узла и не накапливается в других отделах органа. Подобные находки характерны для автономной тиреоидной ткани, токсической аденомы, аутоиммунного тиреоидита, врожденной аплазии доли. Отсутствие накопления РФП в окружающий узел ткани объясняется продукцией автономным узлом тиреоидных гормонов, уменьшающих выделение ТТГ и обусловливающих подавление функции нормальной ткани.
Функционально неактивные («холодные») узлы характеризуются отсутствием или резким снижением накопления радиопертехнетата. Эта менее специфическая находка сопровождает широкий спектр патологии: узловой зоб, коллоидные кисты, аденому, неспецифический струмит, в 15-25% случаев — рак щитовидной железы (рис. 3).
Наибольшие затруднения представляет идентификация «теплых» узлов. Эти узлы рассматривают как разновидность «горячих», но в отличие от последних в них отсутствует или слабо выражено функциональное подавление нормальной тиреоидной ткани. В силу этого накопление РФП в узлах может не отличаться от окружающей паренхимы и приводить к ложноотрицательным трактовкам данных сцинтиграфии.