Фиксация мазков микроорганизмов проводится чем
Фиксация мазков микроорганизмов проводится чем
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.

Окрашенные мазки. Отбор материала для микроскопии
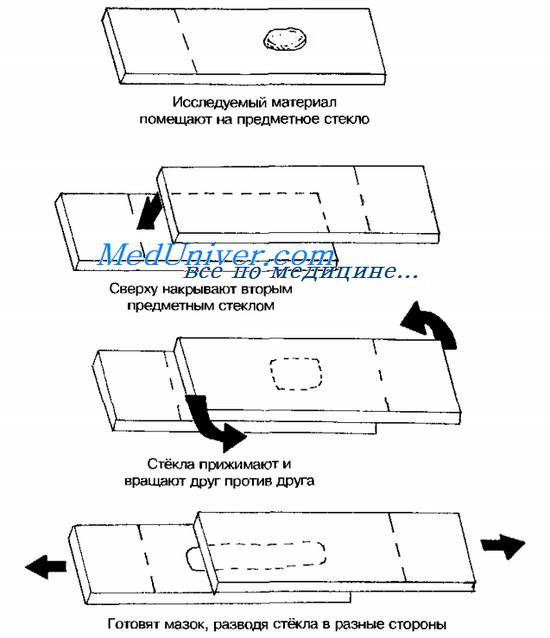
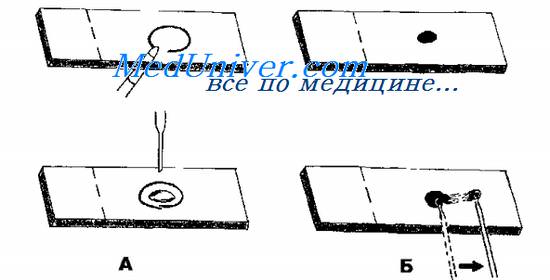
Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 11-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 11-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 11-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 11-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 11-10, Б).
Фиксация препарата. Фиксация мазка. Фиксация бактерий
В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светоопти-ческой микроскопии используют формалин, спирты, глутараль-дегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др.
Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Биологический материал со слизистых оболочек верхних дыхательных путей
Сбор материала для культуральных исследований и микроскопии необходимо проводить до назначения специфической противомикробной терапии. Несоблюдение данного условия может привести к ложноотрицательному результату исследования. материал берут натощак или через 3-4 ч после еды. Для более полного открытия глоточного отверстия рекомендуется по время забора материала надавливать шпателем на корень языка. Важно, чтобы при извлечении тампона он не касался зубов, щек, языка. Для сбора мазков из носоглотки и ротоглотки используются стерильные зонды, которые после сбора материала погружают в контейнеры с транспортной средой, обеспечивающей стабильность и сохранение ростовых свойств микроорганизмов. Тип зондов, состав транспортных сред, методику сбора, а также условия хранения и транспортирования клинического материала следует уточнить в инструкции к используемым реагентам.
Допускается лишь однократное замораживание–оттаивание материала.
Мазки со слизистой носоглотки и ротоглотки для выявления РНК/ДНК – рекомендуется совмещать мазки со слизистой носоглотки и ротоглотки в одной пробирке. Для этого сначала берут мазки разными зондами со слизистой нижнего носового хода, а затем из ротоглотки, при этом рабочие концы зондов после взятия мазков у пациента помещаются в одну пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков, и исследуются как один образец. Материал берется после полоскания полости ротоглотки кипяченой водой комнатной температуры. Если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание. В течение шести часов перед процедурой нельзя использовать медикаменты, орошающие носоглотку или ротоглотку и препараты для рассасывания во рту. Мазки со слизистой носоглотки берут сухим стерильным назофарингеальным велюр-тампоном на пластиковом аппликаторе. Зонд вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину до носоглотки, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (3–4 см для детей и 5–6 см для взрослых). После забора материала конец зонда с тампоном опускают в стерильную одноразовую пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков до места слома, при этом гибкая часть зонда сворачивается спиралью, далее, прикрывая сверху пробирку крышкой, рукоятку зонда опускают вниз, добиваясь полного отламывания верхней части зонда. Пробирку герметично закрывают. Мазки из ротоглотки берут сухими стерильными зондами из полистирола с вискозными тампонами вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки, аккуратно прижимая язык пациента шпателем. После забора материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с 500 мкл транспортной среды и зондом с мазком из носоглотки. Конец зонда с тампоном отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Смыв из ротоглотки для диагностики эпидемического паротита (выделение РНК). Перед взятием смывов из ротоглотки проводят предварительное полоскание полости рта водой. После этого проводят тщательное полоскание ротоглотки (в течение 10-15 с) 25-40 мл изотонического раствора натрия хлорида. Жидкость собирают через стерильную воронку в стерильный флакон на 50 мл.
Мазки из ротоглотки и носа для диагностики дифтерии, пневмококковой, стафилококковой, стрептококковой инфекции (культуральные исследования) – для взятия материала используется сухой стерильный ватный тампон, вмонтированный в пробку пробирки или готовые транспортные среды, отдельным тампоном из ротоглотки и из носа. Взятие мазков осуществляют натощак или не ранее двух часов после еды, не касаясь тампоном языка, внутренних поверхностей щек и зубов.
Мазки из ротоглотки и носа для диагностики менингококковой инфекции (культуральные исследования) – тампон вводят через ротовую полость ватным концом кверху за мягкое небо в носоглотку и проводят 2–3 раза по задней стенке. При извлечении из ротоглотки тампон не должен касаться окружающих тканей (зубы, слизистая щек, язык, небный язычок). После извлечения тампона содержащуюся на нем слизь засевают на чашки (сывороточный агар и сывороточный агар с линкомицином) или помещают в транспортную среду для немедленной доставки в лабораторию. Допускается применение коммерческих питательных транспортных сред разрешенных к применению в Российской Федерации в установленном порядке.
Мазки из носоглотки для диагностики гриппа (культуральные исследования) собирают стерильными зондами с вискозными тампонами из нижнего носового хода. Зонд с тампоном вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход глубоко, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (3–4 см для детей и 5–6 см для взрослых). После взятия материала тампон, не нарушая стерильности, помещают в пробирку с 2,0–5,0 мл вирусологической транспортной среды. Материал хранят в течение 24 ч при температуре 2–8°С, более длительно – при температуре не выше минус 16°С.
Мазки из носоглотки для диагностики коклюша (культуральные исследования) собирают стерильными зонд-тампонами с вискозным наконечником на алюминиевой основе, вмонтированный в пробку и пробирку с транспортной средой AMIES с активированным углем. Зонд извлекают из упаковки, вводят через носовые ходы и удерживают в носоглотке в течение 10 сек, чтобы он пропитался отделяемым слизистой носоглотки. После этого тампон извлекают, делая упор на боковую стенку носа, и немедленно помещают в пробирку с транспортной средой AMIES с активированным углем. Собранный материал необходимо исследовать в день получения (в исключительных случаях – хранить в холодильнике при температуре 2–8°С не более 12 ч).
Заднеглоточные мазки для диагностики коклюша (культуральные исследования) собирают стерильным зонд-тампоном с вискозным наконечником на алюминиевой основе, вмонтированным в пробку, вносят в пробирку с транспортной средой AMIES с активированным углем. Целесообразно использовать готовые комплекты. Зонд извлекают из упаковки, пробирку со средой вскрывают, конец зонда (на расстоянии 2 см от конца с тампоном) помещают в пробирку и изгибают под углом 135°, делая упор на внутренний край пробирки, и извлекают из пробирки. Аккуратно прижимая язык пациента шпателем, вводят изогнутый тампон в ротовую полость ниже язычка и собирают материал с задней стенки глотки, не задевая язык, слизистую оболочку щек и миндалины. Зонд с биоматериалом помещают в пробирку со средой AMIES, следя за тем, чтобы пробка, в которую вмонтирован тампон, плотно закрывала пробирку. Пробирки с транспортной средой AMIES до использования хранят при комнатной температуре. После взятия материала тампон, не нарушая стерильности, помещают в пробирку с 2,0–5,0 мл вирусологической транспортной среды. Собранный материал необходимо исследовать в день получения (в исключительных случаях – хранить в холодильнике при температуре 2–8°С не более 12 ч).
Метод «кашлевых пластинок» для диагностики коклюша (культуральные исследования): чашку со средой (Борде-Жангу или КУА с антибиотиками и добавлением 20% или 10% крови животных соответственно), хранящуюся при температуре 2–8°С, выдерживают при комнатной температуре, подносят на расстоянии 8–10 см ко рту кашляющего ребенка и удерживают ее в течение нескольких секунд (6–8 кашлевых толчков). Собранный материал необходимо исследовать в день получения (в исключительных случаях – хранить при температуре 2–8°С не более 12 ч).
Мазки со слизистой носоглотки для диагностики кори (культуральные и исследования, выделение РНК) – для взятия материала используют стерильный ватный тампон, которым протирают слизистую оболочку носоглотки с достаточным усилием, чтобы снять часть эпителиальных клеток. Тампоны помещают в маркированные стерильные пробирки с завинчивающимися крышками, в которых содержится 2–3 мл транспортной среды для вирусов. Если образец не может быть доставлен в вирусологическую лабораторию в течение 48 часов при температуре 4–8°С, пробирку с тампоном следует энергично встряхнуть так, чтобы смыть клетки, а затем извлечь тампон. Смывы центрифугируют при температуре 4°С при 500g (1500 об./мин) в течение 5 минут, затем осадок ресуспендируют в 2 мл питательной среды для клеточных культур.
Ресуспендированный осадок и надосадочную жидкость хранят раздельно при температуре –70°С и транспортируют в лабораторию на сухом льду в герметично закрытых флаконах, чтобы избежать попадания в них углекислоты.
Мазки из носоглотки для обнаружения антигенов внутриклеточных патогенов собирают стерильными зондами с вискозными тампонами из нижнего носового хода. Зонд с тампоном вводят легким движением по наружной стенке носа на глубину 2–3 см до нижней раковины. Затем зонд слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину глубоко (вплоть до слез у пациента), делают вращательное движение и удаляют вдоль наружной стенки носа. После взятия материала тампон помещают в пробирку с 3 мл 0,1 моль/л фосфатно-солевого буферного раствора. Для получения суспензии клеток тампон в пробирке тщательно отжимают о стенки пробирки, тампон удаляют, пробирку закрывают. Проводят центрифугирование в течение 5 мин при 3000 об/мин для осаждения клеток. Надосадочную жидкость осторожно удаляют, а осадок клеток ресуспендируют в нескольких каплях фосфатно-солевого буферного раствора и наносят на предметные стекла (не менее 3 шт.) раздельными каплями. Препарат высушивают и фиксируют 10 мин в охлажденном до 2–8°С химически чистом ацетоне. Фиксированные предметные стекла хранят при температуре 2–8°С не более 6–7 дней.
6.2. Микроскопия микроорганизмов в окрашенном виде
Тела микробных клеток в преобладающем большинстве случаев прозрачны и для того, чтобы увидеть четкие контуры микробных клеток, применяют метод биологического окрашивания.
Окрашенные тела микроорганизмов, отчетливо выделяясь на серебристо-белом фоне препарата, позволяют ориентировочно оценивать состав микробного пейзажа, изучаемого объекта; при применении специальных методов окраски исследуют некоторые анатомические структуры клетки: наличие капсул, спор, жгутиков, ядерного вещества, мембраны и т. д.
В качестве основных красок в микробиологии используют производные каменноугольной смолы, главным образом искусственные органические красители, получаемые из анилина (С6Н5NН2,), его производных и других ароматических аминов, ряда нафталина и антрацена.
В табл. 6.1 представлены наиболее употребляемые красители катионной и анионной групп.
Таблица 6.1. Наиболее употребляемые красители катионной и анионной групп
Нигрозин (индийские чернила)
Из сухих анилиновых красок готовят обычно насыщенные спиртовые растворы, которые, не изменяя своих свойств, могут храниться длительное время. Из насыщенных спиртовых растворов для окрашивания бактерий изготавливаются рабочие, разбавленные спиртовые растворы нужной концентрации.
Для окрашивания микроорганизмов пользуются преимущественно основными красителями.
6.2.1. Приготовление мазков для окрашивания
Мазки готовят из культур микробов, клинического материала (мокрота, гной, моча, кровь и др.), из биоптатов, органов трупов.
Техника приготовления мазков определяется характером исследуемого материала.
Для изучения взаимного расположения элементов ткани и находящихся в ней микроорганизмов делают мазки-отпечатки. Для этого вырезанный из середины органа небольшой кусочек ткани захватывают пинцетом и прикладывают поверхностью среза к предметному стеклу последовательно в нескольких участках, получая, таким образом, ряд мазков-отпечатков.
6.2.2. Высушивание и фиксирование мазков
Приготовленный на предметном стекле мазок высушивают на воздухе и после полного высыхания фиксируют. При фиксировании мазок закрепляется на поверхности предметного стекла, и поэтому при последующей окраске препарата микробные клетки не смываются. Кроме того, убитые микробные клетки окрашиваются лучше, чем живые.
Различают физический способ фиксации, в основу которого положено воздействие высокой температуры на микробную клетку, и химические способы, предусматривающие применение химических средств, вызывающих коагуляцию белков цитоплазмы.
Физический способ фиксации. Предметное стекло с препаратом берут пинцетом или I и II пальцами правой руки за ребра мазком кверху и плавным движением проводят 2–3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с. Надежность фиксации проверяют следующим простым приемом: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога.
Химический способ фиксации. Для фиксации мазков применяют также химические вещества и соединения (табл. 6.2).
Таблица 6.2. Химические вещества и соединения, применяемые для фиксации мазков
Приготовление, фиксация и окраска мазков крови
Подготовка стекол. Симптом крошковатости мазка крови. Фиксация мазков по Яхонтовой и парами фенола. Определение количества гемоглобина. Взятие крови для подсчета эритроцитов и лейкоцитов. Исследование мочи. Показатель анизоцитоза эритроцитов (RDW).
| Рубрика | Медицина |
| Вид | дипломная работа |
| Язык | русский |
| Дата добавления | 30.10.2011 |
| Размер файла | 53,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Приготовление, фиксация и окраска мазков крови
1. Подготовка стекол
Мазки крови делают на предметных стеклах с помощью более узкого шлифованного предметного стекла.
1. С предметных стекол, бывших в употреблении и соприкасавшихся с иммерсионным маслом, последнее удаляют сухой тряпкой или бензином. Затем стекла кипятят без мыла и соды в течение 15—20 мин, промывают чистой водой и погружают на 1 ч в насыщенный раствор двухромовокислого калия в серной кислоте. Обработанные таким образом стекла промывают в течение не менее 1 ч под струей водопроводной воды и насухо вытирают чистым полотенцем.
2. При отсутствии двухромовокислого калия и серной кислоты стекла, бывшие в употреблении, кладут в мыльный раствор и выдерживают в нем 8—10 ч, а затем в том же растворе кипятят их 5—10 мин.
От более длительного кипячения стекла делаются мутными.
После кипячения стекла вынимают и тщательно промывают под струей водопроводной воды, а затем насухо вытирают.
3. Стекла, не бывшие в употреблении, промывают в горячей воде и насухо вытирают. Хранят стекла в стеклянной широкогорлой банке с крышкой.
2. Приготовление мазков
Взяв предметное стекло за длинные края, прикасаются его поверхностью (отступя 0,5—1 см от узкого края) к капле крови (но не к коже). Предметное стекло держат на столе или в левой руке за узкие края. Правой рукой приставляют шлифованное стекло узким краем к стеклу с кровью слева от капли под углом 45° и продвигают его вправо до соприкосновения с кровью.
Выжидают, пока кровь расплывется по всему ребру шлифованного стекла, и затем легким быстрым движением ведут его справа налево до тех пор, пока не будет исчерпана вся капля. Капля крови должна быть небольшой и соразмерена так, чтобы весь мазок помещался на стекле, не доходя 1—1,5 см до его края. Нельзя прекращать размазывание и отнимать стекло раньше, чем капля будет исчерпана. Нельзя также сильно нажимать на стекло, так как многие клетки могут оказаться поврежденными. Хорошо сделанный мазок тонок, имеет желтоватый цвет и оканчивается «метелочкой».
Густо-розовые и красноватые мазки непригодны для счета, так как они слишком толсты и клеточные элементы при этом дифференцировать невозможно. После приготовления мазки быстро сушат на воздухе до исчезновения влажного блеска. При медленном высыхании может изменяться морфология клеток.
На высушенном мазке уголком предметного стекла или карандашом (только не химическим) пишут фамилию, инициалы больного, дату. При необходимости переслать мазок с консультационной целью в другой город мазок рекомендуется делать на хорошо отмытой использованной рентгеновской пленке, нарезанной по размеру предметного стекла.
Такие мазки можно пересылать в письмах.
Симптом крошковатости мазка крови.
При заболеваниях, протекающих с повышенным содержанием фибриногена в крови, мазок, сделанный на предметном стекле, имеет крошковатый характер. На этот простой, и доступный признак рекомендуется обратить особое внимание при взятии крови.
Обработка мазков фиксирующими жидкостями, придающими форменным элементам стойкость по отношению к содержащейся в красках воде, которая без фиксации мазков гемолизирует эритроциты и изменяет строение лейкоцитов. Кроме того, фиксация, вызывая коагуляцию белка, прикрепляет препарат к стеклу.
Посуда и аппаратура.
2. Специальная посуда для фиксации или стаканы, обрезанные до высоты 6—6,5 см.
3. Штатив для сушки мазков на воздухе.
4. Предметные стекла.
Химически чистый метиловый спирт (метанол) или 96° этиловый спирт, или денатурированный спирт, или смесь Никифорова, состоящая из равных количеств этилового спирта и серного эфира.
Лучшим фиксатором является метиловый спирт.
По окончании срока фиксации препараты вынимают пинцетом, сушат на воздухе или ополаскивают в банке с нейтрализованной дистиллированной водой и укладывают мазками кверху на стеклянный мостик для окраски.
4. Фиксация мазков по Яхонтовой
Повышение качества фиксации этиловым спиртом за счет предварительной обработки его цитратом и оксалатом натрия.
Посуда и аппаратура.
1. Цилиндры емкостью 100 мл.
2. Пипетки, стеклянные палочки для размешивания.
5. Специальная посуда для фиксации или стаканы, обрезанные до высоты 6—6,5 см.
6. Штатив для высушивания мазков на воздухе.
Готовят 2 реактива.
1. В цилиндр емкостью 100 мл вносят 1,5 г цитрата натрия, приливают 1,5 мл дистиллированной воды, размешивают стеклянной палочкой и для ускорения растворения помещают цилиндр в горячую водяную баню. В полученный слегка мутноватый раствор приливают этиловый спирт до объема 100 мл и тщательно, в течение 5—8 мин, размешивают. При размешивании на дне цилиндра образуется клейкое белое вещество, тянущееся за палочкой.
Раствор оставляют в покое на сутки для отстаивания.
2. Реактив готовят так же, как и предыдущий, но вместо цитрата натрия берут оксалат натрия.
Прозрачные реактивы 1 и 2 через сутки после их приготовления сливают в равных количествах и в этой смеси фиксируют сухие мазки крови в течение 20—30 с, после чего их подсушивают на воздухе (можно и не сушить!) и окрашивают.
Если при окраске эритроциты получаются не бледно-розовые, а серовато-розовые, то прибавляют раствор цитрата натрия в большем количестве. Качество окраски при такой фиксации получается хорошее, поэтому при отсутствии метилового спирта может быть применен описанный выше фиксатор.
5. Фиксация мазков парами фенола (по Сюткину)
Получение хорошего качества фиксации мазков при отсутствии спирта.
Посуда и аппаратура.
2. Стеклянный мостик для мазков.
1. Кристаллический фенол.
2. Дистиллированная вода.
В эксикаторе заменяют фарфоровую подставку на стеклянный мостик для мазков. Притираемые поверхности эксикатора и его крышки смазывают вазелином. На дно эксикатора наливают жидкий фенол (90 весовых частей кристаллического фенола и 10 весовых частей дистиллированной воды) из расчета 100 мл на 1,4 л объема эксикатора. В близи эксикатора на стене вешают термометр. Приготовленные обычным способом сухие мазки крови помещают в эксикатор на мостике в один ряд намазанной поверхностью вниз.
По истечении этого времени мазки вынимают, раскладывают на столе намазанной поверхностью кверху. Время выветривания мазков должно быть не менее времени фиксации. Время фиксации мазков крови парами фенола может быть сокращено до 1ч-1ч30мин в условиях термостата при 28—30°.
Время освобождения от паров фенола при воздействии его в течение 10— 20 мин может быть в срочных случаях сокращено до 5 мин путем подогревания при 37° в термостате, сушильном шкафу, на батареях водяного отопления или выветриванием настольным электровентилятором.
Если применяют жидкий фенол, качество которого бывает различным, то время фиксации может не совпасть с указанным выше.
В этом случае во избежание ошибок производят пробную фиксацию нескольких мазков в течение 3; 5; 10; 15; 20; 25 мин.
После окраски мазков отбирают те из них, в которых хорошо выражена нейтрофильная зернистость и отсутствует гемолиз эритроцитов. То же проделывают при возможных колебаниях комнатной температуры.
По отобранным мазкам составляют таблицу времени фиксации парами фенола в зависимости от температуры в комнате.
Недостаточная фиксация мазков дает слабую окраску нейтрофильной зернистости, а недостаточное освобождение мазков от паров фенола ведет к гемолизу эритроцитов при окраске или окрашиванию мазка в красный цвет.
Краску следует готовить на воде нейтральной реакции.
Все предложенные методы окраски мазков основаны главным образом на химическом сродстве основных частей клеток к определенным анилиновым краскам и в меньшей степени на их физических свойствах. Цитоплазма одних клеток, будучи щелочной, имеет сродство к кислым краскам, выявляя оксифильные элементы крови. Цитоплазма других клеток, содержащих базофильные и нейтрофильные субстанции, поглощает и кислые, и основные краски. Ядра, содержащие в значительном количестве нуклеиновую кислоту, связывают главным образом основные краски.
Определение рН воды.
Концентрацию водородных ионов (рН) воды определяют с помощью рН-метра, или индикаторных бумажек.
Нейтрализация дистиллированной воды.
Более удобен способ нейтрализации буферными смесями.
Для этого готовят 1/15 н. растворы:
1) динатрийфосфата (Na2HPO4*2Н20), высушенного в теплом месте в течение 5 сут, растворением 11,876 г его в 1 л дистиллированной воды
2) монофосфата калия (КН2РО4) растворением 9,078 г его в 1 л дистиллированной воды. Эти растворы хранят в темном месте с прибавлением кристаллика тимола для предотвращения образования плесени.
Пользоваться ими можно до образования в них хлопьев.
Рабочую смесь готовят смешиванием 7 частей первого раствора с 3 частями второго.
Определяют рН дистиллированной воды, подлежащей нейтрализации. Допустим, что рН воды 5,2, тогда к 100 мл дистиллированной воды прибавляют 4,5—5 мл указанной выше буферной смеси, перемешивают и вновь определяют рН. Если рН будет 6,8—7,0, т. е. требуемая, то, исходя из этого, высчитывают по простому тройному правилу количество буферного раствора, которое необходимо добавить ко всему количеству дистиллированной воды, подлежащей нейтрализации.
7. Окраска по Романовскому
Окрашивание различных элементов клеток в разные цвета и оттенки смесью основных (азур II) и кислых (водорастворимый желтый эозин) красок.
Посуда и аппаратура.
1. Колба или бутыль емкостью 1 л.
2. Измерительные цилиндры емкостью 250 мл.
3. Цилиндры для разведения красок емкостью 100 мл.
4. Градуированная пипетка.
5. Штатив для мазков.
6. Кювета со стеклянным мостиком для окраски.
В продаже имеется готовый раствор краски Романовского, а также сухая краска Романовского (Гимзы), из которой приготовляют раствор следующим образом: 3,8 г сухой краски Романовского растворяют в 250 мл чистого метилового или этилового спирта (последний хуже).
Раствор оставляют на 3—5 сут, часто взбалтывая для лучшего растворения краски.
Затем прибавляют 250 мл чистого глицерина и вновь оставляют на 3—5 сут, периодически взбалтывая. Приготовленная таким образом краска хорошо сохраняется длительное время в темных бутылях в шкафу, где нет ни кислот, ни щелочей.
Вновь полученный или приготовленный раствор красителя Романовского перед употреблением оттитровывают, т. е. окрашивают несколько фиксированных мазков крови в течение 25—40 мин различно разведенной краской (1—2 капли краски на 1 мл дистиллированной воды). По хорошо окрашенному препарату устанавливают нужное количество капель краски на 1 мл воды и время окрашивания.
Фиксированные мазки укладывают на мостик, состоящий из двух стеклянных палочек, уложенных на два противоположных края кюветы.
Затем мазки заливают разведенной краской, которую наливают на мазок возможно более высоким слоем. Окрашивание длится в зависимости от температуры воздуха в помещении от 25 до 45 мин.
Если температура в помещении низкая или требуется быстрее окрасить мазки, то разведенную краску можно подогреть до 60—70° (до кипения доводить нельзя).
После окончания окраски краску смывают (но не сливают) сильной струей воды и ставят мазки вертикально в деревянный штатиз для просушивания.
Разведенной краской можно пользоваться только в течение одного дня.
8. Окраска по Романовскому в модификации Филипсона
1.Одну часть готовой краски Романовского и 3 части этилового спирта (ректификата) тщательно смешивают. Краска сразу же пригодна к употреблению, но можно готовить ее и заранее.
2. Дистиллированная вода нейтральной реакции.
9. Окраска по Лейшману
Способ Лейшмана отличается от предыдущего лишь применяемым красителем и продолжительностью периодов фиксации и окраски. При этом способе применяют краситель, получаемый растворением смеси азура I, метиленового синего и желтого водорастворимого эозина в количестве 0,2 г в 10 мл абсолютного метилового спирта.
Продолжительность фиксации неразбавленным красителем 3—4 мин, а окраски с равным количеством воды 5—10 мин.
10. Способы быстрой окраски мазков краской Романовского по Алексееву
Посуда и аппаратура.
1. Разведенная краска Романовского (1,5 капли краски на 1 мл дистиллированной воды).
2. Краситель Лейшмана для второго метода (растворяют 4 г сухой краски в 1 л метилового спирта и хранят в темной посуде).
3. Чистый метиловый спирт.
4. Нейтральная дистиллированная вода.
5. Фильтровальная бумага.
1. На сухой нефиксированный мазок наносят глазной пипеткой 6—10 капель краски Романовского, распределяя ее той же пипеткой равномерным слоем. Через 30 с другой пипеткой добавляют к краске по каплям удвоенное количество подогретой до 50—60° дистиллированной воды. Покачиванием препарата перемешивают краску с водой и оставляют на 3 мин в покое, затем смывают ее дистиллированной водой и высушивают мазок фильтровальной бумагой. При этом методе окраски частично гемолизируются эритроциты, однако клетки белой крови не изменяются.
При втором способе, приводимом ниже, результаты получаются лучшей окраска препаратов мало отличается от обычной окраски по Романовскому.
2. На сукой нефиксированный мазок наливают равномерным слоем 10—12 капель краски Лейшмана. Через 20—30 с, не сливая краску, добавляют к ней нагретый до 50—60° раствор краски Романовского в количестве, способном удержаться на препарате. Через 3 мин, не сливая краску, смывают ее сильной струей дистиллированной воды и высушивают препарат фильтровальной бумагой.
11. Окраска по Нохту
Воздействие на фиксированный мазок водного раствора смеси основной (азур II) и кислой краски (эозин).
см. «Окраска по Романовскому».
1. Раствор 1 г азура II в 1 л дистиллированной воды.
2. Раствор 1 г водорастворимого желтого эозина в 1 л дистиллированной воды.
Каждый из этих растворов хорошо перемешивают и оставляют созревать при ежедневном встряхивании на 10—14 дней.
Перед окрашиванием раствор красителя готовят смешиванием 25 мл раствора 1,
20 мл раствора 2 с 55 мл нейтральной дистиллированной воды (пропорции вновь приготовленных растворов иногда приходится подбирать эмпирически).
Краситель наливают на фиксированный мазок, и окрашивание длится в зависимости от температуры воздуха 25—45 мин. Затем краситель смывают и мазки высушивают на воздухе.
Комбинированная окраска фиксатором-красителем Мая—Грюнвальда и краской Романовского, дающая возможность очень хорошо дифференцировать составные части клеток.
1. Готовый краситель-фиксатор Мая—Грюнвальда, состоящий из эозин метиленового синего в метиловом спирте.
2. Свежеприготовленный раствор краски Романовского
(1—2 капли краски на 1 мл дистиллированной воды).
3. Нейтральная дистиллированная вода.
При отсутствии готового красителя-фиксатора Мая-Грюнвальда его можно приготовить растворением 0,3-0,5 г сухой краски Мая-Грюнвальда в 100 мл чистого метилового спирта с добавлением (или без него) 50 мл чистого глицерина.
Краситель в обоих случаях созревает 4 дня при комнатной температуре.
На нефиксированный мазок наливают пипеткой 10—15 капель готового красителя-фиксатора Мая—Грюнвальда, через 3 мин прибавляют по каплям столько же воды и продолжают окрашивание еще 1 мин, после чего краситель смывают водой и мазок высушивают на воздухе.
Затем на высушенный мазок наливают свежеприготовленный водный раствор красителя Романовского на 8—15 мин в зависимости от температуры в помещении, смывают краску водой и мазок высушивают на воздухе. Этот способ окраски является наилучшим.
13. Окраска по Райту
Применение специально приготовленного красителя-фиксатора, дающего наиболее четкую окраску зернистости гранулоцитов особенно базофилов.
Посуда и аппаратура.
1. Стеклянные колбы емкостью 250 и 1000 мл.
4. Измерительный цилиндр емкостью 500 мл.
5. Штатив для мазков.
6. Мостик для окраски с кюветой.
Краситель-фиксатор: 1% раствор медицинского метиленового синего на 0,5% водном растворе двууглекислого натрия наливают в сосуд так, чтобы высота слоя не превышала 6 см, и нагревают в аппарате Коха при 100° в течение часа с момента образования пара. Затем жидкость охлаждают и фильтруют. Фильтрат при искусственном освещении в тонком слое должен иметь пурпурно-красный оттенок.
К 100 мл фильтрата прибавляют 500 мл 0,1% водного раствора эозина (желтого, водорастворимого). При смешении обеих жидкостей тотчас же образуется обильный осадок, который отфильтровывают и высушивают. Полученный краситель растворяют в чистом метиловом спирте в соотношении 0,1 : 60.
На сухой нефиксированный мазок наливают несколько капель краски, спустя 1 мин прибавляют столько же капель дистиллированной воды. Через 2—3 мин препарат промывают в воде (около полминуты), пока он в тонком слое не приобретает розового оттенка.
14. Приготовление и окраска толстой капли
Использование большего объема крови с целью улучшения условий обнаружения в крови малярийных плазмодий, спирохет возвратного тифа, эозинофилов и полихроматофилов.
Посуда и аппаратура.
1. Предметные стекла.
2. Мостик для окраски с кюветой.
3. Штатив для сушки мазков.
1. Краска Романовского.
2. Дистиллированная вода.
Приготовляют обычный мазок крови и на толстые места его наносят отдельно две большие капли крови. Каждую каплю концом иглы или углом другого стекла размазывают до величины двух- или трехкопеечной монеты и сушат на воздухе.
Мазок до нанесения толстых капель и после не фиксируют, а наливают на него на несколько минут дистиллированную воду для извлечения гемоглобина. Окрашенную гемоглобином воду затем осторожно сливают и на препарат наливают разведенную, как обычно, краску Романовского на 20—30 мин. После окраски препарат осторожно промывают водой, чтобы не смыть каплю, и высушивают на воздухе.
Больший объем крови, чем в мазках, и гемолиз эритроцитов позволяют легче обнаружить в крови малярийные плазмодии, спирохеты возвратного тифа, а также эозинофилы и полихроматофилы.
При хорошей фиксации и окраске любым из приведенных выше способов ядра лейкоцитов окрашиваются в вишнево-красный цвет с хорошо видимой структурой хроматина,
Приведенные методы окраски дают возможность дифференцировать вид клеток, особенности структуры их ядер и цитоплазмы и патологические изменения в них.
15. Окраска патологической (токсигенной) зернистости нейтрофилов по Шмелеву
Окрашивание патологической зернистости нейтрофилов в кислых растворах азура II и эозина
(начиная с рН 5,4). При этом в норме зернистость не выявляется и цитоплазма нейтрофилов окрашивается в гомогенно-розовый цвет.
Посуда и аппаратура.
1. Специальная посуда для фиксации или стаканы, обрезанные до высоты 6—6,5 см.
3. Остальное см. «Окраска по Романовскому».
2. Монофосфат калия.
4. Водорастворимый желтоватый эозин.
5. Дистиллированная вода.
6. Фильтровальная бумага.
Приготовление буферного раствора.
11,876 г высушенного в теплом месте в течение 5 сут двуводиого дифосфата натрия (Na2HP04*2H20) растворяют в 1 л дистиллированной воды;
9,078 г монофосфата калия (КН2Р04) также растворяют в 1 л дистиллированной воды.
Для получения буферной смеси рН 5,4 0,4 мл полученного раствора дифосфата натрия смешивают с 9,6 мл раствора монофосфата калия.
Краситель готовят из 0,1% водного раствора азура II и 0,1% водного раствора водорастворимого желтоватого эозина. Смешивают 10 мл фосфатной буферной смеси с 2,5 мл 0,1% водного раствора азура II и 1,5 мл 0,1% водного раствора эозина.
При правильной окраске наряду с нейтрофилами, цитоплазма которых содержит фиолетовые зерна (патологическая зернистость), встречаются клетки с совершенно гомогенной розовой цитоплазмой. При слишком кислой смеси лейкоциты почти не окрашиваются.
При щелочной среде зернистость выявляется во всех нейтрофилах.
В этих случаях нужно немного увеличить количество или дифосфата натрия, или монофосфата калия. Индикатором точности реакции буферной смеси служат мазки крови.
16. Окраска патологической (токсигенной) зернистости по Фреифельд
Посуда и аппаратура см. «Окраска по Романовскому» и водяная баня.
1. 1 г основного фуксина растворяют при слабом нагревании в 15 г 96° этилового спирта, охлаждают и к спиртовому раствору добавляют 100 мл 5% раствора карболовой кислоты.
2. 1% водный раствор метиленового синего.
Оба красителя можно хранить в отдельности практически неограниченное время.
Рабочую смесь готовят непосредственно перед окраской, так как она непригодна для хранения.
К 20 мл водопроводной воды приливают 7 капель первой краски, смешивают, прибавляют 5 капель второй краски и снова смешивают.
Мазки крови, фиксированные 3 мин в метиловом спирте, красят 1 час рабочей смесью красителя, а затем краситель смывают водой и мазки высушивают.
Препарат, уже окрашенный по Романовскому, может быть окрашен этим способом без предварительного обесцвечивания.
В цитоплазме лейкоцитов выявляется синеватая сеточка со всеми переходами к образованию крупных комочков. Количество клеток с патологической зернистостью в цитоплазме выражают в процентном отношении; например, количество всех нейтрофилов 75%, из них с патологической зернистостью 48%
Наличие в цитоплазме нейтрофилов патологической зернистости имеет большое значение для оценки состояния больного при инфекционных процессах, при сепсисе, новообразованиях, интоксикациях и других заболеваниях.
17. Окраска для выявления базофильной пунктации эритроцитов по Фреифельд
Базофильная зернистость эритроцитов хорошо воспринимает щелочной раствор метиленового синего.
Посуда и аппаратура см.
«Окраска по Романовскому».
1. 1% водный раствор метиленового синего.
Мазок фиксируют в течение 3 мин в метиловом спирте, а затем окрашивают в течение часа раствором метиленового синего (5 капель 1% раствора на 20 мл водопроводной воды).
Краску смывают водой и мазок высушивают.
Базофильную пунктацию можно обнаружить и в мазках крови, окрашенных обычными способами по Романовскому, Паппенгейму—Крюкову и др.
В этом случае она приобретает фиолетово-синий цвет.
Обычно сосчитывают 10 000 эритроцитов и отмечают количество эритроцитов с базофильной пунктацией. Лучше считать 1 000 000 эритроцитов, а ответ давать в пересчете на 10 000.
У здоровых людей количество эритроцитов с базофильной пунктацией колеблется от 0 до 3—4 на 10 000 эритроцитов.
Число эритроцитов с базофильной пунктацией увеличивается в крови плода, при некоторых анемиях, отравлении тяжелыми металлами (свинец, висмут, цинк, ртуть). Однако этот симптом не является специфичным для какого-либо заболевания.
Увеличение количества эритроцитов с базофильной пунктацией не всегда наблюдается даже при свинцовом отравлении.
18. Техника взятия крови
Прежде чем приступить к взятию крови у больного, нужно знать, для какой цели ее берут и какое количество крови нужно для анализа.
Место взятия крови. Если нужно взять несколько капель крови, ее берут из мочки уха или из мякоти третьей фаланги пальца руки. В клинических и больничных учреждениях чаще берут кровь из пальца. Когда нужно получить несколько миллилитров крови, ее берут из вены предплечья.
Время взятия крови. Важен также момент взятия крови. Для определения количества лейкоцитов нужно брать кровь натощак, так как после еды может быть пищеварительный лейкоцитоз.
Брать кровь у больного следует таким образом, чтобы возможность внесения инфекции в рану была полностью исключена. Инструменты должны быть простерилизованы кипячением или обеззаражены спиртом. От кипячения скальпель и ланцеты тупятся, а у иглы Франка для взятия крови часто ржавеет пружина. Стерилизация спиртом ланцета иглы Франка недостаточна, в связи с чем не исключена возможность занесения инфекции в ранку пальца.
Поэтому в настоящее время применяют иглу-скарификатор со сменными копьями (иглами), устроенными наподобие иглы Франка. К игле-скарификатору приложено 16 съемных копий (игл), которые кипятят и сменяют после каждого взятия крови.
Часто предпочитают брать кровь из пальца простыми инструментами (оспопрививательными перышками, иглой от шприца и др.), которые стерилизуются кипячением.
Стерилизация кожи больного и медсестры. Кожу на том месте, где должна быть взята кровь, протирают спиртом, а затем эфиром. Если кожа загрязнена, ее тщательно (щеткой) моют водой с мылом. Не нужно слишком растирать кожу, чтобы не вызвать гиперемии: последняя может дать местные изменения состава крови, в результате чего получится неправильный результат анализа.
Медицинская сестра перед взятием крови у больного должна тщательно вымыть руки с мылом и протереть их спиртом. Место укола и инструменты должны быть сухими. В противном случае кровь, выходя на поверхность кожи, смешается с водой или со спиртом и изменит свой состав. Если кожа сухая, то кровь не расплываегся и выступает на поверхность в виде шарика.
Первым и вторым пальцами левой руки захватывают с боков третью фалангу пальца больного и приставляют к ее мякоти перпендикулярно к поверхности колющий инструмент, который держат в правой руке. Слегка нажимая, производят прокол поверхности слоя кожи, вполне достаточный для получения нескольких капель крови.
Силу нажима нужно соразмерять с толщиной кожи больного. Укол должен быть настолько глубоким, чтобы кровь самостоятельно выступила на поверхность кожи.
Первую выступившую каплю стирают кусочком стерильной марли, так как кровь в ней может быть изменена вследствие некоторого разрушения тканей в результате укола.
Кровь для исследований берут из последующих капель. После взятия крови к месту укола прикладывают кусочек стерильной марли или ваты и предлагают больному прижать ее другим пальцем. В большинстве случаев этого бывает вполне достаточно, чтобы кровь быстро остановилась.
Если кровотечение не прекращается, накладывают маленькую давящую повязку.
Как взять кровь из вены, рассказано в курсе по общему уходу за больным.
19. Определение количества гемоглобина
По обе стороны центральной пробирки с исследуемым раствором укреплены две запаянные пробирки, содержащие стандартный раствор сернокислого гематина. Сзади в корпус вмонтировано матовое
стекло. К гемометру прилажены пипетка, которой насасывают кровь, пипетка для прибавления воды и палочка для размешивания. Так как раствор солянокислого гематина, заключенный в стандартных пробирках, постепенно выцветает, в новых приборах пробирки заменены сплошными стеклянными палочками соответствующего цвета, которые не подвержены выцветанию.
Перед взятием крови в совершенно чистую и сухую пробирку до метки 10 наливают децинормальный1 раствор соляной кислоты. Кровь берут из пальца, насасывая ее капиллярной пипеткой до метки 20 мм3. Кончик пипетки обтирают кусочком ваты, опускают до дна пробирки и осторожно выдувают кровь в раствор. Затем раствор втягивают и выдувают обратно в пробирку несколько раз, чтобы промыть оставшуюся в ней кровь. Вследствие смешивания крови с соляной кислотой гемоглобин переходит в солянокислый гематин и раствор приобретает коричневый цвет. Через несколько минут в раствор прибавляют пипеткой по каплям дистиллированную воду и помешивают стеклянной палочкой до тех пор, пока цвет раствора исследуемой крови не сравняется с цветом боковых стандартных пробирок. Деление пробирки, которое будет соответствовать уровню раствора, укажет количество единиц содержания гемоглобина в исследуемой крови. Разумеется, чем больше гемоглобина в крови, тем больше ее нужно разбавлять водой, чтобы окраска сравнялась со стандартами.
20. Взятие крови для подсчета эритроцитов и лейкоцитов
Смесители. Для подсчета форменных элементов кровь набирают в специальные смесители, в которых для облегчения счета разбавляют ее в определенной пропорции. Смесители представляют собой капиллярные пипетки, заканчивающиеся небольшим стеклянным резервуаром, в котором свободно лежит небольшая стеклянная бусинка. Пипетка смесителя для счета красных кровяных телец посредине имеет метку 0,5, в конце— 1,0 а в месте, где оканчивается резервуар,— 101. Пипетка смесителя для счета лейкоцитов имеет такие же деления, но только резервуар ее меньше и в конце его стоит метка 11.
Взятие крови в смесители. Смесители должны быть абсолютно чисты и сухи, а бусинка должна совершенно свободно кататься
По окончании насасывания раствора смеситель хорошо встряхивают, зажав его концы.
21. Приготовление мазков крови и толстой капли
Чтобы увидеть под микроскопом форменные элементы крови или микроорганизмы, нужно тонким равномерным слоем нанести кровь на предметное стекло. Техника приготовления мазка крови очень проста, но требует определенных точных приемов.
Чтобы мазок был правильно приготовлен, удобнее всего пользоваться предметными стеклами; на них наносят каплю крови и затем размазывают ее покровным стеклышком. Для приготовления мазка требуется только 1—2 капли крови. Сделав укол в палец, к выступившей капле, не касаясь пальца, прикладывают предметное стекло с какого-либо одного края. После этого стекло поворачивают каплей вверх и берут его первым и третьим пальцами левой руки. Первым и вторым пальцами правой руки берут покровное стеклышко, приставляют его плотно ребром к предметному стеклу, приблизительно под углом в 45°, подводят к капле крови и, после того как кровь распределится вдоль ребра покровного стеклышка, быстро проводят им по предметному стеклу; при этом получается тонкий равномерный мазок крови (52). После приготовления мазков предметные стекла на 5—10 минут кладут вверх той стороной, на которой размазана кровь, чтобы дать ей высохнуть.
В некоторых случаях бывает нужно приготовить не тонкий слой крови, а толстый. Это бывает необходимо, когда в крови ищут микроорганизмы, например плазмодии малярии, которых может быть настолько мало, что в тонком слое найти их будет чрезвычайно трудно. Для этого приготовляют так называемую толстую каплю. На предметное стекло наносят большую каплю крови и иглой размазывают ее до величины десятикопеечной монеты; стекло кладут вверх той стороной, на которой размазана кровь, чтобы она высохла.
Диагностическое значение имеет не только общее количество лейкоцитов, но и количество различных их видов, которое в норме тоже вполне определенно. Различного вида лейкоциты отличаются тем, что их ядра и протоплазма по-разному окрашиваются одними и теми же красками.
Процентное отношение различных видов лейкоцитов к общему их числу называется лейкоцитарной формулой.
Таким образом, у здорового человека с нормальным составом крови лейкоцитарная формула может в известных пределах видоизменяться. В патологических случаях лейкоцитарная формула изменена значительно, независимо от общего количества белых кровяных телец:
При лейкоцитозе обычно наблюдается не равномерное увеличение количества лейкоцитов всех видов, а увеличение лишь одного или двух—трех видов; при этом число других видов лейкоцитов может даже уменьшаться. Многие болезни, особенно инфекционные, имеют свою определенную формулу, характерную для каждой из них. Так, для туберкулеза характерно увеличение числа лимфоцитов. Увеличение количества эозинофилов наблюдается при различных видах глистов, при бронхиальной астме и при других аллергических состояниях. При крупозном воспалении легких и при всевозможных септических (гнойных) заболеваниях наблюдается нейтрофильный лейкоцитоз, т. е. лейкоцитоз за счет увеличения нейтрофилов. Из этого видно, какое большое значение имеет лейкоцитарная формула для установления диагноза.
22. Определение скорости оседания эритроцитов
В норме скорость оседания эритроцитов равна 4—10 мм в час, в патологических же случаях она доходит до 20—40— 50 мм и даже больше. Во многих случаях реакция оседания эритроцитов (РОЭ) имеет диагностическое и прогностическое значение.
Для определения скорости оседания эритроцитов обычно пользуются способом Панченкова. Т. П. Панченков предложил для этой цели очень простой прибор (53), состоящий из штатива, на котором устанавливают вертикально одновременно четыре пипетки, диаметром 1 мм, градуированные от 0 до 100.
Чтобы кровь не свертывалась, ее при получении сразу же смешивают с 5% раствором лимоннокислого натрия. Перед взятием крови пипетку ополаскивают этим раствором, после чего наполняют этим же раствором наполовину, т. е. до метки 50, и выпускают раствор в заранее приготовленное часовое стекло. Затем набирают кровь из мякоти пальца в эту же пипетку до деления 0 и сразу выпускают ее на часовое стекло; затем набирают вторично и снова выпускают. Раствора было взято до метки 50, а крови 2 раза до метки 0; значит, соотношение количества раствора лимоннокислого натрия к количеству крови будет равно 1 :4. Смешав кровь с указанным раствором, ее вновь набирают в пипетку и устанавливают точно вертикально в штатив. Через час смотрят, до какого деления доходит столбик эритроцитов. Этот уровень укажет результат реакции.
23. Исследование мочи
Реакция мочи у здорового человека должна быть кислой или слабокислой.
Реакцию мочи определяют лакмусовой бумажкой. Синяя лакмусовая бумажка при кислой реакции краснеет, а красная лакмусовая бумажка при щелочной реакции синеет.
Для определения реакции мочи пинцетом захватывают синюю лакмусовую бумажку за один конец, а другой ее конец опускают в мочу. Если бумажка покраснеет, значит моча кислой реакции, если же цвет бумажки не изменится, то реакция может быть нейтральной или щелочной. Тогда таким же образом опускают в мочу красную бумажку. Если она посинеет, значит моча щелочная, если останется без изменения, значит реакция нейтральная.
Средний удельный вес нормальной мочи равен 1015—1020, т. е. если 1 л воды весит 1000 г, то 1 л мочи будет весить 1015—1020 г. Удельный вес мочи определяют особым прибором— урометром. Прибор устроен по типу ареометров, предназначенных для определения удельного веса жидкостей.
Урометр (54) состоит из полого цилиндра, снизу наполненного ртутью, и цилиндрической трубочки, отходящей от верхней части цилиндра, на которую нанесена шкала с делениями.
Урометр должен быть сухим; его опускают медленно и замечают деление на шкале, которое соответствует уровню мочи. Удельный вес мочи определяется делением на шкале, соответствующим нижнему мениску’, причем цилиндр с мочой нужно держать так, чтобы поверхность мочи была на уровне глаза. Так как пена мешает точному определению удельного веса, ее снимают полоской фильтровальной бумаги.
Разбавлять мочу приходится в том случае, если для анализа ее представлено недостаточно. После употребления урометры обмывают водой или каким-либо дезинфицирующим раствором. Хранят урометры в банке с 2% раствором хлорамина, 0,5% раствором формалина или каким-нибудь другим дезинфицирующим раствором.
24. Определение белка
В нормальной моче, как говорилось выше, белок содержится в столь незначительном количестве, которое обычными реактивами не обнаруживается, а поэтому практически принято считать, что в нормальной моче белка нет. В патологических же случаях наблюдается альбуминурия, т. е. выделение белка с мочой, что является одним из главных признаков воспаления почек.
Моча, посланная в лабораторию, должна быть абсолютно чистой, лишенной всяких примесей, особенно примесей, содержащих белок, например, таких, как менструальная кровь, мокрота. Она должна быть прозрачной, поэтому перед исследованием ее фильтруют’. Затем определяют реакцию мочи, так как для исследования на белок она должна быть кислой реакции. Если моча нейтральной или щелочной реакции, то ее предварительно подкисляют несколькими каплями 10% раствора уксусной кислоты.
25. Определение сахара
В норме количество сахара в моче настолько незначительно, что обычными реактивами оно не обнаруживается. Поэтому практически считается, что моча сахара не содержит, наличие же в ней сахара свидетельствует о патологическом состоянии организма. Исключение составляют лишь случаи выделения сахара с мочой после употребления его в большом количестве.
Для определения сахара обычно пользуются реакцией Нилан-дера, которая проводится с реактивом Ниландера. Сущность этой реакции состоит в том, что окись висмута, бесцветная в щелочной среде, при нагревании с виноградным сахаром восстанавливается в закись или в металлический висмут, имеющий черный цвет.
Если моча содержит белок, то перед исследованием ее нужно освободить от него, так как, разлагаясь, белок образует темный сернистый висмут.
Удаление белка из мочи. Профильтрованную мочу слегка подкисляют уксусной кислотой, добавляют поваренную соль и кипятят. Полученный осадок белка отфильтровывают, после чего в фильтрате определяют присутствие сахара.
К 5—10 мл профильтрованной мочи прибавляют 1—2 мл реактива Ниландера и кипятят в течение 2 минут. От выпавших фосфатов образуется белый осадок, который бывает и в норме и диагностического значения не имеет. Если в моче содержится сахар, осадок, а также вся жидкость темнеют, принимая коричневый, а при большом количестве сахара черный цвет.
В настоящее время часто применяют пробу Гайнеса, очень удобную по своей простоте: к 3—4 мл реактива прибавляют 8—12 капель мочи и кипятят. В присутствии сахара появляется желтая или красная окраска жидкости или осадка. Реакция основана на свойстве глюкозы восстанавливать в щелочной среде гидрат окиси меди в гидрат закиси меди (желтый цвет) или в закись меди (красный цвет). Эту реакцию можно произвести еще проще: достаточно смешать одну каплю мочи с 9 каплями реактива и довести их до кипения.
Наиболее распространенным в нашей стране методом определения СОЭ является микрометод Т.П. Панченкова, основанный на свойстве эритроцитов осаждаться на дне сосуда под воздействием силы тяжести.
26. Интерпретация результатов
Механизм агломерации (склеивания) эритроцитов и их оседания чрезвычайно сложен и зависит от многих факторов, в первую очередь от качественного и количественного состава плазмы крови и от физико-химических свойств самих эритроцитов.
Наиболее частой причиной повышения СОЭ является увеличение содержания в плазме крупнодисперсных белков (фибриногена, a- и g-глобулинов, парапротеинов), а также уменьшение содержания альбуминов.
Крупнодисперсные белки обладают меньшим отрицательным зарядом. Адсорбируясь на отрицательно заряженных эритроцитах, они уменьшают их поверхностный заряд и способствуют сближению эритроцитов и более быстрой их агломерации.
Уменьшению СОЭ способствуют три основных фактора: 1) сгущение крови, 2) ацидоз и 3) гипербилирубинемия.
Наибольшее диагностическое значение в клинике имеет повышение СОЭ, непосредственными причинами которого являются:
1. Любые воспалительные процессы и инфекции, сопровождающиеся накоплением в крови грубодисперсных фракций глобулинов (чаще a- и g-фракций), фибриногена и других белков острой фазы воспаления и т. п. (подробнее см. ниже). Исключение составляют ранние стадии некоторых вирусных инфекций (грипп, вирусный гепатит и др.).
2. Заболевания, сопровождающиеся не только воспалительной реакцией, но и распадом (некрозом) тканей, форменных элементов крови и всасыванием продуктов распада белков в кровь (гнойные и септические заболевания, злокачественные новообразования, инфаркты кишечника, мозга, легких и т. д.)
3. Заболевания соединительной ткани и системные васкулиты (ревматизм, ревматоидный артрит, системная красная волчанка, узелковый периартериит, склеродермия, дерматомиозит и др.).
4. Заболевания паренхимы печени (гепатит, циррозы печени, рак и др.), ведущие к выраженной диспротеинемии, иммунному воспалению и некрозам ткани печени.
5. Болезни обмена (сахарный диабет и др.).
6. Гемобластозы (лейкозы, лимфогранулематоз и др.).
7. Парапротеинемические гемобластозы (миеломная болезнь, болезнь Вальденстрема).
9. Заболевания почек, особенно сопровождающиеся нефротическим синдромом (гипоальбуминемия) и другие.
Повышение СОЭ является весьма чувствительным, но неспецифическим гематологическим показателем различных патологических процессов. Наиболее значительное повышение СОЭ (до 50-80 мм/ч) чаще всего наблюдается при: 1) парапротеинемических гемобластозах (миеломная болезнь, болезнь Вальденстрема) и 2) заболеваниях соединительной ткани и системных васкулитах (системная красная волчанка, узелковый периартериит, склеродермия и др.).
Наиболее частой причиной значительного уменьшения СОЭ является увеличение вязкости крови при заболеваниях и синдромах, сопровождающихся увеличением числа эритроцитов (эритремия, вторичные эритроцитозы).
Кроме того, следует помнить, что при любых заболеваниях, для которых в принципе характерно увеличение СОЭ, этот показатель может оказаться не повышенным на определенных стадиях развития патологического процесса, если одновременно наблюдается сгущение крови, состояние ацидоза или гипербилирубинемия (желтуха, сердечная декомпенсация, состояние кетоацидоза при сахарном диабете и др.).
Подобные документы
Специальные методы исследования крови и мочи животных. Условия взятия крови и мочи, сохранность до начала лабораторных исследований. Скорость оседания эритроцитов и содержания гемоглобина. Определение времени свертываемости крови по способу Бюркера.
курсовая работа [34,0 K], добавлен 31.03.2011
Лабораторное исследование периферической крови у детей. Функции эритроцитов, лейкоцитов, тромбоцитов. Качественные изменения нейтрофилов. Скорость оседания эритроцитов. Белковый состав плазмы крови. Нормальные показатели у детей различного возраста.
презентация [3,2 M], добавлен 22.09.2016
Изучение клеточного состава крови: эритроцитов, лейкоцитов, тромбоцитов. Строение, физико-химические свойства, функции крови. Физиологически активные вещества, принимающие участие в свертывании крови и находящиеся в плазме. Скорость оседания эритроцитов.
курсовая работа [146,8 K], добавлен 26.12.2013
Анемия как проявление широчайшего спектра различных заболеваний и один из распространенных видов патологии. Основная функция эритроцитов, показатели красной крови при анемии. Причины уменьшения содержания гемоглобина и количества эритроцитов в крови.
реферат [1,6 M], добавлен 08.04.2019
Анализ форменных элементов крови: эритроцитов, лейкоцитов, тромбоцитов. Гемоглобин и его функции в работе организма. Гранулоциты, моноциты и лимфоциты как составлющие лейкоцитов. Паталогии в составе крови, их влияние на функции организма человека.
реферат [31,4 K], добавлен 06.10.2008
Общая характеристика нарушений функций или строения клеток крови — эритроцитов, лейкоцитов или тромбоцитов, патологических изменений их числа, а также изменений свойств плазмы крови. Виды и проявления анемии, талассемии, диатеза, тромбоцитопатии.
презентация [5,2 M], добавлен 26.06.2015
презентация [2,3 M], добавлен 14.10.2015
