Увеличение чувствительности к инсулину что значит
Мнение эндокринолога: инсулинорезистентность — причина или следствие ожирения? Что лечить в первую очередь?
Диагноз инсулинорезистентность — всегда ли это правильно? Пациенты, обращающиеся по поводу лечения ожирения, часто вместо адекватного набора диагностических и лечебных мер, направленных на устранение именно ожирения получают диагноз «инсулинорезистентность» и список анализов для выявления этого нарушения. В чем ошибка специалистов, рассматривающих ожирение как следствие резистентности к инсулину? Как связаны эти состояния?
Механизм и осложнения инсулинрезистентности
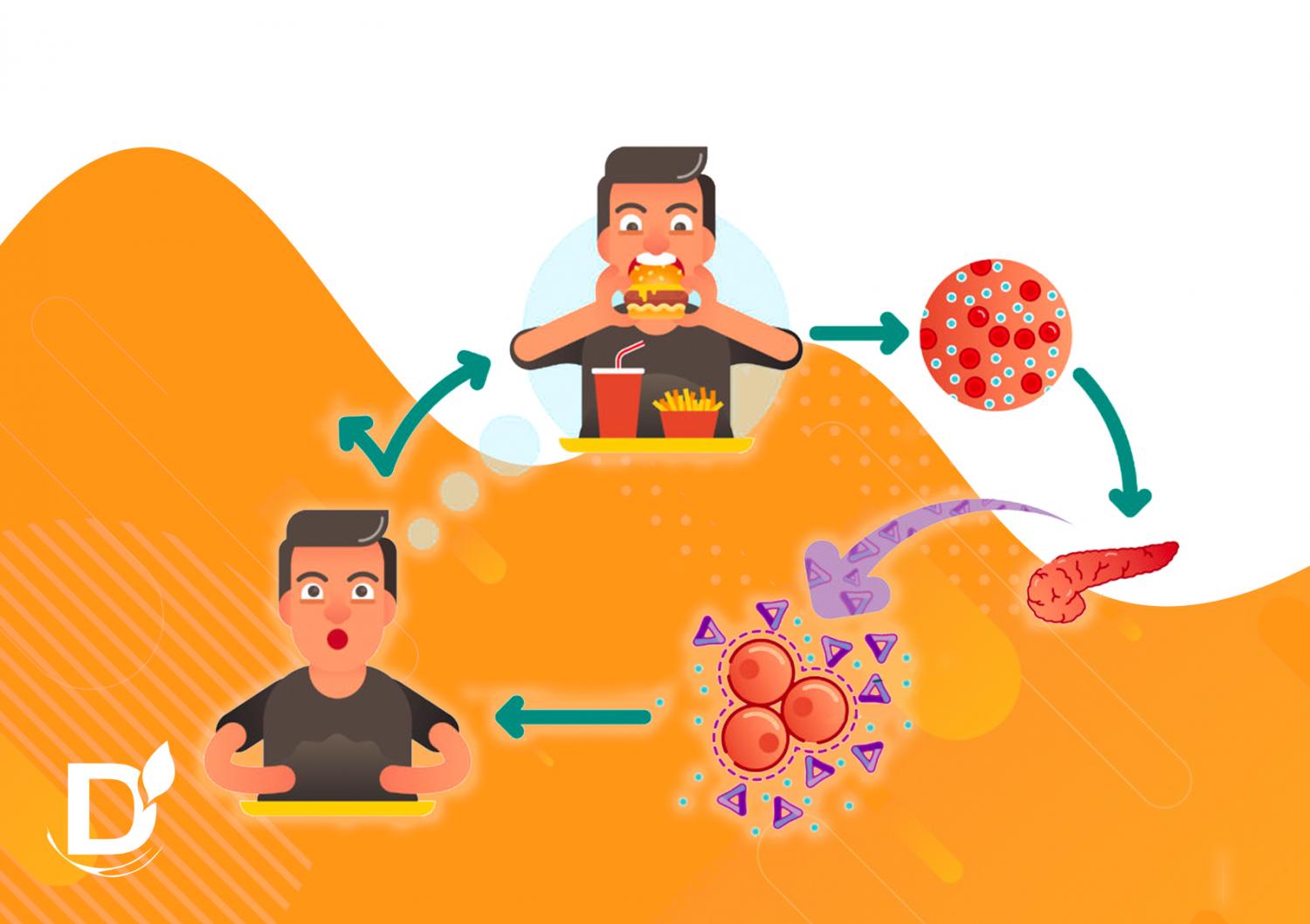
Одним из механизмов, сопровождающих чрезмерное количество жира в организме и недостаточную физическую активность, является феномен увеличения секреции инсулина. Этот механизм имеет компенсационную задачу: он предотвращает гипергликемию, потому что жировая ткань, в отличие от мышечной, обладает гормональной и метаболической активностью (проще говоря), способствует гипергликемии.
Однако со временем, как и любой перегруженный механизм компенсации, он постепенно выходит из строя. Из-за избытка инсулина происходит реактивная гипогликемия, то есть снижение уровня глюкозы через несколько часов после еды.
Когда чувствительность к инсулину снижена, появляются преддиабетические состояния (ненормальный уровень глюкозы натощак, ненормальная толерантность к глюкозе), за которыми следует диабет типа 2. Тем временем могут появляться нарушения, связанные с избытком инсулина, такие как сердечно-сосудистые заболевания или кожные патологии.
Чувствительность к инсулину зависит не только от жировой массы, но и отчасти определяется генетически, что несет в себе риск диабета и сердечно-сосудистых заболеваний. Она также нарушается при некоторых заболеваниях, наиболее распространенным из которых является синдром поликистозных яичников, что может послужить основанием для неправильной диагностики.
Определение инсулинорезистентности и ее ограничения
Следует подчеркнуть, что понятия высокой или низкой чувствительности к инсулину отличается от понятия резистентности к инсулину. Чувствительность к инсулину оценивается количественно, методом, выявляющий реакцию организма на внешний инсулин.
Резистентность к инсулину, как определение расстройства, это порог чувствительности к инсулину, с которого возрастает риск осложнений. Проблема состоит в том, что этот порог определяется совершенно произвольно, поскольку риск осложнений в отношении чувствительности к инсулину не имеет точных рамок.
Анализ на чувствительность к инсулину не охватывает важную проблему: в частности он не отражает динамические расстройства, которые проявляются после приема пищи и повышения уровня глюкозы. Также результат не показывает расстройства, связанные с желудочно-кишечными гормонами. Наиболее распространенным таким расстройством является реактивная гипогликемия.
Описанные ограничения показывают, что само определение инсулинорезистентности и повышение этого определения до названия диагноза заболевания может быть спорным.
Имеет ли диагноз резистентности к инсулину практическое значение
В связи с недостатками диагностики и низкой их значимостью в лечении ожирения, возникает вопрос, имеет ли смысл выполнять дополнительные действия для распознавания резистентности к инсулину?
Многие европейские руководства для практикующих врачей не поддерживают диагноз инсулинорезистентности, поставленный на основании одного теста и определяют это состояние на основе списка клинических симптомов, общим знаменателем которого может быть снижение чувствительности к инсулину.
При этом клиническая практика доказывает, что вместо поиска инсулинорезистентности лучше сосредоточиться на выявлении клинических симптомов и их лечении, включая методы, которые восстанавливают чувствительность к инсулину.
Инсулинорезистентность — частые ошибки
Распространенные рассуждения, часто встречающиеся в Интернете или в беседах эндокринолога с пациентами:
Причина ошибки заключается в том что пациенты и начинающие врачи часто путают последствия с причинами и сопутствующими факторами.
Стремление диагностировать и лечить инсулинорезистентность изолированно от общей картины состояния пациента несет множество побочных эффектов, из которых наиболее важным является демобилизующий фактор, отвлекающий внимание пациента от причинной терапии.
Инсулинорезистентность — правильное управление этими расстройствами
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/Бариатрическая-процедура.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/Бариатрическая-процедура.jpg?fit=826%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/%D0%91%D0%B0%D1%80%D0%B8%D0%B0%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D0%B4%D1%83%D1%80%D0%B0.jpg?resize=900%2C599&ssl=1″ alt=»Бариатрическая процедура» width=»900″ height=»599″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/Бариатрическая-процедура.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/Бариатрическая-процедура.jpg?resize=450%2C300&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/Бариатрическая-процедура.jpg?resize=826%2C550&ssl=1 826w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2020/01/Бариатрическая-процедура.jpg?resize=768%2C511&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Бариатрическая процедура
Резистентность к инсулину — инсулинорезистентность — важный, но не единственный механизм, вызывающий негативные последствия для здоровья людей с избыточным весом. Это значит, что даже если найти идеальный препарат против инсулинорезистентности, он не исправит все последствия неправильного образа жизни и не обеспечит значительную потерю веса.
Это подтверждает текущий опыт применения при преддиабете и ожирении метформина. Это препарат с разнонаправленным действием, который, помимо прочего, улучшает чувствительность к инсулину. Его введение оказало положительное влияние на профилактику диабета 2 типа, но изменение привычек питания и, прежде всего, правильный план ежедневных физических нагрузок, дает во много раз больший эффект, чем просто прием таблеток.
Также трудно переоценить физическую активность и правильные привычки питания в случае заболеваний, связанных с аномальной чувствительностью к инсулину, поскольку они предотвращают обострение расстройства.
Выводы
Диагностика инсулинорезистентности как причины избыточного веса — ошибка, где путаются последствия с причиной. Говоря прямо, для решения этих проблем лучше, использовать не тесты на инсулин, а комнатные весы, сантиметр, тесты на уровень глюкозы, измерение артериального давления, а также устройства контроля физической активности.
Анализ глюкозы и инсулина в крови может иметь смысл для эндокринолога, когда врач рассматривает возможность введения фармакологического лечения, например, назначения метформина, в качестве дополнения к нефармакологическому лечению.
Это делается для предотвращения реактивной гипогликемии, преддиабета и диабета типа 2. Лечение также необходимо при некоторых заболеваниях, связанных с пониженной чувствительностью к инсулину, например, при синдроме поликистозных яичников.
Что такое инсулинорезистентность: ее признаки, причины и лечение
Нам часто поступают запросы осветить в постах ту или иную тему. Мы считаем это своей миссией, ведь если есть вопрос, должен быть и ответ!
Одна из подобных просьб касалась инсулинорезистентности. Пришлось изучить тему вдоль и поперек, прежде, чем опубликовать данный материал 😉
Что такое инсулинорезистентность
Как происходит в норме?
Что случается при резистентность к инсулину?
По ряду причин клетка перестает «слушаться» инсулин: глюкоза из крови больше не может в нее попасть. Не утилизированная клетками глюкоза накапливается в крови, возникает гипергликемия.
Инсулинорезистентность может появиться и как самостоятельный синдром, и как дополнение к диабету 1 / 2 типов.
Симптомы инсулинорезистентности
Типичными симптомами ИР являются:
Причины резистентности к инсулину
Их много. Точную причину может определить ТОЛЬКО врач. Не занимайтесь самодиагностикой и самолечением!
Наиболее частые причины: избыточный вес, пожилой возраст, малоподвижный образ жизни, наследственный фактор.
Если говорить о временной инсулинорезистентности, то она может возникать:
Лечение инсулинорезистентности
Важно понимать, что в некоторые жизненные периоды резистентность к инсулину считается нормальным явлением. Сюда относятся беременность, подростковый возраст, цикл. Серьезного лечения такие состояния, как правило, не требуют, нужно лишь оперативно корректировать дозировки сахароснижающих препаратов и дождаться, когда «гормональная буря» окончится.
В некоторых случаях может понадобится медикаментозное лечение. В этом вопросе важен грамотный индивидуальный подход доктора к пациенту.
Что такое инсулинорезистентность? Симптомы и причины
Роль инсулина в организме
Поджелудочная железа отправляет порцию инсулина в кровоток сразу после еды или при обнаружении высокого уровня сахара в крови. Как только инсулин попадает в кровь, он реализует 2 основные функции:
Когда вы едите пищу с углеводами (сахара, крахмалы), вы быстро получаете прилив энергии. Соответственно, ваши клетки тоже получают энергию из сахара, но как сахар попадает в клетки? Вот тут-то и появляется инсулин.
Большинство клеток тела содержат рецепторы инсулина.
Присоединяясь к рецепторам, инсулин помогает вывести сахар из крови и отправить его в клетки, чтобы он превратился в энергию. В результате, уровень сахара в крови должен вернуться к норме.
Несмотря на то, что клеткам полезно получать сахар из крови для выработки энергии, им не нужен постоянный доступ к этому сахару.
Фактически, инсулин забирает лишний сахар крови, который ваши клетки не могут использовать сразу, и отправляет его в мышечные, жировые клетки и печень для хранения и дальнейшего использования.
При хранении, исходная форма сахара, глюкоза, становятся другой формой сахара, известной как гликоген.
Что такое инсулинорезистентность?
Для реализации основных задач, возложенных на инсулин, требуется взаимодействие с клетками, в частности, наличие рецепторов инсулина на их поверхности, чтобы они могли пропускать глюкозу внутрь.
Но, в силу некоторых причин, клетки могут перестать реагировать на инсулин (полностью или частично).
Когда клетки становятся инсулинорезистентными, сахар остается в кровотоке, что может привести к высокому уровню глюкозы крови.
Что вызывает инсулинорезистентность?
Существует множество потенциальных причин инсулинорезистентности.
Некоторые из наиболее распространенных причин включают:
Синдром поликистозных яичников (СПКЯ)
Это состояние, которое влияет на репродуктивное здоровье женщины, но также вызывает высокий уровень инсулина, что со временем может привести к инсулинорезистентности.
Высокие дозы стероидов, которые принимаются дольше нескольких недель
При длительном приеме стероиды могут вызывать постоянный высокий уровень сахара в крови, что может привести к резистентности к инсулину.
Хронический стресс
Постоянный стресс может иметь те же последствия, что и высокие дозы стероидов, поскольку стресс заставляет тело высвобождать собственные стрессовые стероиды, такие как кортизол.
Избыточный вес или ожирение
Хотя ученые не знают, как именно избыточный вес или ожирение способствует нарушению чувствительности к инсулину, но связь между этими явлениями доказана.
Сидячий образ жизни
Диета с высоким содержанием углеводов или сахара
Любая диета с высоким содержанием углеводов или сахаров повысит уровень сахара в крови, что со временем может привести к инсулинорезистентности.
Приведем пример. Два мужчины в возрасте 40 лет – Сергей и Алексей.
У Сергея в семье есть диабетики (мать и отец), он имеет лишний вес (ИМТ 34) и постоянно работает в офисе, питается блюдами фаст-фуда и часто выпивает.
Алексей имеет вес около 75 кг (ИМТ 24), работает на складе компании, много времени проводит на ногах, вечерами гуляет с собакой, в выходные ездит на природу.
При диспансерном обследовании у Сергея уровень сахара в крови натощак 7,6, после нагрузки до 9,0, он жалуется на периодически повышающееся давление, недомогание. Врачи определили у него нарушение резистентности инсулину. В будущем риск инфаркта у него очень высокий, поэтому врачи будут тщательно наблюдать за здоровьем, рекомендовали снижать вес.
Алексей имеет уровень сахара натощак 4,6, давление в пределах нормы, особых жалоб на здоровье не имеет. Врачи дали рекомендации по прохождению диспансеризации каждые 2-3 года, рекомендовали только избегать стресса и вредных продуктов питания.
Каковы симптомы инсулинорезистентности?
Сначала поджелудочная железа пытается бороться с последствиями инсулинорезистентности, выделяя больше инсулина. Даже если клетки не реагируют на инсулин так, как должны, тот факт, что в кровотоке больше инсулина, помогает поддерживать нормальный уровень сахара в крови.
Поэтому, изначально может не быть каких-либо заметных симптомов инсулинорезистентности.
Со временем, когда резистентность к инсулину усиливается, даже большее количество инсулина не сможет компенсировать слабую реакцию клеток на инсулин. На этом этапе высокий уровень сахара в крови часто становится первым ключевым признаком инсулинорезистентности. Поскольку высокий уровень сахара в крови сохраняется, вы можете начать замечать такие симптомы, как чрезмерная жажда, частое мочеиспускание и головные боли.
Каковы осложнения инсулинорезистентности?
Инсулинорезистентность также может приводить к каждому из симптомов метаболического синдрома индивидуально.
Метаболический синдром, преддиабет и диабет 2 типа являются наиболее частыми осложнениями инсулинорезистентности.
Преддиабет и диабет 2 типа возникают из-за высокого уровня сахара в крови, который, возможно, придется контролировать с помощью лекарств, если изменения диеты и физических упражнений недостаточно.
Эти осложнения особенно серьезны, поскольку повышают риск сердечных заболеваний, сердечных приступов и инсультов.
Есть ли тест на инсулинорезистентность?
К сожалению, не существует теста на инсулинорезистентность, который можно использовать дома или в клинике.
Врач может определить уровень глюкозы в крови (натощак и с нагрузкой) или тест на гемоглобин A1с (гликированный), чтобы оценить уровень сахара в крови.
Но помните, что на ранних стадиях инсулинорезистентности уровень сахара в крови может оставаться нормальным. Таким образом, определение уровня глюкозы в крови или A1с не всегда является надежным тестом на инсулинорезистентность.
Можно ли обратить вспять инсулинорезистентность?
Есть способы улучшить чувствительность к инсулину и обратить вспять резистентность к инсулину:
Несмотря на то, что инсулинорезистентность не обязательно означает, что развивается диабет, соблюдение правильного питания может помочь улучшить чувствительность к инсулину.
Инсулинорезистентность и пути ее коррекции при сахарном диабете 2 типа
Инсулинорезистентность — это недостаточный биологический ответ клеток на действие инсулина при его достаточной концентрации в крови. Биологические эффекты инсулина могут быть объединены в четыре группы: очень быстрые (секунды): гиперполяризация мембран
Инсулинорезистентность — это недостаточный биологический ответ клеток на действие инсулина при его достаточной концентрации в крови. Биологические эффекты инсулина могут быть объединены в четыре группы:
Таким образом, понятие инсулинорезистентности не сводится только к параметрам, характеризующим метаболизм углеводов, а включает также изменение метаболизма жиров, белков, функции эндотелия, экспрессии генов и др.
Можно выделить целый ряд заболеваний и физиологических состояний, сопровождающихся инсулинорезистентностью. Основные из них следующие (М. И. Балаболкин, 2001):
Термин «инсулинорезистентность» не следует отождествлять с «синдромом инсулинорезистентности» или «метаболическим синдромом», описанным G. Reaven (1988) и включающим в себя: нарушение толерантности к глюкозе (или СД 2 типа), артериальную гипертензию, гиперурикемию, гиперкоагуляцию, микроальбуминурию и некоторые другие системные нарушения.
Свое биологическое действие на уровне клетки инсулин осуществляет через соответствующий рецептор. Инсулиновый рецептор представляет собой белок, состоящий из двух α- и двух β-субъединиц. α-субъединица располагается на наружной поверхности клеточной мембраны, именно с ней связывается инсулин. β-субъединица является трансмембранным белком и обладает тирозинкиназной активностью, которая не проявляется при отсутствии инсулина. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причем субстратом служит сам этот фермент, т. е. происходит аутофосфорилирование β-субъединицы рецептора инсулина по нескольким тирозиновым остаткам. Фосфорилирование β-субъединицы, в свою очередь, приводит к изменению субстратной специфичности фермента: теперь он способен фосфорилировать другие внутриклеточные белки — субстраты инсулинового рецептора (СИР). Известны СИР-1, СИР-2, а также некоторые белки семейства STAT (signal transducer and activator of transcription — переносчики сигнала и активаторы транскрипции). Фосфорилирование СИР ведет к плейотропной реакции клетки на инсулиновый сигнал. Мыши лабораторной линии, лишенные гена СИР-1, проявляют резистентность к инсулину и сниженную толерантность при нагрузке глюкозой. Инсулин при посредничестве СИР-1 активирует фосфатидилинозитол-3-киназу (ФИ-3-киназу). Активация ФИ-3-киназы является центральным звеном сигнального пути, стимулирующего транслокацию глюкозного транспортера ГЛЮТ-4 из цитозоля в плазматическую мембрану, а следовательно, и трансмембранный перенос глюкозы в мышечные и жировые клетки. Ингибиторы ФИ-3-киназы подавляют и базальное, и стимулированное инсулином потребление глюкозы; в последнем случае ингибируется транслокация ГЛЮТ-4 к мембране (M. Reaven Gerald, 1999).
Согласно современным представлениям резистентность периферических тканей (мышечной, жировой и ткани печени) к действию инсулина лежит в основе патогенеза СД 2 типа. Нарушения обменных процессов, наблюдаемые вследствие инсулинорезистентности при СД 2 типа, представлены в таблице 1.
Инсулинорезистентность мышечной ткани является наиболее ранним и, возможно, генетически определяемым дефектом, который намного опережает клиническую манифестацию СД 2 типа. Результаты исследований с применением ядерной магнитно-резонансной спектроскопии (NMR) показали (G. I. Shulman, D. L. Rothman, 1990), что синтез гликогена в мышцах играет принципиальную роль в инсулинобусловленном усвоении глюкозы как в норме, так и при СД 2 типа, вместе с тем нарушение синтеза гликогена является вторичным по отношению к дефектам транспорта и фосфорилирования глюкозы.
Снижение концентрации инсулина в печени характеризуется отсутствием его ингибирующего влияния на процессы глюконеогенеза, снижением синтеза гликогена, активацией процессов гликогенолиза, что в конечном итоге приводит к повышению продукции глюкозы печенью (R. A. DeFronzo, 1990).
Другим звеном, играющим значительную роль в развитии гипергликемии, является резистентность жировой ткани к действию инсулина, а именно резистентность к антилиполитическому действию инсулина. В результате неконтролируемого окисления липидов освобождается большое количество свободных жирных кислот (СЖК). Повышение их уровня ведет к ингибированию процессов транспорта и фосфорилирования глюкозы и, как следствие, к снижению окисления глюкозы и синтеза гликогена в мышцах (M. M. Hennes, E. Shrago, 1990). Таким образом, изменения жирового обмена, а именно метаболизма СЖК, способствуют нарушению утилизации глюкозы тканями.
Избыток СЖК активизирует процессы глюконеогенеза, влияет на синтез липопротеидов в печени, приводя к повышенному образованию липопротеинов очень низкой плотности (ЛПОНП) и триглицеридов, что сопровождается снижением уровня липопротеинов высокой плотности (ЛПВП) (R. H.Unger, 1995).
Длительное повышение уровня СЖК оказывает прямое повреждающее действие на β-клетки поджелудочной железы, что описано как эффект липотоксичности, результатом которого является снижение секреторной способности β-клеток панкреатических островков.
Состояние инсулинорезистентности и высокий риск развития СД 2 типа характерен для лиц с висцеральным, а не с периферическим характером распределения жировой клетчатки. Возможно, это связано с биохимическими особенностями висцеральной жировой ткани: она слабо реагирует на антилиполитический эффект инсулина. В висцеральной жировой ткани отмечено усиление синтеза фактора некроза опухолей, который снижает активность тирозинкиназы инсулинового рецептора и фосфорилирование СИР-белков. Гипертрофия адипоцитов при абдоминальном типе ожирения приводит к изменению конформации молекулы инсулинового рецептора и нарушению процессов связывания его с инсулином.
Пока β-клетки поджелудочной железы способны вырабатывать достаточное количество инсулина для компенсации перечисленных дефектов и поддерживать состояние гиперинсулинемии, гипергликемия будет отсутствовать. Однако при истощении резервов β-клеток возникает состояние относительной недостаточности инсулина, что проявляется повышением уровня сахара крови и манифестацией диабета. Как показали результаты исследований (Levy et al., 1998), у больных СД 2 типа находящихся только на диете, через 5–7 лет от начала заболевания происходит значительное снижение функции β-клеток, в то время как чувствительность тканей к инсулину практически не меняется. Существует немало клинических доказательств тому, что гиперинсулинемия является независимым фактором риска развития ишемической болезни сердца как у лиц, не имеющих СД 2 типа, так и у больных с СД 2 типа (S. Lebto et al., 2000).
Тактика лечения СД 2 типа должна быть направлена на нормализацию патогенетических процессов, лежащих в основе заболевания, т. е. на уменьшение инсулинорезистентности и улучшение функции β-клеток.
В настоящее время существуют нефармакологические и фармакологические методы коррекции инсулинорезистентности. К нефармакологическим методам относятся низкокалорийная диета, направленная на снижение массы тела, и физические нагрузки — фундамент на котором базируется лечение всех больных СД 2 типа с инсулинорезистентностью. Снижение веса может быть достигнуто при соблюдении низкокалорийной диеты, содержащей менее 30% жиров, менее 10% насыщенных жиров и более 15 г/ккал клетчатки, а также при регулярном режиме физических нагрузок.
Больным могут быть рекомендованы регулярные аэробные физические нагрузки средней интенсивности (пешие прогулки, плавание, равнинные лыжи, велосипед) продолжительностью 30–45 мин от 3 до 5 раз в неделю, а также любой посильный комплекс физических упражнений (J. Eriksson, S. Taimela, 1997). Физические нагрузки стимулируют инсулиннезависимое поглощение глюкозы, при этом индуцированное упражнениями увеличение потребления глюкозы не зависит от действия инсулина. Более того, во время физических нагрузок происходит парадоксальное снижение уровня инсулина в крови. Потребление глюкозы мышцами увеличивается, несмотря на падение уровня инсулина, при этом физическая нагрузка сопровождается перемещением ГЛЮТ-4 из другого пула, нежели под действием инсулина (N. S. Peirce, 1999).
В период дебюта заболевания, до формирования стойкого снижения секреторной функции β-клеток поджелудочной железы, особенно при избыточной массе тела или ожирении, препаратами выбора являются средства, снижающие инсулинорезистентность периферических тканей. К этой группе препаратов относятся бигуаниды и тиазолидиндионы (глитазоны).
В России, как и во всех странах мира, из группы бигуанидов применяется только метформин (сиофор, глюкофаж, глиформин).
Основной механизм действия метформина направлен на устранение продукции глюкозы печенью, а также на снижение инсулинорезистентности мышечной и жировой ткани. Препарат обладает способностью подавлять глюконеогенез, блокируя ферменты данного процесса в печени. В присутствии инсулина бигуаниды увеличивают периферическую утилизацию глюкозы мышцами, активируя тирозинкиназу инсулинового рецептора и транслокацию ГЛЮТ-4 и ГЛЮТ-1 в мышечных клетках. Бигуаниды повышают утилизацию глюкозы кишечником (усиливая анаэробный гликолиз), что проявляется в снижении уровня глюкозы в крови, оттекающей от кишечника. Длительное применение метформина положительно влияет на липидный обмен: приводит к снижению уровня холестерина и триглицеридов в крови. Механизм действия метформина — антигипергликемический, а не гипогликемический. Препарат не снижает содержание глюкозы в крови ниже ее нормального уровня — вот почему при монотерапии метформином отсутствуют гипогликемические состояния. По данным ряда авторов, метформин обладает аноректическим действием. У больных, получающих метформин, наблюдается снижение массы тела, преимущественно за счет уменьшения жировой ткани. Доказано положительное влияние препарата и на фибринолитические свойства крови за счет подавления ингибитора активатора плазминогена-1.
Результаты проспективного исследования, проведенного в Великобритании (UKPDS), показали, что применение метформина с момента установления диагноза снижает смертность от причин, связанных с СД, на 42%, общую смертность — на 36%, а частоту диабетических осложнений — на 32% (Lancet, 1998). Полученные данные свидетельствует о том, что прием метформина достоверно улучшает выживаемость и снижает риск развития осложнений СД 2 типа. При этом в исследовании UKPDS средняя суточная доза метформина (глюкофаж) составляла для большинства пациентов 2000 мг и выше. Именно доза 2000 мг/сут является оптимальной суточной дозой, при которой наблюдается лучший контроль сахара крови.
Показанием к назначению метформина является СД 2 типа на фоне избыточной массы тела или ожирения, при неудовлетворительной компенсации углеводного обмена на фоне диеты и физической нагрузки.
Начальная суточная доза метформина — 500 мг. Через 1 нед от начала терапии при отсутствии побочных эффектов дозу препарата увеличивают. Максимальная суточная доза препарата составляет 3000 мг. Принимают препарат 2–3 раза в день во время еды, что чрезвычайно важно для максимальной эффективности применения. Длительность действия препарата составляет 8–12 ч.
Среди побочных эффектов действия метформина следует отметить диарею, диспепсические расстройства, металлический вкус во рту. Побочные эффекты обычно исчезают при снижении дозы препарата. Упорная диарея является противопоказанием для отмены препарата.
Угнетая глюконеогенез, бигуаниды способствуют увеличению содержания лактата, пирувата, аланина (веществ, являющихся предшественниками глюкозы в процессе глюконеогенеза), что в крайне редких случаях может привести к развитию лактацидоза. Риск развития лактацидоза увеличивается при приеме чрезмерно больших доз препарата, у больных с почечной и печеночной недостаточностью, а также при наличии состояний, сопровождающихся гипоксией тканей.
Противопоказаниями к назначению метформина являются нарушения функций почек (снижение клиренса креатинина ниже 50 мл/мин или повышение креатинина в крови выше 1,5 ммоль/л), злоупотребление алкоголем, беременность, лактация, а также гипоксические состояния любой природы: недостаточность кровообращения, дыхательная недостаточность, анемия, острые инфекции, острый инфаркт миокарда, шок, внутривенное введение йодсодержащих контрастных веществ.
Исследования последних лет показали, что частота летального повышения в крови уровня молочной кислоты на фоне длительного лечения метформином составляет лишь 0,084 случая на 1000 больных в год. Соблюдение противопоказаний к назначению метформина исключает риск развития данного осложнения.
Метформин может применяться как монотерапия или в сочетании с препаратами сульфонилмочевины у больных СД 2 типа. Комбинация бигуанидов и производных сульфонилмочевины является рациональной, поскольку влияет на оба звена патогенеза СД 2 типа: стимулирует секрецию инсулина и улучшает чувствительность тканей к инсулину. В настоящее время разработаны и активно используются комбинированные препараты с фиксированной дозой метформина и производных сульфонилмочевины:
Комбинированные препараты имеют ряд преимуществ. За счет более низких терапевтических доз комбинируемых препаратов отмечается лучшая их переносимость, а также наблюдается меньшее количество побочных эффектов, чем при монотерапии или при раздельном назначении комбинируемых препаратов. При приеме комбинированных препаратов отмечается более высокая комплаентность, поскольку уменьшается количество и кратность приема таблетированных препаратов. Использование комбинированных препаратов дает возможность назначения трехкомпонентной терапии. Наличие различных дозировок препаратов, входящих в состав комбинированного препарата (как для препарата глюкованс), делает возможным более гибкий подбор именно оптимального, нужного соотношения комбинируемых препаратов. Однако строго фиксированная доза препаратов вызывает вместе с тем и ряд трудностей при необходимости изменения дозы только одного из комбинируемых препаратов.
Также у больных СД 2 типа метформин может применяться в комбинации с инсулином в случае выраженной инсулинорезистентности, что позволяет улучшить компенсацию углеводного обмена.
Активация PPARγ изменяет экспрессию генов, вовлеченных в такие метаболические процессы, как адипогенез, передача инсулинового сигнала, транспорт глюкозы (Y. Miyazaki еt al., 2001), что приводит к снижению резистентности тканей к действию инсулина в клетках-мишенях. В жировой ткани действие глитазонов приводит к торможению процессов липолиза, к накоплению триглицеридов, результатом чего является снижение уровня СЖК в крови. В свою очередь, снижение уровня СЖК в плазме способствует усилению процессов поглощения глюкозы мышцами и уменьшает глюконеогенез. Поскольку СЖК оказывают липотоксическое действие на β-клетки, их снижение улучшает функцию последних.
Глитазоны способны увеличивать экспрессию и транслокацию глюкозного транспортера GLUT4 на поверхности адипоцита в ответ на действие инсулина, что усиливает утилизацию глюкозы жировой тканью. Глитазоны оказывают влияние на дифференцировку преадипоцитов, что приводит к увеличению доли более мелких, но более чувствительных к действию инсулина клеток. In vivo и in vitro глитазоны уменьшают экспрессию лептина, влияя таким образом опосредованно на массу жировой ткани (B. M. Spiegelman, 1998), а также способствуют дифференцировке бурой жировой ткани.
Глитазоны улучшают утилизацию глюкозы в мышцах. Как известно, у больных СД 2 типа наблюдается нарушение инсулинстимулированной активности ФИ-3-киназы инсулинового рецептора в мышцах. В сравнительном исследовании было показано, что на фоне терапии троглитазоном инсулинстимулированная активность ФИ-3-киназы возросла почти в 3 раза. На фоне же терапии метформином изменения активности данного фермента не наблюдалось (Yoshinori Miyazaki et al., 2003).
Результаты лабораторных исследований позволили предположить, что глитазоны (росиглитазон) обладают защитным эффектом в отношении β-клеток, препятствуют гибели β-клеток путем усиления их пролиферации (P. Beales еt al., 2000).
Действие глитазонов, направленное на преодоление инсулинорезистентности и улучшение функции β-клеток, приводит не только к поддержанию удовлетворительного гликемического контроля, но и предотвращает прогрессирование заболевания, дальнейшее снижение функции β-клеток и прогрессирование макрососудистых осложнений. Оказывая воздействие практически на все компоненты метаболического синдрома, глитазоны потенциально снижают риск развития сердечно-сосудистых заболеваний.
Рецепторы PPARγ присутствуют во всех клетках сосудистой стенки и участвующих в развитии атеросклероза: в эндотелиальных клетках, в гладкомышечных клетках сосудов (VSM), моноцитах и макрофагах. PPARγ лиганды ингибируют дифференцировку, пролиферацию и миграцию всех видов клеток. PPARγ лиганды ингибируют рост и миграцию VSM-клеток путем остановки клеточного цикла в фазу G1. Они также ингибируют два процесса, необходимые для движения VSM-клеток: миграцию, индуцированную хемоатрактантами и продукцию матриксной металопротеиназы. Помимо ингибирования миграции моноцитов, индуцированной белком хемотаксиса моноцитов (MCP)-1, PPARγ лиганды ингибируют экспрессию молекул адгезии в эндотелиальных клетках, что приводит к снижению адгезии моноцитов на эндотелиальных клетках и уменьшению воспалительного действия макрофагов (A. Greenberg et al., 2001).
В настоящее время зарегистрированы и разрешены к применению два препарата из группы тиазолидиндионов: пиоглитазон (актос) и росиглитазон (авандия).
Показанием к применению глитазонов в качестве монотерапии является впервые выявленный СД 2 типа с признаками инсулинорезистентности при неэффективности диеты и режима физических нагрузок. Глитазоны показаны в качестве комбинированной терапии в случае отсутствия адекватного гликемического контроля при приеме метформина или производных сульфонилмочевины. Для улучшения гликемического контроля может использоваться и тройная комбинация (глитазоны, метформин и производные сульфонилмочевины).
Рекомендуемые дозы тиазолидиндионов представлены в таблице 2. Препараты могут приниматься как вместе с едой, так и между приемами пищи 1 или 2 раза в день. Уровень глюкозы понижается постепенно, максимальный эффект развивается через 6–8 нед. Препараты являются эффективными и хорошо переносимыми также у пожилых больных СД 2 типа (старше 65 лет).
Противопоказаниями к применению тиазолидиндионов являются: СД 1 типа, беременность и лактация, кетоацидоз, повышение печеночных трансаминаз более чем в 2,5 раза, сердечная недостаточность III–IV класса.
Ни пиоглитазон, ни росиглитазон не обладают гепатотоксичностью.
Вместе с тем при назначении препаратов из группы глитазонов необходимо мониторировать функцию печени до начала лечения. Повышение уровня аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (АСТ) более чем в 2,5 раза является противопоказанием для назначения глитазонов. Регулярный контроль ферментов АЛТ, АСТ в ходе лечения не показан, однако может проводиться по рекомендации врача при индивидуальных показаниях. Увеличение активности АЛТ на фоне лечения более чем в 3 раза требует прекращения дальнейшего приема препаратов.
Прием глитазонов сопровождался умеренной прибавкой массы тела, однако при этом отмечалось улучшение гликемического контроля и улучшение утилизации глюкозы тканями. В среднем при приеме росиглитазона отмечается увеличение массы тела на 1–4 кг в течение первого года. При приеме росиглитазона в комбинации с метформином прибавка массы тела была, как правило, меньше. Важно отметить, что увеличение массы тела происходит за счет увеличения подкожной жировой клетчатки, при этом масса абдоминального жира снижается.
У небольшого числа больных прием глитазонов может сопровождаться развитием анемии и отеками.
Представителем нового поколения глитазонов является росиглитазон (авандия). В отличие от пиоглитазона росиглитазон является более селективным в отношении PPARγ-рецепторов, обладает несравненно более высоким связующим сродством с PPARγ-рецепторами (в 40–100 раз выше, чем пиоглитазон) при меньшей концентрации препарата в крови. Различны и механизмы метаболизма этих двух препаратов. Росиглитазон метаболизируется изоферментными системами цитохрома P450, в основном CYP3С8, в меньшей степени — CYP2C9, в то время как пиоглитазон метаболизируется CYP3A. При терапевтических концентрациях росиглитазона в крови другие изоферменты цитохрома P450, включая CYP3A4, не угнетаются. Это означает, что вероятность взаимодействия росиглитазона с другими препаратами низка. В отличие от пиоглитазона росиглитазон не влияет на формакокинетику дигоксина, нифедипина, ранитидина, этинилэстрадиола, норэтиндрона.
Гипогликемическое действие глитазонов проявляется только в присутствии инсулина. При приеме глитазонов в качестве монотерапии наблюдается достоверное снижение не только базальной гликемии, но и постпрандиальной, при этом, что является несомненно важным, не отмечалось увеличения постпрандиальной гиперинсулинемии (G. Grunberger, W. M. Weston, 1999). Интересны данные, указывающие на более стойкий гипогликемический контроль, достигаемый при приеме росиглитазона, в сравнении с монотерапией глибенкламидом. Было показано, что при монотерапии росиглитазоном уровень НвА1с сохранялся неизменным в течение 30 мес без изменения терапии (B. Charbonnel, F. Lonnqvist, 1999). В проведенных исследованиях было показано, что росиглитазон улучшает функцию β-клеток и тем самым способен замедлять прогрессирование заболевания. Росиглитазон благоприятно влияет на функцию эндотелия и обладает способностью предупреждать развитие рестеноза после оперативных вмешательств на сосудах (T. Yoshimoto et al., 1999).
Сегодня получено много данных, указывающих на то, что применение глитазонов не только компенсирует углеводный обмен для больных диабетом, но и создает условия для блокирования механизмов, приводящих к развитию макро- и микроангиопатий, а значит, расширяются показания для применения этого препарата в клинических целях.
Эффективной и целесообразной является комбинация глитазонов и метформина. Оба препарата обладают сахароснижающим и гиполипидемическим действием, однако механизм действия росиглитазона и метформина различен (V. A. Fonseca et al., 1999). Глитазоны прежде всего усиливают инсулинобусловленное усвоение глюкозы в скелетных мышцах. Действие же метформина направлено на подавление синтеза глюкозы в печени. Как было показано в исследованиях, именно глитазоны, а не метформин способны увеличивать более чем в 3 раза активность ФИ-3-киназы, одного из основных ферментов передачи инсулинового сигнала. Помимо этого добавление глитазонов к терапии метформином приводит к значительному улучшению функции β-клеток в сравнении с терапией метформином.
Фирмой ГлаксоСмитКляйн разработан новый комбинированный препарат — авандамет. Предполагается две формы данного препарата с различной фиксированной дозой росиглитазона и метформина: росиглитазон 2 мг и 500 мг метформина и росиглитазон 1 мг в комбинации с 500 мг метформина. Рекомендуемый режим приема — 1–2 таблетки 2 раза в сутки. Препарат обладает не только более выраженным сахароснижающим действием по сравнению с действием каждого компонента в отдельности, но и уменьшает объем подкожной жировой клетчатки. В 2002 г. авандомет зарегистрирован в США, в 2003 г. — в странах Европы. В ближайшее время ожидается появление этого препарата в России.
Комбинация глитазонов с производными сульфонилмочевины позволяет воздействовать на два основных звена в патогенезе СД 2 типа: усиливать секрецию инсулина (производные сульфонилмочевины) и повышать чувствительность тканей к действию инсулина (глитазоны). В ближайшее время ожидается появление комбинированного препарата компании ГлаксоСмитКляйн — авандарила (росиглитазон и глимепирид).
Комбинация глитазонов и инсулина на сегодняшний день одобрена и рекомендована к применению во многих странах, в том числе и в России (P. Raskin, J. F. Dole, 1999). Вместе с тем результаты ряда исследований свидетельствуют об усилении проявления хронической сердечной недостаточности у больных СД 2 типа, получавших инсулин при добавлении к терапии росиглитазона, что требовало более частых обращений к врачу и коррекции проводимой терапии. Наиболее часто наблюдалось появление отеков нижних конечностей. Поэтому необходим более тщательный контроль состояния сердечно-сосудистой системы у больных с хронической сердечной недостаточностью при добавлении росиглитазона к инсулинотерапии. Глитазоны противопоказаны больным с хронической сердечной недостаточностью III и IV класса.
Воздействуя практически на все компоненты метаболического синдрома, глитазоны способствуют снижению риска развития и прогрессирования сердечно-сосудистых заболеваний.
Успешно разрабатываются препараты новой группы — глитазары. В отличие от глитазонов эти соединения являются двойными агонистами, т. е. стимулируют не только PPARγ-, но и PPARα-рецепторы. Препараты активно влияют на восстановление углеводного и жирового обмена у больных СД 2 типа, оказывают благоприятное воздействие на профилактику и течение сосудистых осложнений. Проведенные клинические исследования по применению тезаглитазара и мураглитазара показали их хорошую эффективность.
И. В. Кононенко, кандидат медицинских наук
О. М. Смирнова, доктор медицинских наук, профессор
ЭНЦ РАМН, Москва