Устойчивость к антибиотикам что это значит
Устойчивость к антибиотикам
Основные факты
Устойчивость к антибиотикам развивается у бактерий, а не людей или животных. Эти бактерии могут заражать людей и животных, и вызванные ими инфекции лечить труднее, чем инфекции от бактерий, не имеющих такой устойчивости.
Следствием устойчивости к антибиотикам являются рост медицинских расходов, более продолжительные госпитализации и рост смертности.
Необходимо срочно изменить порядок назначения и использования антибиотиков во всем мире. Даже в случае разработки новых препаратов серьезная угроза устойчивости к антибиотикам будет сохраняться, если поведение не изменится. Изменение поведения должно также включать меры по сокращению распространения инфекций с помощью вакцинации, мытья рук, более безопасного секса и надлежащей гигиены питания.
Масштабы проблемы
Устойчивость к антибиотикам возрастает до угрожающе высоких уровней во всем мире. Новые механизмы устойчивости появляются и распространяются повсюду, угрожая нашей способности лечить распространенные инфекционные заболевания. Все больше инфекций – например пневмонию, туберкулез, заражение крови, гонорея, заболевания пищевого происхождения – становится труднее, а иногда и невозможно лечить из-за снижения эффективности антибиотиков.
Там, где антибиотики для лечения людей или животных можно приобрести без рецепта, возникновение и распространение устойчивости усугубляются. Аналогичным образом, в тех странах, где нет стандартных лечебных рекомендаций, антибиотики часто назначаются врачами и ветеринарами избыточно и используются населением сверх меры.
В отсутствие неотложных мер на нас начнет надвигаться пост-антибиотическая эра, когда распространенные инфекции и незначительные травмы вновь могут стать смертельными.
Профилактика и борьба
Устойчивость к антибиотикам набирает темпы из-за их неправильного и чрезмерного использования, а также слабой профилактики инфекций и борьбы с ними. Меры к ослаблению последствий устойчивости и ограничению её распространения можно принимать на всех уровнях общества.
Население
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним индивидуумы могут:
Лица, формирующие политику
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним лица, формулирующие политику, могут:
Медработники
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним медработники могут:
Индустрия здравоохранения
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним индустрия здравоохранения может:
Сельскохозяйственный сектор
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним сельскохозяйственный сектор может:
Недавние изменения
Хотя в настоящее время ведется разработка некоторых антибиотиков, ни один из них, как ожидается, не будет эффективен против наиболее опасных форм бактерий с устойчивостью к антибиотикам.
С учетом легкости и частоты поездок, совершаемых сегодня людьми, устойчивость к антибиотикам является глобальной проблемой, которая требует усилий всех стран и многих секторов.
Последствия
В тех случаях, когда инфекции не поддаются более лечению антибиотиками первой линии, надлежит использовать более дорогие препараты. Из-за большей продолжительности болезней и лечения, часто в больницах, возрастают медицинские расходы, а также экономическое бремя, которое ложится на семьи и общество.
Устойчивость к антибиотикам ставит под угрозу достижения современной медицины. В отсутствие эффективных антибиотиков для профилактики и лечения инфекций значительно возрастает риск трансплантации органов, химиотерапии и хирургических операций, например кесарева сечения.
Ответные меры ВОЗ
Решение проблемы устойчивости к антибиотикам является для ВОЗ важным приоритетом. В мае 2015 г. Всемирная ассамблея здравоохранения утвердила Глобальный план действий по устойчивости к противомикробным препаратам, включающий и устойчивость к антибиотикам. Глобальный план действий направлен на обеспечение профилактики и лечения инфекционных болезней с помощью безопасных и эффективных лекарств.
Глобальным планом действий по устойчивости к противомикробным препаратам поставлены 5 стратегических задач:
Собравшиеся на сессии Генеральной Ассамблеи Организации Объединенных Наций в Нью-Йорке в сентябре 2016 г. главы государств приняли обязательство развернуть широкую и координированную деятельность по борьбе с глубинными причинами устойчивости к антибиотикам в ряде секторов, особенно в области охраны здоровья человека и животных, а также сельского хозяйства. Государства-члены подтвердили свою решимость разработать национальные планы действий по борьбе с этим явлением, взяв за основу глобальный план действий. ВОЗ оказывает государствам-членам поддержку по подготовке их национальных планов действий по решению проблемы устойчивости к противомикробным препаратам.
ВОЗ реализует несколько инициатив, направленных на решение проблемы устойчивости к противомикробным препаратам:
Всемирная неделя правильного использования антибиотиков
Эта глобальная многолетняя кампания проводится ежегодно в ноябре начиная с 2015 г. под девизом «Антибиотики: используйте осторожно!» В рамках тематической недели проводятся многочисленные мероприятия.
Глобальная система по надзору за устойчивостью к противомикробным препаратам (GLASS)
Данная система, функционирование которой обеспечивает ВОЗ, базируется на стандартизированном подходе к сбору, анализу и обмену данными, касающимися устойчивости к противомикробным препаратам, в глобальном масштабе. Эти данные используются для принятия решений на местном, национальном и региональном уровнях.
Глобальное партнерство по научным исследованиям и разработке антибиотиков (GARDP)
Эта совместная инициатива ВОЗ и Инициативы по лекарственным средствам против забытых болезней стимулирует исследования и разработки на основе государственно-частных партнерств. К 2023 г. Партнерство планирует разработать и вывести на рынок до четырех новых лекарственных средств за счет совершенствования существующих антибиотиков и ускоренного создания новых антибиотиков.
Межучрежденческая координационная группа по устойчивости к противомикробным препаратам (IACG)
Генеральный секретарь Организации Объединенных Наций учредил Группу для повышения согласованности действий международных организаций и обеспечения эффективности глобальных усилий по устранению этой угрозы безопасности здоровья. Группой совместно руководят заместитель Генерального секретаря ООН и Генеральный директор ВОЗ, в нее входят высокопоставленные представители соответствующих учреждений ООН и других международных организаций, а также эксперты из различных секторов.
Антибиотики: современная точка зрения
Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам Насколько актуальна проблема резистентности? Можно ли (и если можно, то как) контролировать резистентность?
 |
| Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам |
Насколько актуальна проблема резистентности?
Можно ли (и если можно, то как) контролировать резистентность?
Так ли уж неотвратима эра «постантибиотиков»?
Повышение резистентности различных патогенных микроорганизмов к антибиотикам является серьезной проблемой, чреватой такими неприятными последствиями, как грядущая эра «постантибиотиков».
Кризис, наблюдаемый сегодня, не похож на предыдущие. Его особенность прежде всего в количестве вовлеченных микроорганизмов и в отсутствии немедленного ответа на антибактериальную терапию. В прошлом фармацевтическая промышленность решала проблему резистентности путем производства нового, более эффективного антибиотика. Однако на сегодняшний день не существует никакого принципиально нового класса антибиотиков, приемлемого для клинического применения, а разработка новых препаратов может занять 10 — 15 лет.
Расширение спектра используемых в популяции антибиотиков поддерживает выборочное воздействие на целый ряд микроорганизмов, и, в частности, на те из них, которые в настоящее время являются резистентными к большинству антибиотиков (см. табл. 1). Но растет и перечень антибактериальных препаратов, к которым вырабатывается резистентность.
Таблица 1. Бактерии, проявляющие резистентность к антибиотикам
В целом в Англии наблюдалось 45%-ное увеличение случаев назначения антибиотиков за период между 1980 и 1991 гг., что составляет 5%–ное увеличение в год и связано с использованием антибиотиков для лечения респираторных заболеваний.
Следует отметить участившиеся случаи назначения цефалоспоринов, макролидов и хинолонов. Повышение резистентности к этим препаратам вызывает особое беспокойство, так как они используются для лечения очень опасных заболеваний, причем ситуация может усугубиться в случае, если резистентность будет расти.
Последствиями возросшей резистентности микроорганизмов являются увеличение сроков госпитализации, большие затраты на лечение, растущий уровень заболеваемости и смертности.
При современных масштабах международного туризма проблема резистентности к антибиотикам носит не только локальный, но и глобальный характер. Например, путешествия в развивающиеся страны обычно связаны с риском приобретения резистентной бактерии — Escherichia coli.
Структура восприимчивости имеет свои географические особенности, так как показатели резистентности в разных странах разные, что само по себе отражает уровень использования антибиотиков. Например, если взять Европу, то к югу от Скандинавии, в сторону стран Средиземноморья, наблюдается увеличение резистентности патогенных микроорганизмов к антибиотикам.
Степень проявления резистентности зависит не только от географических условий, но и от типа патогенных микроорганизмов, которые теоретически попадают под воздействие антибиотиков. Например, резистентность к пенициллину очень быстро возникла у Staphylococcus aureus, но понадобилось целых 50 лет, чтобы ее обрела Streptococcus pneumoniae, а у Streptococcus pyogenes это явление вообще начало проявляться лишь недавно. В настоящее время никто не может адекватно объяснить такой временной разницы.
В целом существует несколько резервуаров формирования резистентности к антибиотикам, к примеру животноводческие фермы, человеческая облигатная и условно-патогенная флора, клиническая изоляция. Степень значимости каждого из резервуаров не выявлена.
Основными условиями существования упомянутых выше резервуаров является плохое качество питьевой воды, антисанитарные условия, бесконтрольное применение антибиотиков, продающихся без рецептов, и их использование на животноводческих фермах для лечения животных, а также в малых дозах для ускорения роста молодняка.
Таблица 2 Новые подходы к борьбе с инфекциями
Например, известно, что использование триметоприма для лечения скота является одной из вероятных причин появления триметоприм-резистентной сальмонеллы. Кроме того, вызывает тревогу лицензирование таких ветеринарных препаратов, как квинолон и энрофлоксацин, поскольку хинолины могут потерять свою эффективность как основные препараты для лечения инвазивного сальмонеллеза.
Каковы бы ни были причины резистентности Salmonella, фактически зафиксировано 4-кратное увеличение мультирезистентности к антибиотикам за последние 13 лет. Существует предположение, что использование авопарцина (в ветеринарии — гликопептида) могло спровоцировать появление ванкомицин-резистентных энтерококков, микроорганизмов, которые могут соперничать с метициллин-резистентными Staphylococcus aureus по возможному отрицательному воздействию на макроорганизм.
Настораживает увеличение резистентности у ряда часто встречающихся микроорганизмов. Одним из наиболее устойчивых к антибиотикам патогенных микроорганизмов является пенициллин-резистентный пневмококк, впервые выявленный в 1967 г., а в настоящее время являющийся мультирезистентным. Штаммы этого пневмококка в настоящее время распространены во всем мире, особенно часто они встречаются в Испании, Южной Африке и Болгарии.
В Великобритании масштабы бедствия не столь велики: резистентность к пенициллину здесь повысилась с 1,5% в 1990 до 4% в 1995 г. Следует особо отметить появление резистентности пневмококков к эритромицину (до 9 % в 1995 г.), что делает бессмысленным использование этого препарата у пациентов с аллергической реакцией на пенициллин.
 |
| Рисунок 2. Антибиотики используются для ускорения роста домашних животных и в терапевтических целях |
Механизм, формирующий устойчивость к эритромицину, вызывает перекрестную резистентность к азитромицину и кларитромицину, что означает способность данного патогенного микроорганизма противостоять двум наиболее часто используемым антибиотикам первейшей необходимости.
Сегодняшний уровень резистентности пневмококков пока не может повлиять на основные направления лечения инфекционных заболеваний. Но при непрерывном повышении устойчивости к антибиотикам ситуация в будущем может измениться. Пневмонию, вызванную пневмококком, резистентным к пенициллину, сейчас можно лечить с помощью больших доз пенициллина (порядка 18 мегаединиц), но в случае менингита, вызванного тем же микроорганизмом, целесообразно использовать цефалоспорины.
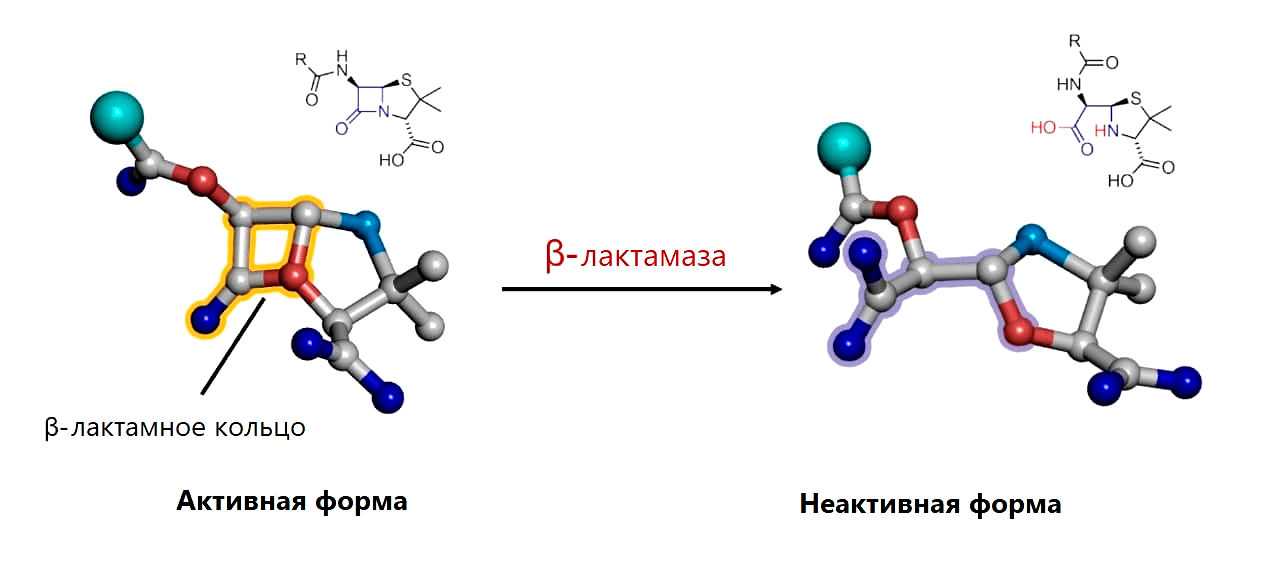
В 70-х годах с Haemophilus influensae успешно боролись с помощью ампициллина. Однако приобретение данным патогенным микроорганизмом бета-лактамазы, способной ферментативно расщеплять бета-лактамное кольцо пенициллина, привело к тому, что 23% H. Influenzae стало ампициллин-резистентным.
С резистентностью можно справиться, если использовать бета-лактамазные ингибиторы, такие как клавулановая кислота. Однако наблюдается повышение устойчивости к ко-амоксиклаву благодаря измененным пенициллин-связывающим белкам, что привело к появлению 14% резистентных H. Influenzae. При столь распространенной резистентности к бета-лактамазе новые макролиды могут стать главным средством для лечения заболеваний, вызванных H. Influenzae.
Недавно в Великобритании и во всем остальном мире были зарегистрированы вспышки туберкулеза. Туберкулез — «капитан смерти» — стал теперь резистентным ко многим противотуберкулезным препаратам, поэтому в настоящее время рекомендуется множественная терапия.
Согласно исследованиям британских ученых, примерно в 10% случаев туберкулезная палочка резистентна хотя бы к одному противотуберкулезному препарату, хотя в США ситуация еще хуже, там нормой становится резистентность, равная 30%. Эти мультирезистентные штаммы не менее вирулентны и плохо поддаются лечению — иногда требуется длительная (в некоторых случаях многолетняя) терапия нового типа.
Работники больниц, где на патогенные микроорганизмы оказывается мощное селективное воздействие при помощи антибиотиков, много сил отдают борьбе с метициллин-резистентным Staphylococcus aureus, ванкомицин-резистентным enterococcus, мультирезистентными Escherichia coli и мультирезистентными Pseudomonas.
В 60-х годах главный хирург США объявил победу над инфекционными заболеваниями. Конечно, он был не прав, но действительно ли мы стоим на пороге эры постантибиотиков?
Терапевтические возможности для лечения ряда заболеваний сейчас сильно ограничены.
Таблица 3. Схема приобретения резистентности организмов к антибиотикам
Энтерококки стали серьезным источником внутрибольничной инфекции, главным образом из-за того, что пациенты в больницах представляют из себя наиболее ослабленную часть населения, требующую серьезной защиты от инфекций. Энтерококки являются резистентными ко многим антибиотикам, таким как цефалоспорины, хинолоны, аминогликозиды и некоторые пенициллины. К тому же недавно они обрели способность вырабатывать бета-лактамазу, стали устойчивыми к повышенным дозам аминогликозидов и, самое главное, у них появилась резистентность к ванкомицину и тейкопланину.
В настоящее время микробиологи заняты исследованием гипотетической ситуации, при которой ванкомицин-резистентные гены от мультирезистентных энтерококков могут перейти в популяцию метициллин-резистентных стафилококков, что станет причиной появления нового микроорганизма «Судного Дня» — S. аuraeus, устойчивого ко всем известным антибиотикам и вызывающего неизлечимые заболевания.
Возможен ли такой сценарий? Уже известно, что гены, ответственные за резистентность к ванкомицину, способны в лабораторных условиях передаваться к S. aureus, хотя полученная резистентность нестабильна.
Также известно, что резистентность энтерококков к гентамицину была приобретена от стафилококка. Если это так, то генетические элементы у них совместимы и генетический барьер может быть легко перейден.
Как снизить вероятность формирования резистентности к антибиотикам? Главное — устранение селективного воздействия антибиотиков на бактерии путем. Для этого необходимо соблюдение следующих условий.
Привлечение к работе местной микробиологической лаборатории, которая располагает информацией о чувствительности к антибиотикам в данном регионе. Строгий контроль за применением антибактериальных препаратов в каждом конкретном регионе.
Время бездумного использования антибиотиков прошло. Сейчас особенно важен ответственный подход к назначению антибиотиков, позволяющий контролировать резистентность микроорганизмов в лечебных учреждениях и в обществе в целом.
1. Service R. F. Antibiotics that resist resistance. Science 1995; 270:724-727.
2. Davey P. G., Bax R. P., Reeves D., Rutherford D., Slack, et al. Growth in the use of antibiotics in the community in England and Scotland in 1980-93. Br Med J 1996; 312:613
3. Holmberg SSSSD, Solomon S. L, Blake P. A. Health and economic aspect of antimicrobial resistance. Rev Inf Dis 1987; 9:1065-1078.
4. Hughes V. M., Datta N. Conjugative plasmids in bacteria of the ‘pre-antibiotic’ era. Nature 1983; 302:725-726.
5. Shanahan P. M. A., Thomson C. J., Amyes S. G. B. The global inpact of antibiotic-resistant bacteria: their sources and reservoirs. Rev Med Micro 1994; 5:1740-1782.
6. Frost J. A, Threfall E. J., Rowe B. Antibiotic resistance in salmonellas from humans in England and Waales: the situation in 1994. PHLS Microbiologi Digest 1996; 12: 131-133.
7. Johson A. P., Speller D. C. E., George R. C., Warner M., Domingue G., Efstratiou A. Prevalence of antibiotic resistance and serotypes in pneumococci in England and Wales:: results of observational surveys in 1990 and 1995. Br Med JJ 1996; 312:: 1454-1456.
8. James P. A., Lewis D. A., Cribb J., Dawson S. J., Murray S. A. The incidence and epidemiology of Beta-lactam resistance in Haemophilus influenzae. J Antimicrobial Chemo 1996; 37: 737-746.
9. Warburton A. R. E., Jenkins P. A., Waight P. A., Watson J. M. Drug resistance in initial isolates of Mycobacterium tuberculosis in England and Wales 1982-1991. CDR Rev 1993; 13:175-179.
10. Young L. Mycobacterial disease in the 1990’s. J Antimicrobial Chemo 1993; 32:179-174.
11. Report of the Expert Group on animal feeding stuffs. HMSO 1992.
12. Noble W. C., Virani Z., Cree R. G. A. Co-transfer of vancomycin and other resistance genes from E faecalis NCCTTC 12201 to S aureus. FEMS Microbiol Lett 1992; 93:195-198.
Природа резистентности
Как удалось бактериям всего за 60 лет научиться противостоять всем известным антибактериальным препаратам? Антибиотики являются естественными субстанциями (или химически модифицированными), вырабатываемыми рядом микроорганизмов.
Эти микроорганизмы экскретируют антибиотикоподобные вещества в окружающую среду, чтобы получить преимущество в условиях естественного отбора. Однако сам микроорганизм должен обладать защитными механизмами против собственного токсина. Таким образом, механизмы, позволяющие ликвидировать воздействие антибиотиков, появились в природе задолго до того, как они стали широко использоваться человеком. Поэтому можно утверждать, что резистентность к антибиотикам является предвестником эры постантибиотиков.
Механизмы резистентности (см. табл. 3) получают все более широкое распространение и укрепляют прежде восприимчивые популяции микроорганизмов.
Распространение резистентности обусловлено не только способностью микроорганизмов развивать устойчивость и существовать в определенной экологической нише (клональная экспансия), но и возможностью независимого переноса механизмов резистентности между различными видами бактерий с помощью мобильных генетических элементов.
В качестве примера можно привести следующий факт: пенициллин-резистентные пневмококки развивались клонально, и рассеивание плазмидов (мобильных генетических элементов) обусловило появление способности вырабатывать бета-лактамазу у таких разных организмов, как E. coli и H. influenzae.
Мероприятия против бактериальной инфекции
Возможно ли контролировать резистентность? Главным условием сдерживания резистентности является улучшение качества питьевой воды и санитарных условий. Антибиотики, используемые для лечения людей, не должны применяться в ветеринарной практике, что и было рекомендовано 5 лет назад экспертной группой по питанию животных.
В ряде стран следует ввести жесткий контроль за безрецептурной продажей антибиотиков. Селективное воздействие антибактериальных препаратов, связанное с неправильным назначением, можно и следует свести до минимума.
Фармацевтическая промышленность ищет принципиально новые химические структуры, нуклеотиды, способные ингибировать клеточные функции микроорганизмов, а также стремится разработать препараты, основное назначение которых — ликвидация механизмов резистентности путем блокирования ферментов и создание условий, исключающих удаление антибиотиков при помощи клеточных насосов.
Многие актуальные на сегодня методы лечения потеряют свою эффективность в будущем. Таким образом, крайне необходим постоянный контроль на международном, национальном и региональном уровнях за использованием антибиотиков и формированием к ним бактериальной резистентности.
Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью
Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью
Антибиотикорезистентные бактерии одолевают один препарат за другим и неконтролируемо распространяются
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Устойчивость бактерий к антибиотикам — серьезная угроза здоровью людей. Из-за распространения резистентности с каждым годом подобрать эффективное лечение становится все сложнее. Человечество использует антибиотики повсеместно и тем самым только ускоряет процесс. К сожалению, резистентные штаммы могут передаваться от одного человека к другому, и масштаб проблемы до сих пор известен не до конца. Может ли, например, высокий уровень потребления антибиотиков в одной стране ухудшить эпидемиологическую обстановку в другой, где правительство регулирует использование противомикробных препаратов? Недавнее исследование, о котором мы расскажем в первой части статьи, утверждает, что да, может. А значит, опасность еще серьезнее, чем мы думали. Поэтому необходимо искать препараты, ломающие сам механизм устойчивости, так как уже сейчас существуют бактерии, которые невозможно остановить практически ни одним антибиотиком. Во второй части статьи мы расскажем об исследовании, открывшем новые свойства уже известных препаратов, как об одном из способов «отключить» резистентность и тем самым спасти миллионы жизней.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Вступление
С тех пор как Александр Флеминг впервые выделил пенициллин, жить стало значительно веселее: теперь можно было не умирать от остеомиелита, родильной горячки, гангрены или сифилиса. За последующие девяносто лет человечество успело обзавестись внушительным арсеналом противомикробных препаратов и начать их активно использовать везде: от медицины до сельского хозяйства. И все бы хорошо, если бы не одно но: со временем антибиотики, которые призваны убивать бактерии или останавливать их рост, предотвращая развитие болезни, перестают работать. Некоторые микроорганизмы выживают после применения того или иного лекарства. Они мутируют и продолжают расти и размножаться, уже не встречая конкуренции со стороны других штаммов. К таким «суперзлодеям» от мира бактерий относятся, например, метициллинрезистентный золотистый стафилококк (рис. 1) или микобактерии туберкулеза со множественной лекарственной устойчивостью.
Рисунок 1. Нейтрофил обезвреживает метициллин-резистентную бактерию Staphylococcus aureus, фагоцитируя ее. Фото конфокального микроскопа, цвета условны. Подробнее о конфокальной микроскопии можно прочесть в материале «12 методов в картинках: микроскопия» [1].
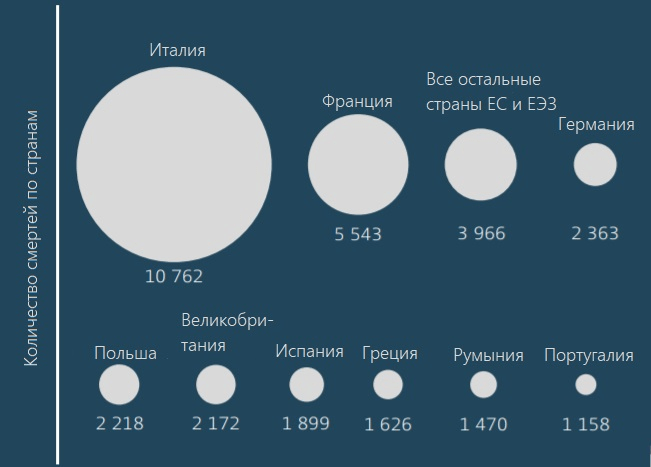
По данным комиссии, собранной британским министерством здравоохранения в 2014–2016 гг., ежегодно около 700 000 человек по всему миру умирает от бактериальных инфекций, которые вызваны невосприимчивыми к действию антибиотиков патогенами. К 2050-му эта цифра может вырасти до 10 миллионов человек в год [2]. А по данным за 2019 год, только в США и европейских странах суммарно от болезней, вызванных резистентными бактериями, умирает около 68 000 человек в год (рис. 2) [3], [4].
Рисунок 2. Количество смертей от болезней, вызванных резистентными к антибиотикам бактериями, в европейских странах по данным за 2015 год
О механизмах резистентности и ее передаче можно подробнее почитать в материалах [5] и [6].
Распространение резистентности: связь с уровнем потребления антибиотиков и влияние окружения
Многие исследования говорят в пользу существования прямой зависимости между увеличением потребления антибиотиков и распространением устойчивости бактерий к их действию [2–4], [7]. Помимо прямого влияния, когда из-за малых доз или недостаточно долгого применения лекарства бактерии быстро адаптируются к враждебной среде, существуют и косвенные «преимущества», которые дает устойчивым штаммам прием противомикробных препаратов: такие как устранение конкурентов в лице восприимчивых штаммов или подавление полезной микрофлоры, которая помогает организму справляться с инфекционной нагрузкой.
Иногда случается так, что потребление антибиотиков сокращается, а уровень устойчивости наоборот, только растет. Например, так произошло в Исландии 20 лет назад. В 2002 году было опубликовано исследование [8], согласно которому, несмотря на сокращение потребления противомикробных препаратов с 1,5 до 1,1 курса в год на одного ребенка (возрастом от одного года до шести лет), за пять лет распространенность устойчивых к пенициллину пневмококков выросла в двух наиболее удаленных от столицы регионах в четыре и в десять раз. Причем в десять раз она выросла там, где сокращение потребления антибиотиков было самым значительным по стране. Хотя в среднем за этот период уровень резистентности в Исландии действительно сократился: на 5%. Авторы исследования предположили, что из-за слабого коллективного иммунитета жители сельских регионов (рис. 3, 4) оказываются более уязвимыми к новым патогенам, которые сначала распространяются в крупных городах и только спустя время доходят до деревень. Можно было бы предположить, что свою роль сыграли и маленькие дозы лекарства или некорректная длительность терапии, однако, по данным исследования, все дети получали адекватное лечение.
Рисунок 3. Поселение Болунгарвик (исл. Bolungarvík), где зарегистрировали самый значительный рост резистентности при наиболее сильном снижении объема потребления антибиотиков.
Рисунок 4. Маяк Оусхоулавити (исл. Óshólaviti) в Болунгарвике. Фотограф: Герберт Ортнер, Вена (Herbert Ortner, Vienna).
Тем не менее исландский кейс остается скорее частным примером того, как на резистентность могут влиять и другие факторы, помимо объема потребления противомикробных препаратов. В целом же, прием антибиотиков остается одной из главных причин распространения устойчивости в мире [2–4].
К сожалению, даже если человек никогда не злоупотреблял антибиотиками, он может получить резистентную микрофлору от кого-то из своего непосредственного окружения, например, от родственников.
Исследование [9] на основе данных, полученных в 1998 году в двух деревнях штата Юта (рис. 5), показало, что вероятность получить как устойчивые, так и чувствительные штаммы растет с увеличением количества детей в семье. А прием антибиотиков ребенком увеличивает количество именно устойчивых бактерий у братьев и сестер.
Рисунок 5. Билборд на въезде в штат Юта со слоганом штата: Life Elevated («Возвышенная жизнь»)
В 2019 году израильские ученые показали, что прием матерями фторхинолонов (противомикробных лекарств широкого действия) повышал риск заражения резистентными штаммами не принимавших эти лекарства детей на 50% [10].
Бактерии распространяются не только в семьях, но и в других небольших сообществах, где люди тесно взаимодействуют, например в больницах. Так, в 2001 году другой исследовательский коллектив из Израиля подтвердил, что прием цефалоспоринов и амикацина (полусинтетического антибиотика группы аминогликозидов) в шести отделениях больницы был связан с повышенным риском заражения устойчивыми патогенами в течение последующих месяцев, в том числе и у пациентов, не принимавших эти антибиотики в течение предыдущего года. Причем у принимавших этот риск был выше 1,5–3 раза [11].
Распространение резистентности в больших сообществах
Второго ноября было опубликовано исследование [12] ученых Гарвардского университета, которое показало, что на степень распространения резистентности к антибиотикам среди населения одного региона существенно влияет уровень их потребления в соседних — точнее, в тех, которые интенсивнее всего с этим регионом взаимодействуют: например, если люди активно перемещаются между ними. Для описания таких ситуаций авторы статьи используют термин «спилловер-эффект» (от англ. to spill over — «выходить за пределы чего-либо, распространяться на другие области»; существительное spillover обозначает соответствующий процесс «распространения»).
Исследователи рассматривали данные о потреблении антибиотиков и распространенности устойчивости к ним в американских штатах и европейских странах. Они предположили, что чем два штата или две страны теснее взаимодействуют, тем меньше между ними разница в уровне резистентности к антибиотикам, и непосредственное влияние объема потребления антибиотиков на устойчивость будет ниже, чем в идеальной ситуации, когда регион полностью изолирован от других.
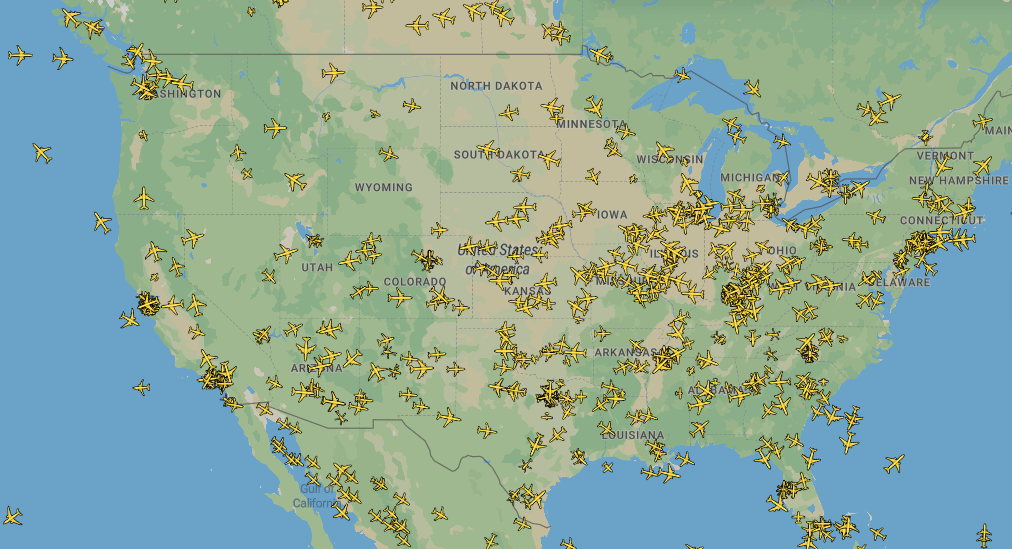
Чтобы проверить гипотезу, ученые сначала использовали математические модели, с помощью которых они делали численные предсказания того, насколько спилловер-эффект увеличится от усиления интенсивности взаимодействия сообществ. А затем они обратились к эмпирическим данным и соотнесли разницу в уровне резистентности внутри регионов с интенсивностью их взаимодействия друг с другом. Степень интенсивности определяли по данным о перелетах американскими и европейскими авиалиниями — ученые предположили, что чем меньше рейсов между регионами, тем слабее эти регионы взаимодействуют (рис. 6).
Рисунок 6. Карта авиаперелетов
В результате две математические модели, применявшиеся в исследовании, — WHN и D-type (см. «Расшифровки» в конце статьи), — подтвердили предположение, что у активно взаимодействующих между собой сообществ разница в уровне устойчивости ниже, чем у тех, которые взаимодействуют меньше. Конкретные величины зависят от выбора модели, однако согласно обеим, достаточно, чтобы было всего на 1% больше взаимодействий между сообществами, для сокращения разницы в уровне резистентности между ними на треть, а то и на 50% — опять же, зависит от выбора модели.
Исследователи рассматривали три пары патогенов и антибиотиков: «пневмококки и макролиды», «пневмококки и β-лактамы» и «кишечная палочка и фторхинолоны». Именно эти комбинации наиболее часто исследовали прежде.
Источники информации о потреблении антибиотиков и распространении устойчивости внутри регионов ученые распределили по трем группам: первые две включали в себя американские базы данных, а третья — данные по европейским странам.
Но в итоге было сформировано шесть датасетов вместо девяти: два убрали, потому что пришлось исключить данные по устойчивости пневмококков к β-лактамам в США — в предыдущих исследованиях на этих датасетах связь между объемом потребления антибиотиков и уровнем резистентности получила отрицательную точечную оценку. Кроме того, информация по потреблению фторхинолонов для США была только во втором наборе данных, так что для этой комбинации патогена и антибиотика собрали два датасета вместо трех, как у остальных (один европейский и один американский).
После попарного сравнения регионов, связь между интенсивностью взаимодействия и снижением зависимости уровня резистентности от объема потребления антибиотиков оказалась статистически значимой в четырех из шести датасетов. Иными словами, чем активнее люди перемещались между сообществами, тем меньшее влияние на распространенность устойчивости оказывал уровень потребления антибиотиков внутри каждого из них — значительную роль начинали играть соседи.
Ученые также сгруппировали все сообщества по парам и ранжировали список по степени интенсивности взаимодействия. Затем они сравнили первые 10% пар из начала с 10% пар с конца и выяснили, что для пар в начале рейтинга связь между объемом потребления антибиотиков и резистентностью в среднем на 50% слабее, чем для пар, которые взаимодействовали меньше всего.
О чем говорят эти данные? В первую очередь о том, что спилловер-эффект оказывает значимое влияние на распространение устойчивости бактерий к антибиотикам на уровне США и европейских стран. Из этого наблюдения следуют несколько важных выводов. Во-первых, бессмысленно проводить какую бы то ни было политику по сокращению потребления антибиотиков с целью снизить уровень резистентности, не учитывая ситуацию в соседних регионах. Во-вторых, куда эффективнее любые меры принимать не на уровне отдельной страны или штата, а на уровне более крупных регионов: США или Евросоюза целиком. В-третьих, массовые испытания антибиотиков могут привести к росту устойчивости внутри всей контрольной популяции (если она не полностью изолирована от испытуемых) за счет все того же спилловер-эффекта.
Однако на распространение устойчивости влияют не только потребление антибиотиков или путешествия между регионами. Свою роль могут играть и другие факторы. Так, исследование 2017 года показало, что устойчивость бактерий к антибиотикам растет с повышением среднегодовой температуры на 2–4% [13]. А согласно другому исследованию, уже 2018 года, на распространение резистентности влияют и социально-экономические факторы (рис. 7): чем лучше развита инфраструктура и выше расходы государства на здравоохранение, тем ниже уровень распространения устойчивости к антибиотикам [14]. Поэтому не исключено, что схожесть в уровне резистентности у тесно взаимодействующих регионов может быть связана с их схожестью в плане географии или на экономическом уровне. Также, различия в образе жизни между разными социальными группами (разделенными по гендерному, этническому или экономическому признакам) может оказаться очень высокой — возможно, сравнение между собой административных единиц не совсем корректно, и куда эффективнее было бы сравнивать разные социальных слои [15], [16]. Кроме того, в исследовании не учитывались другие способы передвижения между регионами, помимо авиаперелетов. Кажется, что на близкие расстояния люди могут чаще перемещаться наземным транспортом: поездами или автомобилями, поэтому небольшое количество рейсов между двумя регионами еще не говорит об их слабом взаимодействии. Поэтому для получения адекватной картины происходящего необходимо принимать во внимание даже такие «мелочи», как дорожная инфраструктура региона или стоимость перемещения разными видами транспорта.
Рисунок 7. Разница в уровне доходов у американского населения по штатам. Экономическое неравенство сказывается и на сфере здравоохранения: у людей с высоким и низким доходом разные условия проживания, неравный доступ к медицине и др. Это может быть релевантно при анализе эпидемиологической обстановки региона.
К тому же, чтобы упростить себе задачу, в рамках исследования ученые исходили из того, что связь между объемом потребления антибиотиков и уровнем резистентности неоспорима, а изменения в распространенности устойчивости следуют за изменениями в объеме потребления антибиотиков в течение какого-то относительно небольшого и обозримого отрезка времени, хотя оба эти положения являются предметом активного изучения. Попарное сравнение сообществ также существенно упрощает задачу построения математической модели и обработки данных. Однако надо понимать, что на деле регионы взаимодействуют между собой одновременно, и это взаимодействие может иметь сезонный характер, или его интенсивность может меняться в зависимости от каких-то социальных, политических или экологических процессов. Так что теоретические выкладки, полученные исследователями, довольно грубы и позволяют составить только беглое представление о проблеме.
Борьба с резистентностью: поиск новых решений
Итак, мы выяснили: устойчивость к антибиотикам страшна не только тем, что ее уровень растет по мере того, как увеличиваются объемы потребления антибиотиков, но и своей способностью распространяться внутри сообществ любого размера: от семей до государств. Особенное беспокойство вызывает распространение мультилекарственной резистентности некоторых патогенов — защищенности сразу от нескольких групп препаратов. Борьба с угрозой идет в основном по двум фронтам: во-первых, человечество создает все новые и новые препараты, способные эффективно подавлять устойчивые микроорганизмы, а во-вторых, придумывает способы замедлить распространение резистентности (как правило, за счет снижения объемов потребления антибиотиков) и выиграть время. Однако эта гонка бесконечна (см. обзор [17]). Как долго мы сможем «убегать»?
Хорошо бы научиться «отключать» резистентность, чтобы уже известные антибиотики заново стали эффективным «оружием». Для этого нужно проанализировать механизмы передачи, хранения и реализации устойчивости к антибиотикам. О некоторых из уже существующих способов борьбы с мультилекарственной резистентностью можно почитать в материалах [6] и [18].
Рисунок 8. Инфографика по карбапенем-резистентным энтеробактериям из доклада Департамента здравоохранения и социальных служб США. Согласно ей, в 2017 году насчитывалось 13 100 случаев госпитализации пациентов с инфекциями, вызванными карбапенем-резистентными энтеробактериями, в том числе и 1100 случаев летального исхода, а соответствующие затраты на здравоохранение в Америке составили 130 миллионов долларов США. Карбапанем-резистентные энтеробактерии представляют серьезную проблему для пациентов медицинских учреждений: некоторые штаммы развили устойчивости почти ко всем распространенным антибиотикам, что вынуждает врачей прибегать к более токсичным или менее эффективным препаратам.
А здесь мы рассмотрим, как может решаться проблема мультилекарственной резистентности, на примере карбапенем-резистентных энтеробактерий (CRE, от Сarbapenem-Resistant Enterobacteriaceae). CRE могут поражать органы мочеполовой системы, кровь или легкие, но главная их опасность заключается в устойчивости к самым серьезным препаратам, направленным против них (рис. 8). Карбапенемы — антибиотики «последней надежды», то есть средства, которые применяются лишь в крайних ситуациях, когда ничто больше не помогает. Часто CRE устойчивы не только к карбапенемам, но и ко многим другим классам антибиотиков, что делает лечение от них чрезвычайно тяжелым [19]. В 2019 году Центр по контролю и профилактике заболеваний США поместил карбапенем-резистентных энтеробактерий среди пяти групп микроорганизмов, защиту от которых из-за угрозы здравоохранению необходимо разрабатывать в первую очередь [3].
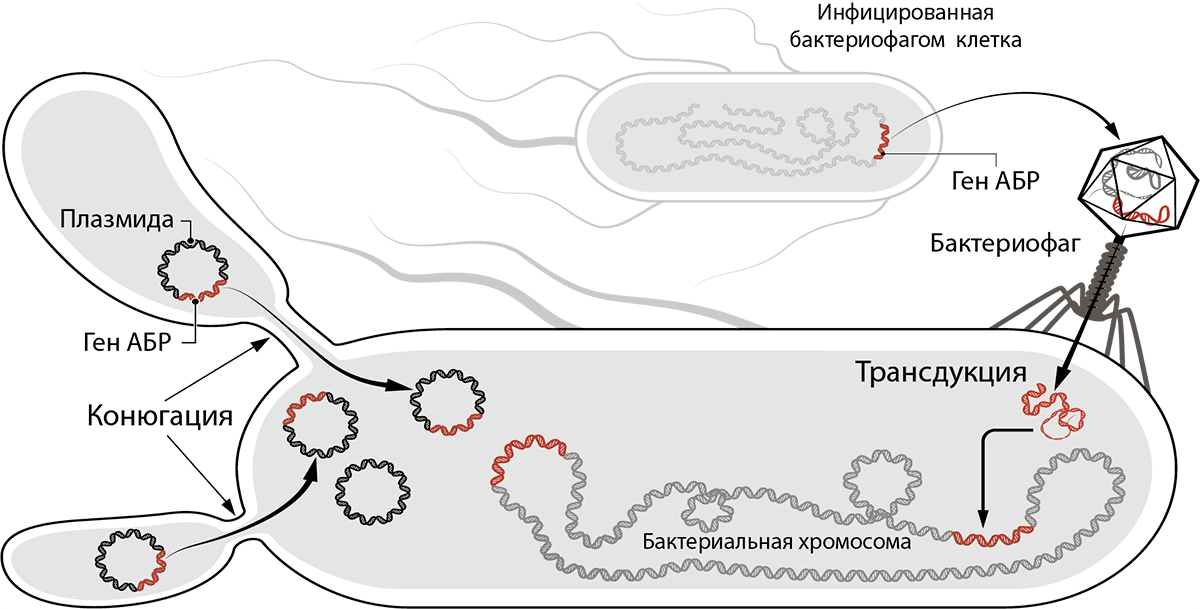
Рисунок 9. Как последовательности ДНК, ответственные за резистентность, попадают в клетку бактерии и хранятся в ней? Последовательности ДНК, кодирующие ферменты, которые обеспечивают резистентность, могут находиться в плазмидах — кольцевых ДНК внутри клеток бактерий, — передаваться в составе плазмид потомкам и родственникам при коньюгации. Еще такие последовательности ДНК могут передаваться из ДНК одной бактерии в ДНК другой путем трансдукции — переноса внутри вируса.
Устойчивость CRE работает по проверенной механике Докинза: резистентность переносится плазмидами устойчивости CRE (pCRE, CRE resistance plasmids), которые так и хочется назвать эгоистичными (рис. 9). Ведь карбапенем-резистентные энтеробактерии платят высокую цену за свою неуязвимость: если клетка утрачивает pCRE, то она погибает из-за токсина, который был закодирован в плазмиде и остался в клетке [20]. (До утраты pCRE с нее синтезировался неустойчивый антидот, блокирующий действие токсина.) pCRE очень большие, поэтому количество их копий в одной клетке CRE можно сосчитать по пальцам. Чтобы не потеряться во время деления, в pCRE закодирован механизм распределения по дочерним клеткам, как и множество ферментов, «обслуживающих» плазмиду, в которой заложено всё для ее распространения и выживания ее носителя, в том числе карбапенемаза — фермент, расщепляющий не только карбапенемы, но и многие другие β-лактамные антибиотики (рис. 10) [21]. Фермент, закодированный в плазмиде, «защищает» ее носителя. То есть в первую очередь опасность представляют не бактерии, а плазмида, поэтому методы борьбы должны быть направлены главным образом против нее.
Рисунок 10. Разрушение β-лактамного кольца β-лактамазой путем гидролиза связи между атомами углерода (серыми) и азота (голубыми)
Кэйтлин Зулауфа и Джеймс Кирби из Гарвардской медицинской школы нашли подходящие для вмешательства в работу плазмиды препараты среди тех, которые уже используются, но в иных целях, и попробовали объяснить их эффективность в борьбе с резистентными штаммами [22]. Это исследование кажется нам важным, поэтому ниже мы расскажем об экспериментах, проведенных коллегами-учеными, и данных, говорящих в пользу их открытия.
В результате скрининга более 12 000 биоактивных соединений исследователи выделили три, после воздействия которых копии pCRE не распространялись в культуре бактерий при делениях, что делало последующие поколения восприимчивыми к карбапенемам.
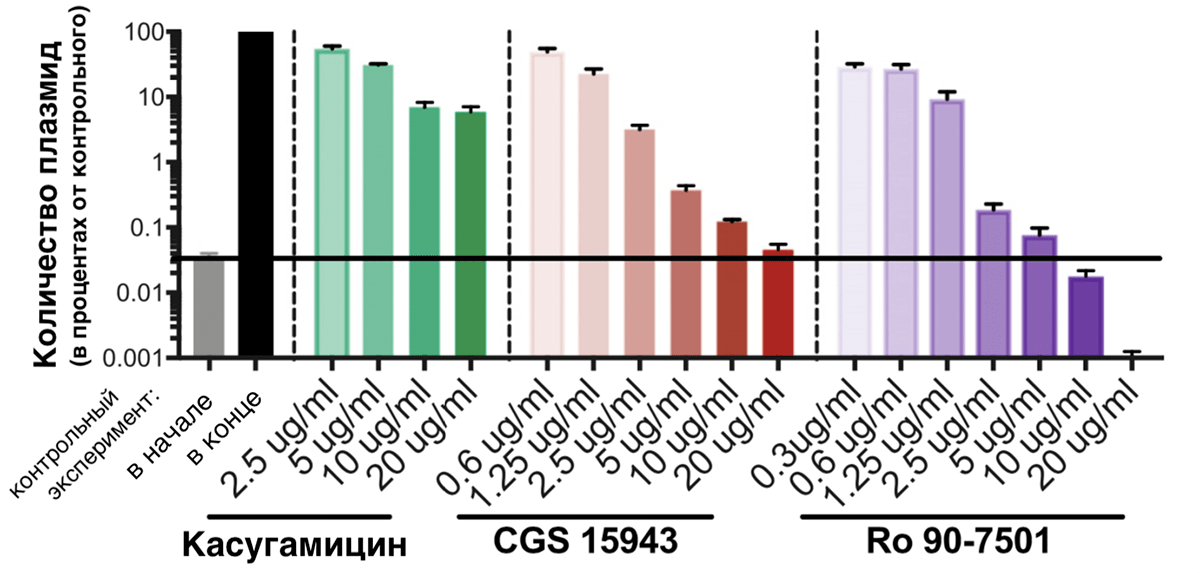
Наш первый кандидат — касугамицин — аминогликозидный антибиотик, который, судя по данным исследователей, мешает процессу синтеза белка RepE, играющего ключевую роль в размножении pCRE путем репликации (удвоения) [23]. То есть без RepE плазмида, скорее всего, не передастся новым поколениям бактерий. После воздействия касугамицина в течение 24 часов репликация pCRE случалась реже более чем в 10 раз (рис. 11), по сравнению с необработанными бактериями (более 90% потомков бактерий, резистентных еще сутки назад, утратили защиту). Однако даже во время применения максимальной в этом исследовании дозы касугамицина плазмиды все же размножались (их становилось больше на два порядка). Зафиксируем, что касугамицин не блокирует репликацию полностью, а лишь сильно замедляет ее.
Рисунок 11. Зависимость активности размножения плазмид в растущей бактериальной культуре от воздействия препаратов. По вертикальной шкале — количество плазмид бактерий после инкубирования при разных концентрациях препаратов, выраженное в процентах от количества плазмид в посевах в обычных условиях. Первые два столбца — контрольный эксперимент (без воздействия препаратов): серый столбец — количество в начале контрольного эксперимента; черный — в бактериях после обычных условий культивирования. Зеленые столбики — после культивирования при разных концентрациях касугамицина; красные столбики — после культивирования при разных концентрациях CGS 15943; фиолетовые столбики — после культивирования при разных концентрациях Ro 90-7501.
Наш второй кандидат — CGS 15943 (см. «Расшифровки» в конце статьи) — возможно, нарушает считывание последовательности RepE. В любом случае, он мешает репликации плазмид настолько, что их количество при максимальной дозе CGS 15943 почти не увеличилось (рис. 11). Отметим, что CGS 15943 способен почти полностью останавливать репликацию pCRE.
Третий кандидат — Ro 90-7501 (см. «Расшифровки» в конце статьи) — имеет самые впечатляющие результаты. Взглянув на рисунок 11, хочется назвать его «убийцей» pCRE. Дело в том, что Ro 90-7501 — интеркалятор ДНК, то есть соединение, которое встраивается между цепями ДНК, «ломая» ее структуру и мешая репликации. Только начиная исследование, ученые не хотели использовать интеркаляторы, потому что для человека целостность собственной ДНК не менее важна, чем для плазмиды целостность своей. Например, зафиксировано воздействие этого же Ro 90-7501 на клетки млекопитающих: он влияет на сборку фибрилл амилоида β42 (связанного с болезнью Альцгеймера) [24], на активность врожденного иммунитета [25] и ингибирует протеинфосфатазу 5 — фермент, важный в регуляции ключевых событий жизни клетки [26], [27]. Однако Ro 90-7501 оказался селективным к pCRE, и ученые изучили его особенно тщательно. Оговорив, что концентрация Ro 90-7501, при которой достигается максимальный антиплазмидный эффект, ниже токсичной для клеток млекопитающих почти в 30 раз [28].
Сравним препараты: CGS 15943 не имеет известных побочных эффектов для клеток человека, однако он и не истребляет плазмиды так, как это делает Ro 90-7501. То есть после окончания курса CGS 15943 резистентные патогены могут выжить и размножиться опять. Возможно, получится изменить последовательность Ro 90-7501 так, чтобы он перестал воздействовать на процессы в клетках млекопитающих. Однако обоим препаратам стоит «поучиться» у касугамицина проникать в клетки грамотрицательных бактерий (к которым относятся и энтеробактерии), видимо, для их применения в реальных условиях нужно разработать подходящий способ проникновения молекул препарата внутрь клетки.
Таким образом, использование каких-то из этих препаратов может привести нас к победе над опасными карбапенем-резистентными энтеробактериями. Ученым предстоит долгая и кропотливая работа по поиску или синтезу веществ, которые окажутся действенными в устранении описанного нами механизма резистентности.
Исследования, подобные этому, внушают надежду на то, что нам удастся не просто вечно бежать на шаг впереди, создавая препараты, к которым у бактерий еще не выработалась устойчивость, но и «поворачивать время вспять» — сопротивляться уже существующим механизмам резистентности, придумывая способы для непосредственной остановки их действия. И тогда пугающая цифра в 10 миллионов смертей в год никогда не станет реальностью.