Уксусная кислота это что такое
Уксусная кислота

Что такое уксусная кислота
Уксусная кислота – это органический продукт со специфическим запахом и вкусом, представляет собой результат брожения спиртовых и углеводных компонентов либо скисания вин.
Это вещество в форме винного уксуса было известно еще в Древней Греции и Древнем Риме. В более поздние времена алхимики научились производить более чистую субстанцию в результате перегонки. Кислота в виде кристаллов была выведена в 1700 году. Приблизительно в это же время химики определили ее формулу и выявили способность вещества к воспламенению.
В природе уксусная кислота редко встречается в свободном виде. В составе растений она представлена в форме солей или эфиров, в теле животных найдена в составе мышечной ткани, селезенки, а также в моче, поте, экскрементах. Легко образуется вследствие брожения, гниения, в процессе распада сложных органических соединений.
Синтетическую форму уксусной кислоты получают после реакции воздействия углекислотой на натрий-метил либо же при воздействии на метилат натрия, нагретый до 160 градусов, окисью углерода. Есть и другие способы создания этой субстанции в лаборатории.
Чистая уксусная кислота – это прозрачная жидкость с удушливым запахом, вызывающая ожоги на теле и слизистых даже при контакте с ними паров. Если зажечь пары вещества, они дадут светло-голубое пламя. Растворяясь в воде, кислота выделяет тепло.
Ацетилкофермент А образовывается при участии уксусной кислоты, которая также необходима для биосинтеза стеринов, жирных кислот, стероидов и других веществ. Химические свойства уксусной кислоты делают ее незаменимой во многих процессах и реакциях. Соединение помогает образовывать соли, амиды, сложные эфиры.
Но помимо полезных свойств, вещество является опасным, легковоспламеняющимся. Поэтому работая с ним, необходимо максимально соблюдать технику безопасности, избегая прямого контакта с кожей, не дышать кислотными парами.
Формы уксусной кислоты:
Виды уксуса
Уксусная кислота в чистом виде – вещество агрессивное, способное нанести вред здоровью.
Поэтому в быту используется ее водный раствор разной концентрации. Существуют два способа создания уксуса:
Продукт промышленного производства может содержать в себе 3, 6 или 9 % уксусной кислоты. Концентрация домашнего уксуса еще ниже, что делает его безопаснее для применения. Также продукт домашнего производства содержит в себе витамины и другие полезные вещества. Спектр нутриентов зависит от продукта, из которого был изготовлен уксус. Наиболее часто применяют яблочное и виноградное сырье. Существует еще так называемый бальзамический уксус, сделанный из виноградного с добавлением пряных трав.
Суточная норма
Говорить о суточной норме потребления уксусной кислоты не приходится. Несмотря на высокую популярность уксуса в быту, широкое применение в кулинарии, ученые так и не рассчитали, сколько этого вещества можно или нужно потреблять человеку. Правда, и современная медицина не знает случаев, когда бы у кого-либо возникли проблемы со здоровьем из-за недостаточного употребления этого продукта.

Помимо этой очевидной причины для отказа от уксуса, существует еще одна. У некоторых людей встречается индивидуальная непереносимость вещества. Во избежание неприятных последствий, таким лицам также не следует потреблять пищу, приправленную уксусом.
Передозировка
Воздействие уксусной кислоты на человеческий организм схоже с влиянием соляной, серной или азотной кислот. Отличие – в более поверхностном воздействии веществ.
Примерно 12 мл чистой уксусной кислоты является смертельной для человека. Эта порция аналогична стакану столового уксуса или 20-40 мл уксусной эссенции. Пары вещества, попадая в легкие, вызывают пневмонию с осложнениями. Среди других возможных последствий передозировки – некроз тканей, геморрагия печени, нефроз с отмиранием почечных клеток.
Взаимодействие с другими веществами
Уксусная кислота быстро вступает в реакцию с протеинами. В комбинации с уксусом белки из пищи легче усваиваются организмом. Аналогично кислый водный раствор воздействует на углеводы, делая их более легкими для переваривания. Эта биохимическая способность делает продукт «правильным» соседом для мясной, рыбной или овощной пищи. Это правило работает только при условии здоровой пищеварительной системы.
Уксус в народной медицине
Альтернативная медицина применяет уксусную кислоту, а точнее ее водный раствор, в качестве лекарства от многих болезней.
Пожалуй, наиболее известный и потребляемый прием – снижение высокой температуры с помощью уксусных компрессов. Однако стоит учитывать, что при таком использовании вещество всасывается в кровь через кожу, что может стать причиной отравления у маленьких детей.
Не менее известное применение этой жидкости при укусах комаров, пчел и других насекомых. С помощью водного раствора кислоты народные целители лечат ангины, фарингиты, артрит, ревматизм, а также грибок стоп и молочницу. Для уменьшения симптомов простуды в комнате, где лежит больной, распыляют уксус. А если участок кожи, обгоревший под солнцем или обожженный медузой, смазать кислым раствором, получится уменьшить неприятные симптомы.

Также он важен для снижения холестерина, стабилизации сахара в крови (у диабетиков), избавления от лишнего веса (за счет ускорения метаболизма). Камни в почках альтернативная медицина также выводит уксусной кислотой из яблок.
Всегда стоит учитывать возможный вред в виде развития гастрита, язвы, отравления.
Кислота для красоты
В косметологии уксусная кислота используется широко. Об эффективности этого вещества в борьбе с целлюлитом и лишними сантиметрами рассказывают весьма вдохновляющие истории. Курс обертываний с использованием уксуса – и можно забыть об «апельсиновой корке». Так, по крайней мере, гласят отзывы на форумах худеющих женщин.
Также известно применение уксусной кислоты для лечения перхоти и прыщей. Результат достигается благодаря антибактериальным способностям вещества. Вернуть волосам блеск и силу также по силам уксусу. Достаточно после каждого мытья ополаскивать чистые кудри легким кислотным раствором. А защитить от облысения поможет уксус с корнем аира и листьями крапивы.
Использование в промышленности
Уксусная кислота – компонент с широким спектром применения. В частности, в фармацевтически токсичной для человека.
Также это вещество – важный компонент в парфюмерии. Ее добавляют в косметические средства в качестве консерванта.
Соли уксусной кислоты используются в качестве протрав и как средство против сорняков.
Пищевые источники
Первым и наиболее концентрированным источником кислоты являются разного вида уксусы: яблочный, винный, столовый и другие.
Также это вещество содержится в меде, винограде, яблоках, финиках, инжире, свекле, арбузе, бананах, солоде, пшенице и других продуктах.
Уксусная кислота – субстанция весьма противоречивая. При правильном использовании она может послужить на пользу человеку. Но если не соблюдать технику безопасности, то последствия могут быть плачевными.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Уксусная кислота
| Уксусная кислота | |
 | |
 | |
| Общие | |
|---|---|
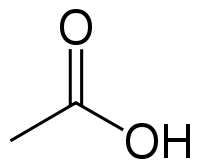
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
Содержание
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии. [1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту. [2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго. [1] [3]
Физические свойства
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
Получение
В промышленности
Окислительные методы
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Каталитическое карбонилирование метанола
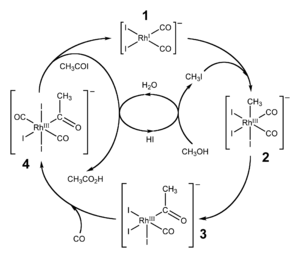
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. [7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. [8] [9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO). [5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты. [10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением [12] :
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
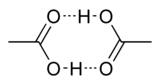
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями. [13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
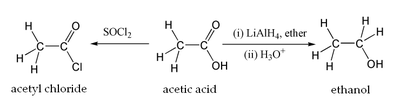
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³. [4]
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Характеристика и свойства уксусной кислоты
Уксусная кислота (или этановая) – органическое химическое соединение, относящееся к карбоновым кислотам (в состав их формулы входит карбоксильная группа – COOH). Это вещество известно человечеству с древних времен. Без нее невозможно производство многих пищевых продуктов и получение органических веществ.
Общая характеристика, формула
Химическая формула вещества СН3СООН. При нормальных условиях это бесцветная жидкость, обладающая резким характерным запахом и кислым вкусом. Попадание концентрированного вещества на слизистые оболочки вызывает химический ожог. «Ледяная» уксусная кислота 99 процентов обладает высокой гигроскопичностью, т.е. она способна поглощать водяной пар из атмосферного воздуха.
В уксусе могут растворяться не только жидкости, но и газы. Например, в нем растворяются фтороводород HF, хлористый водород HCl и бромистый водород HBr.
Соли рассматриваемого химического вещества называются ацетатами. Такое же наименование имеют и сложные эфиры. В качестве пищевой добавки применяется раствор уксусной кислоты с концентрацией 3 – 9%. В составе уксусной кислоты не может быть никаких примесей.
История открытия уксусной кислоты
Рассматриваемое вещество известно человеку с первобытных времен. СН3СООН образуется при скисании вина (отсюда и другое название – винный уксус). Впервые химические свойства уксуса описано в Древней Греции в 3 веке до н.э. В то время это вещество применялось для получения красителей. В Древнем Риме большой популярностью пользовался так называемый свинцовый сахар – ацетат свинца. Эта соль была причиной хронических отравлений и болезней римской аристократии.
Химическое строение уксуса впервые начал исследовать французский химик Дюма: он опубликовал труд о замещении атома водорода в органических соединениях атомом хлора. Так он получил хлоруксусную кислоту.
В середине 19 века немецкий химик А. Кольбе синтезировал уксус путем хлорирования сероуглерода CS2 до тетрахлометана CCl4, который путем пиролиза превращался в тетрахлорэтилен C2Cl4. Дальнейшее воздействие хлором водного раствора тетрахлорэтилена дало возможность получить трихлоруксусную кислоту. После электролитического восстановления ученый получил СН3СООН.
Еще в начале ХХ века значительное количество уксуса проводилось путем перегонки древесины.
Получение и производство
На ранних этапах развития индустрии вещество уксусная кислота получали путем окисления бутана и ацетатальдегида. Этот альдегид окислялся в присутствии катализатора ацетата марганца при высоком давлении и температуре. Реакция имела такой вид: 2СН3СНО + О2→2СН3СООН.
Окисление же бутана проходило при высоком давлении и в присутствии катализатора ацетата кобальта. Реакция имела такой вид: 2С4Н10 + 5О2→ 2СН3СООН.
В результате подорожания нефти (а рассмотренные способы базировались на окислении продуктов ее крекинга) сделали такие химические реакции экономически невыгодными. Более совершенный способ получения уксусной кислоты – это каталитическое карбонилирование метанола (древесного спирта) путем воздействия на него окисью углерода. Реакция имеет такой вид: СН3СОН + СО → СН3СООН. Катализатором служит йодистая соль кобальта.
С 1970 г. компания Монсанто предложила использовать в качестве катализатора родиевые соли. В результате производство уксусной кислоты заметно возросло.
В процессе биохимического производства применяется окисление этилового спирта микроорганизмами. Реакция проходит при участии фермента алькогольдегидрогеназы.
Также пищевую добавку уксусную кислоту можно получить путем окисления этилового спирта: С2Н5ОН + О2→ СН3СООН + Н2О.
Химические и физические свойства
Физические свойства уксусной кислоты следующие:
В следующих примерах показаны кислотные свойства уксусной кислоты.
Качественной реакцией на наличие ацетатов является их взаимодействие с сильными кислотами. Уксус вытесняется из водных растворов солей. При этом появляется характерный запах.
Хранение и транспортировка
Промышленная уксусная кислота наливается в транспортную тару (оцинкованные металлические бочки или канистры из полимерных материалов). В магазины раствор поступает в стеклянных или пластиковых бутылках с навинчивающимися крышками или пробками.
Хранить это вещество нужно в плотно закрытой таре в помещениях, которые специально приспособленные для хранения воспламеняющихся веществ. Места хранения уксусной кислоты должны быть защищенными от попадания прямых солнечных лучей и осадков.
Класс опасности уксусной кислоты – 8: едкие и коррозийные вещества.
Перевозку нужно осуществлять в цистернах из нержавеющей стали. Они не должны иметь нижнего слива. Наливные отверстия, люки оборудуются герметичными резиновыми, полиэтиленовыми прокладками, которые предотвращают расплескивание жидкости в процессе перевозки.
ООО «Эверест» осуществляет оптовые поставки уксусной ледяной (этановой) кислоты по выгодным ценам. Подробнее по телефону: +7 (812) 448-47-55.