У ребенка на узи маленький носик что это
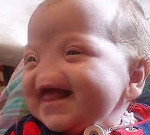
Врожденные аномалии носа
Врожденные аномалии носа – это пороки развития, которые характеризуются изменением формы, размеров, локализации либо темпов внутриутробного развития наружного или внутреннего носа. Клинические проявления включают в себя нарушение общего состояния, затруднение или отсутствие носового дыхания, частые воспаления придаточных пазух, в дальнейшем – дыхательную недостаточность, менингит. Выраженные пороки развития наружного носа определяются визуально. Аномалии внутренних структур диагностируются при помощи риноскопии, фиброскопии, рентгенографии, КТ. Основной метод лечения – хирургическая коррекция.
Общие сведения
Врожденные аномалии носа – это группа гетерогенных пороков развития лицевой части черепа, которые проявляются изменением формы, размеров, строения или расположения носа и внутриносовых структур. Могут возникать изолированно или комбинироваться с другими пороками. 33-60% от общего числа заболеваний этой группы составляют врожденные атрезии хоан. 50% случаев сопровождаются другими аномалиями черепно-лицевой зоны – «волчьей пастью», слабостью сосательных мышц и т. д. Врожденные аномалии носа с одинаковой частотой встречаются среди лиц мужского и женского пола. Не имеют географических особенностей распространения. В преимущественном большинстве случаев такие пороки диагностируют при первичном осмотре новорожденного или в первые дни жизни. При качественном лечении удается достичь нормализации дыхательной функции носа и провести косметическую коррекцию.
Причины
Врожденные аномалии носа – это полиэтиологические состояния. К самым распространенным причинам развития относятся перенесенные матерью инфекционные заболевания из группы TORCH (цитомегаловирус, токсоплазмоз, вирусы гепатита и простого герпеса человека, краснуха и сифилис) во время беременности, радиация, ионизирующее излучение и другие физические факторы, интоксикации химическими веществами и медикаментами, алкоголь, табак и наркотики. В некоторых случаях можно проследить генетическую склонность к подобным порокам развития.
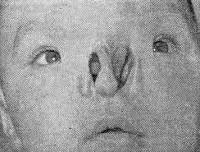
Анатомически врожденные аномалии носа характеризуются дефектами костей лицевого черепа, при которых они не срастаются, срастаются не полностью или гипертрофируются. На фоне незарастания эмбриональных щелей могут образовываться врожденные кисты или свищи. Неполное смыкание передней половины носовой перегородки проявляется углублением спинки носа или бороздой, разделяющей ее на две половины. Врожденные аномалии носа в виде атрезии хоан возникают при чрезмерном сближении и последующем сращивании сошника с задними краями носовых раковин.
Классификация
Все врожденные аномалии носа разделяются на 3 большие группы:
Симптомы
Клинические проявления врожденных аномалий носа варьируют в зависимости от вида порока. Общий симптом всех для форм – нарушения носового дыхания. В педиатрии и неонатологии он проявляется аномально шумным дыханием, беспокойностью ребенка, тахипноэ, в тяжелых случаях – одышкой, цианозом, дыхательной недостаточностью, асфиксией. Все эти проявления могут быть обусловлены выраженной слабостью крыльев носа и их «проседанием» в носовую полость во время вдоха, гипертрофированными носовыми раковинами, полным зарастанием обоих носовых ходов. Самые тяжелые варианты врожденных аномалий носа, при которых носовое дыхание невозможно или затруднено, – тотальная или половинная агенезия носа и прилегающих структур, атрезии полостей носа, медиальные расщелины или углубления. Также ярко выраженные пороки наружного носа сопровождаются характерной деформацией лицевого черепа.
Атрезия хоан нарушает проходимость каналов придаточных пазух, что часто осложняется их воспалением – гайморитом, фронтитом и пр. Со временем эти патологии могут проявляться различными симптомами: деформацией лицевого черепа (высокое небо, асимметрия), смещением резцов, накапливанием в носовой полости густой слизи, дерматитами в области носогубного треугольника на фоне раздражения кожи носовым секретом. Зарастание общих носовых ходов зачастую комбинируется с другими врожденными аномалиями носа. Устья свищей носа, как правило, расположены по медиальной линии в месте перехода костного отдела в хрящевой. Такие свищи заканчиваются кистами в области переносицы. Подобные врожденные аномалии носа имеют склонность к воспалительным и гнойным процессам, что на фоне непосредственно близости мозговой полости черепа нередко приводит к поражению мозговых оболочек – менингиту.
Диагностика
Диагностика врожденных аномалий носа основывается на сборе анамнеза, объективном осмотре ребенка, результатах лабораторных анализов и инструментальных методов диагностики. Анамнестические данные могут указать на возможную этиологию – перенесенные инфекции, воздействие патологических факторов, генетическую склонность и др. Тяжелые пороки наружного носа проявляются характерной деформацией лицевого черепа уже при первичном осмотре педиатром или неонатологом. Определить врожденные аномалии носа с поражением внутренних структур позволяет риноскопия. При развитии синуситов данная методика выявляет бледность, чрезмерную влажность слизистых оболочек. Лабораторные тесты используются с целью подтверждения или опровержения инфекционной этиологии, исключения воспалительных осложнений.
Ведущее место в диагностике врожденных аномалий носа занимают инструментальные методы исследования. В педиатрии используются зондирование носовой полости, фиброэндоскопия, рентгенография (иногда – с контрастированием), КТ, МРТ, фистулография. Зондирование дает возможность определить проходимость носовых ходов, фиброэндоскопия – полноценно изучить состояние всех внутриносовых структур. Рентгенография и КТ – неинвазивные методики, позволяющие детально изучить имеющуюся врожденную аномалию носа, придаточные пазухи носа и окружающие ткани. Также перечисленные методы используются для определения терапевтической тактики и объема необходимого оперативного вмешательства. МРТ проводится с целью оценки состояния головного мозга и исключения его поражения. Фистулографию применяют при наличии свищей для визуализации их ходов и сбора необходимой для хирурга информации.
Лечение
Основное лечение врожденных аномалий носа – хирургическое. Сроки, в которые должна проводиться операция, зависят от тяжести состояния ребенка. При атрезии хоан показана максимально ранняя коррекция, т. к. существует высокий риск асфиксии. Выраженные деформации наружного носа также подлежат ринопластике в ранние сроки. Объем операций и хирургический доступ определяются индивидуально для каждого ребенка. После проведенного лечения всегда следует период реабилитации, включающий полноценный уход, регулярную обработку слизистых оболочек полости носа, смену дренажа каждые 10-15 дней. При необходимости ребенок переводится на парентеральное питание, может применяться инфузионная и антибактериальная терапия. Последняя осуществляется с использованием препаратов широкого спектра действия – цефалоспоринов III-IV поколения и их комбинаций с другими антибиотиками.
Прогноз
Прогноз для жизни у детей с врожденными аномалиями носа при условии своевременного проведения операции – благоприятный. Косметический результат напрямую зависит от тяжести порока и возможностей детского хирурга. У большинства пациентов удается реконструировать физиологическую форму носа, восстановить нормальное носовое дыхание и проходимость придаточных пазух. Профилактика врожденных аномалий носа аналогична любым другим врожденным патологиям. Она подразумевает адекватное ведение беременности, регулярное посещение женской консультации, проведение УЗИ согласно графику, полный отказ от вредных привычек на время вынашивания ребенка.
У ребенка на узи маленький носик что это
Если у Вашего плода найдены ультразвуковые маркёры
Если при ультразвуковом исследовании найдены маркеры хромосомной патологии плода
Самые часто встречающиеся ультразвуковые маркеры хромосомной аномалии:
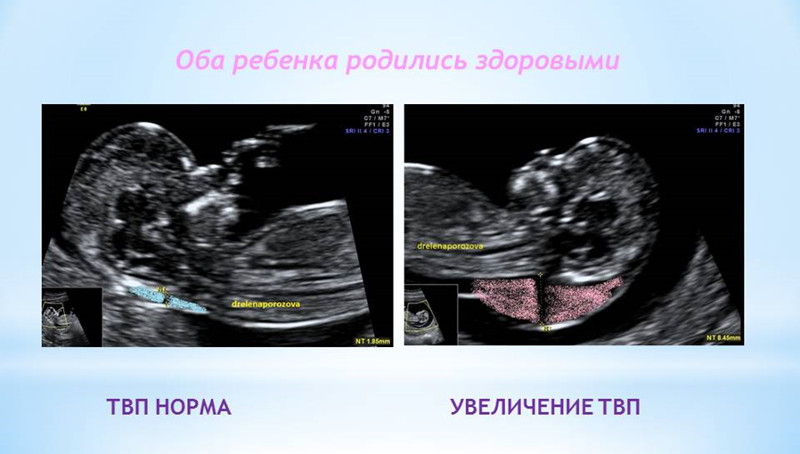
1. Увеличение ТВП.
Оценка этого параметра проводится в первое скрининговое УЗИ (11-14 недель)
ТВП (толщина воротникового пространства) может оказаться больше нормы по нескольким причинам.
Почему у плода может выявляться увеличение ТВП?
Родители бывают крайне взволнованы и хотят сразу же получить ответы на все, возникающие у них вопросы – с чем связано, что делать и многие другие. Вопросы, на которые невозможно ответить сразу. Ведь причин увеличения ТВП множество. Данная находка может встречаться у абсолютно здоровых плодов, это не порок развития, это лишь сигнал к более глубокому обследованию, потому что такая особенность может иметь место у плодов с хромосомной патологией, аномалиями сердца либо другими врожденными или наследственными заболеваниями. При увеличении максимального порога ТВП ВАЖНО, чтобы врач оценил все остальные ультразвуковые маркеры (признаки), а также провел детальную оценку анатомии плода. Возможно, причина увеличения ТВП кроется в нарушении развития плода (например, аномалии строения сердца).
Что делать при выявлении увеличения ТВП у плода?
Если у вашего плода обнаружили расширение ТВП, Вас обязательно направят на консультацию к врачу генетику, который собрав анамнез, оценив все риски, даст рекомендации по дополнительным методам исследования (инвазивная диагностика). Далее потребуется экспертное УЗИ плода на сроке 20 недель для детальной оценки анатомии. Если по всем этим исследованиям отклонений не выявлено, то шансы родить здорового ребенка велики даже при значительной величине ТВП.
2. Гипоплазия\аплазия костей носа.
Гипоплазия костей носа – уменьшение размеров косточки носа в зависимости от КТР вашего малыша.
Аплазия костей носа – отсутствие визуализации косточки носа у вашего малыша.
Отсутствие видимости костной части спинки носа у плода или ее недоразвитие (недостаточно яркая) на первом скрининге связана с задержкой отложения кальция. Такая ситуация несколько чаще может встречаться у плодов с синдромом Дауна, однако важно, что:
3. Гиперэхогенный кишечник.
Это термин, говорящий о повышенной эхогенности (яркости) кишечника на ультразвуковом изображении. Выявление гиперэхогенного кишечника НЕ является пороком развития кишечника, а просто отражает характер его ультразвукового изображения. Необходимо помнить, что эхогенность нормального кишечника выше, чем эхогенность соседних с ним органов (печени, почек, легких), но такой кишечник не считается гиперэхогенным. Гиперэхогенным называется только такой кишечник, эхогенность которого сравнима с эхогенностью костей плода.
Почему кишечник у плода может быть гиперэхогенным?
Иногда гиперэхогенный кишечник выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Повышенная эхогенность кишечника может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного кишечника проводится тщательная оценка анатомии плода. Однако при выявлении гиперэхогенного кишечника можно говорить лишь о повышенном риске синдрома Дауна, так как подобные изменения могут встречаться и у совершенно здоровых плодов. Иногда гиперэхогенный кишечник может быть признаком внутриутробной инфекции плода. Гиперэхогенный кишечник часто обнаруживается у плодов с задержкой внутриутробного развития. Однако при этом будут обязательно выявляться отставание размеров плода от срока беременности, маловодие и нарушение кровотока в сосудах плода и матки. Если ничего из вышеперечисленного не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении гиперэхогенного кишечника у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты биохимического скрининга и даст необходимые рекомендации по дальнейшему ведению беременности.
4. Гиперэхогенный фокус в желудочке сердца.
Это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
Иногда гиперэхогенный фокус в сердце выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Наличие гиперэхогенного фокуса в сердце плода может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного фокуса проводится тщательная оценка анатомии плода. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только гиперэхогенного фокуса в сердце не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур.
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
Если у плода выявлен ТОЛЬКО гиперэхогенный фокус в сердце, то никаких дополнительных обследований не требуется; риск болезни Дауна не увеличивается. На плановом УЗИ в 32-34 недели еще раз будет осмотрено сердце плода. В большинстве случаев гиперэхогенный фокус в сердце исчезает к этому сроку беременности, но даже если он продолжает оставаться в сердце, это никак не влияет на здоровье плода и тактику ведения беременности.
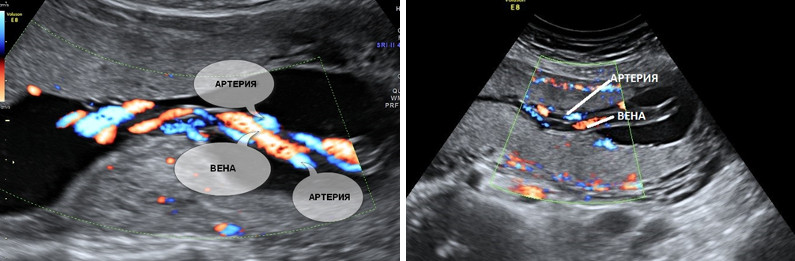
5. Единственная артерия пуповины.
Нормальная пуповина состоит из трех сосудов – две артерии и одна вена. Иногда вместо двух артерий в пуповине формируется только одна артерия и одна вена, таким образом, в пуповине определяется всего два сосуда. Данное состояние считается пороком развития пуповины, однако этот порок не оказывает никакого влияния на послеродовое состояние ребенка и его дальнейшее развитие.
Почему у плода может определяться единственная артерия пуповины?
Иногда единственная артерия пуповины выявляется у абсолютно нормальных плодов; после рождения ребенка данный факт не оказывает никакого влияния на его дальнейшее развитие. Иногда единственная артерия пуповины сочетается с пороками сердечно-сосудистой системы плода, поэтому при выявлении единственной артерии пуповины проводится детальный осмотр анатомии плода и, в частности, сердечно-сосудистой системы. При отсутствии других пороков развития единственная артерия пуповины в состоянии обеспечить адекватный кровоток плода. Несколько чаще единственная артерия пуповины выявляется у плодов с синдромом Дауна и другими хромосомными болезнями. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственная артерия пуповины иногда приводит к возникновению задержки внутриутробного развития плода. В связи с этим при обнаружении единственной артерии пуповины рекомендуется дополнительное УЗИ в 26-28 недель беременности, и плановое в 32-34 недели. Если отставание размеров плода от срока беременности или нарушение кровотока в сосудах плода и матки не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении единственной артерии пуповины у плода?
Выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к консультации генетика и проведению других диагностических процедур. Необходимо контрольное УЗИ в 26-28 и 32 недели беременности для оценки темпов роста плода и оценки его функционального состояния.
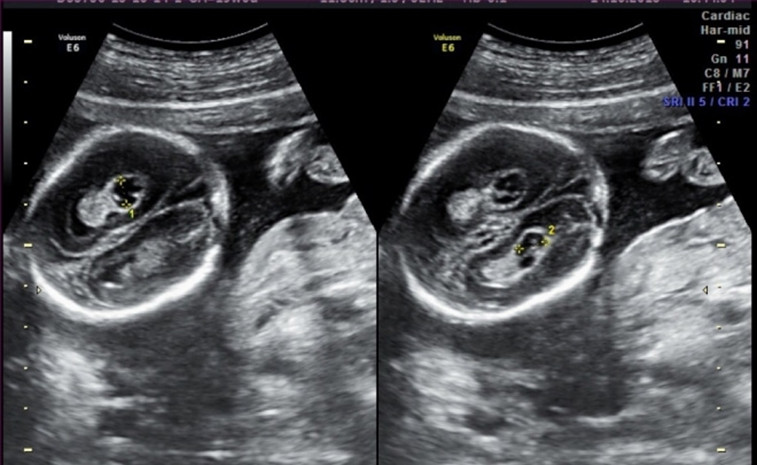
6. Кисты сосудистых сплетений (КСС).
Часто ли встречаются кисты сосудистых сплетений?
В 1-2 % всех нормальных беременностей плоды имеет КСС, в 50 % случаев обнаруживаются двусторонние кисты сосудистых сплетений, в 90 % случаев кисты самопроизвольно исчезают к 26-ой неделе беременности, число, размер, и форма кист могут варьировать, кисты также найдены у здоровых детей и взрослых. Несколько чаще кисты сосудистых сплетений выявляются у плодов с хромосомными болезнями, в частности, с синдромом Эдвардса (трисомия 18, лишняя 18 хромосома). Однако, при данном заболевании у плода всегда будут обнаруживаться множественные пороки развития, поэтому выявление только кист сосудистого сплетения не повышает риск наличия трисомии 18 и не является показанием к проведению других диагностических процедур. При болезни Дауна кисты сосудистых сплетений, как правило, не выявляются. Риск синдрома Эдвардса при обнаружении КСС не зависит от размеров кист и их одностороннего или двустороннего расположения. Большинство кист рассасывается к 24-28 неделям, поэтому в 28 недель проводится контрольное УЗИ. Однако, если кисты сосудистых сплетений не исчезают к 28-30 неделям, это никак не влияет на дальнейшее развитие ребенка.
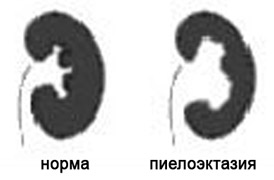
7. Расширение почечных лоханок (пиелоэктазия).
Почечные лоханки это полости, где собирается моча из почек. Из лоханок моча перемещается в мочеточники, по которым она поступает в мочевой пузырь.
Пиелоэктазия представляет собой расширение почечных лоханок. Пиелоэктазия в 3-5 раз чаще встречается у мальчиков, чем у девочек. Встречается как односторонняя, так и двухсторонняя пиелоэктазия. Легкие формы пиелоэктазии проходят чаще самостоятельно, а тяжелые иногда требуют хирургического лечения.
Причина расширения почечных лоханок у плода.
Если на пути естественного оттока мочи встречается препятствие, то моча будет накапливаться выше данного препятствия, что будет приводить к расширению лоханок почек. Пиелоэктазия у плода устанавливается при обычном ультразвуковом исследовании в 18-22 недели беременности.
Опасна ли пиелоэктазия?
Умеренное расширение почечных лоханок, как правило, не влияет на здоровье будущего ребенка. В большинстве случаев при беременности наблюдается самопроизвольное исчезновение умеренной пиелоэктазии. Выраженная пиелоэктазия (более 10 мм) свидетельствует о значительном затруднении оттока мочи из почки. Затруднение оттока мочи из почки может нарастать, вызывая сдавление, атрофию почечной ткани и снижение функции почки.
Кроме того, нарушение оттока мочи нередко сопровождается присоединением пиелонефрита – воспаления почки, ухудшающего ее состояние. Несколько чаще расширение лоханок почек выявляется у плодов с синдромом Дауна. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только расширения почечных лоханок не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственное, что нужно сделать до родов – пройти контрольное УЗИ в 32 недели и еще раз оценить размеры почечных лоханок.
Нужно ли обследовать ребенка после родов?
У многих детей умеренная пиелоэктазия исчезает самопроизвольно в результате дозревания органов мочевыделительной системы после рождения ребенка. При умеренной пиелоэктазии бывает достаточно проводить регулярные ультразвуковые исследования каждые три месяца после рождения ребенка. При присоединении мочевой инфекции может понадобиться применение антибиотиков. При увеличении степени пиелоэктазии необходимо более детальное урологическое обследование.
В случаях выраженной пиелоэктазии, если расширение лоханок прогрессирует, и происходит снижение функции почки, бывает показано хирургическое лечение. Хирургические операции позволяют устранить препятствие оттоку мочи. Часть оперативных вмешательств может с успехом выполняться эндоскопическими методами – без открытой операции, при помощи миниатюрных инструментов, вводимых через мочеиспускательный канал. В любом случае вопрос об оперативном лечении решается после рождения ребенка и полного его обследования.
Что делать при выявлении ультразвуковых маркеров хромосомной патологии у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты ультразвукового исследования и биохимического скрининга, рассчитает риск индивидуально для вашего случая и даст необходимые рекомендации по дальнейшему ведению беременности.
© 2021 краевое государственное бюджетное учреждение здравоохранения «Красноярский краевой медико-генетический центр» (КГБУЗ «ККМГЦ»)
Оценка носовой кости в I триместре беременности: как, где, когда и зачем мы делаем
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
За последние 10 лет данная система полностью оправдала себя и получила дальнейшее развитие, путем прибавления к расчету риска добавочных ультразвуковых маркеров (оценка носовой кости, венозного протока, трикуспидальной регургитации, некоторых маркерных врожденных пороков развития). Расширение протокола осмотра с оценкой новых ультразвуковых маркеров (оценка носовой кости, кровоток в венозном протоке и на трикуспидальном клапане) улучшает чувствительность комбинированного скрининга благодаря увеличению частоты обнаружения и уменьшению частоты ложноположительных результатов [3].
Однако их оценка требует соответствующего углубленного обучения врача УЗД и получение сертификата компетентности на проведение данного вида исследования, так как только после получения доступа на конкретный вид исследования программа расчета риска будет учитывать эти данные в своих расчетах 3.
Преимуществами проведения УЗИ в 11-14 нед помимо установки точного срока беременности являются: ранняя диагностика многих пороков развития плода, оценка маркеров хромосомных аномалий для выявления беременных высокого риска по хромосомным аномалиям у плода, при многоплодной беременности именно в ранний срок возможно установить хориальность, что является важнейшим фактором, определяющим исход многоплодной беременности, возможность выявить женщин группы высокого риска по развитию преэклампсии в поздние сроки беременности [3, 4].
Копчико-теменной размер плода (КТР) для проведения скрининга I триместра должен быть в пределах 45-84 мм. Для оценки носовой кости в I триместре беременности необходимо соблюдать строгие условия. Это адекватное увеличение (на снимке должны быть только голова и верхняя часть грудной клетки), среднесагиттальный скан (должны быть визуализированы эхогенный кончик носа, небный отросток верхней челюсти, диэнцефалон), нос представлен тремя «К» (кончик носа, кожа, кость). Кожные покровы и кости носа визуализируются в виде знака «равенства», нос параллелен датчику.
Такие правила, как размер плода, адекватное увеличение, среднесагиттальный скан идентичны таковым при измерении ТВП. Таким образом, при выведении корректного скана для измерения ТВП, что является обязательным при проведении УЗ-исследования в сроки 11-14 нед беременности, оценка носовой кости проводится в том же самом срезе, не требуя получения дополнительных изображений.
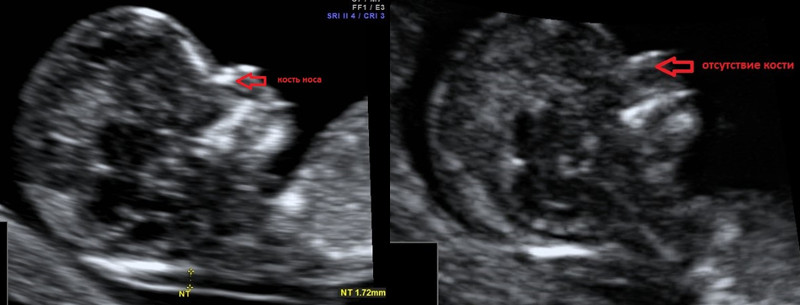
Рис. 1. Нормальная носовая кость.
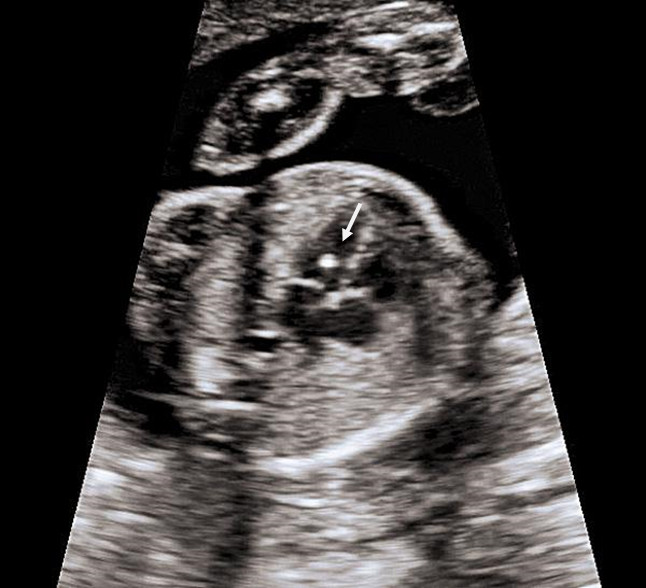
Считается, что носовая кость нормальна, когда она по своей структуре более эхогенна, чем надлежащая кожа и патологична, если она не видна (аплазия) (рис. 2) или ее длина меньше нормы (гипоплазия) (рис. 3). В случае одинаковой или меньшей эхогенности носовой кости чем кожи носовая кость считается патологической (рис. 4).
а) Стрелкой указана эхогенная кожа плода.
б) Стрелкой указано отсутствие носовой кости.
а) Носовая кость в 12 нед и 2 дня длиной 1,4 мм (меньше нижней границы нормы).
б) Носовая кость 2,1 мм в 14 нед у плода с синдромом Дауна.
Рис. 4. Сниженная эхогенность носовой кости.
Итак, патологией носовой кости считается:
Проводились многочисленные работы, посвященные измерению и оценке носовой кости в срок 11-14 нед беременности. Некоторые авторы предлагают оценивать лишь ее наличие или отсутствие (+/-) [7]. Некоторые работы кроме оценки носовой кости посвящены ее измерению, сравнивая длину с нормативными для данного срока значениями 8.
Эволюция развития оценки этого маркера и мнение специалистов на этот счет, пожалуй, одна из самых дискутабельных проблем, не до конца решенных в скрининге I триместра беременности. Большинство авторов считают оценку носовой кости в I триместре одной из самых сложных задач среди всех остальных маркеров. И это мнение не лишено оснований.
Безусловно, сторонники теории о том, что для каждой расы (азиаты, афро-американцы и т.д.) и популяции народов (буряты, калмыки, народы Северного Кавказа) должны существовать свои процентильные нормативы для каждого КТР правы. Однако проведение этих исследований возможно лишь тогда, когда в рамках безвыборочного скрининга на нормальных плодах будут проведены мультицентровые исследования с измерением носовой кости.
В программе расчета риска Astraia при оценке носовой кости есть 4 поля: норма, патология (аплазия/гипоплазия), четко не видна, оценить не удалось, т.е. для того, чтобы поставить диагноз «Гипоплазия носовой кости» нужно удостовериться, что она на самом деле меньше нормативных значений для данного срока беременности, а это можно сделать только путем ее измерения и сравнения с известным нормативом.
Метод оценки носовой кости только лишь «да/нет», когда предлагается только увидеть носовую кость и сравнить ее эхогенность с кожей весьма «аппаратозависим», т.е. очень вариабелен и зависит от технических настроек ультразвукового сканера. При получении «жесткого» изображения, характерного для некоторых ультразвуковых аппаратов со специфическими заводскими пресетами (настройками) для осмотра плода в I триместре, всегда эхогенность кожи будет сопоставима, т. е. одинакова с эхогенностью носовой кости. Таким образом, у врачей практического звена, не имеющих возможности работать на сканерах премиум класса, возникают объективные трудности с оценкой этого важного дополнительного диагностического маркера.
Как сторонники метода измерения носовой кости в 11-14 нед приведем данные по Московской области. Область является разнородной по населяющему ее национальному составу. В своей работе мы пользовались нормативными значениями длины носовой кости, опубликованными J. Sonek и соавт. в 2003 году [8], за нижнюю границу нормы принимая значение 5-го процентиля (таблица).
Экспертами окружных кабинетов Московской области проводилась оценка не только присутствия и отсутствия носовой кости, но и ее измерение у всех беременных женщин (около 150 тысяч обследованных за 3,5 года работы скрининга). Все 31 эксперт Московской области имеют действующий сертификат компетенции FMF как на ТВП, так и на оценку носовой кости. Проведенный анализ выявления патологии (аплазия/гипоплазия) носовой кости у плодов с хромосомной патологией показал, что из пренатально выявленных 266 случаев синдрома Дауна у плода в I триместре носовая кость была патологична в 248 случаях, что составляет 93,2%.
Особо хотелось бы подчеркнуть, что в нашем исследовании было 10 беременных корейской национальности, попавших в группу риска по хромосомной патологии. У 4 из них была диагностирована патология носовой кости у плода. Можно было ожидать, что это этническая особенность, однако все данные плоды при пренатальном кариотипировании имели хромосомную патологию (трисомию 21). И, наоборот, у 6 плодов, имеющих нормальный кариотип как по длине, так и по эхогенности носовой кости были в пределах нормативных для данного срока значений.
В работах некоторых авторов установлено, что при трисомии 21 в I триместре беременности лишь у 25% плодов носовая кость отсутствовала, в более высокой частоте она была гипоплазирована (36%) [11].
Оценка носовой кости улучшает результаты комбинированного скрининга. Частота обнаружения патологии увеличивается с 90 до 93%. Частота ложноположительных результатов уменьшается с 3,0 до 2,5% [2, 3, 5, 6].
Таким образом, собственные данные позволяют нам рекомендовать оценивать носовую кость в сроки 11-14 нед по двум параметрам: эхогенность и длина, принимая за патологию носовой кости ее отсутствие, гипоплазию и снижение эхогенности.
Литература
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.