сирдалуд сколько дней можно принимать при остеохондрозе поясничного отдела
Сирдалуд и физиопроцедуры при остеохондроза
Добрый вечер уважаемые доктора. По результатам МРТ мне был поставлен диагноз остеохондроз шейного отдела, протрузии и сопутствующие заболевания шеи ( фото заключения мрт прилагаю). При очной консультации с невропатологом мне было назначено лечение ( фото так же добавлю к вопросу), но смущает препарат сердалуд. Я гипотоник и мое ежедневное давление составляет 110/60, в инструкции к этому препарату написано, что он оказывает гипотоническое влияние на организм и ещё больше опускает давление, что подтверждает отзывы людей в интернете. О пониженном давлении врач знала, стоит ли мне его пить? Назначен курс 17 дней, могу ли я пропить его 14 дней? Ещё есть вопрос по физиопроцедуры. Физиотерапевт назначила: лфк 10 процедур в группе, далее пол года самостоятельно; ультразвук 10 процедур; амплипульстерапия 10 процедур. Далее 90 процедур электрофореза с каким-то препаратом, с перерывами между курсами ( курс 30 процедур ) 1,5-2 месяца. С ее слов, такой длительный курс электрофореза оказывает положительный эффект на позвоночник, почти как операция, и полностью останавливает развитие болезни. Я так понимаю, что протрузии не вылечивается, можно только не допустить перерастания в грыжу. И ещё я буду принимать препарат аркоксия, допустимо ли приём алкоголя через сутки после Аркоксиа и через 2 суток после последней таблетки сирдалуда? ( свадьба, употребление шампанского неизбежно 🙂
На сервисе СпросиВрача доступна консультация невролога по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
БОЛИ В СПИНЕ: болезненный мышечный спазм и его лечение миорелаксантами
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны тел смежных позвонков. Поражение межпозвонкового диска развивается вследствие его повторных травм (подъем тяжести, избыточная статическая и динамическая нагрузка, падения и др.) и возрастных дегенеративных изменений. Студенистое ядро, центральная часть диска, высыхает и частично утрачивает амортизирующую функцию. Фиброзное кольцо, расположенное по периферии диска, истончается, в нем образуются трещины, к которым смещается студенистое ядро, образуя выпячивание (пролапс), а при разрыве фиброзного кольца — грыжу. В настоящее время созданы препараты, оказывающие структурно-модифицирующее действие на хрящевую ткань (старое название — хондропротекторы). Типичным представителем группы является препарат хондро, назначаемый курсом по 4 месяца (эффект сохраняется 2 месяца после отмены). В пораженном позвоночном сегменте возникает относительная нестабильность позвоночника, развиваются остеофиты тел позвонков (спондилез), повреждаются связки и межпозвонковые суставы (спондилоартроз). Грыжи межпозвонковых дисков наиболее часто наблюдаются в нижних поясничных дисках, реже — в нижних шейных и верхних поясничных, крайне редко — в грудных. Грыжи диска в тело позвонка (грыжи Шморля) клинически не значимы, грыжи диска в заднем и заднебоковом направлении могут вызвать сдавление спинно-мозгового корешка (радикулопатию), спинного мозга (миелопатию на шейном уровне) или их сосудов.
Кроме компрессионных синдромов возможны рефлекторные (мышечно-тонические), которые обусловлены импульсацией из рецепторов в ответ на изменения в дисках, связках и суставах позвоночника — болезненный мышечный спазм. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако в дальнейшем этот фактор становиться причиной возникновения боли. В отличие от компрессионных синдромов остеохондроза позвоночника, которые встречаются относительно редко, болевые мышечные спазмы возникают в течение жизни практически у каждого второго человека.
Классический пример болезненного мышечного спазма представляет люмбаго (поясничный прострел), который характеризуется резкой, простреливающей болью в пояснице, развивающейся, как правило, при физической нагрузке (подъем тяжести и др.) или неловком движении. Больной нередко застывает в неудобном положении, попытка движения приводит к усилению боли. При обследовании выявляют напряжение мышц спины, обычно сколиоз, уплощение поясничного лордоза или кифоз.
Люмбалгия — боль в спине — и люмбоишиалгия — боль в спине и по задней поверхности ноги — развиваются чаще после физической нагрузки, неловкого движения или переохлаждения, реже — без каких-либо причин. Боли носят ноющий характер, усиливаются при движениях в позвоночнике, определенных позах, ходьбе. Для люмбоишиалгии характерна боль в ягодице, в задненаружных отделах ноги, не достигающая пальцев. При обследовании выявляют болезненность, напряжение мышц спины и задней группы мышц ноги, ограничение подвижности позвоночника, часто сколиоз, симптомы натяжения (Ласега, Вассермана и др.).
На шейном уровне могут возникать рефлекторные мышечно-тонические синдромы: цервикалгия и цервикобрахиалгия, которые чаще развиваются после физической нагрузки или неловкого движения шеи. Цервикалгия — боль в шейной области, которая нередко распространяется на затылок (цервикокраниалгия). Цервикобрахиалгия — боль в шейной области, распространяющаяся на руку. Характерно усиление болей при движениях в шее или, наоборот, при длительном статическом положении (в кино, после сна на плотной высокой подушке и др.). При обследовании выявляют напряжение шейных мышц, часто наблюдается ограничение движений в шейном отделе, болезненность при пальпации остистых отростков и межпозвонковых суставов на стороне боли.
При компрессии нервного корешка (радикулопатии) кроме болезненного мышечного спазма и ограничений подвижности в позвоночнике и конечностях выявляются чувствительные, рефлекторные и (или) двигательные нарушения в зоне пораженного корешка. На поясничном уровне чаще поражаются пятый поясничный (L5) и первый крестцовый (S1) корешки, реже — четвертый поясничный корешок и очень редко — верхние поясничные корешки. Радикулопатии нижних шейных корешков встречаются значительно реже.
Важно помнить, что боли в спине могут быть единственным симптомом при опухоли спинного мозга, сирингомиелии и других заболеваниях спинного мозга. Боли возникают при деструкции позвонков и поражении нервных корешков вследствие инфекционных процессов (туберкулезный спондилит, спинальный эпидуральный абсцесс), новообразованиях (первичные и метастатические опухоли позвоночника, миеломная болезнь), дисметаболических нарушениях (остеопороз, гиперпаратиреоз, болезнь Педжета). Боль в спине может быть следствием перелома позвоночника, его врожденных или приобретенных деформаций (сколиоза и др.), стеноза позвоночного канала, спондилолистеза, анкилозирующего спондилоартрита.
Она возможна при различных соматических заболеваниях (сердца, желудка, поджелудочной железы, почек, органов малого таза и др.) по механизму отраженных болей.
Обследование пациента с болью в спине требует тщательности. Нельзя любые боли в спине списывать на «остеохондроз» — состояние, которое при рентгенологическом исследовании выявляется у большинства людей среднего и пожилого возраста. Для неврологических проявлений остеохондроза позвоночника и миофасциальных болей характерны болезненный мышечный спазм и ограничение подвижности позвоночника.
Диагноз рефлекторных и компрессионных осложнений остеохондроза основывается на клинических данных и требует исключения других возможных причин болей в спине. Рентгенографию позвоночника используют, в основном, для исключения врожденных аномалий и деформаций, воспалительных заболеваний (спондилитов), первичных и метастатических опухолей. Рентгеновская КТ или МРТ позволяет выявить грыжу диска, определить ее размеры и локализацию, а также обнаружить стеноз позвоночного канала, опухоль спинного мозга.
Диагноз миофасциальных болей основывается на клинических данных (выявление болезненного мышечного напряжения одной или нескольких мышц) и требует исключения других возможных причин боли; дифференциальный диагноз с рефлекторными синдромами (мышечно-тоническими синдромами) вследствие остеохондроза позвоночника часто вызывает сложности; возможно сочетание этих заболеваний.
Лечение рефлекторных синдромов и радикулопатий вследствие остеохондроза основывается в остром периоде на обеспечении покоя — больному рекомендуется избегать резких наклонов и болезненных поз. Предписаны постельный режим в течение нескольких дней до стихания резких болей, жесткая постель (щит под матрац), прием миорелаксантов центрального действия, при необходимости — также дополнительно анальгетиков, нестероидных противовоспалительных средств. Для облегчения передвижения в этот период следует надеть шейный или поясничный корсет (фиксирующий пояс). Можно использовать физиотерапевтические анальгезирующие процедуры, втирание обезболивающих мазей, компрессы с 30–50-процентным раствором димексида и новокаином, новокаиновые и гидрокортизоновые блокады. При ослаблении болей рекомендуют постепенное увеличение двигательной активности и упражнения на укрепление мышц.
При хроническом течении рефлекторных синдромов и радикулопатий могут быть эффективны мануальная терапия, рефлексотерапия, физиотерапевтическое лечение, санаторно-курортное лечение. Хирургическое лечение (удаление грыжи диска) необходимо в тех редких случаях, когда возникает сдавление спинного мозга или корешков конского хвоста. Хирургическое лечение также показано при дискогенной радикулопатии, сопровождающейся выраженным парезом, и при длительном (более трех-четырех месяцев) отсутствии эффекта от консервативного лечения и наличии большой грыжи диска. Для профилактики обострений остеохондроза рекомендуют избегать провоцирующих факторов (подъем больших грузов, ношение тяжелой сумки в одной руке, переохлаждение и др.), регулярно заниматься лечебной гимнастикой.
При миофасциальных болях необходимо, чтобы мышца находилась в покое в течение нескольких дней. В качестве лечения можно назначать упражнения на растяжение мышц (постизометрическая релаксация), физиотерапию, рефлексотерапию или местное введение анестетиков в триггерные зоны, компрессы с димексидом и анестетиками.
Как уже было отмечено, и при острых болях, и при хронических болевых синдромах большое значение имеет лечение болезненного мышечного спазма. Тоническое напряжение мышц может не только само по себе быть причиной боли, но и способно вызвать деформацию и ограничивать подвижность позвоночника, а также обуславливать компрессию проходящих вблизи нервных стволов и сосудов. Для его лечения помимо нестероидных противовоспалительных средств, анальгетиков, (например, нимулид в форме трансдермального геля для местной терапии или в форме лингвальных таблеток при остром болевом синдроме), физиотерапии и лечебной гимнастики в качестве препаратов первого ряда применяют миорелаксанты — препараты, способные разорвать «порочный круг» болевого синдрома [2].
Для лечения болезненного мышечного спазма миорелаксанты используются внутрь или парентерально. Снижая рефлекторное мышечное напряжение, миорелаксанты уменьшают боль, улучшают двигательные функции и облегчают проведение лечебной физкультуры. Лечение миорелаксантами начинают с обычной терапевтической дозы и продолжают до тех пор, пока сохраняется болевой синдром; как правило, курс лечения составляет несколько недель. В ходе целого ряда исследований удалось доказать, что при болезненном мышечном спазме добавление к стандартной терапии (нестероидные противовоспалительные средства, анальгетики, физиотерапия, лечебная гимнастика) миорелаксантов приводит к более быстрому регрессу боли, мышечного напряжения и улучшению подвижности позвоночника.
В качестве миорелаксантов применяются мидокалм, баклофен и сирдалуд. Миорелаксанты обычно не комбинируют друг с другом. Для снятия болезненных мышечных спазмов можно также использовать диазепам (седуксен, реланиум) в индивидульно подобранной дозе.
Сирдалуд (тизанидин) — агонист α-2 адренергических рецепторов. Препарат снижает мышечный тонус вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга; сирдалуд обладает также умеренным центральным анальгезирующим действием. При приеме внутрь максимальная концентрация сирдалуда в крови достигается через час, прием пищи не влияет на его фармакокинетику. Начальная доза препарата составляет 6 мг в сутки в три приема, средняя терапевтическая доза — 12—24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов отмечаются сонливость, головокружение, незначительное снижение артериального давления; требуется осторожность при приеме препарата больными пожилого возраста.
Мидокалм (толперизон) в течение длительного времени широко используется при лечении рефлекторных и компрессионных осложнений дегенеративно-дистрофических изменений позвоночника (остеохондроз, спондилез, спондилоартроз) и миофасциальных болей [3]. Мидокалм оказывает преимущественно центральное миорелаксирующее действие. Снижение мышечного тонуса при приеме препарата связывается с угнетающим влиянием на каудальную часть ретикулярной фармации и подавлением спинно-мозговой рефлекторной активности. Препарат обладает умеренным центральным анальгезирующим действием и легким сосудорасширяющим влиянием. Прием мидокалма начинают с 150 мг в сутки три раза в день, постепенно увеличивая дозу до получения эффекта, у взрослых обычно до 300—450 мг в сутки. Для быстрого эффекта препарат вводится внутримышечно по 1 мл (100 мг) два раза в сутки или внутривенно по 1 мл один раз в сутки.
Эффективность и безопасность применения мидокалма при болезненном мышечном спазме доказана в ходе двойного слепого плацебо-контролируемого исследования [4]. В восьми исследовательских центрах 110 больных в возрасте от 20 до 75 лет методом рандомизации получали мидокалм в дозе 300 мг в сутки или плацебо в сочетании с физиотерапией и реабилитацией в течение 21 дня. В качестве объективного критерия эффективности лечения рассматривают болевой порог давления, измеряемый с помощью специального прибора (Pressure Tolerance Meter) в 16 симметричных точек туловища и конечностей. Кроме того, пациенты субъективно оценивали свое состояние по интенсивности боли, ощущению напряжения мышц и подвижности позвоночника; врач также оценивал напряжение мышц и подвижность позвоночника. Перед началом лечения и после его окончания проводилось развернутое клиническое и лабораторное обследование, включая ЭКГ, измерение артериального давления, биохимический анализ крови по 16 показателям.
Согласно результатам исследований, применение мидокалма достоверно снижает болезненный мышечный спазм, измеряемый объективно инструментальным методом. Различие между группами лечения и плацебо, которое отмечалось уже на четвертый день, постепенно увеличивалось и становилось статистически достоверным на 10-й и 21-й дни лечения, которые были выбраны в качестве конечных точек для доказательного сравнения. Анализ субъективной оценке результатов лечения, данной врачами и пациентами после его окончания (через 21 день), показал, что в группе больных, получавших мидокалм, достоверно чаще результаты лечения оценивались как очень хорошие, тогда как в группе плацебо эффект существенно чаще отсутствовал. Согласно субъективной оценке результатов лечения, данной больными после его окончания (через 21 день), каких-либо значимых различий, касающихся переносимости мидокалма и плацебо, выявлено не было. У подавляющего большинства больных отмечалась хорошая переносимость мидокалма. Результаты ЭКГ, биохимические и гематологические показатели в группе пациентов, принимавших как мидокалм, так и плацебо, также не различались.
Важно отметить, что более половины (62%) пациентов, включенных в исследование, получали другие виды терапии до начала исследования, и у большинства из них (68%) при этом не отмечалось улучшения. Это свидетельствует об эффективности мидокалма в лечении болезненного мышечного спазма, резистентного к другим видам терапии.
Введение мидокалма парентерально позволяет быстро снять боль и уменьшить мышечное напряжение. При вертеброгенном мышечно-тоническом синдроме внутримышечное введение 100 мг мидокалма ослабляет боль уже через 1,5 ч, а лечение мидокалмом в течение недели по 200 мг/сут в/м, а затем на протяжении двух недель по 450 мг/сут перорально имеет достоверное преимущество над стандартной терапией; при этом терапия мидокалмом не только позволяет уменьшить боль, но и снимает тревожность, повышает умственную работоспособность [1].
При болезненном мышечном спазме достоинствами мидокалма помимо эффективного миорелаксирующего и обезболивающиего эффекта являются отсутствие побочных эффектов и хорошее взаимодействие с нестероидными противовоспалительными средствами, что во многих случаях позволяет уменьшить дозу последних и вследствие этого ослабить или даже полностью устранить их побочные эффекты, не снижая эффективности лечения.
Важным преимуществом мидокалма перед другими миорелаксантами является отсутствие седативного эффекта и мышечной слабости при его приеме. Это преимущество доказано в ходе двойного слепого плацебо-контролируемого исследования [5]. В исследовании вошли 72 здоровых добровольца в возрасте от 19 до 27 лет (средний возраст — 21,7 лет). Исследование проводилось в течение восьми дней, все это время добровольцы методом рандомизации получали 150 или 450 мг мидокалма в сутки в три приема либо плацебо — также в три приема. Нейропсихологические исследования осуществляются утром в первый и последний (восьмой) дни исследования до и после приема мидокалма через 1,5, 4 и 6 ч либо плацебо. Результаты исследования не показали каких-либо существенных различий в скорости сенсомоторных реакций и быстроте выполнения различных психологических тестов через 1,5, 4 и 6 ч после приема мидокалма в дозе 50 или 150 мг либо плацебо. Аналогичные исследования, проведенные на восьмой день с начала приема мидокалма, также не показали существенных различий в сравнении с группой плацебо. Это свидетельствует о хорошей переносимости мидокалма и возможности назначения его в тех случаях, когда по роду деятельности пациенту требуется сохранить быстроту реакций и способность концентрировать внимание, в том числе при вождении автомобиля.
Таким образом, болезненный мышечный спазм представляет собой одну из наиболее распространенных причин болей в спине (вследствие рефлекторных синдромов остеохондроза или миофасциальных болей). В таких случаях рекомендуется применение миорелаксантов в комбинации с различными лекарственными средствами, физиотерапией и лечебной гимнастикой. В последние годы доказана эффективность и безопасность миорелаксанта мидокалма, который не вызывает седативного эффекта и выпускается в форме для парентерального введения с целью быстрого купирования болевого синдрома.
Литература.
В. А. Парфенов, доктор медицинских наук, профессор ММА им. И. М. Сеченова
Т. Т. Батышева, кандидат медицинских наук Поликлиника восстановительного лечения №7 Москвы
Возможности применения тизанидина (Сирдалуда) в клинической практике. Обзор литературы
1370
Данилов А.Б.
Успех проводимого лечения зависит не только от правильности выбора того или иного лекарственного препарата с точки зрения симптомов, описанных в инструкции по применению, и доказательных исследований по эффективности препарата, но также и от того, насколько удается лечащему врачу соотнести особенности клинического воздействия лекарства с индивидуальными характеристиками пациента.
В настоящей статье собрана информация о возможностях клинического применения миорелаксанта центрального действия тизанидина (Сирдалуда), рассказывается о механизме его действия, проводится сравнение тизанидина (Сирдалуда) с другими миорелаксантами, а также даются практические рекомендации по оптимизации лечения при использовании препарата. При подготовке статьи проанализированы результаты доказательных исследований, а также использованы рекомендации зарубежных и отечественных экспертов.
В нашей стране тизанидин зарегистрирован под названием Сирдалуд (Новартис Фарма) и выпускается в виде таблеток для приема внутрь в дозе 2 и 4 мг, а также в виде капсул с модифицированным высвобождением препарата (Сирдалуд МР) в дозе 6 мг.
Механизм действия тизанидина (Сирдалуда)
Тизанидин (Сирдалуд) относится к миорелаксантам центрального действия ( a2–адренергическим агонистам) и реализует свой эффект на спинальном и супраспинальном уровнях. Стимулируя пресинаптические a2–рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют NMDA–рецепторы. Это приводит к угнетению полисинаптических рефлексов спинного мозга, ответственных за гипертонус мышц, и подавлению передачи возбуждения через них, что вызывает снижение повышенного тонуса сгибательной и разгибательной мускулатуры и уменьшение болезненных мышечных спазмов. В дополнение к миорелаксирующим свойствам тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект (за счет снижения высвобождения возбуждающих нейромедиаторов в головном мозге на уровне locus ceruleus). В исследованиях на животных было показано, что тизанидин (Сирдалуд) может реализовывать свой эффект через снижение центральной сенситизации [12].
Клиническая эффективность
тизанидина (Сирдалуда)
Исходно тизанидин (Сирдалуд) был разработан для лечения мышечных спазмов при различных неврологических заболеваниях, однако в скором времени после начала его применения проявил анальгетические свойства. Имеются публикации, показавшие уменьшение боли у пациентов с тригеминальной невралгией [13], миофасциальной болью жевательных мышц [20], головной болью [8,15,21,22], нейропатической болью [19], др. видами мышечно–скелетной боли [2,17,26].
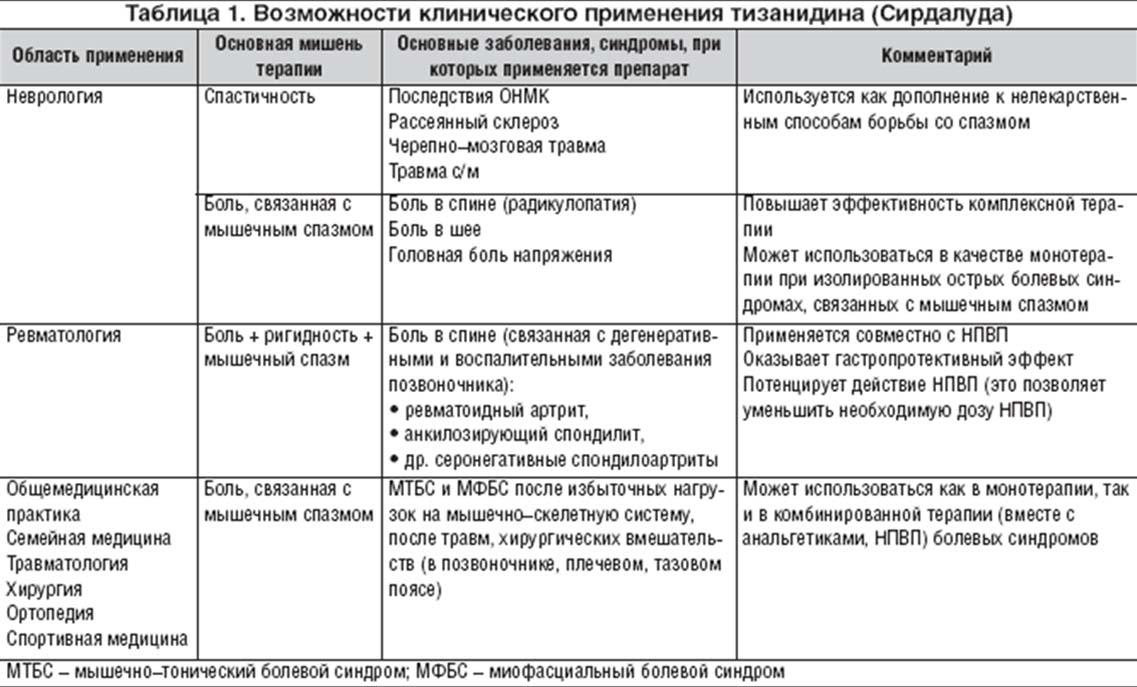
Таким образом, все показания по применению Сирдалуда можно свести в 2 группы: 1) лечение спастичности; 2) лечение боли, связанной с мышечным спазмом.
Рассмотрим возможности применения тизанидина при отдельных патологических состояниях (нарушениях).
Применение тизанидина (Сирдалуда)
при болевых синдромах
Мышечно–тонические синдромы чаще всего отмечаются в мышцах, которые испытывают перегрузки. Больные с мышечно–тоническими синдромами обычно жалуются на боли в позвоночнике или в мышцах плечевого и тазового пояса (в пояснице, в шее, плече), которые уменьшаются после отдыха, растирания, разминания и растяжения мышцы. Мышечно–тонический синдром может выполнять саногенетическую функцию, защищая пораженную область от дальнейшего повреждения. Однако длительно сохраняющийся мышечный спазм приводит к негативным последствиям в виде повышения нагрузки на костные и связочные структуры, что способствует ускорению развития дегенеративных изменений в костной системе, и может привести также к переходу мышечно–тонического синдрома в миофасциальный болевой.
Основной характеристикой миофасциального болевого синдрома является наличие триггерной точки (точек) – участка локального уплотнения в мышце, при раздражении которого вызывается местная болезненность и иррадиация боли. Миофасциальный синдром может развиться в любой поперечно–полосатой мыш-це – от лица до голени. Однако наиболее часто развитию миофасциального синдрома подвержена трапециевидная мышца, что проявляется в виде боли в спине, в области лопатки или шеи. При отсутствии поддерживающих факторов триггерные точки могут самопроизвольно исчезнуть (если мышца сохраняет состояние покоя в течение нескольких дней). Напротив, сохранение воздействия первоначально патогенного фактора способствует формированию вторичных триггеров и увеличению зоны болевого синдрома.
Боль, обусловленная мышечно–тоническим и/или миофасциальным болевым синдромом очень часто являются основной причиной обращения пациента к врачу.
В лечении мышечно–тонической боли центральное место принадлежит местным воздействиям, направленным на расслабление мышцы (массаж, аппликации разогревающих мазей, гелей, влажные компрессы и др.), а в случае миофасциального болевого синдрома – на «разрушение» триггерных точек с помощью постизометрической релаксации, введения сухой иглы или анестетика в триггерную зону. Сроки терапии существенно сокращаются при эффективном обезболивании, общепринятым способом снятия миофасциальной боли является в том числе применение НПВП.
Большую помощь в лечении мышечно–тонических и миофасциальных болевых синдромов могут оказать миорелаксанты за счет уменьшения интенсивности боли, снижения болезненного мышечного напряжения, улучшения двигательной активности. В европейских рекомендациях для лечения острой боли в нижней части спины в качестве эффективных миорелаксантов отмечают тизанидин, дантролен, диазепам, баклофен [26]. Применение миорелаксантов обосновано признанием важной роли мышечного спазма в патогенезе боли в нижней части спины. Боль вследствие поражения межпозвонковых дисков, фасеточных суставов позвоночника, самих мышц и других причин повышает активность двигательных нейронов спинного мозга, что приводит к мышечному спазму, который, в свою очередь, играет значительную роль в поддержании самой боли. Патологичесчки повышенный мышечный тонус имеет различные механизмы усиления боли: непосредственное раздражение болевых рецепторов мышц, ухудшение их кровоснабжения, что приводит к образованию порочного круга, ведущего к усилению мышечного спазма и сопровождающей его боли. Миорелаксанты разрывают порочный круг «боль – мышечный спазм – боль» и вследствие этого способны ускорять процесс выздоровления [6].
При легких болевых синдромах назначение тизанидина (Сирдалуда) можно ограничить приемом препарата на ночь в дозе 2–4 мг до прекращения боли (обычно 5–7 дней). При умеренно выраженном болевом синдроме первый прием лучше также назначить на ночь в дозе 2–4 мг, затем постепенно повысить дозу до 6–8 мг/сут. В тяжелых случаях можно добавить еще 2–4 мг тизанидина (Сирдалуда) на ночь. Диапазон эффективной суточной дозы препарата при болевых синдромах составляет 2–12 мг (оптимальная доза 6–8 мг/сут.). Положительный эффект, как правило, отмечается уже на 3–й день терапии. При хронических болевых синдромах обычно проводят курс длительностью 2–4 недели, регулируя продолжительность лечения и дозу препарата в зависимости от эффективности/переносимости.
Следует отметить, что при слабой или умеренной боли, связанной с мышечным спазмом (например, острая боль в шее или пояснице), может быть достаточно назначить тизанидин (Сирдалуд) в виде монотерапии, эффективность которой была подтверждена во многих исследованиях, в т.ч. и в многоцентровом с участием 2251 пациента с острой болью, вызванной мышечным спазмом в пояснице, шее или плече. 88% пациентов оценили результат лечения как «хороший» или «очень хороший». В исследовании была отмечена также очень хорошая переносимость препарата (90% пациентов отметили переносимость как «хорошую» или «очень хорошую»). Эти результаты позволили авторам рекомендовать тизанидин как препарат выбора среди миорелаксантов для лечения боли, связанной с мышечным спазмом [17].
Однако при более выраженной боли для усиления терапевтического эффекта, либо при лежащих в ее основе воспалительных изменениях, целесообразно совместное применение тизанидина и НПВП. Проведенные исследования показывают, что применение тизанидина потенцирует эффект НПВП [10,23]. Кроме того, прием тизанидина (Сирдалуда) оказывает гастропротективный эффект, который связывают с его адренергической активностью и спазмолитическим действием. Тизанидин (Сирдалуд) уменьшает базальную и индуцированную секрецию кислоты в желудке, устраняет дисбаланс гликопротеидов в слизистой оболочке желудка и в желудочном секрете [12,23].
В экспериментальных исследованиях при применении тизанидина продемонстрировано значительное снижение ульцерогенного эффекта ацетилсалициловой кислоты, индометацина, мелоксикама, нимесулида и напроксена. Гастропротективная активность тизанидина была доказана и в клинических исследованиях. У пациентов, получавших комбинацию ибупрофена и тизанидина, частота желудочно–кишечных побочных эффектов, включая кровотечения, была достоверно (p=0,002) ниже, чем у пациентов, получавших комбинацию ибупрофена и плацебо [10]. Аналогичные результаты были получены и при сравнении комбинации диклофенака и тизанидина с комбинацией диклофенака и плацебо в многоцентровом (12 центров) проспективном двойном слепом плацебо–контролируемом рандомизированном клиническом исследовании, проведенном в 6 странах Азиатско–Тихоокеанского региона и включавшем 405 участников [23]. Гастропатия зарегистрирована у 12% пациентов, получавших комбинацию диклофенака и тизанидина, против 32% пациентов, получавших диклофенак в сочетании с плацебо (p Тизанидин (Сирдалуд) в лечении головной боли
При некоторых цефалгиях существенный вклад в формирование и поддержание головной боли вносит напряжение перикраниальных мышц. Проведенные ис-следования продемонстрировали эффективность тизанидина (Сирдалуда) в лечении головной боли напряжения и других цефалгий.
Двойное слепое плацебо–контролируемое исследование, проведенное R. Fogelhom et al., K. Murros (1992), показало, что лечение тизанидином (Сирдалу-дом) в дозе 6–18 мг/сут. на протяжении 6 недель достоверно снижало интенсивность хронической головной боли напряжения [14]. Меньшие дозы Сирдалуда (3 мг/сут., разделенные на 3 приема), по данным японских исследователей, также дают хороший эффект: значительное уменьшение интенсивности, частоты и продолжительности хронической головной боли напряжения в ходе 4–недельного курса лечения отмечено у 2/3 больных [22]. В работе Филатовой Е.Г. и др. (1997) было показано уменьшение головной боли в 75% случаев у пациентов с головной болью напряжения при применении тизанидина в суточной дозе 4–6 мг в течении 14 дней [8].
Назначение тизанидина (Сирдалуда) включено в рекомендации по лечению головной боли, выпущенные Осиповой В.В. под эгидой Российского общества по изучению головной боли (2009), для головной боли напряжения у пациентов с выраженным напряжением перикраниальных мышц. Лечение рекомендуется начинать с малых доз: 2 мг/сут. (на ночь) в течение первых 3 дней, затем постепенно повысить дозу до 2 мг 2 раза в сут. (утром и на ночь). При недостаточном эффекте доза может быть повышена до 6–8 мг/сут. (по 2 мг 3 раза/сут. или по 2 мг утром и днем и 4 мг на ночь). Продолжительность лечения может составлять от 2 недель до 2 мес. [4].
Таким образом, суммирование имеющихся исследований показывает эффективность тизанидина (Сирдалуда) в большинстве случаев хронических головных болей, в первую очередь при головной боли напряжения, сочетающейся с напряжением перикраниальных мышц.
Применение тизанидина (Сирдалуда)
для снижения спастичности
Нарушения мышечного тонуса, связанные с ними болевые синдромы, ограничения двигательных функций, вторичные изменения суставов и мышц составляют часть клинических проявлений многих заболеваний нервной системы. Как правило, клиническое значение приобретает проблема повышения мышечного тонуса – «гипертонус», или «спастика» [9]. Однако причины и механизмы, лежащие в основе «гипертонуса», могут быть разными, в связи с чем для лечения «спастики» требуются дифференцированные подходы к лечению.
Применение тизанидина (Сирдалуда) получило наиболее широкое распространение в лечении спастичности при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте. При спастичности, связанной с дистоническими нарушениями, паркинсонизмом, более целесообразно использование других средств (например, клоназепама, диазепама).
Спастичность приводит к существенным функциональным расстройствам и снижению качества жизни больного. Однако следует помнить, что сама по себе спастичность не всегда требует лечения. Например, у ряда пациентов с выраженным парезами наличие спастичности в мышцах, анатомически препятствующих силе тяжести (антигравитационные мышцы), может облегчить стояние и ходьбу. Кроме того, наличие повышенного мышечного тонуса может препятствовать развитию мышечных атрофий, отека мягких тканей и остеопороза, а также уменьшить риск развития тромбоза нижних конечностей. Показаниями для лечения спастичности являются лишь те случаи, когда вследствие повышенного тонуса нарушается «функционирование, позиционирование или комфорт» пациента.
Тизанидин (Сирдалуд) в лечении постинсультной спастичности. При инсульте основными задачами лечения являются не только уменьшение выраженности спастичности, но также улучшение функциональных возможностей паретичных конечностей, уменьшение боли и дискомфорта, связанного с высоким мышечным тонусом, облегчением ухода за парализованным пациентом.
Наиболее эффективными средствами в борьбе со спастичностью являются лечебная физкультура и физиотерапия, особенно на раннем этапе. В тех случаях, когда у пациентов с постинсультным парезом конечности имеется локальная спастичность, можно использовать локальное введение препаратов ботулини-ческого токсина. Существенный вклад в лечение спастичности может дать применение антиспастических средств (миорелаксантов) для приема внутрь. Применение миорелаксантов позволяет уменьшить мышечный тонус, улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры и таким образом предупредить развитие контрактур. В России для лечения постинсультной спастичности применяют тизанидин, баклофен, толперизон, диазепам.
Анализ 20 исследований, посвященных сравнению использования различных антиспастических средств при разнообразных неврологических заболеваниях, сопровождающихся спастичностью, показал, что тизанидин, баклофен и диазепам примерно в одинаковой степени способны уменьшить спастичность, но тизанидин (Сирдалуд) эффективнее других антиспастических средств в отношении снижения клонусов [18]. В отличие от баклофена тизанидин (Сирдалуд) не вызывает снижения мышечной силы при уменьшении спастичности (что очень важно для улучшения функциональных возможностей конечности), он лучше переносится пациентами, чем баклофен и диазепам (при его использовании пациенты реже прекращают лечение из–за побочных эффектов) [18,27]. Среди побочных эффектов, выявленных во время исследования по изучению тизанидина у пациентов с постинсультной спастичностью, проведенных Gelber (2001), чаще всего встречались сонливость, слабость, головокружение, сухость во рту, ортостатическая гипотензия. Эти явления проходили при отмене или уменьшении дозы лекарственного средства. Вместе с тем при лечении тизанидином не отмечено ни одного серьезного побочного эффекта [Gelber, 2001], что позволило авторам сделать вывод о высокой безопасности тизанидина.
Авторы, проводившие исследования по изучению клинических эффектов тизанидина (Сирдалуда), и многие клиницисты сходятся во мнении, что среди миорелаксантов тизанидин (Сирдалуд) представляет средство первого выбора при лечении постинсультной спастичности [7,16,18,27].
Для лечения спастичности, обусловленной неврологическими заболеваниями, обычно используются более высокие дозы тизанидина (Сирдалуда), чем при лечении болевых синдромов. Обычно оптимальный терапевтический эффект достигается при суточной дозе от 12 до 24 мг. (Диапазон эффективных доз составляет 2–36 мг). Тем не менее, учитывая дозозависимое повышение риска появления побочных эффектов при увеличении дозы препарата, начинать лечение следует с маленьких доз (2–6 мг/сут.), затем постепенно повышать дозу до достижения терапевтического эффекта, наблюдая за индивидуальной переносимостью (обычно на 2–4 мг каждые 3–7 дней, разделив суточную дозу на 3 приема). При возникновении побочных явлений можно временно приостановить повышение дозы (если не повышать дозу, во многих случаях через несколько дней побочные явления проходят) и продолжить увеличение дозы, после того как пациент «привыкнет» к препарату. Это позволяет, во–первых, подобрать максимально эффективную минимальную дозу препарата для конкретного пациента (у некоторых пациентов (вследствие индивидуальной вариабельности) достаточный терапевтический эффект может возникнуть при приеме меньших доз, чем в рекомендуемых стандартах), а также избавить от лишних страданий больных с индивидуальной плохой переносимостью тизанидина (у больных с плохой переносимостью тизанидина побочные эффекты появляются уже при применении дозы 2–4 мг/сут.). Титрование дозы обычно занимает 2–4 недели. Продолжительность лечения устанавливается индивидуально (от нескольких недель до нескольких месяцев) [9].
При длительном применении удобна лекарственная форма тизанидина в виде капсул с модифицированным освобождением (Сирдалуд МР), которая выпускается в дозе 6 мг. Клинический опыт показывает, что для большинства пациентов оптимальная доза составляет 12 мг/сут. (2 капсулы), в редких случаях может потребоваться увеличение суточной дозы до 24 мг. Лечение при этом также начинают с минимальной дозы – 6 мг (1 капсула), при необходимости постепенно увеличивая дозу на 6 мг (1 капсула) с интервалами 3–7 дней.
Тизанидин (Сирдалуд) в лечении спастичности, связанной с черепно–мозговой травмой
Среди миорелаксантов тизанидин (Сирдалуд) наиболее часто используется для лечения спастичности, связанной с черепно–мозговой травмой [5]. Основания для назначения, тактика подбора дозы и предостережения такие же, как и при лечении постинстультной спастичности.
Тизанидин (Сирдалуд) в лечении спастичности при рассеянном склерозе и спинальной травме. Ограничение подвижности больных рассеянным склерозом связано со значительным повышением мышечного тонуса по спастическому типу, преимущественно в нижних конечностях. Основой лечения подобных нарушений являются специальные упражнения, которые должны выполняться под контролем специалиста по лечебной физкультуре. Лекарственная терапия играет роль дополнительной: применяются толперизон, баклофен, тизанидин, диазепам. Медикаментозное лечение спастического тонуса должно подбираться индивидуально, контролироваться врачом и самим больным. Это связано с тем, что большинство препаратов, снижающих тонус, увеличивают слабость парализованных конечностей и могут приводить к ухудшению состояния пациента. В связи с этим дозу антиспастического препарата необходимо постепенно увеличивать с минимальной до оптимальной, когда уменьшается спастичность, но нет нарастания слабости. Сирдалуд в этом отношении более предпочтителен, чем баклофен и диазепам (при применении тизанидина (Сирдалуда) реже развивается мышечная слабость; из–за избыточного расслабления сфинктеров мочевого пузыря при применении баклофена пациенты чаще жалуются на учащение тазовых нарушений; применение диазепама связано с большей частотой развития побочных эффектов, лекар-ственной зависимости) [3,24]. Сирдалуд более эффективен по сравнению с другими миорелаксанами в отношении клонусов [18].
Оптимальная суточная доза Сирдалуда при лечении спастичности при рассеянном склерозе – 6–8 мг (максимальная суточная доза – 36 мг). Лечение также необходимо начинать с минимальной дозы, шаг увеличения дозы – 2 мг [3].
У больных со спастичностью вследствие спинальной травмы наиболее часто используют тизанидин (Сирдалуд) и баклофен, а для снятия болезненных мышечных спазмов – и диазепам. Лечение начинают с минимальной дозы (4–6 мг Сирдалуда), которую постепенно (на протяжении нескольких дней или недель) доводят до терапевтической, стараясь избежать нежелательных побочных эффектов (мышечной слабости и седативного эффекта). Баклофен эффективен преимущественно при интратекальном введении, при пероральном приеме тизанидин (Сирдалуд) дает более выраженный положительный эффект и лучше переносится больными, чем баклофен [25].
При других видах спастичности, встречающихся в неврологической практике (при паркинсонизме, торсионной дистонии, кривошеи, БАС), применение тизанидина (Сирдалуда) неоправданно: более целесообразно использование клоназепама, диазепама – у этих препаратов больше вероятность побочных эффектов, но и антиспатический эффект у них более выражен при этих нарушениях.
Рекомендации по практическому использованию тизанидина (Сирдалуда)
Достаточно широкий диапазон эффективно действующих доз тизанидина (Сирдалуд) (от 2 до 36 мг/сут.) позволяет использовать препарат для коротких и длительных курсов лечения болевых синдромов и спастичности в виде монотерапии или в сочетании с другими лекарственными средствами. Для улучшения клинической эффективности могут быть полезны следующие рекомендации по практическому использованию тизанидина (Сирдалуда).
1. Начинайте лечение с маленьких доз препарата и контролируйте развитие побочных явлений
Развитие побочных эффектов при применении тизанидина (Сирдалуда) является дозозависимым (например, вероятность развития побочных эффектов при применении дозы 12–24 мг в 2 раза выше, чем при применении дозы 6–12 мг). В то же время достаточного терапевтического эффекта иногда удается добиться и при меньших дозах, чем рекомендуется в стандартах лечения. В связи с этим лечение рекомендуется начинать с минимальной дозы (2–4 мг), затем постепенно ее повышать наблюдая за индивидуальной переносимостью.
2. Проводите постепенную отмену препарата
После длительного применения тизанидина (Сирдалуда), особенно в больших дозах необходимо проводить постепенную отмену препарата, так как резкая отмена препарата может вызвать развитие мышечной слабости (это характерно и для других миорелаксантов).
3. Используйте седативный эффект тизанидина (Сирдалуда) в терапевтических целях
Побочные эффекты препаратов не всегда являются нежелательными и могут быть использованы в терапевтических целях. Среди побочных эффектов тизанидина (Сирдалуда) отмечается повышенная сонливость. Поэтому пациентам, у которых отмечается сонливость при приеме тизанидина (Сирдалуда), следует избегать всех видов деятельности, требующих повышенной концентрации внимания и быстроты реакции. В то же время у многих пациентов, особенно с хроническими болевыми синдромами, нарушен сон. Указанный побочный эффект тизанидина (Сирдалуда) можно использовать в терапевтических целях, назначив препарат «на ночь» для улучшения сна пациента. Учитывая то, что эффект тизанидина (Сирдалуда) является кратковременным, некоторые врачи для сохранения социальной активности пациента назначают препарат только «на ночь» либо распределяют основную суточную дозу препарата на вторую половину дня и «на ночь». Это позволяет пациенту сохранять социальную активность в первой половине дня (работать, водить автомобиль), а вечером помогает заснуть.
4. Добивайтесь получения максимального терапевтического эффекта при комбинировании тизанидина (Сирдалуда) с другими препаратами
а. Тизанидин (Сирдалуд) и НПВП. Тизанидин (Сирдалуд) является наиболее предпочтительным среди миорелаксантов для комбинированной терапии с НПВП. Комбинированное применение тизанидина (Сирдалуда) и НПВП:
1) усиливает эффективность лечения;
2) позволяет уменьшить необходимую дозу НПВП;
3) оказывает гастропротективный эффект.
б. тизанидин (Сирдалуд) и антигипертензивные препараты. Одним из побочных эффектов при применении тизанидина (Сирдалуда) является умеренное снижение АД. Одновременное применение вместе с антигипертензивными средствами может усилить антигипертензивный эффект. При необходимости длительного применения тизанидина (Сирдалуда) (например, при лечении постинсультной спастичности) гипотензивный эффект Сирдалуда можно использовать для уменьшения дозы либо прекращения назначенной ранее антигипертензивной терапии.
в. комбинированное применение тизанидина (Сирдалуда) и других миорелаксантов. Обычно не практикуют одновременное применение различных миорелаксантов у одного пациента. Некоторые специалисты предлагают комбинированное назначение различных миорелаксантов для повышения эффективности и уменьшения развития побочных эффектов (при совместном применении назначаются меньшие дозы препарата), что теоретически, может быть оправданно, учитывая различные точки приложения у разных миорелаксантов.
г. тизанидин (Сирдалуд) и антидепрессанты. Тизанидин может потенцировать действие трициклических антидепрессантов (амитриптилин).
Одновременное применение тизанидина с флувоксамином противопоказано, так как может привести к тяжелому и продолжительному снижению артериального давления и сильно потенцирует эффекты на ЦНС.
5. При выборе миорелаксанта для лечения спастичности учитывайте возможность развития мышечной слабости
Развитие мышечной слабости часто является побочным эффектом, побуждающим пациента прекратить прием миорелаксанта. Сравнительные исследования показывают, что тизанидин (Сирдалуд) является наиболее предпочтительным среди миорелаксантов в отношении риска развития мышечной слабости (при его применении значительно реже наблюдается развитие мышечной слабости, чем при использовании баклофена и диазепама).
Предостережения по безопасности
Обычно, описанные в инструкции по препарату побочные реакции умеренно выражены и преходящи, коррелируют с пиками концентрации препарата в крови, т.е. достигают пика в течение 1 часа после приема. Наиболее частыми побочными эффектами тизанидина являются сухость во рту, сонливость и головокружение. Осторожность следует соблюдать при назначении препарата лицам пожилого возраста и больным с нарушениями функции печени и почек. В последнем случае тизанидин (Сирдалуд) применяют в малых дозах, под контролем лабораторных показателей.
Заключение
Тизанидин (Сирдалуд) относится к a2–адренергическим миорелаксантам центрального действия, который был разработан для лечения спастичности при неврологических заболеваниях. Он является также эффективным препаратом для лечения болевых синдромов, связанных с повышением мышечного тонуса. В настоящее время тизанидин (Сирдалуд) применяется в моно– или комплексной терапии широкого круга болевых синдромов, встречающихся (помимо неврологии) в общеврачебной практике, в ревматологи, травматологии, ортопедии, спортивной медицине (табл. 1).
Литература
1. Бадокин В.В. Применение Сирдалуда в ревматологической практике // Рус. мед. журн. – 2005, том 13, № 24, С. 1588–1589.
2. Воробьева О.В. Возможности альфа2–адренергических агонистов в лечении миофасциальной боли / О. В. Воробьева // Рус. мед. журн. – 2007. – № 5. – C. 445–448.
3. Гусев Е.И., Бойко А.Н. Рассеянный склероз: от новых знаний к новым методам лечения // Русский медицинский журнал. – 2001. – № 1. – С. 4–10.
4. Осипова В.В. Головная боль напряжения: практическое руководство для врачей. – М., 2009.– 44 c.
5. Парфенов В.А. Ведение больных со спастичностью // Рус. мед. журн. – 2004. – Том 12. №10, 2004.
6. Парфенов В.А. Диагноз и лечение при острых болях в нижней части спины // Рус. мед. журн. – 2007. – Т 15. №6.
7. Парфенов В.А. Постинсультная спастичность и ее лечение // Рус. мед. журн. – 2006. – Т. 14. – №9.
8. Филатова Е.Г., Соловьева А.Д., Данилов А.Б. Лечение головной боли напряжения // Журнал неврол. и психиатр. 1996, 4, 21–25.
9. Широков Е.А. Сирдалуд: области клинического применения // Рус. мед. журн. – 2004. – № 14. – C. 874–875.
10. Berry H., Hutchinson D.R. Tizanidine and ibuprofen in acute low–back pain: Results of a double–blind multicentre study in general practice //J. Intern. Med. Res. – 1988. – Vol.16. – Р. 83–91.
11. Bettucci D, Testa L, Calzoni S et al. Combination of tizanidine and amitriptyline in the prophylaxis of chronic tension — type headache: evaluation of efficacy and impact on quality of life // J Headache Pain 2006;7(1):34 – 36.
12. Coward D.M. Tizanidine: Neuropharmacology and mechanism of action. Neurology 1994; 44 (Suppl. 9): 6–11.
13. Delzell JE Jr, Grelle AR. Trigeminal neuralgia. New treatment options for a well–known cause of facial pain. Arch Fam Med 1999 May–Jun; 8 (3): 264–8.
14. Fogelholm R., Murros K. Tizanidine in chronic tension–type headache: a placebo controlled double–blind crosss–over study. Headache 1992; 32: 509–513.
15. Freitag FG. Preventative treatment for migraine and tension–type headaches: do drugs having effects on muscle spasm and tone have a role? CNS Drugs 2003; 17 (6): 373–81.
16.Gelber D. A., Good D. C., Dromerick A. et al. Open–Label Dose–Titration Safety and Efficacy Study of Tizanidine Hydrochloride in the Treatment of Spasticity Associated With Chronic Stroke // Stroke. – 2001. – Vol.32. – P. 1841–1846.
17. Hutchinson DR, Daniels F. A multinational study in general practice to evaluate the effectiveness and tolerability of tizanidine in the treatment of painful muscle spasms. // Br J Clin Res 1990; 1:39–48.
18. Lataste X, Emre M, Davis C, Groves L. Comparative profile of tizanidine in the management of spasticity // Neurology. – 1994. – Vol. 44 (suppl 9). – P. 53–59.
19. Leiphart JW, Dills CV, Levy RM. Alpha2 – adrenergic receptor subtype specificity of intrathecally administered tizanidine used for analgesia for neuropathic pain // J Neurosurg. 2004; 101(24):641–647.
20. Manfredini D, Romagnoli M, Cantini E, Bosco M. Efficacy of tizanidine hydrochloride in the treatment of myofascial face pain. Minerva Med 2004 Apr; 95 (2): 165–71.
21. Saper JR, Lake AE 3rd, Cantrell DT et al. Chronic daily headache prophylaxis with tizanidine: a double–blind, placebo–controlled, multicenter outcome study. Headache 2002 Jun; 42 (6): 470–82.
22. Shimomura T, Awaki E, Kowa H, Takahashi K. Treatment of tension–type headache with tizanidine hydrochloride: its efficacy and relationship to the plasma MHPG concentration. Headache 1991 Oct; 31 (9): 601–4.
23. Sirdalud Ternilin Asia–Pacific Study group. Efficacy and gastroprotective effects of tizanidine plus diclofenac versus placebo plus diclofenac in patients with painful muscle spasm. Curr Ther Res 1998; 59: 13–22.
24. Smolenski C, Muff S, Smolenski–Kautz S. A double–blind comparative trial of new muscle relaxant, tizanidine (DS 103–282), and baclofen in the treatment of chronic spasticity in multiple sclerosis. Curr Med Res Opin. 1981;7(6):374–83.
25. Tarrico M, Adone R, Pagliacci C, Telaro E. Pharmacological interventions for spasticity following spinal cord injury. Cochrane Database Systematic Review. In: The Cochrane Library 2000; Issue 4.
26. van Tulder M., Becker A., Bekkering T. Et al. European guidelines for the management of acute nonspecific low back pain in primary care // Eur Spine J. 2006– Vol. 15. (Suppl. 2): S.169–191.
27. Wallace JD. Summary of combined clinical analysis of controlled clinical trials with tizanidine // Neurology. – 1994. – Vol. 44 (suppl 9). – P. 60–P69.
Ключевые слова статьи: тизанидина, Сирдалуда, применения, практике, Возможности
03 сентября 2009 г, том 17, № 20
РМЖ Неврология. Психиатрия