недоброкачественные документы можно разделить
Недоброкачественные документы можно разделить
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.
Программа разработана совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Постановление Правительства РФ от 12 декабря 2015 г. № 1360 «Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий»
В соответствии с частью 19 статьи 38 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» Правительство Российской Федерации постановляет:
Утвердить прилагаемые Правила уничтожения изъятых фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий.
| Председатель Правительства Российской Федерации | Д. Медведев |
Правила
уничтожения изъятых фальсифицированных медицинских изделий, недоброкачественных медицинских изделий и контрафактных медицинских изделий
(утв. постановлением Правительства РФ от 12 декабря 2015 г. № 1360)
2. Изъятые медицинские изделия, являющиеся вещественными доказательствами по уголовным делам и (или) по делам об административных правонарушениях, подлежат уничтожению в порядке, установленном соответственно Уголовно-процессуальным кодексом Российской Федерации и (или) Кодексом Российской Федерации об административных правонарушениях.
Изъятые медицинские изделия, находящиеся под таможенной процедурой уничтожения, подлежат уничтожению в порядке, установленном законодательством Российской Федерации о таможенном деле.
3. Изъятые медицинские изделия подлежат уничтожению в следующих случаях:
а) на основании решения суда;
б) на основании решения Федеральной службы по надзору в сфере здравоохранения, принятого по результатам государственного контроля за обращением медицинских изделий, в случаях, не предусмотренных пунктом 2 настоящих Правил.
4. Решение Федеральной службы по надзору в сфере здравоохранения об уничтожении изъятых медицинских изделий должно содержать следующие сведения:
а) наименования изъятых медицинских изделий, их серии, количество, информация о таре и (или) упаковке, а также их виды в соответствии с номенклатурной классификацией;
б) дата государственной регистрации изъятых медицинских изделий и их регистрационные номера, срок действия регистрационных удостоверений;
в) реквизиты решения суда или документов о результатах государственного контроля за обращением медицинских изделий (номер, дата);
г) срок уничтожения изъятых медицинских изделий;
д) сведения о владельце изъятых медицинских изделий (полное и сокращенное (в случае, если имеется) наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес его места нахождения либо фамилия, имя и отчество (в случае, если имеется) индивидуального предпринимателя, реквизиты документа, удостоверяющего его личность, адрес места жительства, а также номера телефонов и адрес электронной почты (в случае, если имеется) юридического лица или индивидуального предпринимателя);
е) сведения о производителе (изготовителе) изъятых медицинских изделий (при их наличии) (полное и сокращенное (в случае, если имеется) наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес его места нахождения либо фамилия, имя и отчество (в случае, если имеется) индивидуального предпринимателя, реквизиты документа, удостоверяющего его личность, адрес места жительства, а также номера телефонов и адрес электронной почты (в случае, если имеется) юридического лица или индивидуального предпринимателя).
5. Решение суда или решение Федеральной службы по надзору в сфере здравоохранения об уничтожении изъятых медицинских изделий направляется владельцу изъятых медицинских изделий в срок, не превышающий 5 рабочих дней со дня вступления в законную силу решения суда, или в срок, не превышающий 10 рабочих дней со дня принятия Федеральной службой по надзору в сфере здравоохранения решения об уничтожении изъятых медицинских изделий, заказным почтовым отправлением с уведомлением о вручении или в форме электронного документа, подписанного электронной подписью.
6. Владелец изъятых медицинских изделий в срок, не превышающий 30 рабочих дней со дня получения решения суда или решения Федеральной службы по надзору в сфере здравоохранения об уничтожении изъятых медицинских изделий, обязан исполнить указанные решения.
7. В случае если владелец изъятых медицинских изделий не исполнил решение Федеральной службы по надзору в сфере здравоохранения об уничтожении изъятых медицинских изделий, Федеральная служба по надзору в сфере здравоохранения обращается в суд с требованием о понуждении их владельца к исполнению указанного решения.
8. Уничтожение изъятых медицинских изделий осуществляется с соблюдением требований законодательства в области охраны окружающей среды, законодательства в сфере охраны здоровья, а также законодательства в области обеспечения санитарно-эпидемиологического благополучия населения.
Расходы, связанные с уничтожением изъятых медицинских изделий, возмещаются владельцем изъятых медицинских изделий.
9. Уничтожение изъятых медицинских изделий подтверждается актом уничтожения изъятых медицинских изделий, в котором должны быть указаны:
а) сведения об осуществляющих уничтожение изъятых медицинских изделий организации или индивидуальном предпринимателе (полное и сокращенное наименование (в случае, если имеется), в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес его места нахождения либо фамилия, имя и отчество (в случае, если имеется) индивидуального предпринимателя, реквизиты документа, удостоверяющего его личность, адрес места жительства, а также номера телефонов и адрес электронной почты (в случае, если имеется) юридического лица или индивидуального предпринимателя);
б) основания уничтожения изъятых медицинских изделий (решение суда или решение Федеральной службы по надзору в сфере здравоохранения) с указанием реквизитов документов;
в) наименования изъятых медицинских изделий, их серии, количество, информация о таре и (или) упаковке, а также их виды в соответствии с номенклатурной классификацией;
г) сведения о производителе (изготовителе) изъятых медицинских изделий (при их наличии) (полное и сокращенное наименование (в случае, если имеется), в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес его места нахождения либо фамилия, имя и отчество (в случае, если имеется) индивидуального предпринимателя, реквизиты документа, удостоверяющего его личность, адрес места жительства, а также номера телефонов и адрес электронной почты (в случае, если имеется) юридического лица или индивидуального предпринимателя);
д) сведения о владельце изъятых медицинских изделий (полное и сокращенное (в случае, если имеется) наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес его места нахождения либо фамилия, имя и отчество (в случае, если имеется) индивидуального предпринимателя, реквизиты документа, удостоверяющего его личность, адрес места жительства, а также номера телефонов и адрес электронной почты (в случае, если имеется) юридического лица или индивидуального предпринимателя) или его уполномоченном представителе (с указанием места его работы и должности);
е) дата, место и способ уничтожения изъятых медицинских изделий.
Обзор документа
Урегулированы вопросы уничтожения изъятых фальсифицированных, недоброкачественных и контрафактных медизделий.
Процедура проводится по 2 основаниям: решение суда; решение Росздравнадзора, принятого по результатам госконтроля за обращением медизделий. Исключение составляют ниже упомянутые случаи.
Решение суда (Росздравнадзора) владелец изъятых медизделий должен исполнить его в срок, не превышающий 30 рабочих дней с момента получения.
Уничтожение изделий подтверждается специальным актом.
Текущее хранение документов: порядок формирования дел
При работе с документами, вышедшими из оперативной работы, в первую очередь встает вопрос правильной их систематизации. Правильная классификация документов для размещения их в делах позволит в дальнейшем существенно сократить время на их поиск. Рассказываем, как «1С:Документооборот» помогает при организации текущего хранения документов.
Правила и сроки хранения документов
Правила хранения документов закреплены на государственном уровне в Правилах организации хранения, комплектования, учета и использования документов Архивного фонда Российской Федерации и других архивных документов в органах государственной власти, органах местного самоуправления и организациях, утвержденных приказом Министерства культуры Российской Федерации от 31 марта 2015 г. № 526.
По срокам хранения документы можно разделить на 3 группы:
Сроки хранения документов следует смотреть в типовых перечнях. Основным, использующимся в любой организации, является Перечень типовых управленческих документов, образующихся в деятельности государственных организаций, органов местного самоуправления и организациях, с указанием сроков их хранения, утвержденный приказом Минкультуры России от 25.08.2010 № 558.
Для того чтобы организовать хранение большого объема документов, в организациях создается архив – самостоятельное структурное подразделение, обеспечивающее сохранность документов длительных сроков хранения. При этом дела, имеющие срок хранения свыше 10 лет, передаются в архив не раньше, чем через год, и не позже, чем через 3 года после их завершения. Документы временного срока хранения до 10 лет в архив не передаются и хранятся в структурных подразделениях, в которых они были созданы.
Если организация не имеет возможности хранить документы по месту своего расположения, то она может заключить договор на депозитарное хранение с профильными организациями, которые будут самостоятельно следить за сохранностью документов и вовремя их уничтожать.
Сформированные и законченные дела до передачи их в архив организации хранятся в структурных подразделениях, которые должны обеспечить сохранность документов, защиту от негативного воздействия света и пыли.
Порядок формирования дел
Формированием дел называется группировка исполненных документов в дела в соответствии с номенклатурой дел и их систематизация внутри дела.
Если организация небольшая, то эту работу выполняет секретарь. Если в организации есть структурные подразделения, то дела формируют их сотрудники самостоятельно.
Существуют правила формирования дел, которых следует придерживаться:
В дело включается лишь один экземпляр каждого документа. Черновые экземпляры и копии уничтожаются.
Одно дело должно быть объемом не более 250 листов при толщине не более 4 см. Такие размеры дел позволяют легко брать, носить дела и пользоваться ими впоследствии.
Формирование дел с помощью 1С:Документооборота
Формирование дел легко обеспечивается средствами «1С:Документооборота» с помощью справочника «Дела (тома)» в строгом соответствии с утвержденной в организации номенклатурой дел. В карточку дела автоматически переносится информация из номенклатуры дел организации.
Электронная карточка дела содержит следующие сведения:
Дата начала дела заполняется автоматически датой первого документа, отнесенного к делу.
Поле «Место хранения» содержит информацию о территории и кабинете, в котором хранится бумажный экземпляр дела.
После исполнения документов и окончания работы с ними бумажные документы, подлежащие архивному хранению, помещаются в твердые обложки или папки-регистраторы для обеспечения их физической сохранности, а электронные документы и карточки документов списываются в дела непосредственно в «1С:Документообороте».
Документы внутри бумажного дела обычно располагаются в хронологической последовательности и по тематическому или корреспондентскому признаку. Например, переписка группируется за календарный год по хронологии решения вопроса: документ-ответ помещается за документом-запросом.
Также документы могут размещаться по хронологии и по видам. Так, распорядительные документы группируются с относящимися к ним приложениями. Локальные нормативные акты подшиваются в дела вместе с приказами, которыми они вводятся в действие. Приказы по основной деятельности группируются отдельно от приказов по личному составу. Протоколы формируются в дела по видам заседаний, совещаний, собраний (по каждому виду отдельно) и по хронологии.
Организационные документы и локальные нормативные акты, утвержденные распорядительными документами, подшиваются в дела вместе с ними. При их утверждении в качестве самостоятельных документов они группируются в самостоятельные дела.
Документы в личных делах располагаются в хронологическом порядке по мере их поступления.

Обложка дела формируется автоматически из карточки дела в «1С:Документообороте» по унифицированной форме.
Дела располагаются на полках вертикально. На корешке каждого дела указывается его индекс по номенклатуре.
В конце каждого года в «1С:Документообороте» дела закрываются, если они не являются переходящими, и программа запрещает списание в них документов.
Если одному из сотрудников организации понадобился документ из уже сформированного дела, то на место документа, выдаваемого сотруднику, помещается лист-заместитель. В листе-заместителе указывают номер и дату документа, его краткое содержание, когда и кому он выдан. «1С:Документооборот» формирует лист-заместитель по унифицированной форме.
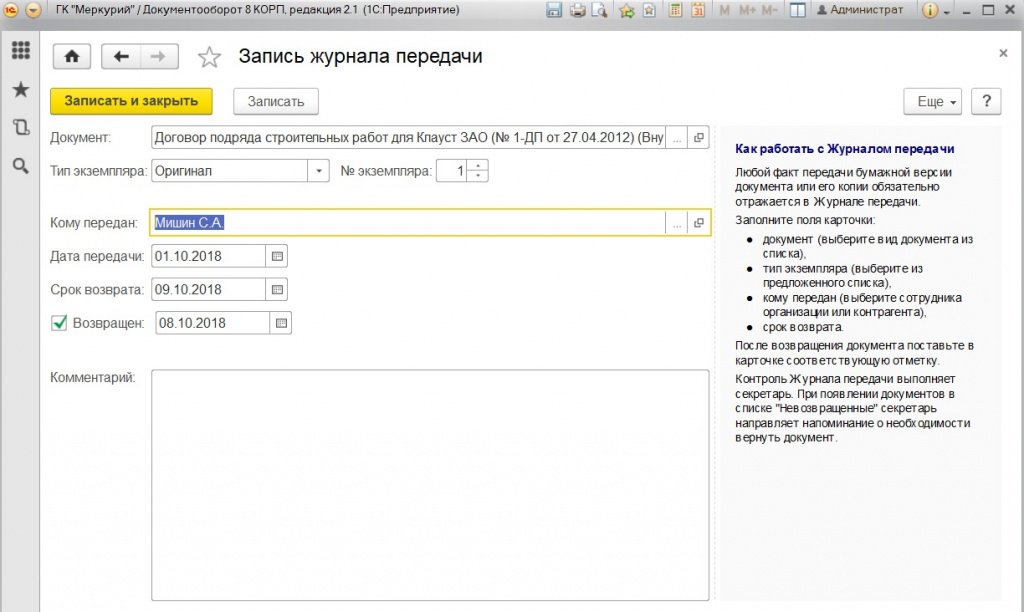
Выдача дел другим подразделениям производится с разрешения руководителя подразделения, в котором находится на текущем хранении документ. В «Журнале передачи» (рис. 1) в «1С:Документоообороте» указывается факт передачи конкретных документов, находящихся в деле. Это позволяет отслеживать возврат документов и дел в дальнейшем.
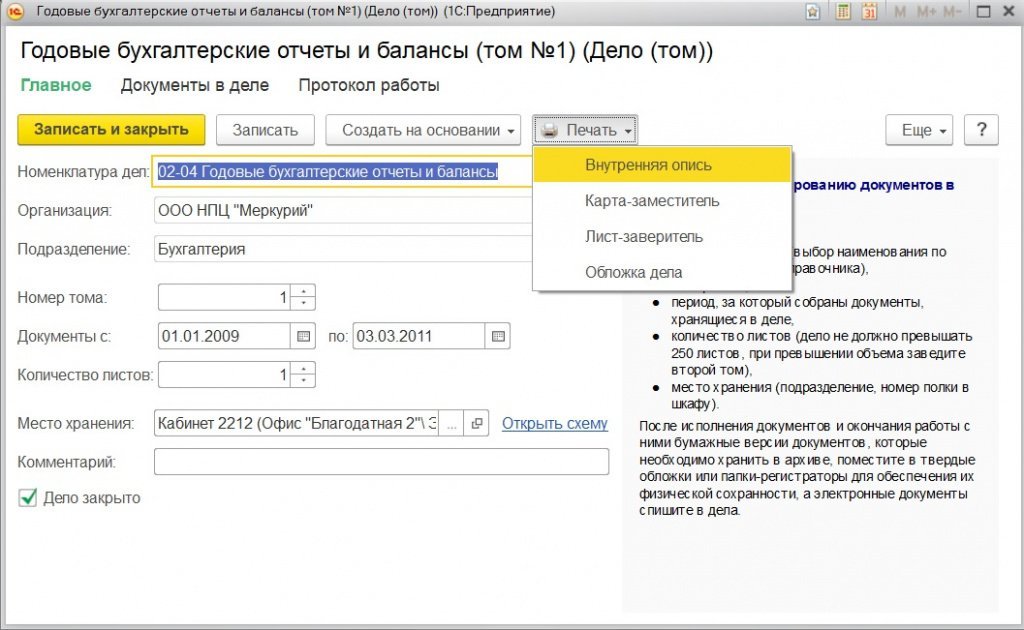
На выданное дело заводится карта-заместитель, помещаемая на место выданного дела. Карта-заместитель также формируется автоматически из карточки дела (рис. 2).
Дела выдаются во временное пользование сотрудникам структурных подразделений не более чем на один месяц и после его истечения подлежат возврату.
Изъятие документов из дел постоянного хранения возможно только в исключительных случаях с разрешения руководителя организации с оставлением в деле заверенной копии документа и акта о причинах выдачи подлинника.
Для обеспечения сохранности и учета документов и дел, доступа к ним следует проводить комплекс работ:
Дела, находящиеся на текущем хранении, следует систематически проверять на наличие и состояние документов в них. Такая проверка обеспечит установление фактического наличия дел и соответствие их количеству, числящемуся по номенклатуре дел.
Проверка наличия и состояния документов и дел также проводится при перемещении дел, при возврате дел, при смене руководителя структурного подразделения, начальника службы делопроизводства, при реорганизации и ликвидации организации или структурного подразделения.
Проверка наличия проводится путем сверки статей номенклатуры дел и карточек дел (томов) в «1С:Документообороте» с описанием дел на обложке. Физическое состояние дел определяется путем полистного просмотра. Все обнаруженные недостатки фиксируются в акте проверки наличия и состояния дел.
В случае утраты документов и дел проводится служебное расследование, по результатам которого лицо, виновное в утрате, несет ответственность в порядке, установленном законодательными, нормативно-правовыми и локальными нормативными актами.
Изменение в фармацевтическом законодательстве в 2021 году
Вместе с наступлением 2021 года произошли значительные изменения в нормативно-правовых актах, регулирующих работу аптеки. Требования некоторых из них фармработники знали почти наизусть, т.к. работали по ним уже десять или более лет. Конечно, все новое часто пугает, а когда еще и в таком количестве, то бывает очень сложно сориентироваться. Именно для того, чтобы не потеряться и не упустить основные изменения был подготовлен этот обзор.
Уничтожение ЛС
Утратили силу 31.12.2020:
1.Постановление Правительства Российской Федерации от 3 сентября 2010 г. N 674 «Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственны х средств и контрафактных лекарственных средств»
2.Постановление Правительства Российской Федерации от 16 января 2016 г. N 8 «О внесении изменений в Правила уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств”
Комментарий: Согласно Постановлению при вынесении уполномоченным органом решения об изъятии и уничтожении фальсифицированных ЛС и (или) недоброкачественных ЛС владелец таких ЛС обязан:
✔изъять эти ЛС из обращения, изолировать и разместить их в специально выделенном помещении (зоне) либо сообщить о несогласии с указанным решением уполномоченному органу в течение 30 дней со дня вынесения решения;
✔уничтожить изъятые лекарственные средства в течение 6 месяцев со дня вынесения решения.
Владелец недоброкачественных ЛС или организация, осуществляющая уничтожение, составляют акт об уничтожении, в котором указываются:
-дата и место уничтожения ЛС;
-ФИО лиц, принимавших участие в уничтожении, место работы и должность;
-обоснование уничтожения ЛС;
-сведения об уничтоженных средствах (наименование, лекарственная форма, дозировка, единицы измерения, серия) и их количестве, а также о таре или упаковке;
-наименование производителя ЛС;
-сведения о владельце ЛС;
-способ уничтожения ЛС.
Акт об уничтожении составляется в день уничтожения ЛС. Количество экземпляров акта определяется по числу сторон, принимавших участие в уничтожении ЛС. Акт подписывают все лица, принимавшие участие в уничтожении ЛС, и заверяется печатью организации, осуществившей уничтожение. Копия акта об уничтожении ЛС, заверенная в установленном порядке, представляется в течение 5 рабочих дней со дня его составления или в течение 5 рабочих дней со дня его получения владельцем уничтоженных лекарственных средств в уполномоченный орган с использованием электронных средств связи.
Виды аптечных организаций
Утратил силу 31.12.2020: Приказ Министерства здравоохранения и социального развития Российской Федерации от 27 июля 2010 г. N 553н «Об утверждении видов аптечных организаций».
Вступил в силу: Приказ Министерства здравоохранения РФ от 31 июля 2020 г. № 780н « Об утверждении видов аптечных организаций ».
Комментарий: Утверждены четыре вида аптечных организаций:
1.Аптеки, осуществляющие розничную торговлю (отпуск) лекарственных препаратов населению. Непроизводственные и производственные с правом изготовления
2️.Аптеки в структуре медицинских организаций. Непроизводственные и производственные с правом изготовления
3️.Аптечные пункты, в том числе в структуре медицинской организации.
Тара, упаковка и комплектность ЛП
Утратил силу 31.12.2020: Приказ Министерства здравоохранения Российской Федерации от 21 декабря 2016 г. N 979н «Об утверждении требований к объему тары, упаковке и комплектности лекарственных препаратов для медицинского применения».
Комментарий: Производство ЛП, предназначенных для внутреннего применения, а также их продажа и передача производители ЛС осуществляют в таре, содержащей объем лекарственного препарата:
-не более 25 мл при объемной доле спирта свыше 50% и курсовой дозе ЛП не более 75 мл включительно;
-не более 50 мл при объемной доле спирта от 30% до 50% и курсовой дозе ЛП не более 100 мл включительно;
-не более 100 мл при объемной доле спирта до 30% и курсовой дозе ЛП не более 200 мл включительно.
На первичной и вторичной (при наличии) упаковке указывается концентрация спирта, входящего в состав лекарственного препарата. Производители при продаже и передаче ЛП комплектуют в соответствии с инструкцией по медицинскому применению лекарственного препарата.
Утратил силу 31.12.2020: Приказ Министерства здравоохранения Российской Федерации от 8 февраля 2017 г. N 47н «Об утверждении перечня лекарственных препаратов для медицинского применения, в отношении которых устанавливаются требования к объему тары, упаковке и комплектности».
Комментарий: Утверждён перечень спиртосодержащих настоек, капель, экстрактов и эликсиров, в отношении которых устанавливаются требования Приказа 779н.
Санитарный режим в аптеках
Утратил силу 31.12.2020: Приказ Министерства здравоохранения Российской Федерации от 21 октября 1997 г. N 309 «Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)».
Комментарий: Пятый раздел данного постановления посвящен аптечным организациям и называется “Санитарно-эпидемиологические требования при предоставлении услуг аптечными организациями”
Качество ЛС
Утратили силу 31.12.2020:
4. Приказ Министерства здравоохранения Российской Федерации от 20 июля 2001 г. N 284 «Об утверждении норм естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности».
Комментарий: Когда Приказ 751н был опубликован, он не отменил действия приказов 214, 305, 308 и 284, что приводило к дублированию и разночтениям. Теперь данный недочет устранен.
Приказ 751н содержит не только правила изготовления разных видов лекарственных форм и виды контроля, а также всю необходимую информацию, используемую при изготовлении лекарственных препаратов в производственных аптеках.
Возврат товаров
Утратило силу 31.12.2020: Постановление Правительства РФ от 19 января 1998 г. N 55 «Об утверждении Правил продажи отдельных видов товаров, перечня товаров длительного пользования, на которые не распространяется требование покупателя о безвозмездном предоставлении ему на период ремонта или замены аналогичного товара, и перечня непродовольственных товаров надлежащего качества, не подлежащих возврату или обмену на аналогичный товар других размера, формы, габарита, фасона, расцветки или комплектации»
Вступило в силу 01.01.2021: Постановление Правительства РФ от 31 декабря 2020 г. N 2463 “Об утверждении Правил продажи товаров по договору розничной купли-продажи, перечня товаров длительного пользования, на которые не распространяется требование потребителя о безвозмездном предоставлении ему товара, обладающего этими же основными потребительскими свойствами, на период ремонта или замены такого товара, и перечня непродовольственных товаров надлежащего качества, не подлежащих обмену, а также о внесении изменений в некоторые акты Правительства Российской Федерации ”
Комментарий: Постановление № 2463 утверждает Перечень
непродовольственных товаров надлежащего качества, не подлежащих обмену, в том числе:
Вступившие в силу изменения в некоторых случаях облегчают жизнь аптек, например, постановление N 1447, где утверждены более длительные сроки уничтожения некачественных ЛС. Другие постановления не содержат в себе глобальных изменений и не создают дополнительных нагрузок для работников аптек.
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Методы контроля. Признаки недоброкачественного документа. Приемы проверки системы бухгалтерский записей
Страницы работы
Содержание работы
1.1. Признаки недоброкачественного документа. Для определения недоброкачественного документа применяются следующие критерии: 1. формальный – любой доброкачественный документ должен быть составлен по определенной форме с заполнением всех реквизитов. 2. критерий законности означает, что хозяйственная операция, отраженная в документе должна быть законна по своему содержанию и санкционирована в установленном порядке должностными лицами. 3. критерий действительности, т.е. документ должен содержать содержание той хозяйственной операции, для которой он был создан в неискаженном виде относительно объема, даты и сторон, участвующих в операции.
Документы, недоброкачественные по существу. Они содержат случайные ошибки, незаконченные операции или признаки материального подлога, т.е. подделки определенной части информации, а также признаки интеллектуального подлога – документы, содержащие заведомо ложную информацию.
Документы, недоброкачест-венные по форме. Они отражают реальные хозяйственные операции в искаженном виде и объеме.
Методические приемы документального контроля:
приемы проверки отдельного документа
приемы проверки нескольких документов по однотипным и взаимосвязанным хозяйственным операциям
приемы проверки системы бухгалтерских записей
1.2. Приемы проверки отдельного документа. При проверке отдельного документа из числа документов, недоброкачественных по форме выделяют: а) документы, при составлении которых были использованы бланки неустановленной формы или нарушался порядок их составления; б) документы, при составлении которых остались незаполненными все необходимые реквизиты; в) документы, при составлении которых были использованы лишние, не предусмотренные типовыми формами реквизиты.
Выделенные документы проверяются с использованием следующих приемов: 1. Формальная проверка – проверка правильности осуществленных исправлений в документе, а также наличия и подлинности реквизитов, предусмотренных для данного типа документов. 2. Арифметическая проверка – заключается в пересчете общих итогов и в взаимоувязке начислений и удержаний. 3. Нормативно-правовая проверка – проверка хозяйственных операции с точки зрения ее соответствия различным нормативным актам. 4. Проверка хозяйственных операций или фактов экономической деятельности на действительность.
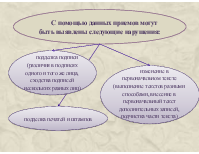
С помощью данных приемов могут быть выявлены следующие нарушения:
подделка подписи (различия в подписях одного и того же лица, сходства подписей нескольких разных лиц)
изменение в первоначальном тексте (выполнение текстов разными способами, внесение в первоначальный текст дополнительных записей, подчистка части текста)
подделка печатей и штампов
Взаимная сверка может проводиться по следующим данным: 1. данные о поступлении ТМЦ сравниваются с данными документов о расходах на их доставку; 2. данные о вывозе ТМЦ сравниваются с данными по таре, в которой осуществлялась их перевозка; 3. данные о начислении з/пл. и страховых взносов сравниваются с объемом фактически оприходованных готовых изделий; 4. данные о списании ОС сравниваются с информацией о затратах на их ликвидацию; 5. данные о списании МЦ на порчу, бой или лом сравниваются с документами, оформляющими операции по оприходованию МЦ от ликвидации.
1.4. Приемы проверки системы бухгалтерских записей
Выделяют следующие приемы проверки:
Восстановление количественно-суммового учета
Хронологическая проверка движения МЦ и ДС
(1).jpg)