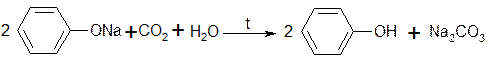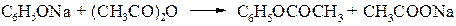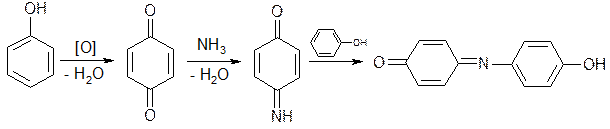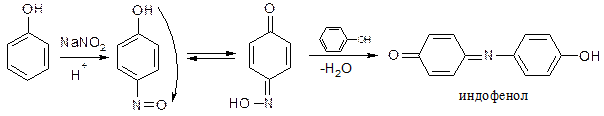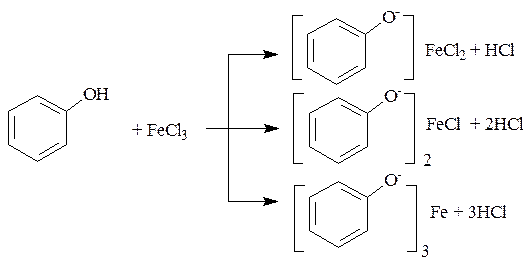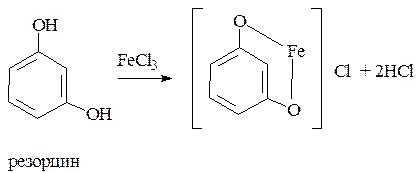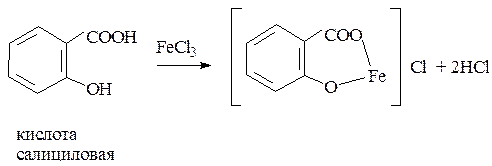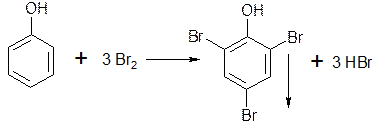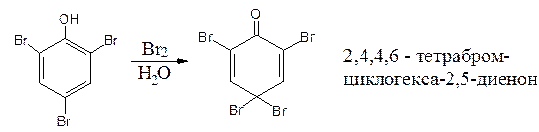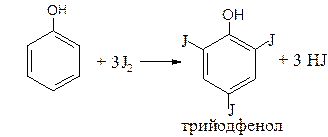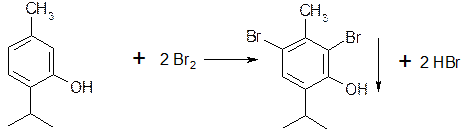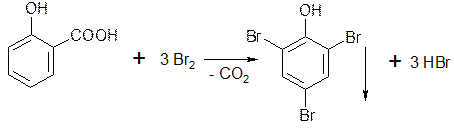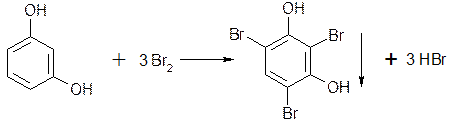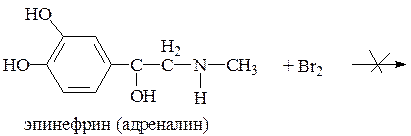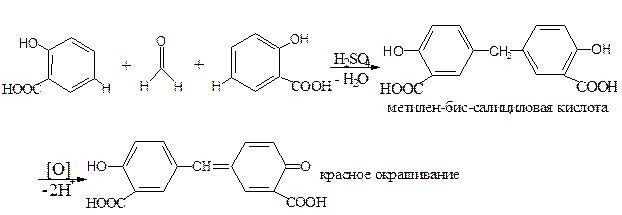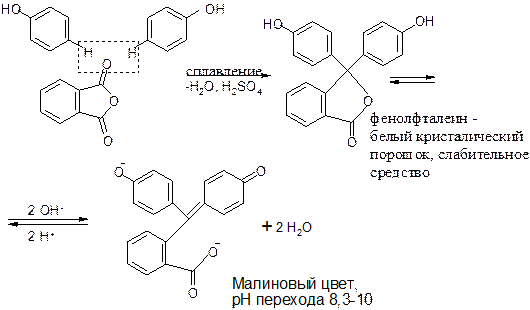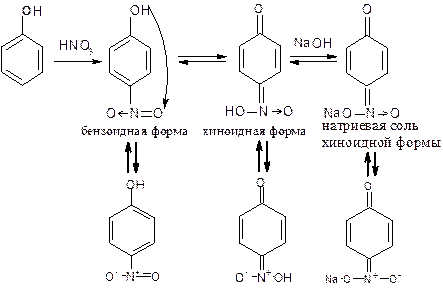наличие фенольного гидроксила в соединении можно доказать с помощью раствора
11. МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВ, СОДЕРЖАЩИХ ФЕНОЛЬНЫЙ ГИДРОКСИЛ
Фенольный гидроксил связан с ароматическим кольцом и проявляет слабые кислотные свойства вследствие взаимодействия неподеленной пары электронов атома кислорода с π-электронами ароматического ядра.
В свою очередь гидроксильная группа оказывает влияние на бензольное кольцо, повышая электронную плотность в орто- и параположениях, облегчая замещение атомов водорода в этих положениях.
Для фенолов характерны реакции кислотно-основного взаимодействия, окисления, замещения, конденсации.
Фенольный гидроксил содержат препараты группы фенолов (фенол, тимол, резорцин), фенолокислот и их производных (салициловая кислота, метилсалицилат, фенилсалицилат и др.); производные фенантренизохинолина (морфин, апоморфин) и многие другие.
Методы идентификации веществ, содержащих фенольный гидроксил
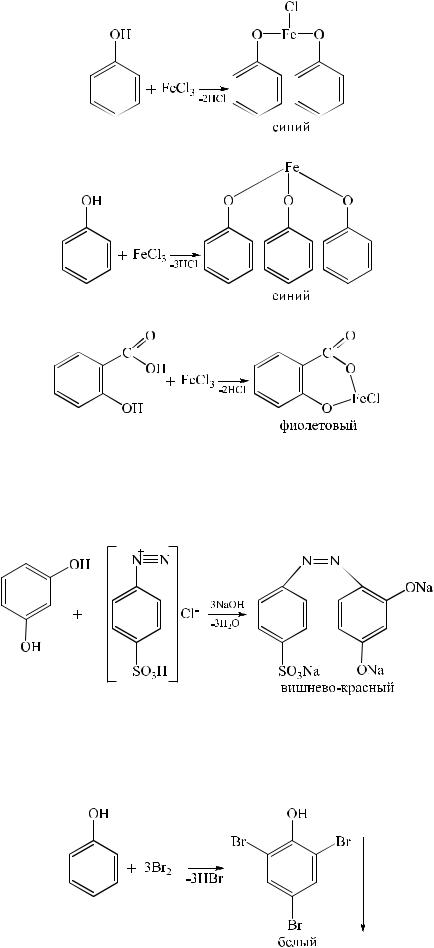
1. Реакция комплексообразования с солями железа (III). В результате образуются соединения, окрашенные чаще всего в синий цвет. Окраска зависит от количества и расположения фенольных гидроксилов.
2. Реакция азосочетания. В результате взаимодействия фенола с диазореактивом образуется азокраситель вишневого, красного или оранжевокрасного цвета.
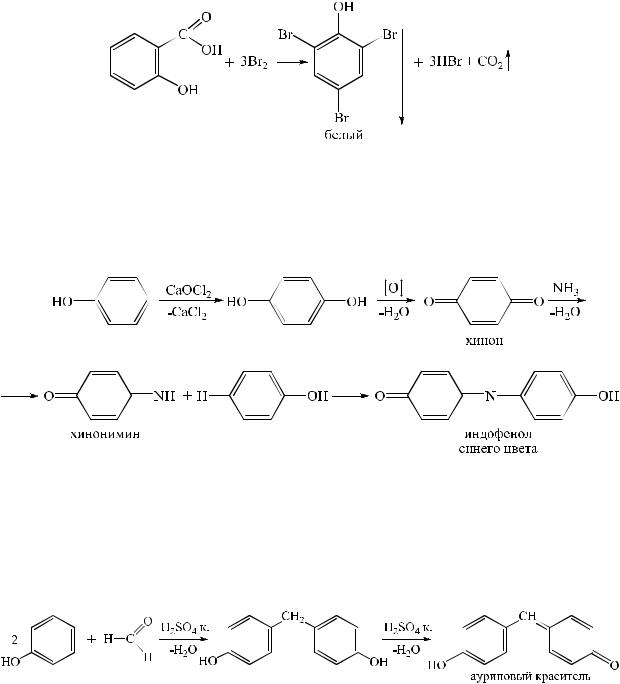
3. Реакции электрофильного замещения. Фенолы вступают в реакции нитрования, сульфирования, но наибольшее распространение получила реакция галогенирования (бромирование, йодирование).
Выделяется белый осадок трибромфенола и происходит обесцвечивание бромной воды.
Салициловая кислота в присутствии избытка брома декарбоксилируется, образуя трибромфенол.
4. Реакции окисления. Фенолы легко окисляются, что сопровождается изменением окраски препаратов. В качестве окислителей можно использовать гипохлориты, бромную воду в присутствии аммиака и др. окислители.
5. Реакции конденсации. Фенолы вступают в реакции конденсации со спиртами, альдегидами, органическими кислотами, ангидридами кислот и др. Характерной для фенолов является реакция конденсации с реактивом Марки (смесь формальдегида и концентрированной серной кислоты). В результате образуется ауриновый краситель темно-вишневого цвета.
Еще одной разновидностью реакции конденсации является реакция Либермана, основанная на взаимодействии фенолов с нитрозосоединениями, которые получаются при действии на фенолы азотистой кислотой:
Количественное определение фенолов
В основе метода лежит реакция галогенирования (бромирования) фенолов. Применяют как прямое, так и обратное броматометрическое титрование. В случае прямого способа титруют исследуемое вещество калия броматом в присутствии калия бромида до обесцвечивания раствора индикатора метилового оранжевого или метилового красного.
После добавления избыточной капли калия бромата образующийся
избыток брома обесцвечивает индикатор.
участвующих в реакции
электрофильного замещения. В данном случае f
Ищем педагогов в команду «Инфоурок»
краевое государственное бюджетное
профессиональное образовательное учреждение
«Владивостокский базовый медицинский колледж»
практическое занятие
Специальность 33.02.01.2 Фармация»
ПМ.02.Изготовление лекарственных форм и проведение обязательных видов внутриаптечного контроля.
МДК.02.02. Организация контроля качества лекарственных средств.
Раздел3.Контроль качества твердых и мягких лекарственных форм.
Тема: 3.1.качественные реакции на функциональные группы органических лекарственных средств.
Тип занятия: совершенствование знаний и умений, целевого применения усвоенного материала.
Форма проведения : практическое занятие.
-освоить внутриаптечный контроль лекарственных средств по реакциям на их структурные фрагменты.
Студент должен обладать общими компетенциями:
О К 1. Понимать сущность и социальную значимость своей будущей профессии.
О К 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач.
ОК5.Использоинформационно-коммуникационные технологии в профессионально деятельности.
ОК 6.Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
Студент должен обладать профессиональными компетенциями:
ПК2.3.Владеть обязательными видами внутриаптечного контроля лекарственных средств.
ПК2.4.Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
изучить внутриаптечный контроль лекарственных средств по реакциям на их структурные фрагменты.
ПМ.03.МДК.03.01. Организация деятельности аптеки и ее структурных подразделений; ПМ.01.МДК.01.01.Лекарствоведение
ОП.01.Основы латинского языка с медицинской терминологией.
После изучения темы обучающийся должен :
иметь практический опыт :
-владеть навыками проведения контроля качества органических лекарственных веществ;
-химические методы, положенные в основу качественного и количественного анализа лекарственных средств;
-основные структурные фрагменты лекарственных веществ, по которым проводится идентификация органических лекарственных веществ;
-общие и специфические реакции на отдельные функциональные группы;
-работать с Государственной фармакопеей, нормативно-технической и справочной литературой;
-выполнять расчеты по результатам химического контроля;
-проводить установление подлинности и количественное определение лекарственных веществ по реакциям на их структурные фрагменты;
4.1.Устный фронтальный опрос.
4.1.1. Особенности анализа органических лекарственных средств.
4.1.2. Классификация основных ФГ; понятие ФГ.
4.1.3. Общие реакции идентификации соединений, содержащих:
– сложноэфирную, лактонную, амидную группы;
-первичную алифатическую аминогруппу;
-первичную ароматическую аминогруппу;
-третичную аминогруппу;
-гидразидную группу;
-ароматическую нитрогруппу;
4.1.5.Общие реакции идентификации соединений, содержащих:
-сульфгидрильную группу;
-сульфаниламидную группу.
NB . Анализ органических лекарственных препаратов имеет ряд особенностей. Вот некоторые из них:
Органические соединения не являются электролитами, поэтому для них не применимы реакции ионного типа (кроме органических кислот и их солей);
Реакции органических веществ идут медленно, их можно остановить на стадии образования промежуточных продуктов, т.е. можно наблюдать целый ряд превращений между исходным и конечным результатом;
Органические соединения мало устойчивы при высоких температурах, полностью сгорают при сильном нагревании;
Все органические вещества содержат углерод (можно доказать его присутствие обугливанием при прокаливании; сжиганием в присутствии окислителя);
Для подтверждения наличия галогена в молекуле органического соединения применяют различные методы в зависимости от строения вещества;
Физические и химические показатели органических веществ служат не только для идентификации, но и для подтверждения чистоты лекарственных веществ. Например, для твердых веществ одним из характерных показателей является температура плавления, для жидких – температура кипения, плотность, показатель преломления. Эти показателя являются вполне определенными только для чистых веществ.
В молекулах органических веществ присутствуют функциональные группы, определяющие свойства веществ. Зная реакции обнаружения функциональных групп, можно правильно выстроить метод анализа органического вещества.
Качественные реакции на некоторые функциональные группы:
реакция среды – с индикатором;
реакция с раствором иодата и иодида калия;
образование сложных эфиров – реакция этерификации;
реакция с растворами солей тяжелых металлов.
Первичная ароматическая аминогруппа – реакция диазотирования и последующего азосочетания.
Реакция серебряного зеркала;
Реакция с реактивом Несслера;
Реакция с реактивом Фелинга;
Реакция конденсации с ароматическими аминами – образование ауриновых красителей.
Фенольный гидроксил – с раствором соли железа ( III ) образуется характерное окрашивание.
Спиртовой гидроксил – образование сложных эфиров (реакция этерификации).
АНАЛИЗ ОРГАНИЧЕСКИХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПО ФУНКЦИОНАЛЬНЫМ ГРУППАМ
Большинство лекарственных средств, используемых в медицинской практике, представляют собой органические вещества.
Чтобы подтвердить принадлежность препарата к той или иной химической группе, необходимо использовать реакции идентификации, которые должны обнаруживать присутствие в его молекуле определённой функциональной группы (например, спиртовый или фенольный гидроксил, первичную ароматическую или алифатическую группу и т.д.). Такой анализ называется анализом по функциональным группам.
Анализ по функциональным группам основывается на знаниях, приобретённых студентами при изучении органической и аналитической химии.
Функциональные группы – это группы атомов, которые отличаются высокой реакционной способностью и легко взаимодействуют с различными реактивами с заметным специфическим аналитическим эффектом (изменение цвета, появление запаха, выделение газа или осадка и т.д.).
Возможна идентификация препаратов и по структурным фрагментам.
Структурный фрагмент – это часть молекулы лекарственного вещества, которая взаимодействует с реактивом с заметным аналитическим эффектом (например, анионы органических кислот, кратные связи и т.д.).
Функциональные группы можно разделить на несколько типов:
2.2.1. Содержащие кислород:
а) гидроксильная группа (спиртовый и фенольный гидроксил):
Химические свойства. Фенольный гидроксил – гидроксил, связанный с ароматическим циклом.
Фенольный гидроксил – гидроксил, связанный с ароматическим циклом.
1. Кислотно–основные свойства обусловлены наличием в фенольном гидроксиле подвижного атома водорода. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов. Так pKa угольной кислоты = 6,35, а pKa фенола = 9,89.
Фенолы растворяются в водных растворах щелочей с образованием фенолятов (феноксидов):
Однако кислотный характер фенолов выражен настолько незначительно, что даже такая слабая кислота как угольная, вытесняет фенолы из их солей:
Поэтому фенолы, растворяясь в щелочах, не могут растворяться в карбонатах, т.к. освобождающаяся при этом угольная кислота тотчас же разлагает фенолят:
Это свойство фенолов отличает их от карбоновых кислот.
При повышении температуры реакция идет в прямом направлении. Феноляты щелочных металлов, как соли сильных оснований и слабых кислот, частично гидролизованы в водных растворах, поэтому растворы фенолятов обладают щелочной реакцией.
2. Реакция этерификации (аналогично спиртовому гидроксилу).
Образование простых эфиров – реакция фенолятов и галоидных алкилов (или алкилсульфатов).
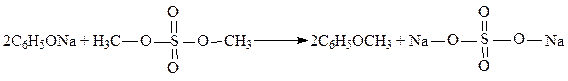
3. Окислительно – восстановительные свойства.
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями, при этом образуются окрашенные соединения хиноидной структуры.
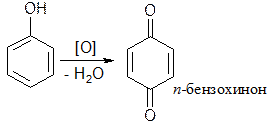 | [О] – CaOCl2, H2O2, Cl2, Br2 |
Примером реакции окисления является образование индофенолового красителя: образующийся хинон при взаимодействии с NH3 превращается в хинонимин, который взаимодействует с не прореагировавшим фенолом. В присутствии аммиака образуется индофенол, окрашенный в синий цвет.
Разновидностью индофеноловой реакции является нитрозореакция Либермана, которая характерна для тех фенолов, у которых нет заместителей в орто- и пара-положениях.
При действии нитрита натрия в кислой среде образуется n-нитрозофенол, изомеризующийся в монооксим n-бензохинона, который затем, реагируя с избытком фенола в кислой среде, дает индофенол.
Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи:
фенол – темно-зеленое, переходящее в вишнево-красное;
тимол – сине-зеленое, переходящее в фиолетовое;
резорцин – фиолетово-черное, переходящее в фиолетовое;
гексэстрол (синэстрол) – красно-фиолетовое, переходящее в вишневое.
4. Реакция комплексообразования с ионами железа.
В зависимости от количества фенольных гидроксилов, наличия в молекуле других функциональных групп, их взаимного расположения, pH среды, температуры, образуются комплексные соединения различного состава и окраски (исключение – тимол).
резорцин – сине-фиолетовый цвет;
кислота салициловая – сине-фиолетовый или красно-фиолетовый цвет;
осалмид (оксафенамид) – красно-фиолетовый цвет;
натрия пара-аминосалицилат – красно-фиолетовый цвет;
хинозол – синевато-зеленый цвет.
Реакция является фармакопейной для большинства фенольных соединений.
5. Реакции электрофильного замещения – SE атома водорода в ароматическом кольце (бромирование, конденсация с альдегидами, сочетание с солями диазония, нитрование, нитрозирование, йодирование и др.). Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподеленной электронной пары атома кислорода с π-электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и n-положениях по отношению к фенольному гидроксилу (ориентанту I рода).
5.1. Реакция галогенирования (бромирование и йодирование).
5.1.1. При взаимодействии с бромной водой образуются белые или желтые осадки бромпроизводных.
При избытке брома происходит окисление:
Реакция бромирования фенолов зависит от природы и положения заместителей.
Аналогично происходит йодирование, например:
5.1.2. При наличии заместителей в о- и n-положениях ароматического кольца в реакцию вступают незамещенные атомы водорода ароматического кольца.
5.1.3. Если в о- и n-положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:
5.1.4. Если соединение содержит два фенольных гидроксила в м-положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):
5.1.5. Если две гидроксильные группы расположены по отношению друг к другу в о- или n-положениях, то реакция бромирования не протекает (несогласованная ориентация)
5.2. Реакции конденсации
Примером конденсации фенолов с альдегидами является реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной H2SO4 образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.
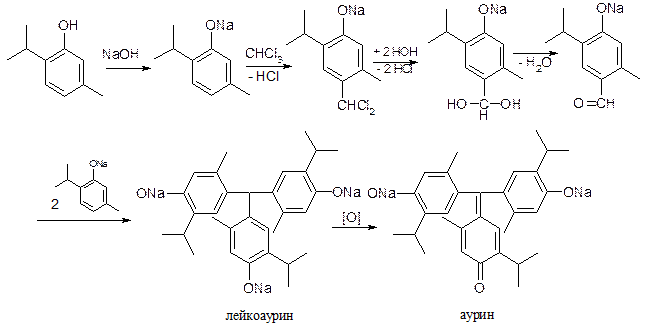
5.2.2. Реакция фенолов с хлороформом (CHCl3) с образованием ауриновых красителей.
При нагревании фенолов с CHCl3 в щелочной среде образуются аурины – трифенилметановые красители:
фенол – желтый цвет;
тимол – желтый цвет, переходящий в фиолетовый;
резорцин – красно-фиолетовый цвет.
5.2.3. С ангидридами кислот.
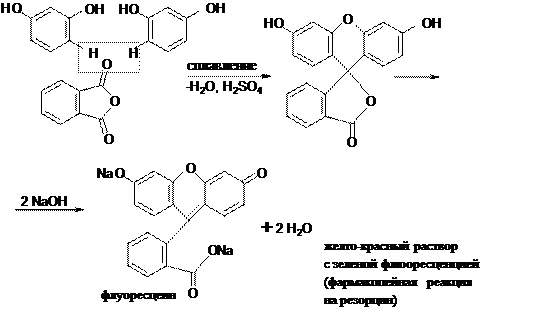
А. Реакция образования флуоресцеина (конденсация резорцина с фталевым ангидридом).
|
Б. Реакция образования фенолфталеина (конденсация фенола с фталевым ангидридом).
При большом избытке щелочи образуется трехзамещенная натриевая соль.
Конденсация тимола с фталевым ангидридом идет аналогично реакции образования фенолфталеина, образуется тимолфталеин, имеющий синее окрашивание в щелочной среде.
5.3. Реакция нитрования
Фенолы вступают в реакцию с разбавленной азотной кислотой (HNO3) и образуют орто- и пара-нитропроизводные. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциированной соли.
5.4. Реакция азосочетания фенолов с солью диазония в щелочной среде.
При взаимодействии фенолов с солью диазония при pH 9-10 образуются азокрасители, окрашенные в желто-оранжевый или красный цвет. Реакция азосочетания протекает в орто- и пара-положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.
Качественные реакции на фенольный гидроксил. Фенольный гидроксил
Тема « Качественные реакции на функциональные группы»
1) Гидроксильная (спиртовая, фенольная)
2) Карбонильная (альдегидная, карбоксильная, сложно-эфирная)
3) Первичная ароматическая аминогруппа, третичная аминогруппа(третичный азот)
4) Имидная, сульфамидная.
Функциональные группы (ФГ)- это связанные с углеродным радикалом отдельные атомы или группы атомов, которые вследствие своих характерных свойств могут быть использованы определения лекарственных веществ.
На основе спиртового гидроксила в анализе содержащих его ЛВ используются следующие реакции:
Этерификации (образования с кислотами или их ангидридами сложных эфиров);
Окисление до альдегидов, а в некоторых случаях и до кислот;
Комплексообразование с ионами меди (II) в щелочной среде.
1.Реакция этерификации в присутствии водоотнимающих средств с кислотами или их ангидридами. Основана на свойстве спиртов образовывать сложные эфиры. В случае низкомолекулярных соединений эфиры обнаруживают по запаху, при анализе ЛВ с высокой молекулярной массой – по температуре плавления.
Реакция этерификации является фармакопейной для спирта этилового.
CH 3 CH 2 OH + CH 3 COOH H 2 SO 4 → CH 3 CH 2 OCOCH 3
2. Реакция окисления, основана на свойстве спиртов окисляться до альдегидов, которые обнаруживают по запаху. В качестве реагентов используют различные окислители: калия перманганат, калия бихромат, гексацианоферрат (III) калия и др. Наибольшую аналитическую ценность имеет калия перманганат, который, восстанавливаясь, меняет степень окисления от +7 до + 2 и обесцвечивается, т.е. делает реакцию эффектной.
Используется для идентификации многоатомного спирта – глицерина и эфедрина гидрохлорида, в котором кроме спиртового гидроксила участвует в комплексообразовании и вторичная аминная группа.
На основе свойств фенольного гидроксила используются следующие реакции:
Образования индофенолового красителя;
1. Реакции комплексообразования фенольного гидроксила с ионами железа (III). Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая), реже в красный (ПАСК – натрия) и зеленый (хинозол).
Состав комплекса, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов (фенол – синее, резорцин – фиолетовое), и влиянием других функциональных групп.
2. Реакция бромирования ароматического кольца. Основана на электрофильном замещении водорода в о- и n- положении на бром с образованием нерастворимого бромопроизводного.

Бром замещает водород в о- и n- положении по отношению к фенольному гидроксилу (наиболее рационноспособное n – положение):


Если заместитель находится в м- положении, то он не препятствует образованию трибромпроизводного:
Если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласной ориентации образуется трибромпроизводное
если две гидроксильные группы расположены в о- или n- положении друг к другу, то они действуют несогласованно: бромирование не происходит:
3.Реакция азосочетания фенолов с диазореактивом (диазотированная сульфаниловая кислота) с образованием азокрасителя, окрашенного в оранжево-красный цвет.
4. Реакция окисления. Фенолы могут окисляться до различных соединений, но чаще всего до хинонов окрашенных в розовый или реже в желтый цвет.
5. Реакция образования индофенолового красителя. Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводными и избытком фенола образуют индофеноловый краситель, окрашенный в фиолетовый цвет.
6. Реакция конденсации с альдегидами или ангидридами кислот:
С формальдегидом в присутствии концентрированной серной кислоты с образованием ауриноваго (арилметанового) красителя окрашенного в красный цвет.
Реакция является фармакопейной для кислоты салициловой.
Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, на второй – является окислителем.
Химизм реакции на резорцин
Функциональный анализ органических лекарственных веществ
Подавляющую часть применяемых в медицинской практике лекарственных веществ составляют соединения органической природы. В отличие от анализа неорганических веществ, в котором используются свойства образующих их ионов, основу анализа органических лекарственных веществ составляют свойства функциональных групп.
Наличие нескольких функциональных групп оказывает влияние на эффекты некоторых общих реакций и на свойства продуктов, образующихся в результате их протекания.
Классификация функциональных групп
1. Кислородсодержащие функциональные группы:
3. Прочие функциональные группы:
Ароматический (фенильный) радикал;

Спиртовый гидроксил: Alk — ОН
спирт этиловый этилацетат (фруктовый запах)
2. Реакция окисления. Основана на свойстве спиртов окисляться до альдегидов, которые обнаруживают по запаху. В качестве реагентов используют различные окислители: калия перманганат, калия бихромат, калия гексацианоферрат (III) и др. Наибольшую аналитическую ценность имеет калия перманганат, который, восстанавливаясь, меняет степень окисления от
7 до +2 и обесцвечивается, т.е. делает реакцию наиболее эффектной.
спирт этиловый ацетальдегид (запах яблок)
3. Реакция комплексообразования , основанная на свойстве многоатомных спиртов образовывать комплексные соединения с сульфатом меди (II) в щелочной среде.
CuSO 4 + 2 NaOH → Cu(OH) 2 + Na 2 SO 4
глицерин синего цвета комплекс
Аналогичную цветную реакцию дают аминоспитры (эфедрин, мезатон и др.). В комплексообразовании принимают участие спиртовый гидроксил и вторичная аминогруппа. Полученные окрашенные комплексы имеют структуру:
В случае эфедрина образующийся комплекс при извлечении в эфир окрашивает его в фиолетово-красный цвет, а водный слой сохраняет синее окрашивание.
1. Метод ацетилирования: алкалиметрия, вариант нейтрализации, способ косвенного титрования. Основан на свойстве спиртов образовывать нерастворимые сложные эфиры. Ацетилирование проводят избытком уксусного ангидрида при нагревании в присутствии пиридина. В процессе титрования выделяется эквивалентное количество уксусной кислоты, которую оттитровывают натрия гидроксидом с индикатором фенолфталеин.
Одновременно будет титроваться также кислота, образованная при гидролизе избытка уксусного ангидрида, взятого для ацетилирования, поэтому необходим контрольный опыт.
(СH 3 CO) 2 O + H 2 O → 2 СH 3 COOH
СH 3 COOH + NaOH → СH 3 COONa + H 2 O Э=М/3
3 C 2 H 5 OH + 2 K 2 Cr 2 O 7 + 16 HNO 3 → 3 CH 3 COОН + 4 Cr(NO 3) 3 + 4 KNO 3 + 11 H 2 O
Избыток бихромата калия определяют йодометрически с индикатором – крахмал:
K 2 Cr 2 O 7 + 6 KJ + 14 HNO 3 → 3 J 2 + 2 Cr(NO 3) 3 + 8 KNO 3 + 7 H 2 O
J 2 + 2 Na 2 S 2 O 3 → 2 NaJ + Na 2 S 4 O 6 Э=М/4
Фенольный гидроксил: А r — ОН
Это гидроксил, связанный с ароматическим радикалом. Его содержат лекарственные вещества группы фенолов, фенолокислот и их производных, производные фенантренизохинолина, синэстрол, адреналин и др.
1. Реакция комплексообразования фенольного гидроксила с ионами железа (III). Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий цвет (фенол) или фиолетовый (резорцин, кислота салициловая), реже в красный (ПАС-натрий) и зеленый цвета (хинозол).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов: синий (фенол) или фиолетовый (резорцин), влиянием других функциональных групп (кислотата салициловая, ПАС-натрий, хинозол), реакцией среды (резорцин).
2. Реакция бромирования ароматического кольца. Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного белого цвета. При избытке бромной воды образуется продукт окисления и галогенирования (тетрабромциклогексадиен-2,5-он) в виде осадка желтого цвета.
29. Наличие в структуре пиридоксина гидрохлорида фенольного гидроксила можно подтвердить с помощью раствора:
A. *Железа(III) хлорида
B. Калия перманганата
30. Во время разработки аналитической нормативной документации на лекарственное средство, которое относится к группе фенолов, провизору-аналитику следует провести реакцию, которая подтверждает наличие фенольного гидроксила. Выберите соответствующий реактив:
A. *Железа(III) хлорид
31. На анализ поступила субстанция парацетамола. При взаимодействии его с раствором железа(III) хлорида образовалось сине-фиолетовое окрашивание, что свидетельствует о наличии в его структуре:
A. *Фенольного гидроксила
B. Сложноэфирной группы
D. Альдегидной группы
E. Спиртового гидроксила
32. Провизор-аналитик проводит экспресс-анализ глазных капель, содержащих адреналина гидротартрат. После прибавления раствора хлорида железа(III) появилось изумрудно-зелёное окрашивание, что свидетельствует о наличии в молекуле адреналина:
A. *Фенольных гидроксильных групп
B. Ароматических аминогрупп
C. Альдегидных групп
D. Сложноэфирных групп
E. Карбоксильных групп
E. Концентрированной HNO 3
A. *Железа (ІІІ) хлоридом
B. Серебра нитратом
D. Калия ферроцианидом
E. Аммония оксалатом
A. *Фенольного гидроксила
B. Альдегидной группы
C. Спиртового гидроксила
E. Сложноэфирной группы
36. Качественная реакция на фенол – появление фиолетовой окраски с водным раствором неорганического соединения. Какого?
A. *Наличие фенольного гидроксила
B. Наличие спиртового гидроксила
C. Наличие третичного азота
D. Наличие двойной связи
E. Наличие хлорид-ионов
E. Концентрированной HNO 3
39. Выберите реактив, который наиболее часто используется в фармацевтическом анализе для подтверждения наличие фенольного гидроксила в структуре лекарственных средств:
A. *Раствор железа(III) хлорида
B. Раствор калия йодида
C. Раствор 2,4-динитрохлорбензола
D. Раствор гидроксиламина
E. Раствор натрия гидрокарбоната
40. Билитраст – рентгеноконтрастное средство. Укажите реагент, с помощью которого можно подтвердить наличие фенольного гидроксила в его молекуле:
A. *Раствор феррума(III) хлорида
B. Спиртовый раствор йода
C. Раствор кислоты хлористоводородной
D. Раствор йода в калия йодиде
E. Раствор серебра нитрата
A. *Наличие свободного фенольного гидроксила
B. Наличие свободного спиртового гидроксила
C. Наличие аминного азота
D. Наличие двойной связи
E. Присутствие хлорид-ионов
42. Укажите, какую реакцию не используют для определения фенольного гидроксила:
43. Качественная реакция на фенол – реакция с бромной водой. Какое соединение образуется при взаимодействии фенола с бромной водой и выпадает из раствора в виде белого осадка?
44. При взаимодействии фенола с бромной водой образовался осадок белого цвета. Какое
соединение образовалось?
45. Наличие какой функциональной группы в молекуле тетрациклиновых антибиотиков обусловливает возможность образования азокрасителей при реакциях с солями диазония?
A. *Фенольный гидроксил
B. Остаток диметиламина
C. Спиртовый гидроксил
D. Карбамидная группа
E. Метильная группа
46. Тимол – лекарственное вещество, содержащее в своей структуре фенольный гидроксил. Какой метод ГФУ рекомендует для количественного определения данного препарата?
Идентификация и количественное определение субстанций,
Фенольный гидроксил – это гидроксил, связанный с ароматическим радикалом. Его содержат ЛВ группы фенолов (фенол, резорцин); фенолокислот и их производных (кислота салициловая, фенилсалицилат, салициламид, оксафенамид); производные фенантренизохинолина (морфина гидрохлорид, апоморфин); синэстрол, адреналин и др.
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π-электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН-группы на кольцо, нарушению в нём равномерности распределения электронов, созданию избыточного отрицательного заряда в орто (о )- и пара (п )-положениях. Атом водорода гидроксигруппы ионизирует и придаёт фенолам слабые кислотные свойства (рКа фенола = 10,0; рКа резорцина = 9,44). Поэтому, в отличие от спиртов, они образуют соли со щелочами (при рН 12-13), растворимые комплексные соединения с хлоридом железа (III) (в нейтральных, слабощелочных и кислых растворах).
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями. Образуют окрашенные соединения хиноидной структуры.
На основе свойств фенольного гидроксила и активированного им ароматического кольца в анализе ЛВ используются следующие реакции:
2 – галогенирования (бромирования);
5 – образования индофенолового красителя;
6 – конденсации с альдегидами.
2.1. Реакция комплексообразования с ионами железа (III )
Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая) реже в красный (ПАСК – натрия) и зелёный (хинозол, адреналин).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов, влиянием других функциональных групп, реакцией среды.
При избытке фенола:
Предположительный состав конечного продукта в реакции с фенолом:
2.2. Реакция бромирования ароматического кольца
Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного (белый осадок).
Основные правила бромирования:
Бром замещает водород в о- и п- положениях по отношению к фенольному гидроксилу (наиболее реакционноспособное – п- положение):
При наличии в о- или п- положениях ароматического кольца заместителей, в реакцию вступает меньше атомов брома;
Если в о- или п- положениях находится карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного:
Если заместитель находится в м- положении, то он не препятствует образованию трибромпроизводного:
Если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласованной ориентации образуется трибромпроизводное:
Если две гидроксильные группы расположены в о- или п- положениях друг к другу, то они действуют несогласованно: бромирование количественно не проходит:
Если кроме фенольных гидроксилов соединение содержит амидную или сложно-эфирную группу (салициламид, фенилсалицилат) для их количественной оценки методом броматометрии необходимо провести предварительный гидролиз.
2.3. Реакция азосочетания
Сочетание идет также в о- и п- положениях, в этом случае также, как и при бромировании, предпочтительным является п- положение. Диазореактив – соль диазония (диазотированная сульфаниловая кислота). Среда – щелочная. Продукт реакции – азокраситель.
2.4. Реакция окисления
2.5. Реакция образования индофенолового красителя
Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют индофеноловый краситель, окрашенный в фиолетовый цвет.
Разновидностью данной реакции является нитрозореакция Либермана, она характерна для фенолов, не имеющих заместителей в о- и п- положениях.
2.6. Образование нитрозосоединений
При взаимодействии с разведенной азотной кислотой фенолы могут нитроваться при комнатной температуре, образуя о- и п- нитропроизводные. Образующееся нитропроизводное содержит в п- положении подвижный атом водорода гидроксильной группы, образуется таутомерная аци-форма с хиноидной структурой, она обычно окрашена в желтый цвет. Добавление щелочи усиливает окраску, вследствие образования хорошо диссоциируемой соли:
2.7. Реакция конденсации с альдегидами или ангидридами кислот
С формальдегидом в присутствии концентрированной серной кислоты с образованием ауринового (арилметанового) красителя окрашенного в красный цвет.
Реакция является фармакопейной для кислоты салициловой. Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, на второй – является окислителем.
С фталевым ангидридом (сплавление и последующее растворение плава в щёлочи) рекомендована фармакопеей для идентификации фенола и резорцина.
Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде.
K
Используют способы прямого и обратного титрования. В прямом – титруют броматом калия в присутствии бромида калия с индикатором метиловым оранжевым или метиловым красным от розовой окраски до обесцвечивания. В точке эквивалентности избыточная капля бромата калия выделяет бром, который окисляет индикатор и раствор обесцвечивается. При обратном титровании вводят избыток бромата калия, добавляют калия бромид, создают кислую среду, выдерживают нужное для бромирования время и после чего избыток брома определяют йодометрически (индикатор – крахмал).
Br 2 + 2KI → I 2 + 2KBr
I 2 + 2Na 2 S 2 O 3 → Na 2 S 4 O 6 + 2NaI
Способом прямого титрования определяют по ГФ Х тимол, обратного – фенол, резорцин, кислоту салициловую, синэстрол и другие ЛВ.
М.э. = 1/6 М.м. (фенол, резорцин, кислота салициловая)
М.э. = 1/8 М.м. (синэстрол)
Основана на электрофильном замещении атомов водорода ароматического кольца на йод.
Для связывания йодоводородной кислоты, смещающей равновесие в обратную сторону, добавляют ацетат или гидрокарбонат натрия.
HI + NaHCO 3 → NaI + H 2 O + CO 2
HI + CH 3 COONa → NaI + CH 3 COOH
Используют способы прямого и обратного титрования. В последнем – избыток йода оттитровывают тиосульфатом натрия.
I 2 + 2NaS 2 O 3 → 2NaI + Na 2 S 4 O 6
Метод основан на электрофильном замещении атомов водорода ароматического кольца на йод, входящий в состав йодмонохлорида.
Используют способ обратного титрования – избыток йодмонохлорида определяют йодометрически.
I 2 + 2Na 2 S 2 O 6 → 2NaI + Na 2 S 4 O 6
2.11. Метод ацетилирования
Используют по ГФ Х для количественной оценки синэстрола.
2.12. Алкалиметрический метод нейтрализации в среде протофильного растворителя диметилформамида (ДМФА).
ЛВ группы фенолов проявляют очень слабые кислотные свойства, их определение алкалиметрическим методом нейтрализации в водных или смешанных средах невозможно, поэтому используют титрование в среде неводных растворителей, в частности, ДМФА. Метод основан на солеобразовании определяемой слабой кислоты (фенола) с титрантом (метилатом натрия) в среде протофильного растворителя, усиливающего кислотные свойства.
2.13. Фотоколориметрия (ФЭК) и спектрофотометрия (СФМ)
Основана на свойстве окрашенных растворов поглощать немонохроматический (ФЭК) или монохроматический (СФМ) свет в видимой области спектра.
Получение окрашенных растворов;
Измерение оптической плотности (D), характеризующей поглощение электромагнитного излучения раствором, содержащим анализируемое вещество;
Проведение расчётов на основе основного закона светопоглощения с использованием калибровочного графика, удельного коэффициента поглощения, раствора стандартного образца.
При определении этими методами ЛВ, содержащих фенольный гидроксил, получают окрашенные соединения на основе реакций комплексообразования с ионами железа (III), азосочетания с солями диазония и образования индофенолового красителя.
Двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон. Способы получения, свойства и применение.
Трехатомные фенолы (арентриолы): пирогаллол, оксигидрохинон, флороглюцин. Способы получения, свойства и применение.
Гидроксильные производные аренов
Фенолы – это производные ароматических углеводородов, в которых одна или несколько гидроксильных групп непосредственно связаны с бензольным ядром.
В зависимости от числа гидроксильных групп в ядре различают одно-, двух- и трехатомные фенолы.
Для названия фенолов часто используют тривиальные названия (фенол, крезолы, пирокатехин, резорцин, гидрохинон, пирогаллол, гидроксигидрохинон, флороглюцин).
Замещенные фенолы называют как производные фенола или как гидроксипроизводные соответствующего ароматического углеводорода.
орто-крезол мета-крезол пара-крезол
2-метилфенол 3-метилфенол 4-метилфенол
2-гидрокситолуол 3-гидрокситолуол 4-гидрокситолуол
В ароматическом ряду встречаются также соединения с гидроксильной группой в боковой цепи – так называемые ароматические спирты.
Свойства гидроксильной группы в ароматических спиртах не отличаются от свойств спиртов алифатического ряда.
Двухатомные фенолы (арендиолы)
пирокатехин резорцин гидрохинон
1,2-дигидроксибензол 1,3-дигидроксибензол 1,4-дигидроксибензол
Трехатомные фенолы (арентриолы)
пирогаллол гидроксигидрохинон флороглюцин
1,2,3-тригидроксибензол 1,2,4-тригидроксибензол 1,3,5-тригидроксибензол
Одноатомные фенолы
Способы получения
Природным источником фенола и его гомологов служит каменный уголь, при сухой перегонке которого образуется каменноугольная смола. При разгонке смолы получают фракцию «карболового масла» (t 0 160-230 0 С), содержащую фенол и крезолы.
1. Сплавление солей ароматических сульфокислот со щелочами
Реакция лежит в основе промышленных методов получения фенолов.
Реакция состоит в нагревании бензолсульфокислоты с твердой щелочью (NaOH, KOH) при температуре 250-300 0 С:
Реакция протекает по механизму нуклеофильного замещения S N 2 аром (присоединение-отщепление).
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к месту замещения облегчает реакцию нуклеофильного замещения.
2. Гидролиз арилгалогенидов
Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию в очень жестких условиях.
Так, хлорбензол гидролизуется с образовнием фенола действием концентрированной щелочи при температуре 350-400 0 С и высоком давлении 30 МПа, либо в присутствии катализаторов – солей меди и высокой температуре:
Реакция протекает по механизму нуклеофильного замещения (отщепление-присоединение) (ариновый или кине-механизм).
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к галогену значительно облегчает реакцию гидролиза.
Так, пара-нитрохлорбензол способен замещать хлор на гидроксил обычным нагреванием с раствором щелочи при атмосферном давлении:

Реакция протекает по механизму S N 2 аром (присоединение-отщепление).
3. Получение фенола из кумола (кумольный способ)
Синтез на основе кумола имеет промышленное значение и ценен тем, что позволяет получать одновременно два технически важных продукта (фенол и ацетон) из дешевого сырья (нефть, газы крекинга нефти).
Кумол (изопропилбензол) при окислении кислородом воздуха превращается в гидропероксид, который под действием водного раствора кислоты распадается с образованием фенола и ацетона:
гидропероксид фенол ацетон
4. Гидроксилирование аренов
Для прямого введения гидроксильной группы в бензольное кольцо используют пероксид водорода в присутствии катализаторов (солей железа (П) или меди (П):
5. Окислительное декарбоксилирование карбоновых кислот
Фенолы получают из ароматических кислот пропуская в реактор водяной пар и воздух при температуре 200-300 0 С в присутствии солей меди (П):
6. Получение из солей диазония
При нагревании арендиазониевых солей в водных растворах выделяется азот с получением фенолов:
Физические свойства фенолов
Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом.
Фенолы малорастворимы в воде, но хорошо растворимы в органических растворителях. При хранении на воздухе темнеют вследствие процессов окисления.
Являются токсичными веществами, вызывают ожоги кожи.
Электронное строение фенола
Строение и распределение электронной плотности в молекуле фенола можно изобразить следующей схемой:
Гидроксильная группа является заместителем 1 рода, т.е. электроно-донорным заместителем.
Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р,π-сопряжение с π-системой бензольного ядра, проявляя +М-эффект.
С другой стороны, гидроксильная группа, вследствие большей электроотрицательности кислорода, проявляет –I-эффект.
Результатом эффекта сопряжения является:
1) увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами;
3) повышение электронной плотности на атомах углерода в орто- и пара-положениях бензольного ядра облегчает реакции электрофильного замещения атомов водорода в этих положениях.
Химические свойства фенолов
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
1. Реакции по гидроксильной группе
1. Кислотные свойства
Фенолы являются слабыми ОН-кислотами, но значительно более сильными по сравнению с алканолами. Константа кислотности рК а фенола равна 10.
Более высокая кислотность фенола объясняется двумя факторами:
1) большей полярностью связи О-Н в фенолах, в результате чего атом водорода гидроксильной группы приобретает большую подвижность и может отщепляться в виде протона с образованием фенолят-иона;
2) Фенолят-ион за счет сопряжения неподеленной пары кислорода с бензольным кольцом мезомерно стабилизирован, т.е. отрицательный заряд на атоме кислорода фенолят-иона значительно делокализован:
Ни одна из этих граничных структур в отдельности не описывает реального состояния молекулы, но их использование позволяет объяснять многие реакции.
Электроноакцепторные заместители увеличивают кислотные свойства фенола.
Оттягивая электронную плотность из бензольного ядра на себя, они способствуют усилению р,π-сопряжения (+М-эффект), тем самым повышают поляризацию связи О-Н и увеличивают подвижность атома водорода гидроксильной группы.

рК а 9,98 7,23 4,03 0,20
Электронодонорные заместители уменьшают кислотность фенолов.
1. Замещение фенольного гидроксила галогеном
Гидроксильная группа в фенолах с большим трудом замещается галогеном.
При взаимодействии фенола с пентахлоридом фосфора PCl 5 основным продуктом является трифенилфосфат и лишь в небольших количествах образуется хлорбензол:
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к гидроксилу намного облегчает реакции нуклеофильного замещения группы ОН.
Так, пикриновая кислота в тех же условиях легко превращается в 2,4,6-тринитрохлорбензол (пикрилхлорид):

2. Взаимодействие с аммиаком

3. Восстановление фенола
При восстановлении фенола алюмогидридом лития образуется бензол:
3. Реакции с участием бензольного кольца
1. Реакции электрофильного замещения в бензольном кольце
Гидроксильная группа является заместителем 1 рода, поэтому реакции электрофильного замещения в бензольном ядре протекают с фенолами значительно легче, чем с бензолом, а заместители направляются в орто- и пара-положения.
1) Реакции галогенирования
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола:
2,4,6-трибромфенол
Эта реакция является качественной на фенолы.
Легко происходит хлорирование фенола:
2) Реакции нитрования
Фенол легко нитруется разбавленной азотной кислотой при температуре 0 0 С с образованием смеси орто- и пара-изомеров с преобладанием орто-изомера:
орто- и пара-нитрофенолы
Большая летучесть орто-нитрофенолов объясняется образованием внутримолекулярной водородной связи, в то время как пара-изомер образует межмолекулярные водородные связи:
При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота):

3) Реакции сульфирования
Фенол легко сульфируется при комнатной температуре концентрированной серной кислотой с образованием орто-изомера, который при температурах выше 100 0 С перегруппировывается в пара-изомер:
4) Реакции алкилирования
Фенолы легко вступают а реакции алкилирования.
5) Реакции ацилирования
Легко происходит ацилирование фенолов под действием галоген-ангидридов или ангидридов карбоновых кислот в присутствии кислот Льюиса:
6) Реакции нитрозирования
Нитрозофенолы получают прямым нитрозированием фенолов:
8) Реакции конденсации
Наиболее легко вступает в реакции конденсации формальдегид.
Если реакцию конденсации фенола с формальдегидом проводить в мягких условиях, то удается выделить орто- и пара-гидроксиметилфенолы:Отдельные представители
Фенол – кристаллическое вещество с т. пл. 43°С, обладает характерным едким запахом, вызывает ожоги на коже. Это один из первых примененных в медицине антисептиков. Применяется в больших количествах для получения пластических масс (конденсация с формальдегидом), лекарственных препаратов (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота).
Метиловый эфир фенола – анизол – применяется для получения душистых веществ и красителей.
Крезолы (метилфенолы) применяются в производстве пластических масс, красителей, дезинфицирующих средств.