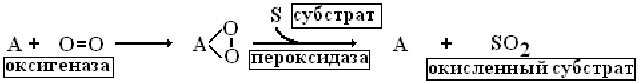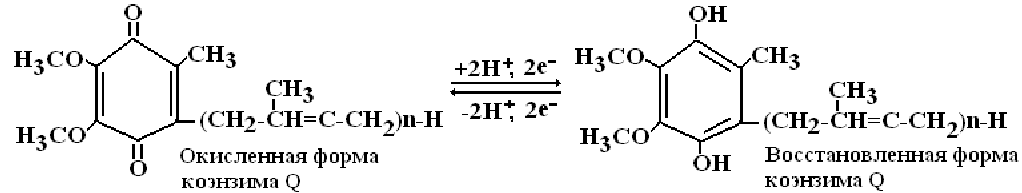какое значение для организма имеет биологическое окисление
Биологическое окисление: суть процесса и его виды
Виды и стадии биологического окисления
Живые организмы не могут существовать без энергии. Ее требует каждый процесс, каждая химическая реакция. Получать энергию многие живые существа, в том числе и человек, могут с пищей. Стоит детально разобраться, откуда появляется энергия, и какие реакции протекают в это время в клетках живых организмов.
Значение биологического окисления и история его исследования
В основе получения энергии лежит процесс биологического окисления. Сейчас он изучен, создана даже целая наука, занимающаяся всеми тонкостями и механизмами процесса — биохимия. Биологическое окисление — это совокупность окислительно-восстановительных превращений веществ в живых организмах. Окислительно-восстановительными называют реакции, которые протекают с изменением степени окисления атомов вследствие перераспределения электронов между ними.
Первые предположения ученых о том, что внутри каждого живого организма протекают сложные химические реакции, были выдвинуты в XVIII столетии. Изучением проблемы занимался французский химик Антуан Лавуазье, обративший внимание на то, что процессы горения и биологического окисления похожи друг на друга.
Ученый проследил путь кислорода, который поглощается живым организмом в процессе дыхания, и сделал вывод, что в организме происходит процесс окисления, напоминающий процесс горения, но протекающий более медленно. Лавуазье обнаружил, что молекулы кислорода (окислитель) взаимодействуют с органическими соединениями, содержащими углерод и водород. В результате происходит абсолютное превращение, при котором соединения разлагаются.
Некоторые моменты в процессе изучения проблемы оставались для ученых непонятыми:
Чтобы ответить на эти и многие другие вопросы, а также уяснить, что такое биологическое окисление, ученым потребовался не один год. К настоящему времени химиками были изучены: связь дыхания с другими процессами обмена веществ, в т.ч. процесс фосфорилирования. Кроме того, ученые исследовали свойства ферментов, катализирующих реакции биологического окисления; локализацию ферментов в клетке; механизм аккумуляции и преобразования энергии.
Здесь вы найдете безопасные эксперименты на исследование химических свойств белков, жиров и углеводов.
Биологическое окисление и его виды
При разных условиях возможны два вида биологического окисления. Многие грибки и микроорганизмы получают энергию, преобразовывая питательные вещества анаэробным способом. Анаэробное биологическое окисление – это реакция, происходящая без доступа и какого-либо участия в процессе кислорода. Такой способ получения энергии применим живыми организмами в среде, в которую не поступает воздух: в глине, под землей, в иле, на болоте, в гниющих субстанциях. Анаэробное биологическое окисление называют гликолизом.
Более сложный способ преобразования питательных веществ в энергию — аэробное биологическое окисление, или тканевое дыхание. Эта реакция осуществляется во всех аэробных организмах, использующих кислород в процессе дыхания. Аэробный способ биологического окисления невозможен без молекулярного кислорода.
Пути биологического окисления и участники процесса
Чтобы окончательно понять, что собой представляет процесс биологического окисления, следует рассмотреть его стадии.
Гликолиз — это беcкислородное расщепление моносахаридов, предшествующее процессу клеточного дыхания и сопровождающееся выходом энергии. Такая стадия является начальной для каждого организма-гетеротрофа. После гликолиза у анаэробов наступает процесс брожения.
Окисление пирувата заключается в преобразовании пировиноградной кислоты, получаемой в процессе гликолиза, в ацетилкоэнзим. Реакция происходит с помощью ферментного комплекса пируватдегидрогеназы. Локализация – кристы митохондрий.
Распад бета-жирных кислот осуществляется параллельно с окислением пирувата на кристах митохондрий. Цель – переработка всех жирных кислот в ацетилкоэнзим и постановка его в цикл трикарбоновых кислот.
Цикл Кребса: сначала ацетилкоэнзим превращается в лимонную кислоту, затем она подвергается последующим преобразованиям (дегидрированию, декарбоксилированию и регенерации). Все процессы несколько раз повторяются.
Окислительное фосфорилирование — заключительная стадия преобразования в организмах эукариот соединений. Осуществляется преобразование аденозиндифосфата в аденозинтрифосфорную кислоту. Необходимая для этого энергия поступает в процессе окисления молекул фермент-дегидрогеназа и кофермента дегидрогеназа, сформировавшихся в предыдущих стадиях. Затем энергия заключается в макроэргические связи аденозинтрифосфорной кислоты.
Таким образом, окисление веществ осуществляется такими способами:
В клетках живых организмов встречаются все перечисленные типы окислительных реакций, катализируемых соответствующими ферментами — оксидоредуктазами. Процесс окисления происходит неизолированно, он связан с реакцией восстановления: одновременно происходят реакции присоединения водорода или электрона, то есть осуществляются окислительно-восстановительные реакции. Процесс окисления — это каждая химическая реакция, которая сопровождается отдачей электронов с увеличением степеней окисления (окисленный атом имеет большую степень окисления). С окислением вещества может происходить и восстановление — присоединение электронов к атомам другого вещества.
Какое значение для организма имеет биологическое окисление
Развитие представлений о биологическом окислении
Биологическое окисление представляет собой совокупность реакций окисления, протекающих во всех живых клетках. Основной функцией данного процесса является обеспечение организма энергией в доступной для использования форме (прежде всего в форме АТФ).
Принципиальной особенностью биологического окисления, или тканевого дыхания, является то, что оно протекает постепенно, через многочисленные промежуточные ферментативные стадии, т. е. происходит многократная передача протонов и электронов или только электронов от одного соединения-донора к другому-акцептору; при этом протоны транспортируются лишь частью промежуточных переносчиков. У аэробов конечным акцептором электронов и протонов служит кислород.
ИЗ ИСТОРИИ РАЗВИТИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ
Изучение процессов окисления в организме было начато в XVIII веке Лавуазье. Он обратил внимание на наличие известного сходства между процессами горения органических веществ вне организма и дыхания животных. Лавуазье считал, что сущность процесса дыхания состоит в соединении кислорода вдыхаемого воздуха с углеродом и водородом органических веществ внутри тела. После работ Лавуазье в науке в течение долгого времени господствовало мнение о тождестве явлений горения и медленного окисления питательных веществ в организме. Вместе с тем было ясно, что биологическое окисление протекает при весьма необычных условиях: при низкой температуре (температура тела), без появления пламени (как это бывает при горении) и, наконец, в присутствии воды, содержание которой обычно достигает в тканях 75-80%, от сырой массы.
Образующиеся высокомолекулярные перекиси отдают активированный кислород при участии ферментов (пероксидаз) субстрату.
Таким образом, по мнению А. Н. Баха, путь использования кислорода в клетках лежит через образование перекисей, поэтому данная теория получила название перекисной теории окисления. Однако истинный механизм главного пути окисления различных субстратов дыхания оказался иным.
Основные положения о механизме биологического окисления В. И. Палладии пояснил на примере окисления глюкозы:
Суммируя эти два уравнения, получим:
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ
В переносе электронов от субстратов к молекулярному кислороду принимают участие: 1) пиридинзависимые дегидрогеназы, для которых коферментами служат либо НАД, либо НАДФ; 2) флавинзависимые дегидрогеназы (флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН; 3) цитохромы, содержащие в качестве простетической группы железопорфириновую кольцевую систему. Среди компонентов дыхательной цепи обнаружены также убихинон (коэнзим Q) и белки, содержащие негемовое, или негеминовое, железо.
К числу пиридинзависимых дегидрогеназ относится свыше 150 ферментов, которые катализируют восстановление НАД и НАДФ различными органическими субстратами. Структура НАД была выяснена Эйлером и соавт. Варбургу принадлежит заслуга открытия НАДФ. НАД и НАДФ являются динуклеотидами, в которых мононуклеотиды связаны между собой через остатки фосфорной кислоты. В состав одного из нуклеотидов входит амид никотиновой кислоты (витамин РР), другой представляет собой адениловую кислоту. В молекуле НАДФ имеется еще один остаток фосфорной кислоты, присоединенный к рибозе в положении С3′.
Катализируемые пиридинзависимыми дегидрогеназами реакции можно изобразить так:
В клетках НАД-зависимые дегидрогеназы преимущественно участвуют в процессах, связанных с переносом электронов от органических субстратов к кислороду. В свою очередь НАДФ-зависимые дегидрогеназы играют существенную роль в реакциях биосинтеза (например, высших жирных кислот, сте-ринов и др.). В соответствии с этим коферменты НАД и НАДФ различаются по своей внутриклеточной локализации: НАД концентрируется главным образом в митохондриях, а бoльшая часть НАДФ находится в цитоплазме клеток.
Следующим акцептором атомов водорода является группа флавиновых ферментов, которые осуществляют перенос водородов (протонов и электронов) от восстановленных НАД или НАДФ:
В некоторых случаях (например, при окислении сукцината или жирных кислот) флавиновые ферменты могут играть роль первичных дегидрогеназ, т. е. прямо, без участия НАД- или НАДФ-зависимых дегидрогеназ, принимать электроны и протоны от окисляемых субстратов.
Насчитывается около 30 флавиновых ферментов. Это сложные белки, простетической группой которых, как уже отмечалось, являются либо ФМН, либо ФАД. ФМН и ФАД очень прочно, в отличие от коферментов НАД и НАДФ, присоединены к ферменту (точнее, к апоферменту) и не отщепляются от него ни на одной из стадий каталитического цикла.
Флавиновые дегидрогеназы, входящие в систему дыхательных катализаторов животных клеток, обычно содержат в качестве простетической группы не ФМН, а ФАД. Впервые ФМН и ФАД были выделены Варбургом в середине 30-х годов XX столетия. В это же время Куном был идентифицирован витамин B2 (рибофлавин), который входит в структуру ФАД и ФМН.
Окисленные формы ФМН и ФАД обладают характерным спектром поглощения с максимумом при 450 нм; в окисленном состоянии флавиновые ферменты окрашены в красный, коричневый или зеленый цвет. При восстановлении ФАД и ФМН полоса 450 нм в спектре поглощения исчезает. Активной частью молекулы ФАД или ФМН является изоаллоксазиновое кольцо рибофлавина, к атомам азота которого могут присоединяться два атома водорода, т. е. два электрона и два протона при соответствующей внутримолекулярной перегруппировке двойных связей.
Кофермент Q (убихинон)
Следующим компонентом дыхательной цепи является кофермент Q (KoQ), или убихинон. Этот кофермент впервые был описан Мортоном, который показал, что данное соединение имеет повсеместное распространение в клетках, и назвал его убихиноном. Позже было установлено, что убихинон, подобно НАД и ФАД, может играть роль промежуточного переносчика водородных атомов, т. е. электронов и протонов.
KoQ является производным бензохинона с длинной боковой цепью, которая в большинстве тканей млекопитающих состоит из 10 изопреноидных единиц (KoQ10).
Считают, что восстановленная форма флавиновых ферментов в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны) KoQ. Как всякий хинон, KoQ может существовать как в окисленной, так и восстановленной форме:
Приводим структуру простетических групп некоторых цитохромов:
Цитохромы отличаются друг от друга не только своими простетическими группами, но и белковыми компонентами. В ходе каталитического процесса валентность содержащегося в цитохромах железа обратимо изменяется (Fe 2+ Fe 3+ ).
Все цитохромы, особенно в восстановленной форме, имеют характерные спектры поглощения. Величины окислительно-восстановительного потенциала у разных цитохромов также неодинаковы (табл. 24). Например, для цитохрома «с» окислительно-восстановительный потенциал составляет +0,25 В, а для цитохрома «а» +0,29 В. Система 1/2O2/H2O имеет потенциал + 0,82 В. Таким образом, было выяснено, что звено цитохромов располагается в цепи окисления между убихиноном и кислородом; при этом цитохромы в цепь дыхательных катализаторов включаются в определенной последовательности:
В последнее время установлено, что цитохромоксидаза состоит из 6 субъединиц; каждая из них содержит геминовую группу и атом меди. По-видимому, две субъединицы из шести составляют цитохром а, а остальные четыре относятся к цитохрому а3.
| Таблица 24. Окислительно-восстановительные потенциалы некоторых систем дыхательной цепи (в изолированном состоянии, pH 7,0) | ||
| Восстановленная форма | Окисленная форма | Е ‘ 0, В |
| НАДН2 | НАДН | -0,32 |
| ФАДН2-белок | ФАД-белок | -0,05 |
| KoQ-Н2 | KoQ | +0,10 |
| Цитохром b (Fe 2+ ) | Цитохром b (Fe 3+ ) | +0,12 |
| Цитохром с1 (Fe 2+ ) | Цитохром с1 (Fe 3+ ) | +0,21 |
| Цитохром с (Fe 2+ ) | Цитохром с (Fe 3+ ) | +0,25 |
| Цитохром a (Fe 2+ ) | Цитохром a (Fe 3+ ) | +0,29 |
| Н2О | 1/2 O2 | +0,82 |
Как уже отмечалось, иногда цепь биологического окисления может быть укорочена. Имеются флавиновые ферменты, например сукцинатдегидрогеназа, которые способны отнимать водород непосредственно от субстрата. В ряде случаев цепь дыхательного катализатора может иметь еще более простое строение. Так, например, оксидазы L- и D-аминокислот (за исключением глутаматдегидрогеназы), ксантиноксидаза и некоторые другие ферменты катализируют окисление соответствующих субстратов без участия как НАД или НАДФ, так и цитохромов. Эти оксидазы по своей химической природе являются флавопротеидами.
3.2. Биологическое окисление.
Биологическое окислениеэто процесс окисления биологических веществ с выделением энергии.
Тканевое дыхание– процесс поглощения кислорода (О2) тканями при окислении органического субстрата с выделением углекислого газа (СО2) и воды (Н2О).
Главными источниками СО2является реакции декарбоксилирования пировиноградной и альфа-кетоглутаровой кислот. Еще один источник – это процесс декарбоксилирование аминокислот, который катализируется пиридоксаль-зависимыми ферментами.
Окислительное фосфорилированиеэто синтез АТФ сопряженный с тканевым дыханием.
Основным топливом при биологическом окислении является водород. Известно, что реакция окисление водорода кислородом в газовой среде сопровождается выделением большого количества энергии, сопровождаемым взрывом и пламенем. Эволюция живых организмов привела к тому, что реакция окисления водорода до воды оказалась разделенной на отдельные этапы, что обеспечивает постепенное высвобождение энергии в процессе биологического окисления. При этом часть полученной энергии рассеивается в виде тепла (около 60%) а другая часть (около 40%) аккумулируется в молекулах АТФ.
Макроэргические соединения– это вещества, содержащие богатые энергией связи.
Макроэргическая связь обозначается символом ∼(знак «тильда»). Понятие макроэргическая связь довольно условно и применяется для обозначения тех связей, которые гидролизуются в водной среде с выделением значительной энергии. Так, гидролиз концевой фосфоангидридной связи АТФ (АТФ + Н2О → АДФ + Фн), ведет к освобождению 34,5 кДж/моль энергии).
Однако если реакция протекает в неводной среде (например, в липидном слое мембран), то образование и разрушение АТФ протекает без больших затрат энергии.
История развития учения о биологическом окислении.
1. Теория активации кислорода (А.Н.Бах). Согласно этой теории непосредственным агентом, окисляющим субстрат является активированный кислород. Активация молекулярного кислорода осуществляется особыми ферментами оксигеназами и ведет к образованию реакционноспособных пероксидов, которые при участии ферментов пероксидаз и взаимодействуют с субстратом.
В дальнейшем оказалось, что действительно в клетках существует ферменты, способные активировать молекулярный кислород и использовать его для окисления ряда веществ. Существуют ферменты монооксигеназы, которые присоединяют к субстрату один атом кислорода (SH +1/2 O2 > SOH ) и диоксигеназы, которые присоединяют к субстрату 2 атома кислорода (S + O2 > SO2). Монооксигеназы и диоксигеназы катализируют реакции гидроксилирования стероидов, ксенобиотиков, образование простагландинов и лейкотриенов, но не принимают участия в процессах биологического окисления в митохондриях.
2.Теория активации водорода (Палладин, Украина). По этой теории, биологическое окисление может происходить путем дегидрирования субстрата и без участия кислорода, но при помощи коферментов – акцепторов водорода, т.е. окисление на первых этапах может происходить и в анаэробных условиях, а затем может идти при участии кислорода в аэробных условиях, в результате чего образуются молекулы воды.
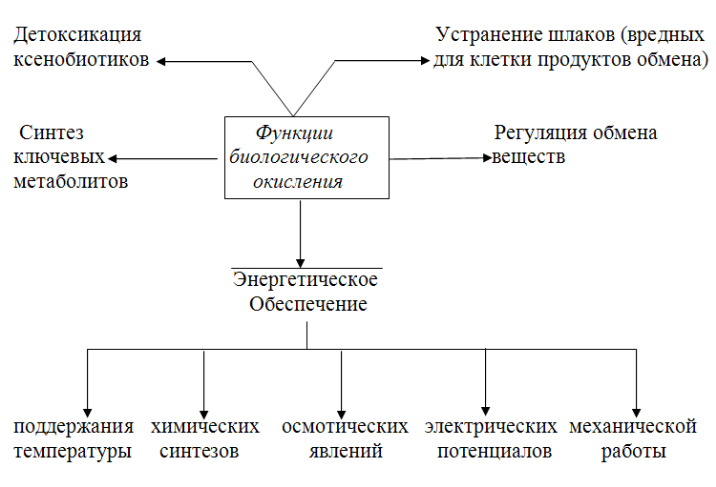
Таким образом, Основным генератором энергии для процессов жизнедеятельности служат реакции биологического окисления, т.е. окислительно-восстановительные реакции, протекающие во всех живых системах. Реакции биологического окисления в клетках выполняют следующие функции: 1) запасание энергии, утилизируемой в форме трансмембранного электрохимического потенциала (ΔμН+) или макроэргических связей АТФ; 2) рассеивание энергии в форме тепла; 3) образование полезных соединений; 4) расщепление вредных веществ (рис. 5).
Рис. 5. Функции биологического окисления
Биологическое окисление, происходящее в животном организме, по сути, является процессом, обратным фотосинтезу. В ходе этих реакций высокоэнергетические электроны, находящиеся в молекулах углеводов и других соединений, переходят на уровень с наименьшей энергией, связываясь с кислородом в молекуле воды. Энергия, отдаваемая ими при этом, идет на образование макроэргических фосфатных связей, в основном АТФ (сопряженное окисление). Сопряженное окисление – ведущее звено во всех изученных к настоящему времени биологических генераторах энергии. Только через систему сопряженных реакций осуществляется передача энергии к преобразующим устройствам клетки, специализированным на выполнении определенного вида биологической работы.
Кроме окисления, сопряженного с синтезом универсальной энергетической валюты – АТФ, в организме человека имеет место и несопряженное или свободное окисление (дыхание), при котором не происходит синтеза АТФ, а энергия, высвобождаемая в процессах окисления используется для: 1) пластических целей (синтез биологически активных соединений, например стероидных гормонов, катехоламинов, эйкозаноидов и других соединений), 2) обезвреживания токсичных продуктов обмена веществ и лекарственных препаратов (микросомальное окисление, пероксидазы), 3) участия в воспалительных и иммунных реакциях, апоптозе (перекисное окисление липидов (ПОЛ), миелопероксидаза), 4) теплопродукции (разобщение окисления и фосфорилирования).
Функции сопряженного и свободного окисления представлены в таблице 2.
Таблица 2. Функции сопряженного и свободного окисления
Генерация ΔμН+, исполь-зуемого для синтеза АТФ
Митохондриальная дыхательная цепь, окисляющая НАДН2и ФАДН2
Генерация ΔμН+, исполь-зуемого для синтеза АТФ, гидролизуемого актомиозином
Мышечная дрожь при охлаждении
Рассеивание образованного ΔμН+ благодаря действию разобщителей
Несократительный тер-могенез в скелетных мышцах и буром жире при охлаждении
Образование полезных веществ
Генерация ΔμН+ и образование АТФ для биосинтезов
Большинство биосинте-зов (углеводов, липидов, белков, биологически активных соединений и др.)
Образование полезных веществ
Перенос электронов по специализированным ды-хательным цепям
Цепи микросомального окисления в биосинтезе стероидных гормонов и др.
Удаление вредных веществ
Генерация ΔμН+ и образование АТФ для процессов детоксикации
Включение аммиака в цикл синтеза мочевины
Удаление вредных веществ
Перенос электронов по специализированным ды-хательным цепям
Дыхательная цепь эндо-плазматического ретикулума, окисляющая ксено-биотики
Образование и удаление вредных веществ
Образование и нейтрали-зация активных форм ки-слорода
Перекисное окисление липидов и антиоксидантная система
НАД – никотинамидадениндинуклеотид, НАДН2 – восстановленный кофермент
НАДГ– никотинамидные дегидрогеназы
Свободное окисление Свободное окисление, не сопряженное с фосфорилированием АДФ, не сопровождается трансформацией энергии, выделяющейся при окислении в энергию макроэргических связей. При свободном окислении высвобождающаяся при сопряженном с окислением распаде химических связей энергия переходит в тепловую и рассеивается. По типу свободного окисления идут все без исключения оксигеназные реакции, все окислительные реакции, ускоряемые пероксидазами или сопровождающиеся образованием Н2О2, многие реакции, катализируемые оксидазами. Процессы свободного окисления сосредоточены в цитозоле, в мембране эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов. Они идут также в ядерном аппарате клетки. Свободное окисление выполняет важные биологические функции, оно обеспечивает поддержание температуры тела на более высоком энергетическом уровне, чем температура окружающей среды. Биологическое окисление выполняет важную функцию модификации чужеродных соединений (ксенобиотиков). Окисление, сопряженное с фосфорилированием АДФ. Такой тип биологического окисления может осуществляться несколькими способами: – на уровне субстрата (субстратное фосфорилирование); сосредоточено в растворимой части клеток; – на уровне электронно-транспортной цепи (окислительное фосфорилирование); сопряжение идет на внутренних мембранах митохондрий. Механизм фотосинтетического и хемосинтетического фосфорилирования АДФ, сопровождающегося биосинтезом АТФ, близок к таковому при окислительном фосфорилировании в митохондриях. Примерами сопряжения окисления с фосфорилированием на уровне субстрата могут служить реакции окисления 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, 2-фосфоглицериновой кислоты – в 2-фосфоенолпировиноградную, -кетоглутаровой кислоты – в янтарную. Однако посредством реакций субстратного фосфорилирования образуется сравнительно небольшое количество АТФ. Главная масса АТФ у аэробных организмов синтезируется путем окислительного фосфорилирования в митохондриях.
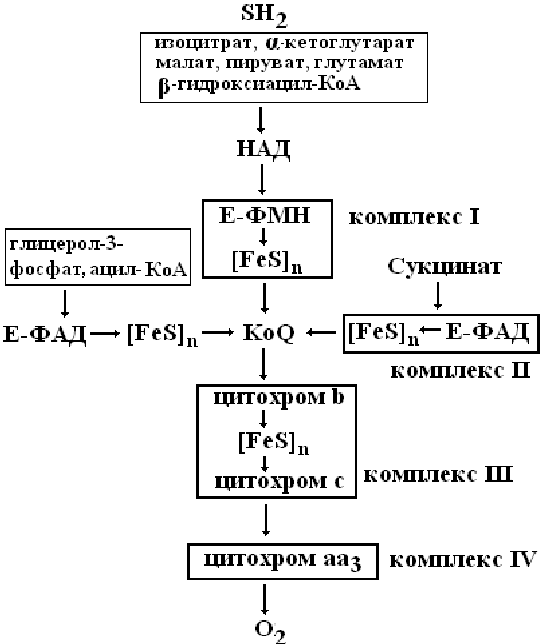
Дыхательня цепь – это система ферментов и коферментов, которые принимают участие в транспорте электронов и протонов от окисляемого субстрата к кислороду. Дыхательная цепь включает: а) ферменты: НАД- или ФМН(ФАД)-зависимые дегидрогеназы; цитохромы (гемопротеины,
(комплексы), связанные между собой убихиноном (КоQ) и цитохромом с. Процесс начинается с переноса протонов и электронов от окисляемого субстрата на коферменты НАД или ФАД. Последнеее определяется тем, является ли дегидрогеназа, катализирующая первую стадию, НАД-зависимой или ФАД-зависимой. Но каким содержащие простетическую группу гем); б) коферменты: НАД, ФМН, КоQ, гем. в) електронотранспортные белки (железосерные белки).
Все участники этой цепи разделены на четыре окислительно-восстановительные системы бы ни был исходный субстрат, электроны и протоны от флавинов переносятся к коферменту Q, после которого пути электронов и протонов расходятся: электроны далее транспортируются по цепи цитохромов, а протоны переносятся из матрикса в межмембранное пространство.
Состав комплексов дыхательной цепи:
I комплекс – НАД.Н–коэнзим Q–оксидоредуктаза. Включает ключевой фермент НАДН-дегидрогеназа и 5 железо-серных кластеров (железосерные белки). Благодаря НАДН-дегидрогеназе (кофермент ФМН) и железосерным белкам комплекс I катализирует перенос атомов водорода и электронов к коэнзиму Q.
II комплекс (сукцинатдегидрогеназный (СДГ). Включает ФАД-зависимую сукцинатдегидрогеназу, железосерные белки и катализирует перенос электронов от сукци-
ната на коэнзим Q. Коэнзим Q является коллектором электронов и атомов водорода не только от I и II комплексов, но также и от ФАД-зависимых ферментов бета-окисления жирных кислот и других дегидрогеназ.
III комплекс – КоQ.Н2-цитохром-С-оксидоредуктаза. Включает цитохромы b и c и один железосерный белок. Комплекс осуществляет перенос электронов от восстановленной формы коэнзима Q к цитохрому с.
QН2 + цитохром с (Fe 3+ ) Q + цитохром с (Fe 2+ ) + 2H +
IV комплекс – (цитохромоксидаза). Включает 2 цитохрома (а и а3), (которые обозначаются как цитохромоксидаза), которые содержат 2 атома меди (медь также способна переносит электроны Cu 1+ Cu 2+ ). Цитохромоксидаза катализирует конечную реакцию биологического окисления – восстановление 2 электронами кислорода и образование воды.
2е- + 1/2О2 О2-; 2Н+ О 2- Н2О
Поглощенный клеткой кислород в основном (до 80-90%) используется для производства энергии в митохондриях. Однако, кислород используется и на другие цели – для синтеза стероидов, простагландинов, лейкотриенов, тирозина, катехоламинов, для метаболизма чужеродных веществ и т.д.. При этом часть поглощенного тканями кислорода не ферментативным путем или при участии монооксигеназ способна превращаться в активные формы (супероксидный, гидроксильный. пероксильный радикалы, синглетный кислород, пероксид водорода, органическое пероксиды)
Например, в митохондриях около 8% кислорода может превращаться в активные формы, поскольку ФМНН2 способен отдавать электороны не только на убихинон, но и непосредственно на молекулу кислорода, превращая его в супероксидный радикал. Супероксидный радикал и пероксид водорода, образуется также и под влиянием ксантиноксидазы, монооаминоксидазы, НАДФН-оксидазы, цитохрома Р450 и т.д. Супероксидный радикал при участии фермента супероксиддисмутазы превращается в пероксид водорода (Н2О2), а последний разрушается до воды каталазой и пероксидазой, глутатионпероксидазой). Ферменты обезвреживающие активные формы кислорода называются антиоксидантными, поскольку они защищают клетку от окислительного повреждения.
В клетках существуют специальные системы обезвреживания токсичных кислородных радикалов, в частности ферментные: супероксиддисмутаза, катализирующая превращение супероксида в перекись водорода, каталазаи пероксидазы, катализирующие реакции, в которых перекись водорода восстанавливается до воды. К наиболее реакционноспособным и поэтому наиболее опасным радикалам кислорода относится гидроксильный радикал •ОН — один из основных повреждающих факторов при действии на живойорганизм.
Ферменты обезвреживающие активные формы кислорода называются антиоксидантными, поскольку они защищают клетку от окислительного повреждения.
H2O2 + 2G-SH > H2O + G-S-S-G (глутатионпероксидаза)
Ферменты, катализирующие окислительно-восстановительные реакции, называют оксидоредуктазами. Согласно международной классификации и номенклатуре ферментовоксидоредуктазы относятся к1 классу, в пределах которого выделяют двадцать два подкласса:
Их разделяют на 5 групп.
1. Оксидазы. Они катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород.
Оксидазы содержат медь, продуктом реакции является вода. Широко распространена в растительных животных тканях цитохромоксидаза (цитохром аа3). Она служит конечным компонентом цепи дыхательных переносчиков, локализованных в митохондриях, и катализирует реакцию, в результате которой электроны, высвобождающиеся из молекул субстрата при их окислении дегидрогеназами, переносятся на кислород.
Фенолаза катализирует превращение монофенола в о-фенол; уриказа катализирует окисление мочевой кислоты в аллантоин; моноаминоксидаза окисляет адреналин и тиамин в митохондриях.
2. Аэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата они переносят водород непосредственно на молекулярный кислород и в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие как метиленовый синий.
Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода. Аэробные дегидрогеназы содержат в качестве простетической группы флавинмононкулеотид (ФМН) или флавнадениндинуклеотид (ФАД). (ФМН) и (ФАД) образуются в организме из рибофлавина (витамин В2). Многие флавопротеиновые ферменты содержат один или несколько ионов металлов, выполняющих роль кофакторов; такие флавопротеиновые ферменты называют флавопротеинами.
К ферментам группы аэробных дегидрогеназ относятся также дегидрогеназа L-аминокислот(ФМН-содержащий фермент), катализирующая окислительное дезаминирование природных L-аминокислот. Широко распространена ксантиндегидрогеназа (ксантиноксидаза), она обнаружена в молоке, тонком кишечнике, почках и печени. Ксантиндегидрогеназа содержит молибден; играет важную роль в превращении пуриновых оснований в мочевую кислоту и особое значение имеет в печени и в почках птиц, которые экскретируют мочевую кислоту как главный конечный азотофиксирующий продукт метаболизма пуринов, а также катаболизма белков и аминокислот.
Альдегиддегидрогеназа – FAD-содержащий фермент, находящийся в печени млекопитающих. Это – металлофлавопротеин, содержащий молибден и негемовое железо, окисляющий альдегиды и N-гетероциклические субстраты. Глюкозооксидаза – FAD-специфичный фермент, получаемый из грибов; используется при определении глюкозы.
3. Анаэробные дегидрогеназы – ферменты, катализирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода.
Эти ферменты выполняют две главные функции:
а) Перенос водорода с одного субстрата на другой в сопряженной окислительно-восстановительной реакции. Эти дегидрогеназы специфичны к субстратам, но часто используют один и тот же кофермент или переносчик водорода.
б) Функцию компонентов дыхательной цепи, обеспечивающих транспорт электоронов от субстрата на кислород.
Среди анаэробных дегидрогеназ различают дегидрогеназы, зависимые от никотинамидных коферментов, рибофлавиновые дегидрогеназы, цитохромы. NAD-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции окислительных путей метаболизма – гликолиза, цикла лимонной кислоты, дыхательной цепи митохондрий. NADP-зависимые дегидрогеназы участвуют в процессах восстановительного синтеза, в частности, во внемитохондриальном синтезе жирных кислот и стероидов; они также являются коферментами дегидрогеназ пентозофосфатного пути.
Большинство раибофлавин-зависимых аэробных дегидрогеназ либо участвуют в транспорте электронов по дыхательной цепи, либо поставляют электроны для этой цепи. NADН-дегидрогеназа – компонент дыхательной цепи, переносящий электроны от NADH к более электроположительным компонентам. Другие дегидрогеназы, например, сукцинатдегидрогеназа, ацил-СоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа, переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь.
Цитохромы служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b5 ), в растительных клетках, бактериях и дрожжах.
4. Гидроксипероксидазы – ферменты, использующие в качестве субстрата перекись водорода или органические перекиси. К этой категории относятся два типа ферментов: пероксидазы, находящиеся в составе молока, в растениях, лейкоцитах, тромбоцитах, эритроцитах и т. д., и каталаза, функционирующая в тканях животных и растений.
5. Оксигеназы – катализирующие прямое введение кислорода в молекулу субстрата. Оксигеназы не относятся к ферментам, катализирующим реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов. Ферменты этой группы делятся на две подгруппы:
а) Диоксигеназы (кислород-трансферазы, истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
Примером служат железосерные ферменты гомогентизатдиоксигеназа и 3-гидроксиантранилат-диоксигеназа, а также гемсодержащие ферменты, в частности L-триптофандиоксигеназа (триптофанпирролаза).
б) Монооксигеназы (оксидаза со смешанной функцией, гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для этой цели необходим дополнительный донор электронов (косубстрат):
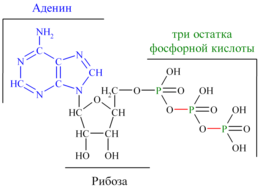
3.3. Аденозинтрифосфорная кислота (АТФ), особенности ее химического строения, биологическая роль. Аденозинтрифосфа́т (сокр. АТФ, англ.АТР) C10H16N5O13P3 – нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. АТФ был открыт в1929 годуКарлом Ломанном, а в1941 годуФриц Липманпоказал, что АТФ является основным переносчиком энергии в клетке.
Структура аденозинтрифосфорной кислоты
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, пригидролизекоторых происходит освобождение значительного количества энергии. Гидролиз макроэргических связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60кДж/моль.
Высвобожденная энергия используется в разнообразных процессах, протекающих с затратой энергии.
Роль в организме. Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекулчерезбиологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществлениямышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата— вторичного посредника передачи в клеткугормональногосигнала.
Также известна роль АТФ в качестве медиаторавсинапсах.
Пути синтеза. В организме АТФ синтезируется путём фосфорилирования АДФ:
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилированиеиокислительное фосфорилирование(используя энергию окисляющихся веществ). Основная масса АТФ образуется на мембранахмитохондрийв ходе окислительного фосфорилированияH-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в процессегликолизаили путём переноса фосфатной группы с другихмакроэргических соединений.
Субстратное фосфорилирование является ведущим при гипоксии, протекает как в матриксе митохондрий, так и в цитоплазме клеток. При этом энергия окисления субстрата, накапливаемая в виде макроэргической связи, переносится на адениловую кислоту, образуя АТФ в реакциях перефосфорилирования (деацилирования), катализируемых специфическими киназами (фосфоглицераткиназа, пируваткиназа, сукцинил-SКоА-тиокиназа и др.).
В отличие от окислительного фосфорилирования, сопряженного с переносом электронов, при субстратном фосфорилировании донором активированной фосфорильной группы (
РО3Н2), необходимой для регенерации АТФ, являются промежуточные метаболиты гликолиза (1,3-бисфосфоглицерат, фосфоенолпиру-ват) и цикла трикарбоновых кислот (сукцинил-КоА). Во всех этих случаях окислительные процессы приводят к образованию высокоэнергетических соединений, которые при участии соответствующих ферментов способны фосфорилировать АДФ с образованием АТФ.
1,3-Бисфосфоглицерат + АДФ 3-Фосфоглицерат + АТФ
Фосфоенолпируват + АДФ Пируват + АТФ
Сукцинил-КоА + ГДФ + Фн Сукцинат + ГТФ + HSKoA
Важным обстоятельством является то, что трансформация энергии на уровне субстрата является единственным путем синтеза АТФ в анаэробных организмах. В организме человека этот процесс синтеза АТФ позволяет поддерживать
Окислительное фосфорилирование – это процесс синтеза АТФ из АДФ и неорганического фосфата, сопряженный с транспортом электронов по дыхательной цепи к кислороду. Этот процесс может быть разделен на три части:
1. биохимические реакции, генерирующие электроны с высоким уровнем энергии (НАДН2 или ФАДН2), так называемое первичное окисление;
2. мембранная система транспорта электронов, которая позволяет превращать энергию высокоэнергетических электронов в энергию электрохимического протонного градиента (терминальное окисление);
3. АТФ-синтетаза (Н+-зависимая аденозинтрифосфатаза), которая использует протонный градиент для производства АТФ.
Следует заметить, что окислительное фосфорилирование служит основным источником энергии в клетках. Следовательно, дефекты на любом этапе этого пути могут приводить к нарушению функции клеток, и в первую очередь, работы мышц и головного мозга.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
К первому принадлежат креатинфосфокиназная и миокиназная реакция, гликолитическое фосфорилирование и восстановительное образование сукцината (фермента). Ко вторым – субстратное и медиаторное дыхательное фосфорилирование. Анаэробные и аэробные возможности полностью характеризуют функциональный «потолок» организма – его общий энергетический потенциал, находящийся в тесной зависимости от генетических факторов
В организме АТФ является одним из самых часто обновляемых веществ, так у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.