какое координационное число характерно для ионов натрия в структуре поваренной соли
Какое координационное число характерно для ионов натрия в структуре поваренной соли
Силы притяжения между ионами значительны и поэтому, привести их в движение, то есть расплавить требуется t˚ = 800˚ C, а температура кипения составляет 1413˚С.
Если кристаллик поваренной соли попадает в воду, то он быстро растворяется. Ионы Na + и Cl — легко разъединяются между собой. В этом им помогают молекулы воды (диполи), несущие на своей поверхности положительные и отрицательные заряды.
Диполи воды ориентируются около ионов Na + и Cl — на поверхности кристаллов своими зарядами и разрушают ионные связи в кристалле. Ионы Na + и Cl — переходят в раствор, окруженные диполями воды, то есть становятся гидратированными ионами.
Освободиться от молекул воды ионам Na + и Cl — можно лишь только в процессе кристаллизации, но и то это трудно. Каждый замечает, что если бросить на горячую сковороду кристаллы соли, то они трещат и разрываются, это вскипающая в них вода (она образует в кристаллах полости) разрывает кристаллы.
Доказать, что в состав хлорида натрия входят ионы Na + и Cl — можно с помощью опытов:
• Ионы Na + окрашивают пламя в желтый цвет
• Ионы Cl — образуют с ионами серебра Ag + (р-ра нитрата серебра AgNO3) белый творожистый осадок.
Природная соль (галит) редко бывает чисто белого цвета. Она бывает окрашена в буроватый или желтоватый цвет из-за примесей соединений железа. Встречаются, но очень редко, кристаллы галита голубого, синего, фиолетовых цветов. В этом случае окраска обусловлена наличием следов металлического натрия. Металлический натрий образуется в соли под действием радиоактивного излучения, если есть присутствие радиоактивных элементов.
Поваренная соль также встречается в природе в виде кристаллов красного цвета. Виновником такой окраски являются микроорганизмы – галофилы (любители соли). Они придают соли и приятный аромат. В низовьях Волги есть озеро Розовое, Красное, Малиновское, где можно встретить такую красную соль. Чистая поваренная соль, или хлорид натрия NaCl — бесцветное негигроскопичное (не поглощающее влагу из воздуха) кристаллическое вещество.
Процесс образования соляных залежей
В земной коре и на ее поверхности наряду с залежами различных не растворимых в воде минералов находятся залежи растворимых минералов — солей, встречающихся как в виде твердых отложений, так и в виде растворов. Соляные месторождения — это остатки высохшего древнего океана. Соляные пласты могут располагаться и под землей (глубина их залегания может достигать) более 1 км, и на поверхности — в этом случае они часто образуют соляные озера. Эти залежи возникали на протяжении многих геологических периодов жизни земли, когда создавались благоприятные для их появления геохимические, гидрогеологические и климатические условия. Источником этих залежей является морская вода, из солей которой образовались и месторождения ископаемых солей, и соляные озера, и подземные рассолы. При испарении морской воды, проникавшей в бессточные котловины, концентрация солей постепенно повышалась. Из насыщенных рассолов кристаллизовались соли, образовавшие в течение длительного времени мощные напластования. Часто испарение воды происходило при последовательном перемещении через несколько котловин с ограниченным стоком, что приводило к образованию солевых залежей различного состава, соответствующих составу солей, выделявшихся в разных стадиях испарения. Солеотложение продолжалось и в зимние периоды, при понижении температуры рассолов, что также приводило к изменению состава кристаллических фаз.
Концентрация и соотношение солей в воде мирового океана в разные геологические эпохи не остается неизменным. К изменению состава первичных соляных отложений и к образованию вторичных месторождений приводит размывание уже образовавшихся первичных залежей грунтовыми водами и рассолами. Существенную роль в этих процессах играют химические взаимодействия растворов с окружающими их материковыми породами. Наконец, значительное влияние на формирование солевых залежей и на последующие изменения их оказывают тектонические явления.
Все эти процессы, продолжающиеся и в настоящее время, приводят к образованию многочисленных месторождений растворимых солей — соляных озер и их донных отложений, подземных скоплений рассолов и мощных твердых залежей, которые состоят из покрывающих друг друга солевых пластов различного состава. Вследствие осадочного происхождения твердые солевые отложения, находящиеся в геологически не нарушенных районах, залегают в виде пологих пластов разной толщины, измеряемой десятками и сотнями метров и распространяющихся на значительных пространствах.
Хлорид натрия находится в природе уже в готовом виде. Но особенно его много в морской воде и в соленых озерах, в больших массах он встречается в виде твердой каменной соли. Подсчитано, что в морской воде всех морей и океанов содержится приблизительно 50•10 15 тонн различных солей. Эта соль могла бы покрыть весь земной шар пластом толщиной в 45м. На долю поваренной соли приходится большая часть. В одном литре океанской воды содержится около 26-30 г. поваренной соли. В закрытых морях, куда впадают крупные реки соленость меньше (Черное, Каспийское), в морях же Красном, Средиземном, Персидском соленость выше среднеокеанической, т.к. мало выпадает осадков и нет притока пресной воды, а также значительное испарение. В приполярных областях соленость воды больше, т.к. образующиеся льды содержат в себе мало солей. Таким образом, соленость морской воды зависит от испарения, таяния и образования льдов, осадков и притока пресных вод с суши.
Огромные подземные горы каменной соли находятся на Прикаспийской низменности, в отрогах Урала, в горах средней Азии. В Таджикистане находятся самые высокие соляные купола, один из которых поднимается на высоту 900 метров.
Подробнее с текущей ситуацией и прогнозом развития российского рынка поваренной соли можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков « Рынок поваренной соли в России ».
Урок №15. Комплексные соединения
Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Координационное число зависит:
от природы центрального атома;
условий образования комплексов.
Виды комплексов
Соединения с комплексными анионами
Соединения с комплексными катионами
[Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
[Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия
[Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
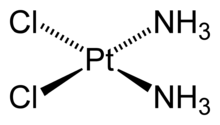
[Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II)
[Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III)
Номенклатура
в названиях комплексных ионов сначала указываются лиганды;
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
в названиях комплексных катионов используются русские названия металлов;
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
Ионная связь
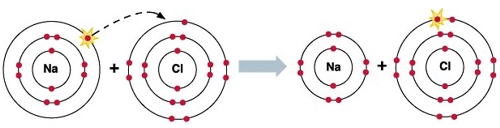
Как видим, натрий имеет один валентный электрон, который он «согласен» отдать, чтобы его энергетические уровни стали завершенными.
Как видим, хлор имеет 7 валентных электронов и ему «не хватает» одного электрона, чтобы его энергетические уровни стали завершенными.
Теперь догадываетесь, почему так «дружны» атомы хлора и натрия?
| Главный закон химической реакции — заполнение валентного энергетического уровня |
Натрий: Na
Электронная конфигурация катиона натрия: Na + 1s 2 2s 2 2p 6
Хлор: Cl
Поваренная соль (хлорид натрия): NaCl
Исходя из вышесказанного, видно, что электрон, который отдает натрий, становится электроном, который получает хлор.
В кристаллической решетке хлорида натрия каждый катион натрия окружен шестью анионами хлора. И наоборот, каждый анион хлора окружен шестью катионами натрия.
Соединения с ионными связями называют солями. В твердом состоянии все ионные соединения являются кристаллическими веществами.
| Ионная связь — химическая связь между катионами и анионами (заряженными частицами, в которые превращаются атомы после отдачи или присоединения электронов). |
Чтобы не «обижать» ионные соединения, химики договорились считать, что химическая связь является ионной, если разность электроотрицательностей атомов, образующих молекулу вещества равна или более 2. (см. понятие электроотрицательности).
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA | Литий Натрий Калий | Катион лития Катион натрия Катион калия | Li + Na + K + |
| IIA | Бериллий Магний Кальций Стронций Барий | Катион бериллия Катион магния Катион кальция Катион стронция Катион бария | Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+ |
| IB | Серебро | Катион серебра | Ag + |
| IIB | Цинк | Катион цинка | Zn 2+ |
| IIIB | Алюминий | Катион алюминия | Al 3+ |
Распространенные одноатомные анионы
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Примеры многоатомных ионов:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Какое координационное число характерно для ионов натрия в структуре поваренной соли
§3.9 Кристаллические решетки.
Например, в металлическом кристалле натрия (повторяем здесь рис. 3-13 из предыдущего параграфа) каждый ион натрия окружен восемью ближайшими соседями – на рисунке это особенно хорошо видно по атому, который помещен в центр куба. Но в металле все атомы натрия равноценны и имеют одинаковое окружение. Таким образом, координационное число натрия в металлическом кристалле равно 8.
Точно такое же координационное число у ионов цезия и хлора в кристалле CsCl. Кристалл CsCl построен как бы из вложенных друг в друга кубиков двух разных сортов. Например, можно нарисовать кубик с вершинами из ионов цезия, и тогда в центре окажется ион хлора (как на рис. 3-20). Но если вы представите 8 ионов хлора и мысленно соедините их линиями, то получится кубик с вершинами из ионов хлора, в центре которого окажется ион цезия.
Рис. 3-20. Строение кристалла хлористого цезия CsCl. Координационное число 8 по цезию и по хлору.
Чтобы правильно нарисовать элементарную ячейку, надо поместить в ее центр любую частицу и расположить вокруг нее только ближайшие соседние частицы в соответствии с координационным числом. Неопытный химик (но не мы!) при рассматривании элементарной ячейки кристалла CsCl (рис. 3-20) может прийти к выводу, что в соединении на один атом хлора приходится 8 атомов цезия (или наоборот, если нарисовать ячейку с атомом цезия в середине). Но мы с вами знаем, что это не так: в соединении CsCl соотношение цезия и хлора 1:1, а элементарная ячейка служит для описания структурных особенностей кристалла, а не состава соединения.
Рис. 3-21. Элементарная ячейка кристалла NaCl. Координационное число 6 по натрию и по хлору.
Элементарной ячейке NaCl соответствует гранецентрированная кубическая упаковка, а рассмотренной выше ячейке кристалла CsCl – объемноцентрированная кубическая упаковка. Названия упаковок говорят сами за себя: у гранецентрированной есть частица в центре каждой грани куба, а у объемноцентрированной – частица находится в центре куба.
Мир кристаллов настолько красив, что даже обычно сдержанные ученые-химики иногда описывают его не сухим языком научных статей, а скорее поэтическими категориями. Посмотрите, с каким восхищением пишет о строении кристаллов норвежский химик Юхан Фогт:
«Представьте себе двести замечательных скрипачей, играющих одну и ту же пьесу на прекрасно настроенных инструментах, но не в унисон. Результат будет не из приятных, и даже человек с хорошим слухом не поймет, что они играют. Аналогичную музыку издают молекулы газов, жидкостей и обычных твердых тел. В отличие от этого кристалл подобен оркестру, руководимому блестящим дирижером; за движениями дирижера следят глаза всех музыкантов, и все смычки повинуются каждому мановению его руки. Для меня музыка физических законов звучит самым полным и сильным аккордом именно в области науки о кристаллах».
Вы можете посетить удивительно красивые коллекции Минералогического музея РАН им. Ферсмана.
Координационное число
Координационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле.
Содержание
Координационное число в химии
Например, в комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe 3+ равно 6, а в цис-дихлородиамминплатине (II) (соли Пейроне) Pt(NH3)2Cl2 центральный атом платины связан с четырьмя лигандами.
Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным.
Координационное число в кристаллографии
В кристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке. Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом.
В решётках Браве для всех узлов координационное число одинаково. Число ближайших соседей отражает плотность упаковки вещества. Чем больше координационное число, тем больше плотность и соответственно свойства вещества ближе к металлическим. Данному параметру решетки соответствует первая, вторая (соседи, следующие за ближайшими), третья и т. д. координационные группы частиц.
Для простой кубической решетки координационное число равно шести, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
См. также
Источники
Примечания
Полезное
Смотреть что такое «Координационное число» в других словарях:
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому соседних атомов в кристаллической решётке (атомной структуре кристалла) или молекул в молекулярных кристаллах. Если центры этих ближайших соседей соединить друг с другом прямыми линиями, то получится плоская фигура … Физическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии.2) В химии число лигандов, связанных с центральным ионом в комплексных соединениях … Большой Энциклопедический словарь
КООРДИНАЦИОННОЕ ЧИСЛО — одно из основных понятий кристаллохимии, означающее число атомов или ионов, окружающих любой атом или ион на ближайшем расстоянии, или в первой сфере. В гольдшмидто паулинговской кристаллохимии считалось, что К.ч. определяется соотношением… … Геологическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому (иону) соседних атомов (ионов) в кристаллической решетке. В титаномагнетите, например, у катионов в тетраэдрических узлах подрешетки А координационное число – 4, в октаэдрических узлах подрешетки В – 6. Существуют… … Палеомагнитология, петромагнитология и геология. Словарь-справочник.
координационное число — – число лигандов, непосредственно связанных с комплексообразователем, определяемое числом свободных орбиталей в центральном атоме. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
координационное число — (напр. атомов) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN cooordinate numberCNcoordination number … Справочник технического переводчика
координационное число — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии. 2) В химии число лигандов, связанных с центральных ионом в комплексных соединениях. * * *… … Энциклопедический словарь
координационное число — [coordination number] число ближайших соседних атомов, окружающих на равных расстояниях данный атом. Металлы с ГЦК и ГПУ решеткой имеют координационное число = 12. У металлов с ОЦК решеткой координационное число = 8; Смотри также: Число число… … Энциклопедический словарь по металлургии
координационное число — (см. координация) 1) физ. число ближайших к данному атому или иону соседних атомов или ионов в кристалле (наибольшее координационное число равно 12); 2) хим. число атомов (групп атомов) или ионов, связанных хим. связью с центральным атомом в… … Словарь иностранных слов русского языка
координационное число — koordinacijos skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų ar atomų grupių, tiesiogiai prisijungusių prie atomo, skaičius kompleksiniame junginyje. atitikmenys: angl. coordination number vok. Koordinationszahl, f rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas