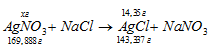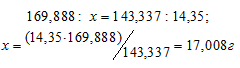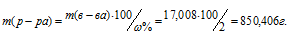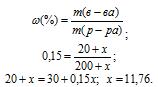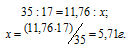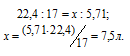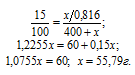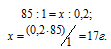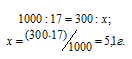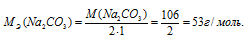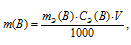какое количество нитрата натрия по массе надо взять для приготовления 300 мл 0 2м раствора
Рассчеты, связанные с приготовлением растворов
Задача 411.
Сколько граммов 2%-ного (по массе) раствора AgNO3 дадут при взаимодействии с избытком NaCl 14,35г осадка?
Решение:
М(AgNO3) = 169,888г/моль; М(AgCl) = 143,337г/моль.
Уравнение реакции имеет вид:
Рассчитаем массу AgNO3, необходимую для получения 14,35г AgCl из пропорции:
Массу 2%-ного раствора AgNO3 рассчитаем по уравнению:

Отсюда масса раствора равна:
Ответ: 850,406г.
m(NH4OH) = 20 + x; m() = 200 + x; 
Отсюда находим x по формуле:
Массу NH3, содержащуюся в11,76г NH4OH находим из пропорции:
Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает объём равный 22,4л. Объём, который занимает NH3 массой 5,71г, находим из пропорции:
Ответ: 7,5л.
Задача 413.
Сколько граммов SO3 надо растворить в 400г Н2О, чтобы получить 15%-ный (по массе) раствор Н2SO4?
Решение:
В молекуле Н2SO4 масса SO3 и Н2SO4 связаны друг с другом соотношением:
M(SO3) = 
где


Обозначим массу SO3 через х, а массу Н2SO4, соответственно, можно обозначить как x/0,816, массу полученного раствора – как (400 + х).
Для расчета х используем формулу:

Ответ: 55,79г.
Задача 414.
Найти массу NaNO3, необходимую для приготовления 300 мл 0,2М раствора.
Решение:
М(NaNO3) = 85г/моль. Массу NaNO3, содержащуюся в 0,2 М находим из пропорции:
Массу NaNO3, необходимую для приготовления 300мл 0,2 М раствора находим из пропорции:
Ответ: 5,1г.
Задача 415.
Сколько граммов Na2CO3 содержится в 500 мл 0,25 н. раствора?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:
Массу соли Na2CO3, содержащуюся в 500мл 0,25н раствора, находим по формуле:
Концентрация раствора
Весовая процентная концентрация показывает, какой процент от общего веса раствора составляет растворенное вещество.
■ 18. Сколько нитрата калия нужно взять для приготовления 300 г 2% раствора соли?
19? Сколько воды и сахара требуется для приготовления 250 г 10% раствора?
20. Сколько хлорида бария потребуется для приготовления 50 г 0,5% раствора? (См. Ответ)
В лабораторной практике часто приходится иметь дело с кристаллогидратами — солями, содержащими кристаллизационную воду, например CuSО4 ·5H2O, FeSО4 · 7H2О и т. д. В этом случае следует уметь учитывать кристаллизационную воду.
■ 21. Сколько кристаллогидрата Na2SO4 · 10H2O понадобится для приготовления 2 кг 34 раствора Na2SО4?
22. Сколько кристаллогидрата железного купороса FeSO4·7H2O потребуется для приготовления 30 кг 0,5% раствора FeSO4?
23. Сколько кристаллогидрата CaCl2 · 6H2O потребуется для приготовления 500 г 10% раствора СаСl2?
24. Сколько кристаллогидрата ZnSO4· 7H2O потребуется для приготовления 400 г 0,1 % раствора ZuSО4? (См. Ответ)
Иногда приходится приготовлять растворы определенной процентной концентрации, пользуясь для этого другими, более концентрированными растворами. Особенно часто с этим приходится сталкиваться в лаборатории при получении растворов кислот разной концентрации.
■ 25. Сколько потребуется 80% фосфорной кислоты для приготовления 2 кг 5% раствора?
26. Сколько потребуется 20% щелочи для приготовления 5 кг. 1 % раствора?
27. Сколько потребуется 15% азотной кислоты для приготовления 700 г 5% раствора?
28. Сколько потребуется 40% серной кислоты для приготовления 4 кг 2% раствора?
29. Сколько потребуется 10% соляной кислоты для приготовления 500 г 0,5% раствора? (См. Ответ)
Однако произвести правильный расчет — это для лаборанта еще не все. Нужно уметь не только рассчитать, но и приготовить раствор кислоты. Но кислоты нельзя взвешивать на весах, их можно только отмерять при помощи мерной посуды. Мерная же посуда предназначена для измерений объема, а не веса. Поэтому нужно суметь вычислить объем найденного количества раствора. Этого нельзя сделать, не зная удельного веса (плотности) раствора.
Обратимся снова к примеру 3, приведен ному на стр 67. Из таблицы (приложение III, п. 3, стр. 394) видно, что 80% серная кислота имеет плотность d=1,7, а масса раствора Р =25 г. Следовательно, по формуле
V = P : d находим: V = 25 : 1,7 = 14,7 мл.
Плотность воды практически считаем равной единице. Следовательно, 175 г воды займут объем 175 мл. Таким образом, чтобы приготовить 200 г 10% раствора из 80% серной кислоты, следует взять 175 мл воды и налить в нее 14,7 мл 80% серной кислоты. Смешивание можно производить в любой химической посуде.
■ 30. Сколько миллилитров 50% серной кислоты следует взять для приготовления 2 кг 10% раствора этой кислоты?
31. Сколько миллилитров 40% серной кислоты следует взять для приготовления 5 л 4% серной кислоты?
32. Сколько миллилитров 34% едкого кали потребуется для приготовления 10 л 10% раствора?
33. Сколько миллилитров 30% соляной кислоты потребуется для приготовления 500 мл 2% соляной кислоты? (См. Ответ)
Примеры расчетов, которые мы разбирали до сих пор, были посвящены определению веса или объема раствора, а также количества вещества, содержащегося в нем. Однако бывают случаи, когда нужно определить концентрацию раствора. Рассмотрим простейший случай.
■ 34 Смешано 25 г соли и 35 г воды. Какова процентная концентрация раствора?
35. Смешано 5 г кислоты и 75 г воды. Какова процентная концентрация раствора? (См. Ответ)
Довольно часто приходится разбавлять, упаривать и смешивать растворы, после чего определять их концентрацию.
■ 36. К 2 кг 20% раствора прилили 500 г воды. Какой стала концентрация раствора?
37. К 5 а 36% соляной кислоты прилили 1 л воды. Какой стала концентрация раствора?
38. Смешали 40 кг 2% и 10 кг 3% растворов одного и того же вещества. Какой стала концентрация полученного раствора?
39. Смешали 4 л 28% серной кислоты и 500 мл 60% серной кислоты. Какова концентрация полученного раствора?
40. 3 кг 20% раствора едкого натра упарили до 2 кг. Какова концентрация полученного раствора?
41. Сколько воды нужно прибавить к 500 мл 30% раствора (плотность 1,224 г/см 3 ), чтобы получить 5% раствор? (См. Ответ)
Для определения, в каком соотношении следует смешать растворы разных концентраций, чтобы получить раствор искомой концентрации, можно применять так называемое «правило смешивания», или «диагональную
схему»
■ 42. Рассчитайте по диагональной схеме, в каком соотношении следует смешать растворы:
а) 20% и 3% для получения 10%;
б) 70% и 17% для получения 25%;
в) 25% и воду для получения 6% (См. Ответ)
Объемная концентрация растворов. Молярная концентрация
При определении объемной концентрации растворов расчеты производят применительно к 1 л раствора. Молярная концентрация, например, показывает сколько грамм-молекул (молей) растворенного вещества содержится в 1 л раствора.
Если вы не помните, что такое грамм-молекула, обратитесь к приложению на стр. 374.
Например, если в 1л раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1 М), если 2 моля, то двумолярным(2 М), если 0,1 моля, тo раствор децимолярный (0,1 М), если 0,01 моля, то раствор сантимолярный (0,01 М) и т. д. Для приготовления растворов молярной концентрации необходимо знать формулу вещества.
Молярная концентрация очень удобна тем, что в равных объемах растворов с одинаковой молярностью содержится одинаковое количество молекул, так как в грамм-молекуле любого вещества содержится одно и то же число молекул.
Готовят раствор молярной концентрации в мерных колбах определенного объема. На шейке такой колбы имеется отметка, точно ограничивающая нужный объем, а надпись на колбе указывает, на какой объем рассчитана данная мерная колба.
■ 43. Рассчитайте, какое количество вещества требуется для приготовления следующих растворов:
а) 5 л 0,1 М раствора серной кислоты;
б) 20 мл 2 М раствора соляной кислоты;
в) 500 мл 0,25 М раствора сульфата алюминия;
г) 250 мл 0,5 М раствора хлорида кальция. (См. Ответ)
Растворы кислот молярной концентрации нередко приходится готовить из процентных растворов.
■ 44. Сколько потребуется 50% азотной кислоты для приготовления 500 мл 0,5 М раствора.
45. Какой объем 98% серной кислоты необходим для приготовления 10 л 3 М раствора?
46. Вычислите молярность следующих растворов:
а) 20% серной кислоты;
б) 4% едкого натра;
в) 10% азотной кислоты;
г) 50% едкого кали. (См. Ответ)
Нормальная концентрация растворов
Нормальная концентрация растворов выражается количеством грамм-эквивалентов растворенного вещества в 1 л раствора. Для того чтобы произвести расчет для Приготовления раствора нормальной концентрации, нужно знать, что такое эквивалент. Слово «эквивалентный» означает «равноценный».
Эквивалентом называется весовое количество элемента, которое может соединяться с 1 весовой частью водорода или замещать ее в соединениях.
Если в молекуле воды Н2О содержится два атома водорода, весящих в сумме 2 у. е., и один атом кислорода, весящий 16 у. е., то на 1 у. е. водорода приходится 8 у. е. кислорода, что и будет эквивалентом кислорода. Если мы возьмем какой-нибудь окисел, например закись железа FeO, то в нем водорода нет, но зато есть кислород, а мы нашли из предыдущего расчета, что 8 у. е. кислорода эквивалентны 1 у. е. водорода. Следовательно, достаточно найти количество железа, способное соединиться с 8 у. е. кислорода, и это также будет его эквивалентом. Атомный вес железа 56. В окисле 56 у. е. Fe приходится на 16 у. е. кислорода, а на 8 у. е. кислорода железа придется вдвое меньше.
Можно найти эквивалент и для сложных веществ, например для серной кислоты H2SО4. В серной кислоте на 1 у. е. водорода приходится половина молекулы кислоты (включая, конечно, и водород), так как кислота двухосновная, т. е. эквивалент серной кислоты равен ее молекулярному весу (98 у. е.), деленному на 2, т. е. 49 у. е.
Эквивалент для основания можно найти, разделив его молекулярный вес на валентность металла Например, эквивалент NaOH равен молекулярному весу (40 у. е.), деленному на 1, т. е. на валентность натрия. Эквивалент NaOH равен 40 у. е. Эквивалент гидроокиси кальция Са(ОН)2 равен молекулярному весу (74 у. е.), деленному на валентность кальция, а именно на 2, т. е. 37 у, е.
Для того чтобы найти эквивалент для какой-нибудь соли, нужно молекулярный вес ее разделить на валентность металла и количество его атомов. Так, молекулярный вес сульфата алюминия Al2(SO4)3 равен 342 у. е. Эквивалент его равен: 342 : (3 · 2) = 57 у.е. где 3 — валентность алюминия, а 2 — количество атомов алюминия.
■ 47. Рассчитайте эквиваленты следующих соединений; а) фосфорной кислоты; б) гидроокиси бария; в) сульфата натрия;г) нитрата алюминия. (См. Ответ)
Грамм-эквивалентом называется количество граммов вещества, численно равное эквиваленту.
Если в 1 л раствора содержится 1 грамм-эквивалент (г-экв) растворенного вещества, то раствор является одно-нормальным (1 н.), если 0,1 грамм-эквивалента, то деци-нормальным (0,1 н.), если 0,01 грамм-эквивалента, то сантинормальным (0,01 н.) и т. д. Для расчета нормальной концентрации растворов также необходимо знать формулу вещества.
Сколько нужно взять 60% азотной кислот, чтобы приготовить 200 мл 3 н. раствора? 61. Какой объем 20% серной кислоты необходим для приготовления 20 л 0,1 н. раствора?
Нормальная концентрация очень удобна, так как если растворы имеют одинаковую нормальность, то в равных объемах этих растворов содержатся эквивалентные количества растворенных веществ. Поэтому вещества, содержащиеся в равных объемах таких растворов, реагируют нацело (если, разумеется, вообще могут между собой реагировать). Например, если взять 1,5 л 0,1 н. раствора едкого натра и 0,1 н. раствор соляной кислоты, то для реакции с едким натром потребуется также 1,5 л раствора соляной кислоты.
Чем выше концентрация раствора, тем меньший его объем требуется для реакции, т. е. между объемами растворов реагирующих веществ и их концентрациями существует обратная зависимость, которую можно выразить формулой:
где V — объем, а С — концентрация раствора.
Исходя из этой формулы, можно определить любую из четырех величин, если известны три остальные.
Какое количество нитрата натрия по массе надо взять для приготовления 300 мл 0 2м раствора
Задача 20
Вычислить рН раствора, содержащего 0,05 моль/л аммиака и 0,02 моль/л хлорида аммония.
Решение:
При смешении слабого основания с его солью получается щелочная буферная смесь.
Для щелочной буферной смеси рН = 14 – рКb + lg(Cосн./Cсоли)
рКb аммиака = – lg Kb
Kb (NH4OH)=1,8∙10^-5
рН =14 + lg(1,8∙10^-5) + lg (0,05 / 0,02) = 9,653 ≈ 9,65
Задача 21
Какую массу NH4Cl надо растворить в 100 мл раствора NH3 с массовой долей 1%, чтобы получить раствор с pН=9?
Решение:
для щелочной буферной смеси рН = 14 – рКb + lgCосн/Cсоли
рКb аммиака = 4,75
См(NH3) = 1000ωρ/M
ρ (1% NH3) = 0,9940 (справ. табл. http://techemy.com/handbook/tab0002.php)
См(NH3) = 1000 ∙ 0,01 ∙ 0,9940 / 17 = 0,585 М
lg(0,585/[NH4Cl]) = 9 – 14 + 4,75 = –0,25
[NH4Cl]= 0,585 / 10^–0,25 = 1,040 M
m=nM = CVM = 1,040 ∙ 0,100 ∙ 53,50 = 5,564 г
Решение:
Для щелочной буферной смеси рН = 14 – рКb + lg(Cосн/Cсоли)
рКb(NH3) = 4,75
lg(Cосн/Cсоли) = рН –14 + рКb = –0,25
для слабого основания рН = 14 – рКb/2 + lgСосн./2
lgСосн. = (рН – 14 + рКb/2)2 = 2рН – 28 + рКb = 22 – 28 + 4,75 = –1,25
lg(Cсоли) = lgСосн. – lg(Cосн/Cсоли) = –1,25 + 0,25 = –1
Cсоли = 10^–1 = 0,1 моль/л
m=nM = CVM = 0,1 ∙ 0,25 ∙ 53,50 = 1,3375 г
Задача 23
Рассчитайте рН буферного раствора, один литр которого содержит 0,1 моль уксусной кислоты и 0,01 моль ацетата натрия. Константа диссоциации уксусной кислоты Ка=1,74∙10-5; рКа=4,76.Ответ: рН=3,76.
Решение:
рН = рКа + lg ([соли] / [кислоты]) = 4,76 + lg (0,01 / 0,1) = 3,76
Задача 25
Рассчитайте объем 0,5%-ного раствора соляной кислоты (плотность раствора 1,002 г/мл) и 0,2М раствора аммиака необходимых для приготовления 200 мл буферного раствора с pH=8,5.
Решение:
В рез. частичной реакции аммиака с соляной кислотой: HCl + NH3 → NH4Cl
(или точнее: NH3∙H2O + HCl → NH4Cl + H2O),
образовалась смесь аммиака с хлоридом аммония, т.е. щелочная буферная смесь.
Для щелочной буферной смеси рН = 14 – рКb + lg(Cосн/Cсоли)
рКb аммиака = 4,75
lg(Cосн/Cсоли) = рН –14 + рКb = 8,5 –14 + 4,75 = – 0,75
Cосн/Cсоли = 10^– 0,75=0,1778
Основание и соль находятся в одном объеме буферного раствора, поэтому вместо отношения конц-й можно использовать отношение количеств веществ в молях:
n осн/ n соли = 0,1778
По ур. реакции, для получения 1 моль соли прореагировали 1 моль кислоты и 1 моль аммиака. Т.е. до реакции на 0,1778+1=1,1778 часть аммиака приходилась 1 часть кислоты, и образовалась 1 часть соли. Т.о. кол-во кислоты = кол-ву полученнной соли.
Общий объем полученного раствора равен 200 мл = 0,2 л
n = СV
См(NH3) = 0,2М
См(HCl) = 1000ρω / M = 1002 ∙ 0,005 / 36,46 = 0,1374 М
Обозначим объем раствора аммиака Vо=х, а объем раствора взятой кислоты Vк=200–х
СоVо / СкVк = 1,1778 / 1
0,2х / 0,1374(200–х) = 1,1778
Vо= х= 89,45 мл
Vк = 200,0–89,45 = 110,55 мл
Задача 26
Рассчитать буферную ёмкость раствора, содержащего 0,3 моль/л хлорида метиламмония и 0,25 моль/л метиламина.
Решение:
при смешении слабого основания с его солью получается щелочная буферная смесь.
Бесконечно малый прирост сильной кислоты вызываеттакой же прирост концентрации слабой кислоты, а бесконечно малый прирост сильного основания приводит к появлению такого же количества слабого основания, только в первом случае рН немного уменьшится, а во втором увеличится.
Суммарная концентрация компонентов смеси Сбуф не меняется, отсюда уравнение материального баланса: Сбуф = Скисл + Ссоли
Поэтому для щелочного буферного раствора: β = 2,3 С осн. ∙ С соли / (С осн. + С соли)
(для кислого: β = 2,3 С кисл. ∙ С соли / (С кисл. + С соли))
β = 2,3 ∙ 0,3 ∙ 0,25 / (0,3+0,25) = 0,31 моль/л
[OH-] = Kb ∙ Cосн/Cсоли = Kосн ∙ 0,06/0,06 = Косн, рН=4,75
n(HCl) = CV = 0.01 ∙ 0.1 = 0.001 моль
Кислота одноосновная, поэтому z=1
При прибавлении 0,001 моль экв. к-ты Cосн = 0,059 н, Ссоли=0,061 н, [OH-] = Косн. ∙ 0,97,
рН=4,76,
ΔpH = 4,76-4,75 = 0,01
буферная емкость β – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу (ΔpH=1)
β = n / (z ∙ V ∙ ΔpH)
V(буфера) =1 л, z = 1
β = 0,001 / 0,01 = 0,1 моль-экв/л = 10^-1 моль-экв/л
Снежана,
Задача 28
Рассчитайте рН буферного раствора CH3COOH + CH3COONa, если концентрации кислоты и соли одинаковы, а объемы кислоты и соли 20 мл и 80 мл соотвтственно.
Решение:
Несмотря на то, что конц-и взятых растворов кислоты и соли одинаковы, их концентрации в полученном буферном растворе не одинаковы, т.к. они взяты в соотношении 1:4 (20 мл : 80 мл).
Для кислой буферной смеси рН = рКа – lgСк-ты/Ссоли
рКа(CH3COOH)= – lg Kа = – lg (1,75∙10^–5) = 4,76
рН = 4,76 – lg (20/80) = 5,36
Марина,
Задача 29
Для получения буферного раствора с pH = 5,76 к 1 л 1н раствора ацетата натрия необходимо добавить __ моль уксусной кислоты.
Решение:
для кислой буферной смеси рН=рКа – lg(Ск-ты/Ссоли)
рКа уксусной кислоты = 4,76
lg(Ск-ты/Ссоли) = рКа – рН = 4,76 – 5,76 = – 1
Cк-ты/Cсоли = nк-ты / nсоли = 10^– 1=0,1
1 л 1 н р-ра ацетата натрия содержит 1 моль соли
nк-ты = 0,1 nсоли = 0,1 моль
Задача 30
Чему будет равно pН раствора, если к 1 л воды прибавить 1 мл 5%-ого раствора муравьиной кислоты и 1 мл 5%-ного раствора едкого кали?
Решение:
в рез. реакции слабой кислоты со щелочью получим соль слабой кислоты:
НСООН + КОН → НСООК + Н2О
Если НСООН в избытке, получится кислая буферная смесь, содержащая слабую кислоту и ее соль.
Посчитаем кол-ва веществ:
n(в-ва) = m/M
m=m(p-pa) ∙ ω
m(p-pa)=V(p-pa) ∙ ρ
Отсюда: n(в-ва, моль)= V(p-pa, мл) ∙ ρ(г/мл) ∙ ω / M (г/моль)
Для кислой буферной смеси: рН = рКа– lgСкисл./Ссоли
С=n/V
V=1,002 л, однако оба в-ва находятся в одном и том же объеме раствора, поэтому вместо молярной конц-и можно подставить в выражение для расчета рН количества кислоты и соли в растворе:
рН = рКа– lg n кисл./n соли
рКа(НСООН)=3,75 (http://www.novedu.ru/ionkisl.htm)
рН = 3,75 – lg (0,93 ∙ 10^-3 / 0,17 ∙ 10^-3) = 3,75 – lg (0,93 / 0,17) = 3,01
Задачa 31
Вычислить pН 0.02 M растворов KOH и HCOOH (Ka=1.8 ∙ 10^-4), pH смеси по 50 мл и 100 мл этих растворов соответственно.
Решение:
KOH: для сильного основания рН = 14 рН + lg[ОН–] = 14 + lg 0,02
HCOOH: для слабой кислоты рН = ½ рКа – ½ lgСк-ты
рКа = – lg Ка
рН = – 0,5 ∙ lg (1,8 ∙ 10^–4) – 0,5 lg 0,02
При смешивании слабой кислоты со щелочью в отношении 2:1 получим эквимолярный (1:1) раствор слабой кислоты и ее соли, т.е. кислую буферную смесь:
KOH + HCOOH → HCOOK + Н2О
Для кислой буферной смеси рН = рКа – lgСк-ты/Ссоли
Для эквимолярного буф. р-ра Ск-ты : Ссоли = 1:1, lgСк-ты/Ссоли = 0, отсюда
рН = рКа = – lg (1,8 ∙ 10^–4)
Задачa 33
К 40 мл 0,1 М раствора гидрофосфата калия добавлено 20 мл 0,1 М раствора соляной кислоты. Вычислите рН раствора (Кa1=7,1×10⁻³, Кa2=6,2×10^-8, Кa3=5,0×10^-13).
Как изменится рН буферного раствора, если прилить к нему 10 мл 0,1 М раствора гидроксида калия?
Решение:
К2НРО4 + HCl → КН2РО4 + КCl
2×10^-3 2×10^-3
После добавления 20 мл 0,1 М раствора соляной кислоты половина гидрофосфата калия превратилась в дигидрофосфат калия, так что раствор содержит эквимолярную смесь гидрофосфата калия и дигидрофосфата калия:
n(К2НРО4) = n(КН2РО4) = 0,04 ∙ 0,1/2 = 2×10^-3 моль
Образовалась фосфатная буферная смесь, в кот. ион Н2РО4ˉ играет роль кислоты, а ион НРО42– – сопряженного основания.
рН фосфатного буфера:
рН=рК (Н2РО4⁻) +lg[К2НРО4]/[КН2РО4] = рК (Н2РО4⁻) = – lgКa2=– lg(6,2×10^-8) = 7,21
Решение:
HCl + NH3 → NH4Cl
n(HCl) = CV = 0,2 ∙ 0,02 = 0,004 моль
n(NH3) = CV = 0,25 ∙ 0,04 = 0,01 моль
В получ. р-ре 0,004 моль NH4Cl и 0,01– 0,004 моль = 0,006 моль NH3 не прореагировали.
Получилась буферная смесь слабого основания и его соли.
рН = 14 – рКосн. + lgCосн./Cсоли
Т.к. оба в-ва в одном р-ре (V=const), то можно вместо отношения конц-й подставить колд-ва в-в:
рН1 = 14 – 4,755 + lg(0,006 / 0,004) = 9,421
При добавления 20 мл 0,1 NH4Cl:
n(NH4Cl) = n1 + n2 = 0,004 + 0,02∙0,1) = 0,006 моль
рН2 = 14 – 4,755 + lg(0,006 / 0,006) = 9,245
ΔрН = 9,421 – 9,245 = 0,176
Биржан,
Задачa 35
Вычислить pH раствора, содержащего в 500 мл 6 гр CH3COOH и 8,2 гр CH3COONa.
Вычислить pH буферного раствора, если к 1 литру добавить 2 грамма NaOH.
Решение:
для кислой буферной смеси рН = рКа – lgСк-ты/Ссоли
С=n/V=m/MV (л)
C(CH3COOH) = 6 г / (60 г/моль ∙ 0,5 л)=0,2 моль/л
C(CH3COONa) = 8,2 г / (82 г/моль ∙ 0,5 л)=0,2 моль/л
рКа(CH3COOH)= 4,76 (http://www.novedu.ru/ionkisl.htm)
рН1 = 4,76 – lg(0,2/0,2) = 4,76
1 л буф. раствора содержит n=CV = 0,2 моль CH3COOH и 0,2 моль CH3COONa.
NaOH + CH3COOH → CH3COONa + Н2О
n(NaOH)=m/M=2/40=0,05 моль, в реакции прореагировали 0,05 моль CH3COOH и
образовались 0,05 моль CH3COONa.
По окончании реакции 1 л р-ра содержит 0,2+0,05=0,25 моль CH3COONa и 0,2–0,05 = 0,15 моль CH3COOH (образованной в реакции водой массой 0,05 ∙ 18=0,9 г можно пренебречь).
рН2 = 4,76 – lg(0,15/0,25) = 4,98
Задачa 36
Определите концентрацию ионов водорода и рН в растворе, содержащем 0,01 моль бензойной кислоты и 0,03 моль бензоата натрия.
Ответ: 2,09 ∙ 10^-5 моль/л; 4,68.
Решение:
Слабая кислота и ее соль образуют кислый буферный раствор, для которого:
рН = рКа – lgСк-ты/Ссоли.
Т.к. оба в-ва находятся в одном растворе, то V одинаков и Ск-ты/Ссоли = n к-ты/n соли.
рКа=4,2 (http://www.novedu.ru/ionkisl.htm)
рН = 4,2 – lg(0,01/0,03) = 4,68
[H+]=10^–рН = 10^–4,68 = 2,09 ∙ 10^-5 моль/л
Надя,
Задачa 37
К 25 мл 0,3 М раствора дигидрофосфата калия добавлено 20 мл 0,2 М раствора гидроксида калия. Вычислите pH раствора (К1 =7,1×10^-3, К2=6,2×10^-8, К3=5,0×10^-13).
Как изменится pH буферного раствора, если к нему прилить 8 мл 0,1М раствора соляной кислоты?
Решение:
КН2РО4 + КОН → К2НРО4 + Н2О
n(КН2РО4)=CV=0,3×0,025 = 7,5×10^-3 моль
n(КОН)=CV=0,2×0,020 = 4,0×10^-3 моль
После добавления 20 мл 0,2 М р-ра КОН 4,0×10^-3 моль дигидрофосфата калия превратилась в 4,0×10^-3 моль гидрофосфат калия, так что раствор содержит смесь обеих солей:
n(КН2РО4) = 3,5×10^-3 моль
n(К2НРО4) = 4,0×10^-3 моль
Задачa 38
Рассчитать массу муравьиной кислоты с концентрацией 100%, которую необходимо добавить к 2 л формиата калия с концентрацией 2% и плотностью 1,02 г/см3, чтобы получить буферный раствор с рН=12, если рКк=3,62.
Решение:
Достаточное буферное действие проявляется в интервале рН = рК ± 1, поэтому приготовить формиатный буфер с рН = 12 невозможно, поскольку 12 > рКк + 1.
Это же показывает расчет:
Слабая кислота и ее соль образуют кислый буферный раствор, для которого:
рН = рКа– lg(Скисл/Ссоли)
lg(Скисл/Ссоли) = рКк – рН = 3,62 – 12 = –8,38
Ссоли = 1000ρω/М=1000 ∙ 1,02 ∙ 0,02 / 84,12 = 0,2425 моль/л
Ск-ты/0,2425 = 10^–8,38
Ск-ты = 0,2425 ∙10^–8,38 = 1,011∙10^–9 моль/л
m (НСООН) = Ск-ты ∙ V(р-ра) ∙ М = 1,011∙10^–9 ∙ 2 ∙ 46,02 = 9,300∙10^–8 г
Т.е. невозможно приготовить буферный раствор с рн=12 из муравьиной кислоты и ее соли.
Решение:
для кислой буферной смеси рОН = 14 – рКа + lgСк-ты/Ссоли
Т.к. оба вещества находятся в одном объеме раствора, то вместо конц-й можно использовать их кол-ва:
n = СV, n к-ты = 0,01∙0,1 = 0,001 моль, n соли = 0,01∙0,05 = 0,0005 моль
рКа(CH3COOH)= 4,76 (http://www.novedu.ru/ionkisl.htm)
рОН1 =14 – 4,76 + lg(0,001/0,0005) = 14 – 4,76 + lg2 = 9,54