какое агрегатное состояние у серы
Какое агрегатное состояние у серы
Сера, её физические и химические свойства. Биологическое значение серы, её применение (демеркуризация).
 |  |
FeS 2 – пирит, серный колчедан, кошачье золото
H 2 S – сероводород (в минеральных источниках и природном газе)
MgSO 4 * 7H 2 O – горькая соль (английская)
Na 2 SO 4 * 10 H 2 O – глауберова соль (мирабилит)
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t °кип = 445°С.
темно-желтые иглы, t °пл. = 119° C ; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
Размещение электронов по уровням и подуровням
1 s 2 2s 2 2 p 6 3 s 2 3 p 4
Размещение электронов по
орбиталям (последний слой)
В основном состоянии
Первое возбуждённое состояние
Второе возбуждённое состояние
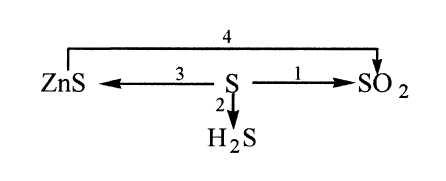
2. Неполное окисление сероводорода (при недостатке кислорода).
1. Взаимодействие серы со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром без нагревания:
Ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Места, из которых нельзя извлечь капельки ртути, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество.
Этот процесс называется демеркуризацией
3. Взаимодействие серы с некоторыми неметаллами с образованием бинарных соединений:
1. Взаимодействие серы c кислородом:
2 S + 3 O 2 t ° ; pt → 2 S +6 O 3
2. Взаимодействие серы c галогенами (кроме йода):
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100.
Закончите уравнения реакций, р асставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
Какое агрегатное состояние у серы
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Какое агрегатное состояние у серы
Сера — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulfur ). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
(молярная масса)
(первый электрон)
Содержание
Изотопы
Природная Сера состоит из четырёх стабильных изотопов:
32 S (95,02 %), 33 S (0,75 %), 34 S (4,21 %), 36 S (0,02 %).
Получены также искусственные радиоактивные изотопы
История и происхождение названия
Происхождение названия
Слово «сера», известное в древнерусском языке с XV века, заимствовано из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир». Этимология слова не выяснена до настоящих времен, поскольку первоначальное общеславянское название вещества утрачено и слово дошло до современного русского языка в искажённом виде.
По предположению Фасмера, «сера» восходит к лат. сera — «воск» или лат. serum — «сыворотка».
Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur ), предположительно, восходит к индоевропейскому корню *swelp — «гореть».
История открытия
Точное время открытия серы не установлено, но этот элемент использовался до нашей эры.
Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных богов.
Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII века китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.
Пресвитер Теофил (XII век) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию.
С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы.
Сера в природе
Большие скопления самородной серы (с содержанием > 25 %) редки, они встречаются в местах вулканической активности, им сопутствуют сернистые фумаролы и сернистые воды.
Серная руда разрабатывается в месторождениях самородной серы, добывается из сульфидных руд и промышленных газов.
Серные бактерии могут окислять сероводород от гниющих органических остатков до серы и накапливать её.
Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Важнейшие природные минералы серы: FeS2 — железный колчедан, или пирит, ZnS — цинковая обманка, или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит, HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS — ковеллин, CuFeS2 — халькопирит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Получение
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
При добыче руды открытым способом экскаваторами снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Серу из природного сернистого газа получают методом Клауса. Для этого используются так называемые серные ямы, где происходит дегазация серы, на выходе получают модифицированную серу — продукт, широко использующийся в производстве асфальта. Технологические установки для получения серы обычно включают в себя ямы недегазированной серы, ямы дегазации, ямы хранения дегазированной серы, а также налив жидкой серы и склад комовой серы. Стены ямы обычно делают из кирпича, дно заливают бетоном, а сверху закрывают яму алюминиевой крышей. Так как сера — это весьма агрессивная среда, ямы периодически приходится полностью реконструировать.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
С 1939 по 1986 год крупнейшим производителем серы в СССР был Медногорский медно-серный комбинат (ММСК): в середине 1950-х годов он выпускал до 250—280 тысяч тонн в год, что составляло 80 % серы, производившейся в стране.
…Утром мы были на медносерном заводе. Около 80 процентов серы, выпускаемой в нашей стране, добывается на этом предприятии.
— До пятидесятого года стране приходилось импортировать много серы из-за границы. Теперь нужда в импорте серы отпала, — говорил директор завода Александр Адольфович Бурба. — Но завод продолжает расширяться. Начали строить цех производства серной кислоты.
С высокой эстакады застывшим потоком повис ярко-жёлтый массив серы. То, что мы видим в небольших количествах в стеклянных баночках в лабораториях, здесь, на заводском дворе, лежало огромными глыбами».
В начале XXI века основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие её как побочный продукт при очистке газа.
Товарные формы
В промышленности реализовано получение серы в различных товарных формах. Выбор той или иной формы определяется требованиями заказчика.
Комовая сера до начала 1970-х годов была основным видом серы, выпускаемым промышленностью СССР. Её получение технологически просто и осуществляется подачей жидкой серы по обогреваемому трубопроводу на склад, где производится заливка серных блоков. Застывшие блоки высотой 1—3 метра разрушают на более мелкие куски и транспортируют заказчику. Метод, однако, имеет недостатки: невысокое качество серы, потери на пыль и крошку при рыхлении и погрузке, сложность автоматизации.
Жидкую серу хранят в обогреваемых резервуарах и транспортируют в цистернах. Транспорт жидкой серы более выгоден, чем её плавление на месте. Достоинства получения жидкой серы — отсутствие потерь и высокая чистота. Недостатки — опасность возгорания, траты на обогрев цистерн.
Формованная сера бывает чешуйчатая и пластинчатая. Чешуйчатую серу начали производить на НПЗ в 1950-х годах. Для получения используют вращающийся барабан, внутри он охлаждается водой, а снаружи кристаллизуется сера в виде чешуек толщиной 0,5—0,7 мм. В начале 1980-х годов вместо чешуйчатой стали выпускать пластинчатую серу. На движущуюся ленту подается расплав серы, который охлаждается по мере движения ленты. На выходе образуется застывший лист серы, который ломают с образованием пластинок. Сегодня эта технология считается устаревшей, хотя около 40 % канадской серы экспортируется именно в таком виде ввиду больших капиталовложений в установки для её получения.
Гранулированную серу получают различными методами.
Молотая сера является продуктом размола комовой серы. Степень измельчения может быть различной. Его проводят сначала в дробилке, потом в мельнице. Таким способом возможно получение очень высокодисперсной серы с размером частиц менее 2 мкм. Грануляцию порошковой серы проводят в прессах. Необходимо использование связующих добавок, в качестве которых используют битумы, стеариновую кислоту, жирные кислоты в виде водной эмульсии с триэтаноламином и другие.
Коллоидная сера — это разновидность молотой серы с размером частиц менее 20 мкм. Её применяют в сельском хозяйстве для борьбы с вредителями и в медицине как противовоспалительные и дезинфицирующие средства. Коллоидную серу получают различными способами.
Высокочистую серу получают используя химические, дистилляционные и кристаллизационные методы. Её применяют в электронной технике, при изготовлении оптических приборов, люминофоров, в производстве фармацевтических и косметических препаратов — лосьонов, мазей, средств против кожных болезней.
Применение
Примерно половина производимой серы используется в производстве серной кислоты.
Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Свойства
Физические свойства
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, но хорошо растворяется в органических растворителях, например, в сероуглероде, скипидаре.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
Фазовая диаграмма серы
Элементарная кристаллическая сера может существовать в виде двух аллотропных модификаций (энантиотропия серы) — ромбической и моноклинной, — то есть сера диморфна, поэтому для элементарной серы возможно существование четырёх фаз: твёрдой ромбической, твёрдой моноклинной, жидкой и газообразной, а на фазовой диаграмме серы (см. рисунок; для давления использован логарифмический масштаб) имеются два поля твёрдых фаз: область ромбической серы и область существования моноклинной серы (треугольник АВС).
На фазовой диаграмме серы:
Пунктирные линии отражают возможность существования метастабильных фаз, которые наблюдаются при резком изменении температуры:
На фазовой диаграмме серы имеются три стабильные тройные точки и одна метастабильная, каждая из которых отвечает условиям термодинамического равновесия трёх фаз:
Как показывает фазовая диаграмма, ромбическая сера не может одновременно находиться в равновесии с расплавом и парами серы, поэтому в основной тройной точке (когда равновесные фазы находятся в разных агрегатных состояниях) твёрдая фаза представлена моноклинной серой. Метастабильная тройная точка появляется вследствие низкой скорости превращения одной кристаллической модификации серы в другую.
Химические свойства
На воздухе сера горит, образуя сернистый газ — бесцветный газ с резким запахом:
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид):
При избытке серы также образуются разнообразные дихлориды полисеры типа SnCl2.
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P2S5:
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
S + H2 → H2S (сероводород) C + 2S → CS2 (сероуглерод) Si + 2S → SiS2 (сульфид кремния)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:
2Na + S → Na2S Ca + S → CaS 2Al + 3S → Al2S3 Fe + S → FeS
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов:
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору:
Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
При увеличении температуры в парах серы происходят изменения в количественном молекулярном составе. Число атомов в молекуле уменьшается:
При 800—1400 °C пары состоят в основном из двухатомной серы:
А при 1700 °C сера становится атомарной:
Биологическая роль
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе.
В человеке содержится примерно 2 г серы на 1 кг массы тела.
Биологической действие
Чистая сера не ядовита, все же летучие серосодержащие соединения ядовиты (сернистый газ, серный ангидрид, сероводород и др.).
Пожароопасные свойства серы
Тонкоизмельчённая сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углём, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распылённая вода, воздушно-механическая пена.
По данным В. Маршалла пыль серы относится к разряду взрывоопасных, но для взрыва необходима достаточно высокая концентрация пыли — порядка 20 г/м³ (20 000 мг/м³), такая концентрация во много раз превышает предельно допустимую концентрацию для человека в воздухе рабочей зоны — 6 мг/м³.
Пары образуют с воздухом взрывчатую смесь.
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабо светящееся голубое пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C.
Так как воздух по объёму состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объёма кислорода получается один объём SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха, и объёмное содержание SO2 в газовой смеси меньше теоретически возможного, составляя обычно 14—15 %.
Обнаружение горения серы пожарной автоматикой является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Тепловыделение при пожаре приводит к температуре ниже, чем при пожарах других распространённых пожароопасных веществ. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространёнными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Для выполнения требований пожарной безопасности на складах серы необходимо:
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет-Уэст Западно-Капской провинции Южно-Африканской Республики, произошёл крупный пожар, погибли два человека.
16 января 2006 года около 17 часов на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250 квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет.
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов.
В апреле 2008 недалеко от посёлка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчётов и спасатели. В тот момент, когда пожарные оказались около склада, горела ещё не вся сера, а только её небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землёй и залиты водой.
В июле 2009 года в Днепродзержинске горела сера. Пожар произошёл на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
В конце июля 2012 года под Уфой в поселке Тимашево загорелся склад с серой площадью 3200 квадратных метров. На место выехало 13 единиц техники, в тушении пожара задействован 31 пожарный. Произошло загрязнение атмосферного воздуха продуктами горения. Погибших и пострадавших нет.