Фазекас 1 степени что это
Лейкоареоз на МРТ головного мозга
Под медицинским термином лейкоареоз (Leuko-araiosis — разрежение/разжижение белого вещества) скрывается аномалия белого вещества головного мозга, которая выявляется методом магнитно-резонансной томографии в режимах подавления импульсов Т2 и FLAIR (TIRM) в виде увеличения МР-сигнала. Он также дает снижение так называемой “рентгеновской плотности” при прохождении рентгеновских лучей через белое вещество мозга при КТ. Рост количества выявляемых случаев лейкоареоза при МРТ в последние годы указывает не на увеличение распространения патологии, а на использование более совершенных томографов, способных выявить едва заметные изменения в структурах центральной нервной системы.
Лейкоареоз на МРТ головного мозга: как выглядит лейкоареоз на МРТ головы
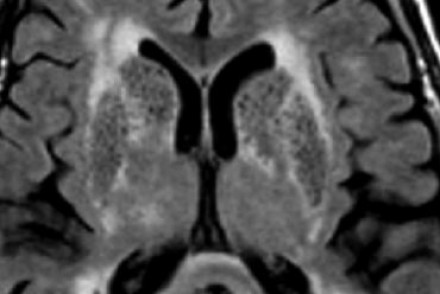
Визуальные следы лейкоареоза при МРТ представляют собой высветленные очаги, расположение которых зависит от формы аномалии. Лейкоареоз выражается снижением плотности мозговых тканей в области куполов, то есть вокруг желудочков.
Дата загрузки: 2019-01-21
Видео — Лейкоареоз на МРТ головного мозга
Покажет ли лейкоареоз на МРТ головного мозга?
Чтобы понять, насколько видимой является патология нервной ткани для МР-томографа, стоит разобраться в причинах ее появления, особенностях поражения тканей и т. д. По своей сути лейкоареоз не относится к числу самостоятельных заболеваний. Врачи относят его к признакам, сопровождающим нарушения мозгового кровообращения.
Полезно знать! Ряд врачей называют лейкоареоз при МРТ головного мозга естественным состоянием, характерным для стареющего организма. В пользу этого говорит тот факт, что расстройство чаще выявляется в процессе диагностики у людей преклонного возраста, то есть после 70 лет. Обнаружение аномалии не значит, что пациенту придется лечить лейкоареоз. Часто достаточно общих мер профилактики и регулярного наблюдения, чтобы не допустить перехода болезни на следующий этап развития.
Для возникновения расстройства, известного как лейкоареоз, нужны определенные условия. К основным факторам риска относят наличие проблем в системе транспортировки крови в области головы:
По последним данным спровоцировать изменения при лейкоариозе может недостаточно активная умственная и физическая нагрузка. Это ускоряет деградацию нервной и мышечной системы, приводит к нарушениям метаболизма и провоцирует различные виды сосудистых патологий.
Как правило, изменения белого вещества, расположенного в глубине головного мозга, происходят из-за того, что оно меньше насыщено мелкими кровеносными сосудами. Вследствие этого даже незначительные нарушения в работе капиллярной сети моментально накладывают отпечаток на функциональности и физическом состоянии мозга пациента. По статистике патологические очаги при такой аномалии сосредоточены в области боковых желудочков или непосредственно в подкорковой зоне.
Какие именно изменения наблюдаются при лейкоареозе:
Все изменения, перечисленные выше, проходят несколько стадий развития, и уже на начальном этапе становятся заметны при исследовании головного мозга на высокопольном аппарате. Этот тип устройств может обнаруживать виды патологий, не заметные для томографов мощностью менее 1 Тесла.
Как выглядит лейкоареоз на МРТ?
Визуальные следы лейкоареоза при МРТ представляют собой высветленные очаги, расположение которых зависит от формы аномалии. При первентрикулярном лейкоареозе, который выражается снижением плотности мозговых тканей в области куполов, то есть вокруг желудочков, на снимках видны:
Параллельно с этим могут наблюдаться признаки лакунарных инсультов с неограниченным некрозом тканей. На снимках с высоким разрешением заметно, что белое вещество мозга становится похоже на губку.
При субкортикальной форме аномалии, когда патологические области локализованы в области в глубинных структурах головного мозга, на снимках видны:
Также на основании полученных в процессе томографии данных врач провести дифференциальную диагностику с очагами демиелинизации — локального или рассеянного разрушения миелиновых оболочек, как при рассеянном склерозе.
Современный подход к диагностике и лечению хронической ишемии мозга
Д.м.н. С.П. Маркин
Воронежская государственная медицинская академия им. Н.Н. Бурденко
В последние годы в мире наблюдается постарение населения, прежде всего за счет снижения рождаемости. По образному выражению В. Коняхина, «молодые приходят и уходят, а старики остаются». Так, в 2000 г во всем мире в возрасте старше 65 лет было около 400 млн человек. Тем не менее ожидается, что к 2025 г эта возрастная группа увеличится до 800 млн.
Изменения со стороны нервной системы занимают ведущее место среди данного контингента людей. При этом наиболее часто встречаются поражения сосудов головного мозга, приводящие к его ишемии, т.е. развитию дисциркуляторной энцефалопатии (ДЭ).
В современной классификации МКБ-10 отсутствует термин «дисциркуляторная энцефалопатия». Вместо прежнего диагноза рекомендуется использовать следующие шифры заболеваний:
167.2 Церебральный атеросклероз
167.3 Прогрессирующая сосудистая лейкоэнцефалопатия
167.4 Гипертензивная энцефалопатия
167.8 Другие уточненные поражения сосудов мозга.
Однако, термин «дисциркуляторная энцефалопатия» традиционно используется среди неврологов в нашей стране. ДЭ представляет собой гетерогенное состояние, которое может иметь различную этиологию. Наибольшее этиологическое значение в развитии ДЭ имеют:
— атеросклероз (атеросклеротическая ДЭ);
— артериальная гипертония (гипертоническая ДЭ);
— их сочетание (смешанная ДЭ).
При атеросклеротической ДЭ преобладает поражение крупных магистральных и внутричерепных сосудов (стеноз). При этом в начальных стадиях заболевания выявляются стенозирующие изменения одного (реже двух) магистральных сосудов, в то время как в развитых стадиях процесса нередко оказываются измененными большинство (или все) магистральные артерии головы. Снижение кровотока возникает при гемодинамически значимом стенозе (сужение 70-75% площади просвета артерии) и далее нарастает пропорционально степени сужения. Вместе с этим важнейшую роль в механизмах компенсации мозгового кровообращения играет состояние внутричерепных сосудов (развитие сети коллатерального кровообращения).
При гипертонической ДЭ основные патологические процессы наблюдаются в более мелких ветвях сосудистой системы головного мозга (перфорирующих артериях) в виде липогиалиноза и фибриноидного некроза.
Основные патогенетические механизмы развития ДЭ:
— хроническая ишемия;
— «незавершенный инсульт»;
— завершенный инсульт [2].
Основные морфологические изменения при ДЭ:
— очаговые изменения головного мозга (постишемические кисты вследствие перенесенного лакунарного инсульта);
— диффузные изменения белого вещества (лейкоареоз);
— церебральная атрофия (коры больших полушарий и гиппокампа) [1].
Рис. 1. Множественные лакунарные очаги в бассейне правой средней мозговой артерии, по данным МРТ головного мозга
Лейкоареоз визуализируется в виде двусторонних очаговых или диффузных областей пониженной плотности в белом веществе при компьютерной томографии и Т1-взвешенных изображениях на магнитно-резонансной томографии, или в виде областей повышенной плотности на Т2-взвешенных изображениях при магнитно-резонансной томографии [Pantoni L. et al., 1997] (рис. 2).
Рис. 2. Выраженный лейкоареоз
В клинической картине ДЭ выделяют ряд основных синдромов:
— вестибулярно-атактический (головокружение, пошатывание, неустойчивость при ходьбе);
— пирамидный (оживление сухожильных рефлексов с расширением рефлексогенных зон, анизорефлексия, иногда клонусы стоп);
— амиостатический (дрожание головы, пальцев рук, гипомимия, мышечная ригидность, замедленность движений);
— псевдобульбарный (нечеткость речи, «насильственный» смех и плач, поперхивание при глотании);
— психопатологический (депрессия, нарушение когнитивных функций).
При этом ведущую роль играет поражение вестибулярных ядер ствола или вестибуло-мозжечковых связей. Определенное значение имеет так называемый периферический компонент, обусловленный атеросклеротическим поражением сосудов внутреннего уха.
Двигательные нарушения в пожилом возрасте (до 40% случаев) обусловлены поражением лобных долей и их связей с подкорковыми образованиями.
Основные двигательные нарушения у пожилых:
— «лобное нарушение ходьбы» (лобная дисбазия);
— «лобное нарушение равновесия» (лобная астазия);
— «подкорковое нарушение равновесия» (субкортикальная астазия);
— нарушение инициации ходьбы;
— «осторожная» (или неуверенная) ходьба [3].
Двигательные нарушения часто сопровождаются падениями. По данным ряда исследователей, падения хотя бы один раз в течение года отмечаются у 30% лиц в возрасте 65 лет и старше, при этом примерно в половине случаев это случается более одного раза в год. Вероятность падений усиливается при наличии нарушений когнитивных функций, депрессии, а также приеме пациентами антидепрессантов, транквилизаторов бензодиазепинового ряда, гипотензивных средств.
Распространенность депрессии среди больных с ДЭ (по данным исследования «Компас») составляет более 50% (при этом треть пациентов имеет выраженные депрессивные расстройства).
Особенности клинической картины депрессии у пожилых:
— преобладание соматических симптомов депрессии над психическими;
— выраженное нарушение витальных функций, особенно сна;
— маской психических симптомов депрессии могут выступать тревога, раздражительность, «ворчливость», которые окружающими часто рассматриваются как особенности пожилого возраста;
— когнитивные симптомы депрессии часто оцениваются в рамках старческой забывчивости;
— значительные колебания симптоматики;
— неполное соответствие критериям депрессивного эпизода (отдельные симптомы депрессии);
— тесная связь между обострениями соматического заболевания и депрессии;
— наличие общих симптомов депрессии и соматического заболевания.
Основные проявления нарушений сна у пожилых:
— упорные жалобы на бессонницу;
— постоянные трудности засыпания;
— поверхностный и прерывистый сон;
— наличие ярких, множественных сновидений, нередко тягостного содержания;
— ранние пробуждения;
— ощущение тревожного беспокойства при пробуждениях;
— затруднение или невозможность уснуть вновь;
— отсутствие ощущение отдыха от сна.
Когнитивные нарушения при депрессии обусловлены перераспределением внимания, пониженной самооценкой и медиаторными нарушениями. Для расстройства когнитивных функций при депрессии характерно:
— острое/подострое начало заболевания;
— быстрое прогрессирование симптомов;
— указания на предшествующую психическую патологию;
— настойчивые жалобы на снижение интеллектуальных способностей;
— отсутствие усилия при выполнении тестов («не знаю»);
— вариабельность выполнения тестов;
— привлечение внимания улучшает выполнение тестов;
— память на недавние и отдаленные события страдает в одинаковой степени.
Однако при депрессии субъективная оценка когнитивных способностей и степень социальной дезадаптации, как правило, не соответствуют объективным данным тестирования когнитивных функций. Уменьшение выраженности эмоциональных нарушений приводит к регрессу связанных с депрессией когнитивных расстройств. Тем не менее в результате многочисленных исследований области гиппокампа у больных с большим депрессивным расстройством накоплены доказательные данные о том, что при депрессии происходит его атрофия. Недавно появились даже сообщения об атрофии гиппокампа после первого депрессивного эпизода [Ж.П. Олье, Франция, 2007]. Кроме того, по мнению чикагских специалистов из Rush Alzheimers Disease Centre, затянувшаяся депрессия может стать причиной развития болезни Альцгеймера. Так, с каждым новым признаком депрессии вероятность развития болезни Альцгеймера увеличивается на 20%.
Умеренные когнитивные расстройства (УКР) при ДЭ (по данным исследования «Прометей») встречается в 56% случаев. О связи выявляющегося у больного умеренных когнитивных расстройств с ДЭ могут свидетельствовать:
— преобладание регуляторных когнитивных нарушений, связанных с дисфункцией лобных долей (нарушение планирования, организации и контроля деятельности, снижение речевой активности, умеренное вторичное ослабление памяти при относительно сохранном узнавании);
— сочетание когнитивных нарушений с аффективными нарушениями (апатией, депрессией, раздражительностью), а также очаговыми неврологическими симптомами, в том числе свидетельствующими о страдании глубинных отделов мозга (дизартрия, нарушения ходьбы и постуральной устойчивости, экстрапирамидные знаки, нейрогенные нарушения мочеиспускания).
В таблице 1 представлена сравнительная характеристика УКР «альцгеймеровского типа» и ДЭ с УКР [4].
Таблица 1. Отличительные характеристики УКР альцгеймеровского типа и ДЭ с УКР
| Признаки | УКР альцгеймеровского типа | ДЭ с УКР |
| Сосудистые факторы риска (артериальная гипертензия, сахарный диабет, ожирение и т.д.) | ± | ++ |
| Признаки цереброваскулярного заболевания (ТИА или инсульт в анамнезе, стеноз сонных артерий и т.д.) | ± | ++ |
| Течение | Прогредиентное (возможны периоды плато) | Вариабельное |
| Нейропсихологическое исследование | Преобладают нарушения памяти (дисфункция гиппокампа) | Преобладают нарушения внимания и регуляторных функций (лобная дисфункция) |
| Аффективные нарушения | ± | + |
| Двигательные нарушения (нарушения ходьбы, псевдобульбарный синдром, экстрапирамидные или пирамидные знаки) | ± | ++ |
| Нейрогенные нарушения мочеиспускания | — | + |
| Данные МРТ атрофия гиппокампа множественные очаги/лейкоареоз | + ± | ± ++ |
УКР у пациентов с диффузным поражением белого вещества появляются тогда, когда их объем превысит 10% объема белого вещества полушарий. Однако в течение 5 лет 70-80% пациентов с умеренными когнитивными расстройствами «переходят» в группу больных с деменцией. При этом наличие «немых» инфарктов, особенно множественных, ассоциируется с общим ухудшением когнитивной деятельности и более чем в 2 раза увеличивает риск развития деменции в последующие несколько лет.
ДЭ является ведущей причиной развития сосудистой деменции. Так, в структуре сосудистой деменции 67% составляет деменция вследствие заболевания мелких сосудов (субкортикальная деменция, лакунарный статус, сенильная деменция бинсвангеровского типа). При таком варианте деменции когнитивные нарушения могут непрерывно прогрессировать с эпизодами резкого ухудшения вследствие инсультов. На этапе деменции пациенты частично или полностью зависимы от окружающих. Наиболее наглядно снижение качества жизни пациентов с деменцией можно проследить, анализируя работы известных художников, страдавших деменцией. На рисунке 3 представлены ранние работы американского художника Вильяма де Кунинга (1904-1997), который был мастером абстрактного искусства. В 80-х годах ему ставят диагноз «деменция», что нашло отражение в работах под общим названием «Без названия». На рисунке 4 представлены картины, написанные художником на стадии деменции.
Рис. 3. Ранние работы де Кунинга («Женщины»)
Рис. 4. Последние работы де Кунинга («Без названия»)
Основные клинические проявления сосудистой деменции (по Т. Erkinjuntti (1997) с измен.)
Течение заболевания:
— относительно внезапное начало (дни, недели) когнитивных нарушений;
— частое ступенеобразное прогрессирование (некоторое улучшение после эпизода ухудшения) и флюктуирующее течение (т.е. различия в состоянии больных в разные дни) когнитивных нарушений;
— в некоторых случаях (20-40%) более незаметное и прогрессирующее течение.
Неврологические/психиатрические симптомы
— выявляемая в неврологическом статусе симптоматика указывает на очаговое поражение головного мозга на начальных стадиях заболевания (легкий двигательный дефект, нарушения координации и др.);
— бульбарная симптоматика (включая дизартрию и дисфагию);
— нарушения ходьбы (гемипаретическая и др.);
— неустойчивость и частые, ничем не спровоцированные падения;
— учащенное мочеиспускание и недержание мочи;
— замедление психомоторных функций, нарушение исполнительных функций;
— эмоциональная лабильность (насильственный плач и др.);
— сохранность личности и интуиции в легких и умеренно тяжелых случаях;
— аффективные нарушения (депрессия, тревожность, аффективная лабильность).
Сопутствующие заболевания
Наличие в анамнезе сердечно-сосудистых заболеваний (не во всех случаях): артериальной гипертензии, ишемической болезни сердца.
По мере прогрессирования ДЭ количество жалоб пациентов значительно уменьшается, что обусловлено снижением критики больных к своему состоянию. Сохраняются в основном жалобы на неустойчивость при ходьбе, шум и тяжесть в голове, нарушение сна. При этом возрастает выраженность социальной дезадаптации. На рисунке 5 представлен фрагмент записи жалоб больного Б., 59 лет, страдающего ДЭ 3 степени [6].
Рис. 5. Жалоба больного Б., 59 лет, с ДЭ 3 степени
Критерии диагностики ДЭ:
— объективно выявляемые нейропсихологические и/или неврологические симптомы;
— признаки цереброваскулярного заболевания, включающие факторы риска и/или инструментально подтвержденные признаки поражения мозговых сосудов (например, данные УЗИ) и/или вещества мозга (данные КТ/МРТ);
— наличие причинно-следственной связи между сосудистым поражением мозга и клинической картиной;
— отсутствие признаков других заболеваний, способных объяснить клиническую картину.
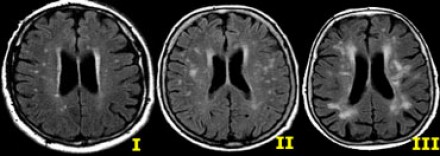
О.С. Левиным (2006) разработаны диагностические критерии на основе данных КТ и МРТ различных стадий дисциркуляторной энцефалопатии (табл. 2).
Таблица 2. Нейровизуализационные изменения при ДЭ
| Стадии типы изменений | 1-я стадия | 2-я стадия | 3-я стадия |
| Лейкоареоз | |||
| тип | Перивентрикулярный и/или пунктирный субкортикальный | Пятнистый, частично сливающийся субкортикальный | Сливающийся субкортикальный |
| ширина | Менее 10 мм | Более 10 мм | Более 20 мм |
| Лакуны | |||
| число | 2-5 | 3-5 | Более 5 |
| Территориальные инфаркты | |||
| число | 0-1 | 2-3 | Более 3 |
| площадь | Не более 1/8 полушарий | Не более 1/4 полушарий | не менее 1/4 полушарий |
| (диаметр) | (до 10 мм) | (до 25 мм) | (>25 мм) |
| Атрофия головного мозга | ± | +/++ | ++/+++ |
Принципы лечения ДЭ:
1) действие на сосудистые факторы (коррекция артериального давления, профилактика ОНМК);
2) восстановление мозгового кровотока, улучшение церебрального метаболизма;
3) улучшение и стабилизация когнитивных функций;
4) коррекция других клинических проявлений заболевания.
Одним из наиболее перспективных подходов в терапии ДЭ является назначение комбинированных препаратов, обладающих полимодальным действием (антигипоксическое, метаболическое (ноотропное) и сосудорасширяющее). В последнее время для этих целей широко используется препарат Омарон , содержащий 400 мг пирацетама и 25 мг циннаризина.
Механизм действия пирацетама многообразен. Одной из теорий, объясняющей множество эффектов пирацетама, является мембранная. Согласно ей, эффекты пирацетама могут быть результатом восстановления текучести мембран (а она уменьшается с возрастом):
— специфическое взаимодействие с мембраной клетки;
— восстановление структуры мембран;
— восстановление жидкостных свойств мембран клеток;
— нормализация функции мембраной клеток.
Принято выделять два основных направления действия пирацетама: нейрональное и сосудистое [Muller W.E., 1997]. Нейрональный эффект реализуется благодаря улучшению метаболических процессов вследствие оптимизации потребления кислорода и утилизации глюкозы. Доказано, что пирацетам взаимодействует с системой трансмиттеров, оказывая модулирующее действие. Совершенствование нейронального эффекта облегчает когнитивные процессы. В ряде исследований [Mindus P. et al., 1976; Israel L. et al., 1994] с двойным слепым контролем было установлено, что применение пирацетама значительно повышает высшие психические функции не только в условиях так называемого физиологического старения, но и у пациентов с психоорганическим синдромом при сенильной инволюции. Кроме этого, в последние годы появились работы [Tsolaki M., 2001; Muller W., 2006], подтверждающие эффективность пирацетама на ранней стадии болезни Альцгеймера.
Сосудистый эффект пирацетама проявляется за счет его влияния на микроциркуляцию и клетки крови: уменьшение агрегации тромбоцитов, увеличение деформируемости эритроцитов. Вследствие этого пирацетам проявляет антитромботическое действие и существенно улучшает реологические свойства крови, что, в свою очередь, является основой для нормализации нарушенного мозгового кровообращения.
В многоцентровом (5 клинических центров Российской Федерации) открытом рандомизированном исследовании, включавшем 90 больных, перенесших инсульт (давностью от 1 месяца до 1 года), сравнивали эффективность и переносимость омарона (по 1 таблетке 3 раза в день) в сочетании с базовой терапией (гипотензивные препараты, дезагреганты и статины) при применении в течение 2 мес. по сравнению с базисной терапией [7].
Результаты исследования показали, что в группе терапии препаратом омарон уже через месяц лечения отмечено достоверное улучшение всех когнитивных функций. Улучшение было наиболее значительным через два месяца лечения. В контрольной же группе динамика была гораздо менее выраженной. Так, в качестве примера ниже представлены результаты выполнения тестов запоминания 5 слов и рисования часов (рис. 6, 7).
Рис. 6. Динамика показателей теста запоминания 5 слов
Рис. 7. Динамика показателей теста рисования часов (баллы)
Кроме того, в группе лечения омароном отмечено достоверное уменьшение выраженности депрессивных и тревожных расстройств (рис. 8).
Рис. 8. Динамика показателей шкалы депрессии и тревоги
В ходе исследования установлены хорошая переносимость омарона, отсутствие побочных эффектов при его комбинации с другими лекарственными средствами, которые используются для профилактики повторного инсульта, а также отсутствие влияния омарона на показатели системной гемодинамики.
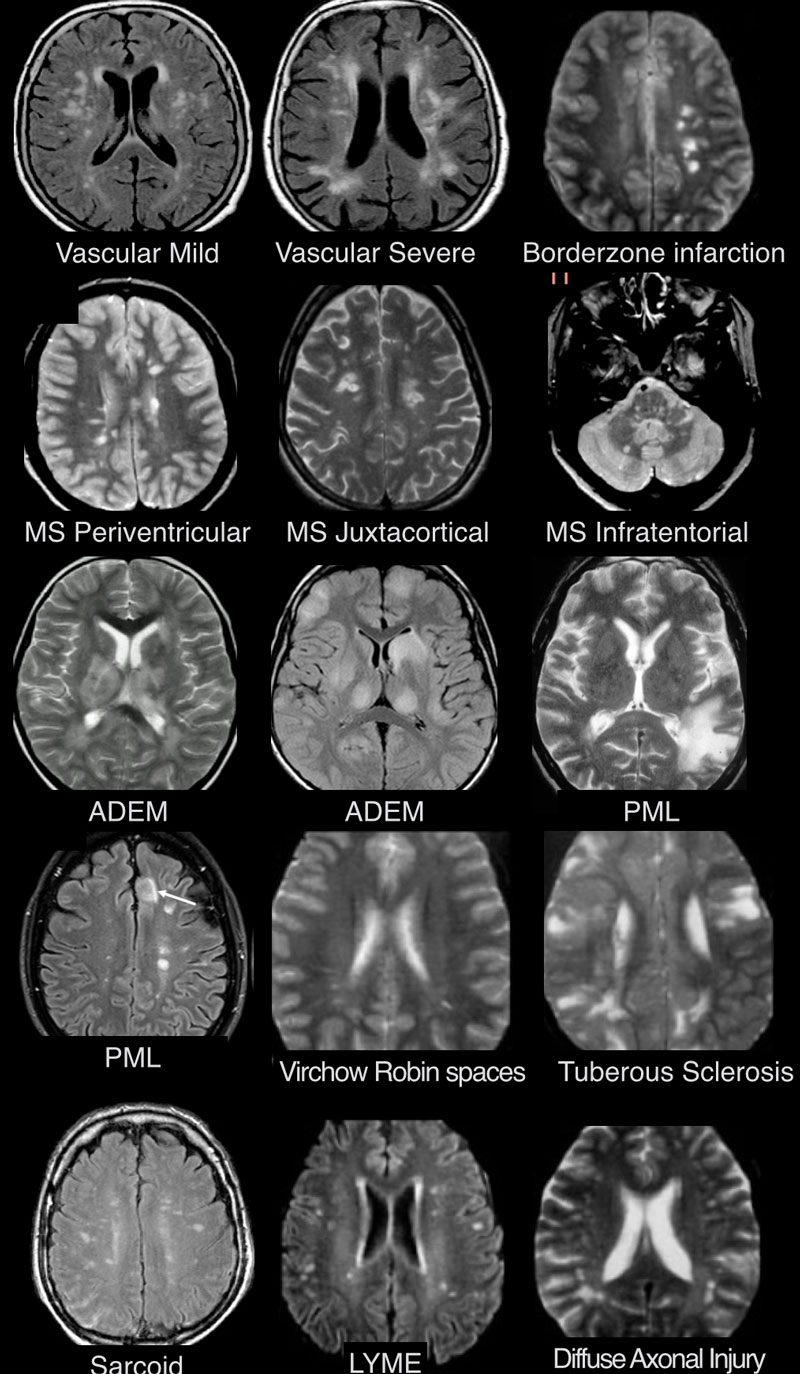
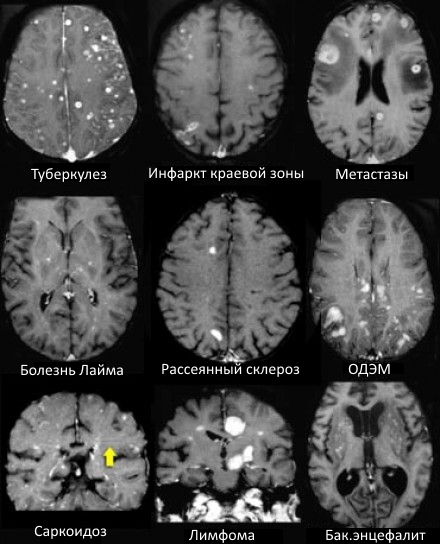
Дифференциальная диагностика поражений белого вещества головного мозга при магнитно-резонансной томографии
Врач МРТ
Воронцова Жанна Ватиславовна
Дифференциально-диагностический ряд заболеваний белого вещества является очень длинным. Выявленные с помощью МРТ очаги могут отражать нормальные возрастные изменения, но большинство очагов в белом веществе возникают в течение жизни и в результате гипоксии и ишемии.
ПРИ КАКИХ БОЛЕЗНЯХ ВОЗНИКАЮТ ОЧАГИ
В БЕЛОМ ВЕЩЕСТВЕ?
Очаговые изменения сосудистого генеза
Воспалительные заболевания
Заболевания инфекционной природы
Интоксикации и метаболические расстройства
Травматические процессы
Врожденные заболевания
Могут наблюдаться в норме
МРТ ГОЛОВНОГО МОЗГА: МНОЖЕСТВЕННЫЕ ОЧАГОВЫЕ ИЗМЕНЕНИЯ
На изображениях определяются множественные точечные и «пятнистые» очаги (некоторые из них будут рассмотрены более детально).
Рассеянный склероз — хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга, характеризующееся многоочаговостью поражения белого вещества центральной нервной системы, ремиттирующе-прогредиентным течением, вариабельностью неврологических симптомов и преимущественным поражением лиц молодого возраста (подробнее с диагностическими критериями указанного заболевания Вы можете ознакомится в статье «Современные критерии диагностики рассеянного склероза», опубликованной на нашем сайте).
Острые нарушения мозгового кровообращения:
Острый диссеминированный энцефаломиелит (ОДЭМ)
Саркоидоз головного мозга
Прогрессирующая мультфокальная лейкоэнцефалопатия (ПМЛ)
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА МНОЖЕСТВЕННЫХ ОЧАГОВ, УСИЛИВАЮЩИХСЯ ПРИ КОНТРАСТИРОВАНИИ
На МР-томограммах продемонстрированы множественные патологические зоны, накапливающие контрастное веществ (некоторые из них описаны далее подробнее).
Острые нарушения мозгового кровобращения
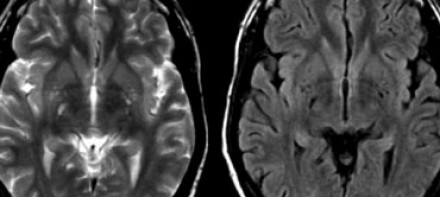
ПЕРИВАСКУЛЯРНЫЕ ПРОСТРАНСТВА ВИРХОВА-РОБИНА
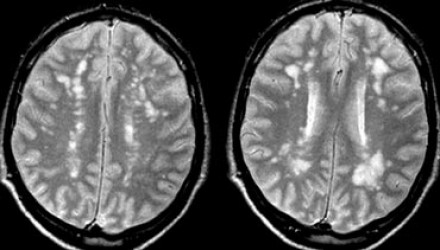
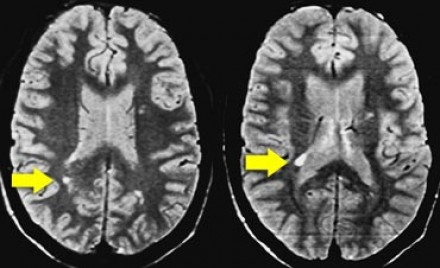
Слева на Т2-взвешенной томограмме видны множественные очаги высокой интенсивности в области базальных ганглиев. Справа в режиме FLAIR сигнал от них подавляется, и они выглядят темными. На всех остальных последовательностях они характеризуются такими же характеристиками сигнала, как ликвор (в частности, гипоинтенсивным сигналом на Т1 ВИ). Такая интенсивность сигнала в сочетании с локализацией описанного процесса являются типичными признаками пространств Вирхова-Робина (они же криблюры).
Пространства Вирхова-Робина окружают пенетрирующие лептоменингеальные сосуды, содержат ликвор. Их типичной локализацией считается область базальных ганглиев, характерно также расположение вблизи передней комиссуры и в центре мозгового ствола. На МРТ сигнал от пространств Вирхова-Робина на всех последовательностях аналогичен сигналу от ликвора. В режиме FLAIR и на томограммах, взвешенных по протонной плотности, они дают гипоинтенсивный сигнал в отличие от очагов иного характера. Пространства Вирхова-Робина имеют небольшие размеры, за исключением передней комиссуры, где периваскулярные пространства могут быть больше.
На МР-томограмме можно обнаружить как расширенные периваскулярные пространства Вирхова-Робина, так и диффузные гиперинтенсивные участки в белом веществе. Данная МР-томограмма превосходно иллюстрирует различия между пространствами Вирхова-Робина и поражениями белого вещества. В данном случае изменения выражены в значительной степени; для их описания иногда используется термин «ситовидное состояние» (etat crible).
Пространства Вирхова-Робина увеличиваются с возрастом, а также при гипертонической болезни в результате атрофического процесса в окружающей ткани мозга.
НОРМАЛЬНЫЕ ВОЗРАСТНЫЕ ИЗМЕНЕНИЯ
БЕЛОГО ВЕЩЕСТВА НА МРТ
К ожидаемым возрастным изменениям относятся:
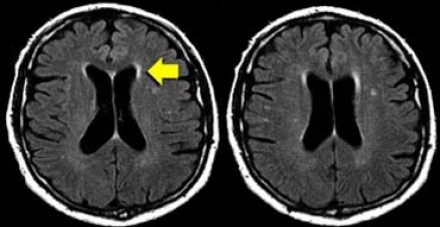
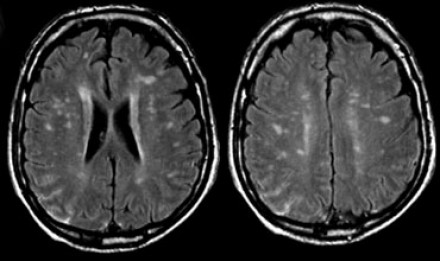
Перивентрикулярные «шапочки» представляют собой области, дающие гиперинтенсивный сигнал, расположенные вокруг передних и задних рогов боковых желудочков, обусловленные побледнением миелина и расширением периваскулярных пространств. Перивентрикулярные «полосы» или «ободки» это тонкие участки линейной формы, расположенные параллельно телам боковых желудочков, обусловленные субэпендимальным глиозом.
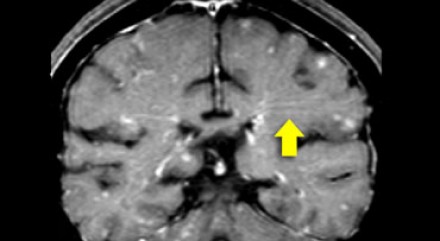
На магнитно-резонансных томограммах продемонстрирована нормальная возрастная картина: расширение борозд, перивентрикулярные «шапочки» (желтая стрелка), «полосы» и точечные очажки в глубоком белом веществе.
Клиническое значение возрастных изменений мозга недостаточно хорошо освещено. Тем не менее, имеется связь между очагами и некоторыми факторами риска возникновения цереброваскулярных расстройств. Одним из самых значительных факторов риска является гипертония, особенно, у пожилых людей.
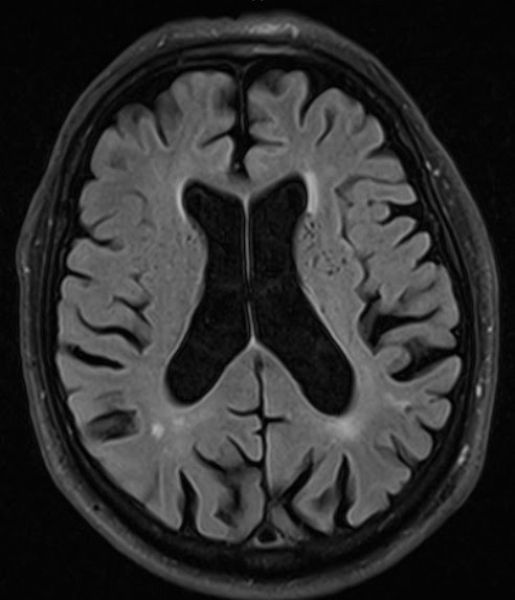
Степень вовлечения белого вещества в соответствии со шкалой Fazekas:
ДИСЦИРКУЛЯТОРНАЯ ЭНЦЕФАЛОПАТИЯ НА МРТ
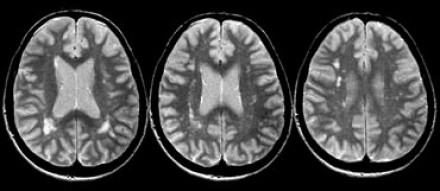
Очаговые изменения белого вещества сосудистого генеза — самая частая МРТ-находка у пациентов пожилого возраста. Они возникают в связи с нарушениями циркуляции крови по мелким сосудам, что является причиной хронических гипоксических/дистрофических процессов в мозговой ткани.
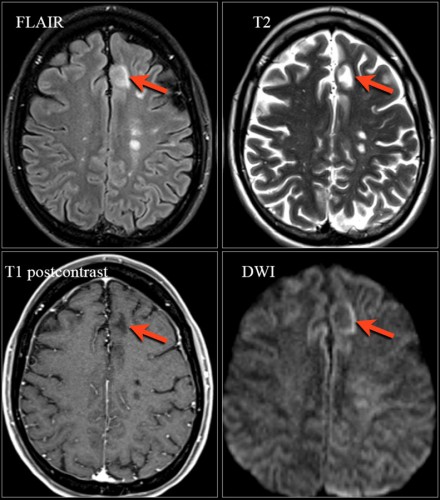
На серии МР-томограмм: множественные гиперинтенсивные участки в белом веществе головного мозга у пациента, страдающего гипертонической болезнью.
На МР-томограммах, представленных выше, визуализируются нарушения МР-сигнала в глубоких отделах больших полушарий. Важно отметить, что они не являются юкставентрикулярными, юкстакортикальными и не локализуются в области мозолистого тела. В отличие от рассеянного склероза, они не затрагивают желудочки мозга или кору. Учитывая, что вероятность развития гипоксически-ишемических поражений априори выше, можно сделать заключение о том, что представленные очаги, вероятнее, имеют сосудистое происхождение.
Только при наличии клинической симптоматики, непосредственно указывающей на воспалительное, инфекционное или иное заболевание, а также токсическую энцефалопатию, становится возможным рассматривать очаговые изменения белого вещества в связи с этими состояниями. Подозрение на рассеянный склероз у пациента с подобными нарушениями на МРТ, но без клинических признаков, признается необоснованным.
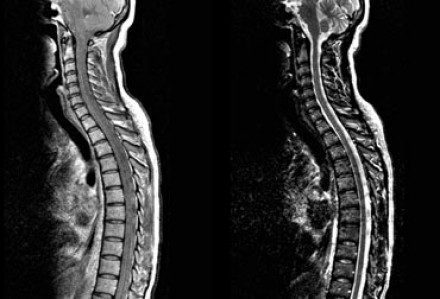
На представленных МР-томограммах патологических участков в спинном мозге не выявлено.
У пациентов, страдающих васкулитами или ишемическими заболеваниями, спинной мозг обычно не изменен, в то время как у пациентов с рассеянным склерозом в более чем 90% случаев обнаруживаются патологические нарушения в спинном мозге. Если дифференциальная диагностика очагов сосудистого характера и рассеянного склероза затруднительна, например, у пожилых пациентов с подозрением на РС, может быть полезна МРТ спинного мозга.
Вернемся снова к первому случаю: на МР-томограммах выявлены очаговые изменения, и сейчас они гораздо более очевидны. Имеет место распространенное вовлечение глубоких отделов полушарий, однако дугообразные волокна и мозолистое тело остаются интактными. Нарушения ишемического характера в белом веществе могут проявляться как лакунарные инфаркты, инфаркты пограничной зоны или диффузные гиперинтенсивные зоны в глубоком белом веществе.
Лакунарные инфаркты возникают в результате склероза артериол или мелких пенетерирующих медуллярных артерий. Инфаркты пограничной зоны возникают в результате атеросклероза более крупных сосудов, например, при каротидной обструкции или вследствие гипоперфузии.
Структурные нарушения артерий головного мозга по типу атеросклероза наблюдаются у 50% пациентов старше 50 лет. Они также могут обнаруживаться и у пациентов с нормальным артериальным давлением, однако более характерны для гипертоников.
САРКОИДОЗ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
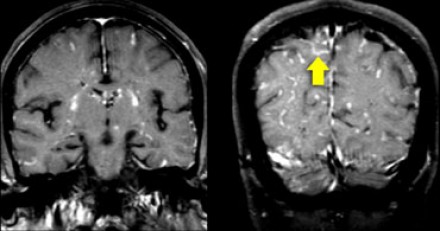
На Т1 взвешенных томограммах с контрастным усилением препаратами гадолиния, выполненных этому же пациенту, что и в предыдущем случае, визуализируются точечные участки накопления контраста в базальных ядрах. Подобные участки наблюдаются при саркоидозе, а также могут быть обнаружены при системной красной волчанке и других васкулитах. Типичным для саркоидоза в этом случае считается лептоменингеальное контрастное усиление (желтая стрелка), которое происходит в результате гранулематозного воспаления мягкой и паутинной оболочки.
Еще одним типичным проявлением в этом же случае является линейное контрастное усиление (желтая стрелка). Оно возникает в результате воспаления вокруг пространств Вирхова-Робина, а также считается одной из форм лептоменингеального контрастного усиления. Таким образом объясняется, почему при саркоидозе патологические зоны имеют схожее распределение с рассеянным склерозом: в пространствах Вирхова-Робина проходят мелкие пенетрирующие вены, которые поражаются при РС.
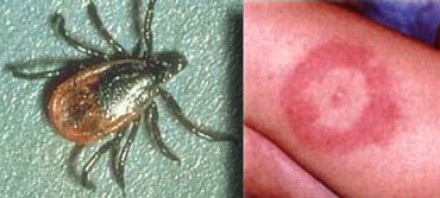
БОЛЕЗНЬ ЛАЙМА (БОРРЕЛИОЗ)
На фотографии справа: типичный вид сыпи на коже, возникающей при укусе клеща (слева) — переносчика спирохет.
Болезнь Лайма, или боррелиоз, вызывают спирохеты (Borrelia Burgdorferi), переносчиком инфекции являются клещи, заражение происходит трансмиссивным путем (при присасывании клеща). В первую очередь при боррелиозе на возникает кожная сыпь. Через несколько месяцев спирохеты могут инфицировать ЦНС, в результате чего появляются патологические участки в белом веществе, напоминающие таковые при рассеянном склерозе. Клинически болезнь Лайма проявляется острой симптоматикой со стороны ЦНС (в том числе, парезами и параличами), а в некоторых случаях может возникать поперечный миелит.
Ключевой признак болезни Лайма — это наличие мелких очажков размером 2-3 мм, симулирующих картину рассеянного склероза, у пациента с кожной сыпью и гриппоподобным синдромом. К другим признакам относится гиперинтенсивный сигнал от спинного мозга и контрастное усиление седьмой пары черепно-мозговых нервов (корневая входная зона).
ПРОГРЕССИРУЮЩАЯ МУЛЬТИФОКАЛЬНАЯ ЛЕЙКОЭНЦЕФАЛОПАТИЯ, ОБУСЛОВЛЕННАЯ ПРИЕМОМ НАТАЛИЗУМАБА
Относительно редкий, но в то же время серьезный побочный эффект приема этого препарата — повышение риска развития ПМЛ. Диагноз ПМЛ основывается на клинических проявлениях, обнаружении ДНК вируса в ЦНС (в частности, в цереброспинальной жидкости), и на данных методов визуализации, в частности, МРТ.
По сравнению с пациентами, у которых ПМЛ обусловлен другими причинами, например, ВИЧ, изменения на МРТ при ПМЛ, связанной с приемом натализумаба, могут быть описаны как однородные и с наличием флюктуации.
Ключевые диагностические признаки при этой форме ПМЛ:
На МРТ видны признаки ПМЛ, обусловленной приемом натализумаба. Изображения любезно предоставлены Bénédicte Quivron, Ла-Лувьер, Бельгия.
Дифференциальная диагностика между прогрессирующим РС и ПМЛ, обусловленной приемом натализумаба, может быть достаточно сложной. Для натализумаб-ассоциированной ПМЛ характерны следующие нарушения:
Дифференциальная диагностика РС и ПМЛ