Фагоцитоз что это такое
Фагоцитоз что это такое
Наиболее важной функцией нейтрофилов и макрофагов является фагоцитоз — поглощение клеткой вредоносного агента. Фагоциты избирательны в отношении материала, который они фагоцитируют; иначе они могли бы фагоцитировать нормальные клетки и структуры организма. Осуществление фагоцитоза зависит главным образом от трех специфических условий.
Во-первых, большинство естественных структур имеют гладкую поверхность, которая препятствует фагоцитозу. Но если поверхность неровная, возможность фагоцитирования возрастает.
Во-вторых, большинство естественных поверхностей имеют защитные белковые оболочки, отталкивающие фагоциты. С другой стороны, большинство погибших тканей и инородных частиц лишены защитных оболочек, что делает их объектом фагоцитоза.
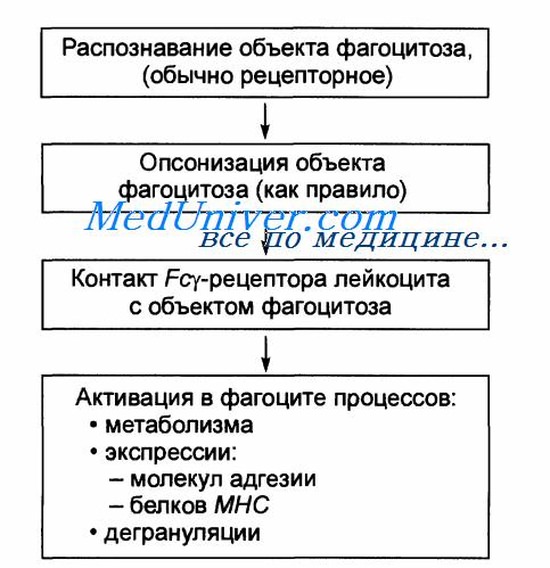
В-третьих, иммунная система организма образует антитела против инфекционных агентов, например бактерий. Антитела прикрепляются к мембранам бактерий, и бактерии становятся особенно чувствительными к фагоцитозу. Для осуществления этой функции молекула антитела также соединяется с продуктом С3 каскада комплемента — дополнительной частью иммунной системы, обсуждаемой в отдельной статье на сайте (просим вас пользоваться формой поиска выше). Молекулы С3, в свою очередь, прикрепляются к рецепторам на мембране фагоцитов, инициируя фагоцитоз. Этот процесс выбора и фагоцитоза называют опсонизацией.
а) Фагоцитоз, осуществляемый нейтрофилами. Нейтрофилы, входящие в ткани, являются уже зрелыми клетками, способными к немедленному фагоцитозу. При встрече с частицей, которая должна быть фагоцитирована, нейтрофил сначала прикрепляется к ней, а затем выпускает псевдоподии во всех направлениях вокруг частицы. На противоположной стороне частицы псевдоподии встречаются и сливаются друг с другом. При этом образуется замкнутая камера, содержащая фагоцитируемую частицу. Затем камера погружается в цитоплазматическую полость и отрывается от наружной стороны клеточной мембраны, формируя свободно плавающий фагоцитарный пузырек (также называемый фагосомои) внутри цитоплазмы. Один нейтрофил обычно может фагоцитировать от 3 до 20 бактерий, прежде чем он сам инактивируется или погибает.
б) Фагоцитоз, осуществляемый макрофагами. Макрофаги представляют собой конечную стадию развития моноцитов, входящих в ткани из крови. При активации иммунной системой они становятся гораздо более мощными фагоцитами, чем нейтрофилы, и часто могут фагоцитировать до 100 бактерий. Макрофаги также способны поглощать гораздо более крупные частицы, даже целые эритроциты и иногда малярийных паразитов, тогда как нейтрофилы не могут фагоцитировать частички, размер которых значительно превышает размер бактерии. Кроме того, макрофаги могут выталкивать конечные продукты и часто живут и функционируют в течение многих месяцев.
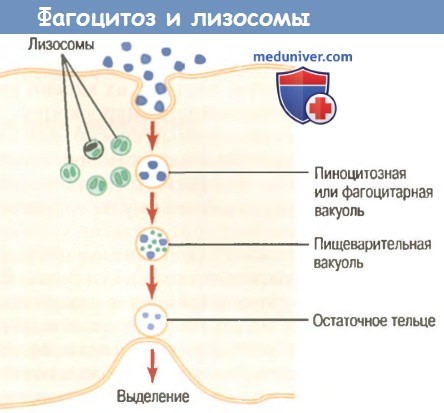
в) Сразу после фагоцитирования большинство частиц перевариваются внутриклеточными ферментами. После фагоцитирования инородной частицы лизосомы и другие цитоплазматические гранулы нейтрофила или макрофага немедленно вступают в контакт с фагоцитарным пузырьком, их мембраны сливаются, в результате в пузырек вбрасываются многие переваривающие ферменты и бактерицидные вещества. Таким образом, фагоцитарный пузырек теперь становится переваривающим пузырьком, и сразу начинается расщепление фагоцитированной частицы.
И нейтрофилы, и макрофаги содержат громадное количество лизосом, наполненных протеолитическими ферментами, особенно приспособленными для переваривания бактерий и других чужеродных белковых веществ. Лизосомы макрофагов (но не нейтрофилов) содержат также большое количество липаз, которые разрушают толстые липидные мембраны, покрывающие некоторые бактерии, например туберкулезную палочку.
Однако некоторые бактерии, особенно туберкулезная палочка, имеют оболочки, устойчивые к лизосомальному перевариванию, и к тому же секретируют вещества, отчасти препятствующие «убивающим» эффектам нейтрофилов и макрофагов. Такие бактерии ответственны за многие хронические болезни, например туберкулез.
Видео стадии фагоцитоза и питание клетки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
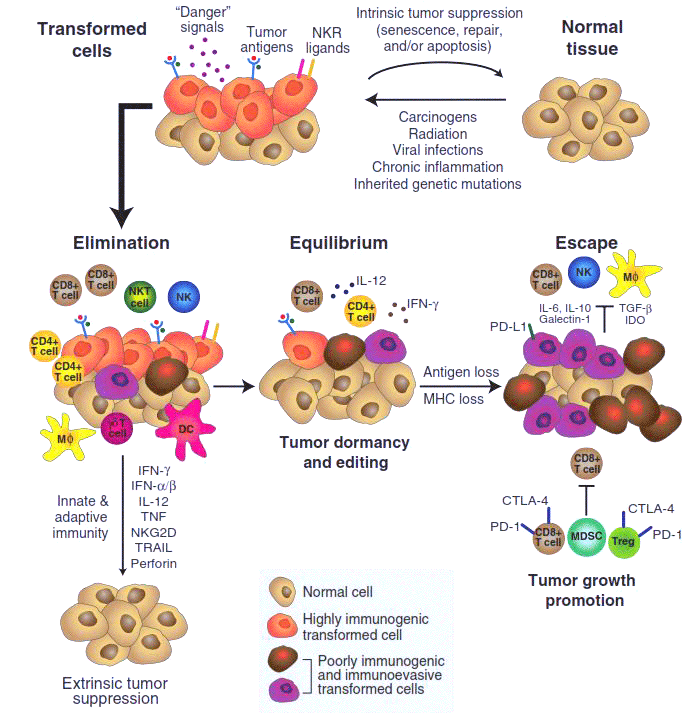
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
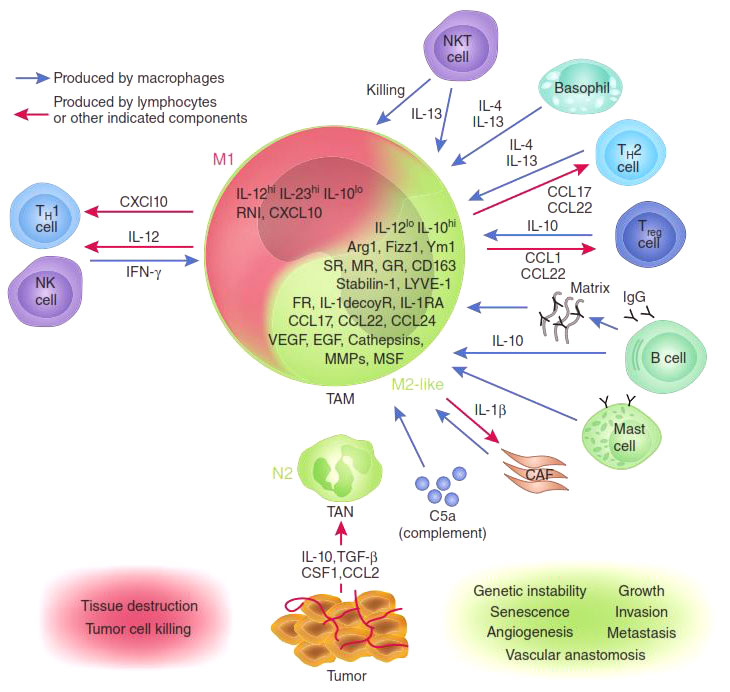
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Клетки иммунной системы и типы иммунитета
РАБОТА КЛЕТОК ИММУННОЙ СИСТЕМЫ, ИММУНИТЕТ И АЛЛЕРГИЯ
Часть 1. ЛЕЙКОЦИТЫ, ГРАНУЛОЦИТЫ, МОНОЦИТАРНО-МАКРОФАГАЛЬНАЯ СИСТЕМА И ВОСПАЛЕНИЕ
Наш организм имеет специфическую систему для борьбы с разными инфекционными и токсическими агентами. Она включает лейкоциты (белые клетки крови) и тканевые клетки, происходящие из лейкоцитов. С целью предупреждения болезни эти клетки работают вместе: (1) непосредственно разрушая вторгшиеся бактерии или вирусы с помощью фагоцитоза; (2) формируя антитела и активированные лимфоциты, способные разрушать или инактивировать внедрившийся агент. Данная часть 1 посвящена первому из этих путей.
1.1. ЛЕЙКОЦИТЫ (БЕЛЫЕ КЛЕТКИ КРОВИ)
Лейкоциты, называемые также белыми клетками крови, являются подвижными единицами защитной системы организма. Они формируются в костном мозге (гранулоциты, моноциты и некоторые лимфоциты) и в лимфоидной ткани (лимфоциты и плазматические клетки). После формирования лейкоциты транспортируются в кровь к разным частям тела, где они необходимы.
Важным свойством лейкоцитов является их способность перемещаться к областям инфицирования и воспаления, обеспечивая быструю и мощную защиту против инфекционных агентов. Как мы увидим позже, гранулоциты и моноциты имеют особую способность «разыскивать и разрушать» внедрившихся инородных «оккупантов».
ТИПЫ БЕЛЫХ КЛЕТОК КРОВИ
В норме в крови присутствуют шесть типов белых клеток крови: полиморфноядерные нейтрофилы, полиморфноядерные эозинофилы, полиморфноядерные базофилы, моноциты, лимфоциты и иногда — плазматические клетки. Кроме того, существует большое количество тромбоцитов представляющих фрагменты клеток другого типа — мегакариоцитов, которые, подобно лейкоцитам, обнаруживают в костном мозге. Первые три типа клеток имеют зернистость, как в клетках 7, 10 и 12 на рис. 1, поэтому их называют гранулоцитами или, согласно клинической терминологии, полиморфноядерными клетками из-за многочисленных ядер.
Рис. 1. Разные клетки миелоцитарного ряда: 1 – миелобласт; 2 – промиелоцит; 3 – мегакариоцит; 4 — нейтрофильный миелоцит; 5 — молодой нейтрофильный метамиелоцит; 6 – палочкоядерный нейтрофильный метамиелоцит; 7 – полиморфноядерный нейтрофил; 8 – эозинофильный миелоцит; 9 – эозинофильный метамиелоцит; 10 – полиморфноядерный эозинофил; 11 – базофильный миелоцит; 12 – полиморфноядерный базофил; 13-16 — стадии формирования моноцитов
Гранулоциты и моноциты защищают организм от внедряющихся агентов, главным образом путем их поглощения, т.е. фагоцитоза. Лимфоциты и плазматические клетки функционируют в основном в связи с иммунной системой. Наконец, специфической функцией тромбоцитов является активация механизма свертывания крови.
КОНЦЕНТРАЦИИ РАЗНЫХ ТИПОВ ЛЕЙКОЦИТОВ В КРОВИ
Взрослый человек имеет около 7000 белых клеток крови на микролитр крови (сравните с 5 млн красных клеток крови). По отношению к общему количеству лейкоцитов нормальное процентное содержание разных их типов приблизительно следующее.
Количество тромбоцитов, которые являются лишь фрагментами клеток, в каждом микролитре крови в норме — около 300000.
1.2. ПРОИСХОЖДЕНИЕ БЕЛЫХ КЛЕТОК КРОВИ
Ранняя дифференцировка полипотентной гемопоэтической стволовой клетки в разные типы коммитированных стволовых клеток показана на рис. 2.
Рис. 2. Ранняя дифференцировка полипотентной гемопоэтической стволовой клетки в разные типы коммитированных стволовых клеток
Помимо клеток, предназначенных для образования эритроцитов, формируются два основных направления дифференцировки белых клеток крови: миелоцитарное и лимфоцитарное. Слева на рис. 1 показано миелоцитарное направление дифференцировки, начинающееся с миелобласта; справа показано лимфоцитарное направление дифференцировки, начинающееся с лимфобласта.
Гранулоциты и моноциты формируются только в костном мозге. Лимфоциты и плазматические клетки образуются главным образом в разных лимфогенных тканях, особенно в лимфатических железах, селезенке, тимусе, миндалинах и в разнообразных очагах лимфоидной ткани повсюду в теле, например в костном мозге и так называемых пейеровых бляшках под эпителием кишечной стенки.
Лейкоциты, сформированные в костном мозге, хранятся там до тех пор, пока не возникнет необходимость их выхода в систему кровообращения. Выход осуществляется под действием различных факторов, которые обсуждаются далее. В норме в костном мозге хранятся примерно в 3 раза больше лейкоцитов по сравнению с количеством этих клеток, циркулирующих в крови. Это составляет примерно 6-суточный запас лейкоцитов.
Лимфоциты хранятся главным образом в различных лимфоидных тканях, за исключением небольшого их числа, временно транспортируемого в кровь.
ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ БЕЛЫХ КЛЕТОК КРОВИ
Жизнь гранулоцитов после их выделения из костного мозга в норме продолжается 4-8 ч в циркулирующей крови и еще 4-5 сут в тканях, которые в них нуждаются. Во время тяжелой тканевой инфекции этот общий срок жизни часто укорачивается до нескольких часов, поскольку гранулоциты поступают еще быстрее в инфицированную область, выполняют свои функции и в процессе этого саморазрушаются.
Моноциты тоже имеют короткий транзитный период, находясь в крови 10-20 ч, затем выходят через мембраны капилляров в ткани. В тканях размер моноцитов значительно увеличивается, они становятся тканевыми макрофагами, и в такой форме могут жить месяцами до тех пор, пока не разрушатся во время выполнения фагоцитарной функции. Тканевые макрофаги составляют основу тканевой макрофагальной системы, которая обеспечивает постоянную защиту против инфекции, что подробно обсуждается далее.
Лимфоциты постоянно поступают в систему кровообращения вместе с дренажом лимфы из лимфатических узлов и другой лимфоидной ткани. Через несколько часов они выходят из крови в ткани путем диапедеза. Затем лимфоциты вновь входят в лимфу и опять возвращаются в кровь; так происходит постоянная циркуляция лимфоцитов в теле. Срок жизни лимфоцитов составляет недели или месяцы в зависимости от потребности организма в этих клетках.
Тромбоциты в крови заменяются примерно каждые 10 сут; другими словами, каждые сутки формируются примерно 30000 пластинок на каждый микролитр крови.
1.3. НЕЙТРОФИЛЫ И МАКРОФАГИ ЗАЩИЩАЮТ ОТ ИНФЕКЦИЙ
Видео: Роль фагоцитов во врожденном или неспецифическом иммунитете
Если видео не отображается оно доступно по ссылке →
Именно нейтрофилы и тканевые макрофаги в основном атакуют и разрушают внедрившиеся бактерии, вирусы и другие вредоносные агенты. Нейтрофилы — зрелые клетки, способные атаковать и разрушать бактерии даже в циркулирующей крови. Наоборот, тканевые макрофаги начинают жизнь как моноциты крови и, пока они находятся в крови, являются незрелыми клетками с низкой способностью к борьбе с инфекционными агентами. Однако сразу после выхода в ткани моноциты начинают разбухать, иногда увеличиваясь в диаметре в 5 раз до размера, видимого невооруженным глазом — 60-80 мкм. Теперь эти клетки называют макрофагами, и они обладают очень высокой способностью бороться с внутритканевыми болезнетворными агентами.
КРАТКО О МАКРОФАГАХ

На рисунке слева: Макрофаг, протягивающий свои «руки», чтобы поглотить две частицы, возможно патогенные, в Мыши.
Эти крупные фагоциты обнаруживаются в основном во всех тканях, где они патрулируют потенциальные патогены амебоидным движением. Они принимают различные формы (с различными названиями) по всему организму, но все они являются частью системы мононуклеарных фагоцитов.
Помимо фагоцитоза, они играют важную роль в неспецифической защите (врожденный иммунитет), а также помогают инициировать специфические защитные механизмы (адаптивный иммунитет), рекрутируя другие иммунные клетки, такие как лимфоциты. Например, они важны в качестве носителей антигена для Т-клетки.
Помимо усиления воспаления и стимуляции иммунной системы, макрофаги также играют важную противовоспалительную роль и могут снижать иммунные реакции за счет высвобождения цитокинов. Макрофаги которые ободряют воспаление вызваны макрофагами М1, тогда как те которые уменьшают воспаление и ободряют ремонт ткани вызваны макрофагами М2.
Это различие отражается на их метаболизме; макрофаги М1 обладают уникальной способностью метаболизировать аргинин до молекулы «киллера» оксида азота, в то время как макрофаги грызуна М2 обладают уникальной способностью метаболизировать аргинин до «ремонтной» молекулы орнитина. Однако эта дихотомия была недавно поставлена под сомнение, поскольку была обнаружена дальнейшая сложность…
Подробнее о перепрограммировании метаболических путей макрофагов см. по ссылке →
Белые клетки крови продвигаются через тканевые пространства амебоидными движениями. И нейтрофилы, и макрофаги могут двигаться через ткани амебоидными движениями. Некоторые клетки двигаются со скоростью, достигающей 40 мкм/мин, т.е. каждую минуту перемещаются на расстояние, равное их собственной длине.
Белые клетки крови притягиваются к области воспаления путем хемотаксиса. Многие химические вещества в тканях заставляют нейтрофилы и макрофаги двигаться по направлению к источнику химического агента. Этот феномен, показанный на рис. 33-2, известен как хемотаксис. При воспалении ткани формируется, по крайней мере, дюжина разных продуктов, способных вызывать хемотаксис по направлению к воспаленной области. К таким веществам относят: (1) некоторые из бактериальных или вирусных токсинов; (2) продукты дегенерации самих воспаленных тканей; (3) некоторые продукты реакции системы комплемента, активируемой в воспаленных тканях; (4) некоторые продукты взаимодействия, возникающие при свертывании плазмы в воспаленной области, и другие вещества.
ФАГОЦИТОЗ
Наиболее важной функцией нейтрофилов и макрофагов является фагоцитоз — поглощение клеткой вредоносного агента. Фагоциты избирательны в отношении материала, который они фагоцитируют; иначе они могли бы фагоцитировать нормальные клетки и структуры организма. Осуществление фагоцитоза зависит главным образом от трех специфических условий.
Во-первых, большинство естественных структур имеют гладкую поверхность, которая препятствует фагоцитозу. Но если поверхность неровная, возможность фагоцитирования возрастает.
Во-вторых, большинство естественных поверхностей имеют защитные белковые оболочки, отталкивающие фагоциты. С другой стороны, большинство погибших тканей и инородных частиц лишены защитных оболочек, что делает их объектом фагоцитоза.
В-третьих, иммунная система организма образует антитела против инфекционных агентов, например бактерий. Антитела прикрепляются к мембранам бактерий, и бактерии становятся особенно чувствительными к фагоцитозу. Для осуществления этой функции молекула антитела также соединяется с продуктом С3 каскада комплемента — дополнительной частью иммунной системы, обсуждаемой в следующей главе. Молекулы С3, в свою очередь, прикрепляются к рецепторам на мембране фагоцитов, инициируя фагоцитоз. Этот процесс выбора и фагоцитоза называют опсонизацией.
Фагоцитоз, осуществляемый нейтрофилами. Нейтрофилы, входящие в ткани, являются уже зрелыми клетками, способными к немедленному фагоцитозу. При встрече с частицей, которая должна быть фагоцитирована, нейтрофил сначала прикрепляется к ней, а затем выпускает псевдоподии во всех направлениях вокруг частицы. На противоположной стороне частицы псевдоподии встречаются и сливаются друг с другом. При этом образуется замкнутая камера, содержащая фагоцитируемую частицу. Затем камера погружается в цитоплазматическую полость и отрывается от наружной стороны клеточной мембраны, формируя свободно плавающий фагоцитарный пузырек (также называемый фагосомой) внутри цитоплазмы. Один нейтрофил обычно может фагоцитировать от 3 до 20 бактерий, прежде чем он сам инактивируется или погибает.
Фагоцитоз, осуществляемый макрофагами. Макрофаги представляют собой конечную стадию развития моноцитов, входящих в ткани из крови. При активации иммунной системой они становятся гораздо более мощными фагоцитами, чем нейтрофилы, и часто могут фагоцитировать до 100 бактерий. Макрофаги также способны поглощать гораздо более крупные частицы, даже целые эритроциты и иногда малярийных паразитов, тогда как нейтрофилы не могут фагоцитировать частички, размер которых значительно превышает размер бактерии. Кроме того, макрофаги могут выталкивать конечные продукты и часто живут и функционируют в течение многих месяцев.
Сразу после фагоцитирования большинство частиц перевариваются внутриклеточными ферментами. После фагоцитирования инородной частицы лизосомы и другие цитоплазматические гранулы нейтрофила или макрофага немедленно вступают в контакт с фагоцитарным пузырьком, их мембраны сливаются, в результате в пузырек вбрасываются многие переваривающие ферменты и бактерицидные вещества. Таким образом, фагоцитарный пузырек теперь становится переваривающим пузырьком, и сразу начинается расщепление фагоцитированной частицы.
И нейтрофилы, и макрофаги содержат громадное количество лизосом, наполненных протеолитинескими ферментами, особенно приспособленными для переваривания бактерий и других чужеродных белковых веществ. Лизосомы макрофагов (но не нейтрофилов) содержат также большое количество липаз, которые разрушают толстые липидные мембраны, покрывающие некоторые бактерии, например туберкулезную палочку.
И нейтрофилы, и макрофаги могут уничтожать бактерии. Кроме переваривания поглощенных бактерий в фагосомах нейтрофилы и макрофаги содержат бактерицидные агенты, уничтожающие большинство бактерий, даже если лизосомальные ферменты не могут их переварить. Это особенно важно, поскольку некоторые бактерии имеют защитные оболочки или другие факторы, предупреждающие их разрушение пищеварительными ферментами. Основная часть «убивающего» эффекта связана с действием некоторых мощных окислителей, образуемых в больших количествах ферментами мембраны фагосомы, или специфической органеллой, называемой пероксисомой. К этим окислителям относятся супероксид (О2 – ), пероксид водорода (Н2О2) и гидроксильные ионы (-ОН – ), каждый из них даже в небольших количествах смертелен для большинства бактерий. Кроме того, один из лизосомальных ферментов — миелопероксидаза — катализирует реакцию между Н2О2 и ионами Cl – с образованием гипохлорита — мощного бактерицидного агента.
Однако некоторые бактерии, особенно туберкулезная палочка, имеют оболочки, устойчивые к лизосомальному перевариванию, и к тому же секретируют вещества, отчасти препятствующие «убивающим» эффектам нейтрофилов и макрофагов. Такие бактерии ответственны за многие хронические болезни, например туберкулез.
1.4. МОНОЦИТАРНО-МАКРОФАГАЛЬНАЯ КЛЕТОЧНАЯ СИСТЕМА (РЕТИКУЛОЭНДОТЕЛИАЛЬНАЯ СИСТЕМА)
Макрофаги в основном обсуждаются как мобильные клетки, способные блуждать в тканях. Однако большая часть моноцитов после попадания их в ткани и превращения в макрофаги прикрепляется к тканям и остается прикрепленной в течение нескольких месяцев и даже лет до тех пор, пока они не понадобятся для выполнения специфических местных защитных функций. Как и мобильные макрофаги, они способны фагоцитировать большое количество бактерий, вирусов, некротических тканей или других инородных частиц. При соответствующей стимуляции фиксированные макрофаги могут отрываться от мест их прикрепления и вновь становиться мобильными макрофагами, реагирующими на хемотаксис и другие стимулы, связанные с воспалительным процессом. Таким образом, организм имеет широко распространенную моноцитарно-макрофагальную систему фактически во всех тканевых областях.
Общую совокупность моноцитов, мобильных макрофагов, фиксированных тканевых макрофагов и некоторых специализированных эндотелиальных клеток костного мозга, селезенки и лимфатических узлов называют ретикулоэндотелиальной системой. Однако все или почти все эти клетки происходят из моноцитарных стволовых клеток; следовательно, ретикулоэндотелиальная система практически синонимична моноцитарно-макрофагальной системе. Поскольку термин ретикулоэндотелиальная система гораздо более распространен в медицинской литературе, чем термин моноцитарно-макрофагальная система, его следует понимать как генерализованную фагоцитарную систему, локализованную во всех тканях, особенно в тех тканевых областях, где должны разрушаться большие количества частиц, токсинов и других нежелательных веществ.
ТКАНЕВЫЕ МАКРОФАГИ В КОЖЕ И ПОДКОЖНЫХ ТКАНЯХ (ГИСТИОЦИТЫ)
Нормальная кожа в основном недоступна для инфекционных агентов, но при ее повреждении возможно инфицирование подкожной ткани, в результате развивается локальное воспаление. Местные тканевые макрофаги могут делиться in situ (на своем месте) и формировать еще больше макрофагов. Затем они выполняют обычные функции, атакуя и разрушая инфекционные агенты, как было изложено ранее.
МАКРОФАГИ В ЛИМФАТИЧЕСКИХ УЗЛАХ
По существу ни один корпускулярный материал, попавший в ткани, например бактерии, не может проходить непосредственно через капиллярные мембраны в кровь. Вместо этого, если частицы не разрушились местно в тканях, они входят в лимфу и текут к лимфатическим узлам, расположенным периодически вдоль хода лимфооттока. Чужеродные частицы задерживаются в этих узлах, в сетчатой структуре их синусов, выстланных тканевыми макрофагами.
На рис. 3 показана общая организация лимфатического узла. Видно, что по приносящим лимфатическим сосудам лимфа проходит через капсулу лимфатического узла, затем течет через синусы мозгового вещества узла и через ворота поступает в выносящие лимфатические сосуды, которые в итоге опорожняются в венозную кровь.
Рис. 3. Функциональная схема лимфатического узла [Ham A.W. Histology, 6th ed. Philadelphia: JB Lippincott, 1969: Gartner LP, Hiatt J.L. Color Textbook of Histology, 2nd ed. Philadelphia, WB Saunders, 2001; с измен.]
Большое число макрофагов выстилают синусы лимфатических узлов, и когда любые частицы входят в синусы с лимфой, макрофаги фагоцитируют их и предупреждают распространение по всему телу.
АЛЬВЕОЛЯРНЫЕ МАКРОФАГИ В ЛЕГКИХ
Патогенные организмы часто поступают в организм через легкие. Многочисленные тканевые макрофаги являются неотъемлемыми компонентами альвеолярных стенок. Они могут фагоцитировать частицы, попавшие в альвеолы. Если частицы поддаются расщеплению, макрофаги переваривают их и выделяют конечные продукты в лимфу. Если частицы не поддаются перевариванию, макрофаги часто формируют вокруг них капсулу, создавая «гигантскую клетку», внутри которой частицы остаются до тех пор, пока они медленно не растворятся (если это когда-либо произойдет). Такие капсулы часто формируются вокруг туберкулезных палочек, частичек кремниевой пыли и даже частичек угля.
МАКРОФАГИ ( КЛЕТКИ КУПФЕРА ) В СИНУСОИДАХ ПЕЧЕНИ
Еще одним наиболее распространенным путем проникновения бактерий в организм является желудочно-кишечный тракт. Большое число бактерий из проглоченной пищи постоянно проходит через слизистую желудочно-кишечного тракта в кровь воротной вены. Прежде чем эта кровь попадет в общую систему кровообращения, она проходит через синусоиды печени, выстланные тканевыми макрофагами, или клетками Купфера, которые показаны на рис. 4. Эти клетки формируют такую эффективную систему фильтрации частиц, что практически ни одной бактерии из желудочно-кишечного тракта не удается пройти с кровью воротной вены в системный кровоток. Действительно, киносъемка фагоцитоза клетками Купфера показала, что фагоцитоз одной бактерии осуществляется менее чем за 1/100 сек.
Рис. 4. Клетки Купфера, выстилающие синусоиды печени, показаны в виде клеток, которые фагоцитировали в цитоплазму частицы туши [Copenhaver W.M. et al. Bailey’s Textbook of Histology, 10th ed. Baltimore: Williams & Wilkins, 1971; с измен.]
МАКРОФАГИ СЕЛЕЗЕНКИ И КОСТНОГО МОЗГА
Если патогенному организму удалось войти в общую систему кровообращения, существуют другие «линии обороны» тканевой макрофагальной системы, представленные в основном макрофагами селезенки и костного мозга. Макрофаги захватываются ретикулярной сетью этих органов, и при контакте с макрофагами инородные частицы здесь фагоцитируются.
Рис. 5. Функциональные структуры селезенки [Bloom W, Fawcett D.W. A Textbook of Histology, 10thed. Philadelphia: WB Saunders, 1975]
Селезенка похожа на лимфатические узлы, за исключением того, что через ее тканевые пространства течет кровь, а не лимфа. На рис. 5 показан участок периферического сегмента ткани селезенки. Видно, что небольшая артерия проникает через селезеночную капсулу в пульпу селезенки и заканчивается небольшими капиллярами. Эти капилляры имеют крупные поры, позволяющие цельной крови выходить из капилляров в тяжи красной пульпы. Затем кровь постепенно просачивается через трабекулярную сеть этих тяжей и в результате возвращается в кровоток через эндотелиальные стенки венозных синусов. Трабекулы красной пульпы, как и венозные синусы, выстланы огромным количеством макрофагов. Этот своеобразный проход крови через тяжи красной пульпы обеспечивает исключительный способ фагоцитирования нежелательных элементов, имеющихся в крови, включая старые и поврежденные красные клетки крови.
1.5. ВОСПАЛЕНИЕ. РОЛЬ НЕЙТРОФИЛОВ И МАКРОФАГОВ
Видео: Воспалительная реакция
Если видео не отображается, оно доступно по ссылке →
ВОСПАЛЕНИЕ
При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением.
Воспаление характеризуется: (1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком; (2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство; (3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров; (4) миграцией большого числа гранулоцитов и моноцитов в ткани; (5) отеком тканевых клеток. К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками. Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
«Ограждающий» эффект воспаления. Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу. Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.
РЕАКЦИИ МАКРОФАГОВ И НЕЙТРОФИЛОВ ВО ВРЕМЯ ВОСПАЛЕНИЯ
Тканевые макрофаги – первая «линия обороны» против инфекции. В течение нескольких минут после начала воспаления макрофаги, уже присутствующие в тканях, немедленно начинают свое фагоцитарное действие, будь то гистиоциты в подкожных тканях, альвеолярные макрофаги в легких, микроглия в мозге или др. При активации продуктами инфицирования и воспаления первым эффектом является быстрое увеличение каждого из макрофагов. Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
Рис. 6. Движение нейтрофилов путем диапедеза через поры капилляров и путем хемотаксиса по направлению к области повреждения ткани
Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции: (1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области. Этот эффект, показанный на рис. 2, называют маргинацией (или краевым стоянием лейкоцитов); (2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедезанепосредственно из крови в тканевые пространства; (3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
Резкое увеличение количества нейтрофилов в крови – нейтрофилия. В течение нескольких часов после начала острого, тяжелого воспаления количество нейтрофилов в крови возрастает иногда в 4-5 раз, т.е. от нормального количества 4000-5000 до 15000-25000 нейтрофилов в 1 мкл. Это состояние называют нейтрофилией, что означает увеличение количества нейтрофилов в крови. Нейтрофилия вызывается продуктами воспаления, которые входят в кровоток, транспортируются к костному мозгу и там действуют на резервные нейтрофилы костного мозга, заставляя их выходить в циркулирующую кровь. Это обеспечивает возможность доставки еще большего числа нейтрофилов в воспаленную тканевую область.
Вторичная инвазия макрофагов в воспаленную ткань является третьей «линией обороны». Вместе с инвазией нейтрофилов моноциты поступают из крови в воспаленную ткань и увеличиваются, становясь макрофагами. Однако количество моноцитов в циркулирующей крови низкое; запас моноцитов в костном мозге также гораздо меньший, чем запас нейтрофилов. Следовательно, увеличение количества макрофагов в воспаленной ткани происходит значительно медленнее, чем нейтрофилов, и требует нескольких дней, чтобы стать эффективным. Более того, даже после внедрения в воспаленную ткань моноциты являются еще незрелыми клетками, и нужно 8 ч или более для разбухания их до значительных размеров и развития громадного количества лизосом; только тогда они приобретают характерную для тканевых макрофагов высокую способность к фагоцитозу. Однако на протяжении периода от нескольких дней до нескольких недель макрофаги становятся преобладающими фагоцитарными клетками воспаленной области из-за значительного увеличения продукции новых моноцитов костным мозгом, что будет объяснено далее.
Как уже подчеркивалось, в сравнении с нейтрофилами макрофаги могут фагоцитировать гораздо больше бактерий (примерно в 5 раз) и значительно более крупные частицы, включая даже сами нейтрофилы и большое количество некротизированной ткани. Кроме того, макрофаги играют важную роль в инициации развития антител.
Увеличение продукции гранулоцитов и моноцитов костным мозгом является четвертой «линией обороны». Это происходит в связи со стимуляцией гранулоцитарных и моноцитарных клеток-предшественников костного мозга. Однако требуются 3-4 сут, прежде чем вновь сформированные гранулоциты и моноциты достигнут стадии, когда они покидают костный мозг. Если стимул из воспаленной ткани продолжает действовать, костный мозг может непрерывно производить эти клетки в огромных количествах в течение нескольких месяцев и даже лет, иногда со скоростью, в 20-50 раз превышающей норму.
Регуляция реакций макрофагов и нейтрофилов по принципу обратной связи. В настоящее время известно более двух дюжин факторов, участвующих в регуляции реакции макрофагов на воспаление, пять из них, как полагают, играют доминирующую роль. Они представлены на рис. 7 и включают: (1) фактор некроза опухоли (ФНО); (2) интерлейкин-1 (ИЛ-1); (3) гранулоцитарно-моноцитарный колониестимупирующий фактор (ГМ- КСФ); (4) гранулоцитарный колониестимулирующий фактор (Г-КСФ); (5) моноцитарный колониестимулирующий фактор (М-КСФ).
Рис. 7. Регуляция формирования гранулоцитов и моноцитов-макрофагов костным мозгом с помощью множества факторов роста, выделяемых из активированных макрофагов в воспаленной ткани. Г-КСФ – гранулоцитарный колониестимулирующий фактор, ГМ-КСФ – гранулоцитарно-моноцитарный колониестимулирующий фактор, ИЛ-1 — интерлейкин-1, М-КСФ — моноцитарный колониестимулирующий фактор, ФНО – фактор некроза опухоли
Эти факторы формируются активированными макрофагальными клетками и в меньших количествах — другими клетками воспаленной ткани.
Основными стимуляторами увеличения продукции гранулоцитов и моноцитов костным мозгом являются три колониестимулирующих фактора, один из которых (ГМ-КСФ) повышает продукцию и гранулоцитов, и моноцитов; два других (Г-КСФ и М-КСФ) усиливают продукцию гранулоцитов и моноцитов, соответственно. Эта совокупность ФНО, ИЛ-1 и колониестимулирующих факторов обеспечивает мощный механизм обратной связи, который начинается с воспаления ткани и развивается до формирования большого количества защитных белых клеток крови, которые помогают удалять причину воспаления.
ОБРАЗОВАНИЕ ГНОЯ
Когда нейтрофилы и макрофаги поглощают большое количество бактерий и некротической ткани, практически все нейтрофилы и многие (но не большинство) макрофаги погибают. Через несколько дней в воспаленной ткани часто формируется полость, содержащая различные части некротизированной ткани, погибшие нейтрофилы и макрофаги, а также тканевую жидкость. Эту смесь обычно называют гноем. После прекращения инфекционного процесса мертвые клетки и некротическая ткань в гное постепенно, в течение нескольких дней растворяются, а конечные продукты в итоге всасываются в окружающие ткани и лимфу до тех пор, пока большинство признаков повреждения ткани не исчезнут.
1.6. ЭОЗИНОФИЛЫ
В норме эозинофилы составляют около 2% всех лейкоцитов крови. Эозинофилы — слабые фагоциты и способны к хемотаксису, но в отличие от нейтрофилов значение эозинофилов в защите против обычных типов инфицирования сомнительно.
Однако у людей с паразитарными инфекциями часто образуется большое число эозинофилов, которые мигрируют в ткани, пораженные паразитами. Хотя большинство паразитов слишком велики, чтобы их могли поглотить эозинофилы или любые другие клетки-фагоциты, эозинофилы способны прикрепляться к паразитам с помощью специфических поверхностных молекул и выделять вещества, губительные для многих из них. Например, одной из наиболее распространенных паразитарных инфекций является шистосомоз, которым страдает треть населения в некоторых развивающихся странах. Паразит, вызывающий эту инфекцию, может проникать в любую часть тела. Эозинофилы прикрепляются к незрелым формам паразитов и уничтожают многих из них несколькими способами: (1) выделением гидролитических ферментов из гранул, представляющих собой модифицированные лизосомы; (2) выделением высокореактивных форм кислорода, особенно губительных для паразитов; (3) выделением из гранул полипептида, убивающего личинки, который называют главным основным белком.
В некоторых районах мира эозинофилию вызывает другое паразитарное заболевание — трихинеллез. Оно возникает в результате проникновения в мышцы тела паразита трихинеллы (Trichinella, или «свиной червь») после того, как человек съедает плохо проваренную свинину.
Эозинофилы обычно собираются также в тканях, где осуществляются аллергические реакции, например в перибронхиальных тканях легких у людей с астмой и в коже после аллергических кожных реакций. Частично это связано с фактом участия в аллергических реакциях многих тучных клеток и базофилов, которые мы обсудим в следующем разделе. Тучные клетки и базофилы выделяют эозинофилъный хемотаксический фактор, заставляющий эозинофилы мигрировать по направлению к ткани, воспаленной в связи с аллергической реакцией. Полагают, что эозинофилы нейтрализуют некоторые из вызывающих воспаление веществ, выделяемых тучными клетками и базофилами и, вероятно, фагоцитируют и разрушают комплексы аллерген-антитело, предупреждая чрезмерное распространение местного воспалительного процесса.
1.7. БАЗОФИЛЫ
Базофилы циркулирующей крови похожи на большие тканевые тучные клетки, локализованные непосредственно снаружи капилляров. И тучные клетки, и базофилы высвобождают в кровь гепарин — вещество, способное предупреждать свертывание крови.
Эти клетки выделяют также гистамин и небольшое количество брадикинина и серотонина. В воспаленных тканях именно тучные клетки в основном высвобождают эти вещества.
Тучные клетки и базофилы играют чрезвычайно важную роль в некоторых типах аллергических реакций, поскольку вызывающий эти реакции особый тип антител — иммуноглобулин Е (IgE) — имеет специфическую способность прикрепляться к тучным клеткам и базофилам. Когда впоследствии специфический антиген реагирует со специфическим IgE антителом, возникающее в результате прикрепление антигена к антителу заставляет тучную клетку или базофил разрываться и выделять очень большие количества гистамина, брадикинина, серотонина, гепарина, медленно действующей анафилактической субстанции и ряда лизосомалъных ферментов. Они вызывают локальные сосудистые и тканевые реакции, лежащие в основе большинства аллергических реакций.
1.8. ЛЕЙКОПЕНИЯ
Иногда возникает клиническое состояние, известное как лейкопения, при котором костный мозг продуцирует очень мало лейкоцитов, оставляя организм незащищенным против многих бактерий и других агентов, способных проникать в ткани.
В норме организм человека живет в симбиозе со многими бактериями, поскольку все слизистые мембраны тела постоянно подвергаются действию большого количества бактерий. Во рту почти всегда находятся различные спирохетозные, пневмококковые и стрептококковые бактерии, такие же бактерии в меньшей степени присутствуют по ходу дыхательных путей. Дистальный отдел желудочно-кишечного тракта особенно нагружен палочками толстой кишки. Более того, всегда можно найти бактерии на поверхности глаз, уретры и вагины. Любое снижение количества лейкоцитов немедленно позволяет уже имеющимся бактериям внедриться в прилежащие ткани.
В течение 2 сут после прекращения продукции лейкоцитов костным мозгом у человека обычно появляются язвы во рту и толстой кишке или развивается какая-либо форма тяжелой респираторной инфекции. Из язв бактерии быстро проникают в окружающие ткани и кровь. Без лечения человек часто погибает менее чем через неделю после начала острой тотальной лейкопении.
При облучении организма рентгеновскими или гамма-лучами или под воздействием лекарств и химических веществ, содержащих бензольные или антраценовые ядра, вероятно возникновение аплазии костного мозга. Очень редко лейкопению и, следовательно, все инфекционные последствия этого поражения вызывают некоторые распространенные лекарства, например хлорамфеникол (антибиотик), тиоурацил (используемый для лечения тиреотоксикоза) и даже разные снотворные-барбитураты.
После умеренного лучевого поражения костного мозга некоторые стволовые клетки, миелобласты и гемоцитобласты могут сохраниться в костном мозге, что дает ему возможность регенерировать при наличии достаточного времени. У больного, которого должным образом лечат переливаниями крови, а также антибиотиками и другими лекарственными средствами для предупреждения инфекции, обычно в течение нескольких недель или месяцев развивается достаточный объем нового костного мозга для возвращения концентрации клеток крови к нормальным значениям.
1.9. ЛЕЙКЕМИИ
Неконтролируемая продукция белых клеток крови может быть вызвана канцерогенной мутацией миелогенной или лимфогенной клетки. Это ведет к лейкемии, которая обычно характеризуется значительно увеличенным количеством аномальных лейкоцитов в циркулирующей крови.
Типы лейкемий. Лейкемии делятся на два основных типа: лимфоцитарная лейкемия (лимфолейкоз) и миелоидная лейкемия (миелолейкоз). Лимфолейкоз связан со злокачественной продукцией лимфоидных клеток, обычно начинающейся в лимфатическом узле или другой лимфоцитарной ткани и распространяющейся на другие области тела. Миелолейкоз начинается со злокачественной продукции молодых миелоидных клеток в костном мозге и затем распространяется по телу, в результате белые клетки крови образуются во многих тканях за пределами костного мозга, особенно в лимфатических узлах, селезенке и печени.
При миелоидной лейкемии злокачественный процесс иногда формирует дифференцированные клетки, и его могут называть нейтрофильной лейкемией, эозинофилъной лейкемией, базофилъной лейкемией или моноцитарной лейкемией. Чаще, однако, клетки при лейкемии — неестественные, недифференцированные и не похожи ни на одну из нормальных белых клеток крови. Обычно чем менее клетки дифференцированы, тем более острая лейкемия, без лечения часто приводящая к смерти в течение нескольких месяцев. При наличии более дифференцированных клеток процесс может стать хроническим, медленно развиваясь на протяжении 10-20 лет. Белые клетки крови при лейкемии, особенно малодифференцированные, обычно функционально недостаточны для обеспечения нормальной защиты против инфекции.
ВЛИЯНИЕ ЛЕЙКЕМИИ НА ОРГАНИЗМ
Первым эффектом лейкемии является метастатический рост лейкемических клеток в необычных областях тела. В костном мозге лейкемические клетки могут столь значительно размножиться, что начинают проникать в окружающую кость, вызывая боль и способствуя частым переломам костей.
Почти все лейкемии распространяются на селезенку, лимфатические узлы, печень и другие сосудистые области, независимо от того, находится ли источник лейкемии в костном мозге или в лимфатических узлах. Обычными симптомами лейкемии являются развитие инфекции, тяжелая анемия и склонность к кровотечениям, связанным с тромбоцитопенией (недостатком тромбоцитов). Эти симптомы являются в основном результатом замещения нормальных клеток костного мозга и лимфоидной ткани нефункционирующими лейкемическими клетками.
Вероятно, наиболее важным действием лейкемии на организм является чрезмерное использование метаболических субстратов растущими злокачественными клетками. Лейкемические ткани воспроизводят новые клетки так быстро, что к резервам питательных веществ, специфических аминокислот и витаминов в организме предъявляются чрезмерные требования. В результате энергетические запасы организма значительно истощаются, а избыточная утилизация аминокислот лейкемическими клетками особенно быстро разрушает ткани, в норме богатые белком.
Следовательно, в то время как лейкемические ткани растут, другие ткани истощаются. Если метаболическое голодание продолжается достаточно долго, летальный исход неизбежен.
Часть 2. ИММУНИТЕТ И АЛЛЕРГИЯ
2.1. ВРОЖДЕННЫЙ ИММУНИТЕТ
Перечислим некоторые из этих общих процессов.
Врожденный иммунитет делает наш организм устоичивым к некоторым паралитическим вирусным инфекциям животных, чуме свиней и рогатого скота, собачьей чумке (вирусной болезни, от которой погибает большинство пораженных ею собак). И наоборот, многие животные устойчивы пли даже невосприимчивы ко многим очень опасным и даже смертельным для человека болезням, например к полиомиелиту, эпидемическому паротиту, холере, кори и сифилису.
2.2. ПРИОБРЕТЕННЫЙ (АДАПТИВНЫЙ) ИММУНИТЕТ
Видео: Типы иммунных ответов – врожденный и адаптивный. Сравнение гуморального и клеточного иммунитета
Если видео не отображается, оно доступно по ссылке →
Кроме общего врожденного иммунитета организм способен развивать чрезвычайно мощный специфический иммунитет против особых патогенных агентов, например смертельно опасных бактерий, вирусов, токсинов и даже чужеродных тканей от других животных. Эту способность называют приобретенным, или адаптивным, иммунитетом. Приобретенный иммунитет создается специфической иммунной системой, которая формирует антитела и/или активированные лимфоциты, атакующие и разрушающие специфический патогенный микроорганизм или токсин. Механизму приобретенного иммунитета и некоторым связанным с ним реакциям, особенно аллергиям, посвящена эта 2-я часть раздела.
Приобретенный иммунитет часто может осуществлять экстремальную защиту. Например, он способен защитить против некоторых токсинов, таких как паралитический токсин ботулина или тетанизирующий токсин столбняка, когда они действуют на организм в дозах, в 100000 раз превышающих летальные без иммунитета. Именно поэтому так важен для защиты человека против болезней и токсинов способ лечения, известный как иммунизация, что объясняется в этой части раздела.
ОСНОВНЫЕ ТИПЫ ПРИОБРЕТЕННОГО ИММУНИТЕТА
В организме существуют два разных, но тесно связанных типа приобретенного иммунитета. Один из них основан на развитии антител, представляющих собой глобулиновые молекулы плазмы крови, способные атаковать внедрившиеся в организм агенты. Этот тип иммунитета называют гуморальным иммунитетом, или В-клеточным иммунитетом (поскольку антитела формируются В-лимфоцитами). Второй тип приобретенного иммунитета связан с формированием большого количества активированных Т-лимфоцитов, которые специфически подготавливаются в лимфатических узлах для разрушения особого инородного агента. Этот тип иммунитета называют клеточно-опосредованным иммунитетом, или Т-клеточным иммунитетом (поскольку активированные лимфоциты являются Т-лимфоцитами). Далее увидим, что и антитела, и активированные лимфоциты формируются в лимфоидных тканях тела. Рассмотрим запуск иммунного процесса антигенами.
ОБА ТИПА ПРИОБРЕТЕННОГО ИММУНИТЕТА ИНИЦИИРУЮТСЯ АНТИГЕНАМИ
Поскольку приобретенный иммунитет развивается только после проникновения внутрь тела чужеродного микроорганизма или токсина, ясно, что должен существовать некий механизм распознавания этого проникновения. Любой токсин или микроорганизм почти всегда содержит в своем составе специфические химические соединения, отличающиеся от всех других соединений. В основном это белки или крупные полисахариды, и именно они стимулируют формирование приобретенного иммунитета. Эти вещества называют антигенами (генераторами антител).
Чтобы быть антигеном, вещество обычно должно иметь большую молекулярную массу (8000 или выше). Более того, антигенность (способность вызывать синтез антител) обычно зависит от наличия на поверхности большой молекулы регулярно повторяющихся молекулярных групп, называемых эпитопами. Этим объясняется, почему белки и крупные полисахариды, которым присущ такой стереохимический признак, почти всегда являются антигенами.
2.3. ЛИМФОЦИТЫ ОТВЕТСТВЕННЫ ЗА ПРИОБРЕТЕННЫЙ ИММУНИТЕТ
Видео: B-лимфоциты и T-лимфоциты популяций CD4 и CD8
Если видео не отображается, оно доступно по ссылке →
Приобретенный иммунитет является результатом деятельности лимфоцитов организма. У людей, имеющих дефицит лимфоцитов, обусловленный либо генетическими причинами, либо воздействием радиации или химических веществ, разрушающих лимфоциты, приобретенный иммунитет не развивается. В течение нескольких дней после рождения такой ребенок умирает от скоротечной бактериальной инфекции, если не получает чрезвычайно интенсивного лечения. Следовательно, лимфоциты необходимы для выживания человека.
Особенно много лимфоцитов локализуются в лимфатических узлах, но они также обнаруживаются в специализированных лимфоидных тканях, таких как селезенка, подслизистые области желудочно-кишечного тракта, тимус и костный мозг. Лимфоидная ткань распределяется в организме преимущественно так, чтобы предупредить широкое распространение вторгшихся в организм микроорганизмов или токсинов.
В большинстве случаев вторгшийся агент сначала входит в тканевые жидкости и затем переносится по лимфатическим сосудам к лимфатическому узлу или другой лимфоидной ткани. Например, лимфоидная ткань стенок желудочно-кишечного тракта сразу подвергается воздействию антигенов, внедряющихся из кишечника. Лимфоидная ткань горла и глотки (миндалины и аденоиды) занимает удобную позицию для задержки антигенов, входящих через верхние дыхательные пути. Лимфоидная ткань в лимфатических узлах принимает на себя антигены, проникающие в периферические ткани тела. И наконец, лимфоидная ткань селезенки, тимуса и костного мозга играет особую роль в улавливании антигенных агентов, которым удалось попасть в циркулирующую кровь.
Клеточно-опосредованный и гуморальный иммунитеты обеспечивают два типа лимфоцитов – Т- и В-лимфоциты. Хотя при исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаковыми, эти клетки подразделяют на две основные популяции. Одна популяция — Т-лимфоциты — ответственна за формирование активированных лимфоцитов, обеспечивающих клеточно-опосредованный иммунитет. Другая популяция — В-лимфоциты — ответственна за формирование антител, обеспечивающих гуморальный иммунитет.
Оба типа лимфоцитов образуются у эмбриона из полипотентных гемопоэтических стволовых клеток, формирующих лимфоциты как один из наиболее важных результатов их дифференцировки. Почти все сформированные лимфоциты в результате заселяют лимфоидную ткань, однако прежде чем это произойдет, они дополнительно дифференцируются или проходят предварительную обработку.
Лимфоциты, которые в итоге станут активированными Т-лимфоцитами, сначала мигрируют к тимусу, где подвергаются предварительной обработке. Эти ответственные за клеточно-опосредованный иммунитет лимфоциты называют Т-лимфоцитами, что подчеркивает роль тимуса.
Другая популяция лимфоцитов, В-лимфоциты, предназначенные для формирования антител, проходят предварительную обработку в печени плода в середине периода внутриутробной жизни, а также в костном мозге в конце внутриутробной жизни плода и после рождения. Эта популяция клеток впервые была открыта у птиц, имеющих специальный орган для их предварительной обработки, который называют бурсой Фабриция (фабрициевой сумкой). Ответственные за гуморальный иммунитет лимфоциты называют В-лимфоцитами, что подчеркивает роль бурсы. На рис. 8 показаны две лимфоцитарные системы для формирования: (1) активированных Т-лимфоцитов; (2) антител.
Рис. 8. Формирование антител и активированных лимфоцитов в лимфатическом узле в ответ на действие антигенов. Этот рисунок также демонстрирует происхождение лимфоцитов тимуса (Т-лимфоцитов) и бурсы (В-лимфоцитов), ответственных за клеточно-опосредованные и гуморальные иммунные процессы, соответственно
ПРЕДВАРИТЕЛЬНАЯ ОБРАБОТКА Т- И В-ЛИМФОЦИТОВ
Все лимфоциты организма происходят от коммитированных в лимфоцитарном направлении стволовых клеток эмбриона, но эти клетки не могут непосредственно превратиться в активированные Т-лимфоциты или антитела. Прежде чем это станет возможным, клетки должны подвергнуться дальнейшей дифференцировке в соответствующих областях, где они проходят специфическую обработку.
Т-лимфоциты проходят предварительную обработку в тимусе (вилочковой железе). После образования в костном мозге Т-лимфоциты сначала мигрируют к вилочковой железе. Здесь они быстро делятся, одновременно становясь чрезвычайно разнообразными, т.е. предназначенными для реакции против разных специфических антигенов. Это значит, что один лимфоцит, обработанный в тимусе, проявляет специфическую реактивность в отношении одного антигена. Следующий лимфоцит специфически реагирует на другой антиген. Это продолжается до тех пор, пока в тимусе не появятся тысячи разных типов лимфоцитов со специфической реактивностью в отношении тысяч разных антигенов. Эти разные типы предварительно обработанных Т-лимфоцитов оставляют тимус и распространяются кровью по всему телу, временно оседая в лимфоидной ткани.
Кроме того, благодаря обработке в тимусе любой оставляющий его Т-лимфоцит не реагирует с белками или другими антигенами собственных тканей организма (иначе Т-лимфоциты погубили бы собственное тело человека в течение всего нескольких дней). Тимус выбирает, какие Т-лимфоциты могут его покинуть, сначала смешивая их практически со всеми специфическими аутоантигенами собственных тканей тела. Если Т-лимфоцит реагирует, он разрушается и фагоцитируется, вместо того, чтобы выделяться. Это происходит с основной частью клеток (вплоть до 90%). Таким образом, клетки, выделяющиеся из тимуса, не реагируют против собственных антигенов тела; они реагируют лишь на антигены внешних источников, например бактерий, токсинов или тканей, пересаженных от другого человека.
Основная часть предобработки Т-лимфоцитов в тимусе происходит перед рождением ребенка и в течение нескольких месяцев после рождения. Удаление вилочковой железы после этого периода ослабляет (но не исключает) Т-лимфоцитарную иммунную систему. Однако удаление тимуса за несколько месяцев до рождения может нарушить развитие всего клеточно-опосредованного иммунитета. Поскольку именно клеточный тип иммунитета в основном отвечает за отторжение трансплантированных органов, например сердца или почек, органы можно пересаживать с меньшей вероятностью отторжения, если у животного в соответствующее время до его рождения удалить тимус.
В-лимфоциты проходят предварительную обработку в печени и костном мозге. О деталях предварительной обработки В-лимфоцитов известно гораздо меньше, чем о предобработке Т-лимфоцитов. Известно, что у человека предварительная обработка В-лимфоцитов осуществляется в печени в середине внутриутробного периода развития, а также в костном мозге в конце внутриутробного периода и после рождения.
Существуют два важных различия между В- и Т-лимфоцитами. Во-первых, В-лимфоциты активно секретируют реактивные агенты, называемые антителами, в отличие от Т-лимфоцитов, реагирующих с антигеном непосредственно. Антитела — это крупные белковые молекулы, способные соединяться с антигенной субстанцией и разрушать ее, что объясняется далее в этой части раздела. Во-вторых, разнообразие В-лимфоцитов выражено больше, чем у Т-лимфоцитов, т.е. формируются миллионы типов В-лимфоцитарных антител с разными специфическими реактивностями. После предобработки В-лимфоциты, как и Т-лимфоциты, мигрируют к лимфоидной ткани по всему телу, где временно располагаются рядом, но несколько обособленно от областей локализации Т-лимфоцитов.
ВЫСОКОСПЕЦИФИЧЕСКАЯ РЕАКЦИЯ Т-ЛИМФОЦИТОВ И В-ЛИМФОЦИТАРНЫХ АНТИТЕЛ ПРОТИВ ОПРЕДЕЛЕННЫХ АНТИГЕНОВ. РОЛЬ ЛИМФОЦИТАРНЫХ КЛОНОВ
Когда специфические антигены вступают в контакт с Т- и В-лимфоцитами в лимфоидной ткани, происходит активация некоторых Т-лимфоцитов, формирующих активированные Т-клетки, и некоторых В-лимфоцитов, формирующих антитела. Активированные Т-клетки и антитела, в свою очередь, реагируют высокоспецифически против особых типов антигенов, которые инициировали их развитие. Механизм этой специфичности изложен далее.
Миллионы специфических типов лимфоцитов хранятся в лимфоидной ткани. Как объяснялось ранее, в лимфоидной ткани хранятся миллионы разных типов, заранее сформированных В- и Т-лимфоцитов, способных образовывать высокоспецифические типы антител или Т-клеток. Каждый из этих лимфоцитов способен к формированию только одного типа антитела или одного типа Т-клетки с уникальной специфичностью. И только специфический антиген, с которым лимфоцит может реагировать, активирует его. Сразу после активации специфическим антигеном лимфоцит очень интенсивно размножается, образуя огромное количество своих копий. Если это В-лимфоцит, его потомство будет, в конце концов, секретировать антитела специфического типа, циркулирующие затем по телу. Если это Т-лимфоцит, его потомством являются специфически активированные Т-клетки, которые выделяются в лимфу, затем переносятся в кровь, а с нею попадают во все тканевые жидкости, откуда возвращаются снова в лимфу, иногда циркулируя по этому кругу в течение нескольких месяцев или лет.
Лимфоциты, способные к формированию антител или Т-клеток уникальной специфичности, называют клоном лимфоцитов. Это значит, что в каждом клоне лимфоциты идентичны и происходят от одного или нескольких ранних лимфоцитов специфического для данного клона типа.
ПРОИСХОЖДЕНИЕ МНОГИХ КЛОНОВ ЛИМФОЦИТОВ
Количество генов, кодирующих миллионы разных типов антител и Т-лимфоцитов, гораздо меньше — от нескольких сотен до нескольких тысяч. Сначала было непонятно, как может такое небольшое число генов кодировать миллионы особенностей молекул антител или Т-клеток, создаваемых лимфоидной тканью, особенно если учесть, что для образования каждого особого типа белка обычно необходим один ген. В настоящее время ответ на этот вопрос получен.
В исходных стволовых клетках, из которых формируются нормальные иммунные клетки, нет целого гена для формирования каждого типа Т- или В-клетки. Существуют лишь «сегменты генов», фактически сотни таких сегментов, но не целые гены. Во время предварительной обработки соответствующих Т- и В-лимфоцитов эти генные сегменты смешиваются друг с другом в случайных комбинациях, формируя в итоге целые гены.
Поскольку существуют несколько сотен типов генных сегментов и миллионы различных комбинаций, в которые они могут быть собраны в отдельных клетках, легко понять возможность появления миллионов генетически различных клеточных типов. Генетическая структура каждого формирующегося в итоге функционально полноценного Т- или В-лимфоцита кодирует только одну антигенную специфичность. Зрелые Т- и В-лимфоциты являются высокоспецифичными клетками, которые распределяются по лимфоидной ткани и заселяют ее.
МЕХАНИЗМ АКТИВАЦИИ КЛОНА ЛИМФОЦИТОВ
Каждый клон лимфоцитов чувствителен только к одному типу антигена (или к нескольким сходным антигенам, имеющим практически те же стереохимические характеристики). Связано это с наличием особых белков на поверхности мембран этих клеток. Так, на поверхности клеточной мембраны каждого из В-лимфоцитов имеются около 100000 молекул антител, которые будут реагировать высокоспецифически только с определенным типом антигена. Следовательно, при появлении соответствующего антигена он немедленно прикрепляется к антителу в клеточной мембране; это ведет к процессу активации, который мы опишем подробнее далее. На поверхности мембраны Т-лимфоцитов имеются молекулы, подобные антителам и называемые поверхностными рецепторными белками (или маркерами Т-клеток); они тоже высокоспецифичны для определенного активирующего антигена.
Роль макрофагов в процессе активации. Помимо лимфоцитов в лимфоидной ткани также присутствуют буквально миллионы макрофагов. Они выстилают синусоиды лимфатических узлов, селезенки и других лимфоидных тканей и контактируют со многими лимфоцитами лимфатических узлов. Большинство проникших в тело человека микроорганизмов сначала фагоцитируются и частично перевариваются макрофагами, причем антигенные продукты освобождаются в цитозоль макрофагов. Макрофаги затем передают эти антигены путем клеточно-клеточных контактов непосредственно лимфоцитам, что ведет к активации определенных лимфоцитарных клонов. Макрофаги, кроме того, секретируют особое активирующее вещество, способствующее дальнейшему росту и размножению специфических лимфоцитов. Это вещество называют интерлейкином-1.
Роль Т-клеток в активации В-лимфоцитов. Большинство антигенов активируют одновременно и Т-, и В-лимфоциты. Некоторые Т-клетки, называемые Т-хелперами, секретируют специфические вещества (в совокупности называемые лимфокинами), которые активируют специфические В-лимфоциты. Действительно, без помощи Т-хелперов количество антител, формируемых В-лимфоцитами, обычно незначительно. Мы вернемся к обсуждению взаимодействия между Т- и В-клетками при изложении механизмов Т-клеточной системы иммунитета.
2.4. СПЕЦИФИЧЕСКИЕ СВОЙСТВА В-ЛИМФОЦИТАРНОЙ СИСТЕМЫ: ГУМОРАЛЬНЫЙ ИММУНИТЕТ И АНТИТЕЛА
Если видео не отображается, оно доступно по ссылке →
Формирование антител плазматическими клетками. До воздействия специфического антигена клоны В-лимфоцитов находятся в лимфоидной ткани в состоянии покоя. При входе инородного антигена макрофаги лимфоидной ткани фагоцитируют антиген и затем представляют его прилежащим В-лимфоцитам. Кроме того, одновременно антиген представляется также Т-клеткам, и формируются активированные Т-лимфоциты. Эти Т-хелперы также вносят вклад в мощную активацию В-лимфоцитов, что мы обсудим подробно далее.
В-лимфоциты, специфичные для данного антигена, немедленно увеличиваются и принимают вид лимфобластов. Некоторые из них подвергаются дальнейшей дифференцировке, превращаясь в плазмобласты, которые являются предшественниками плазматических клеток. В плазмобластах увеличивается объем цитоплазмы, и очень сильно разрастается гранулярная эндоплазматическая сеть. Плазмобласты затем начинают делиться со скоростью примерно один раз каждые 10 ч, производя около девяти делений, что через 4 сут приводит к появлению общей популяции примерно из 500 клеток на каждый исходный плазмобласт. Затем каждая зрелая плазматическая клетка синтезирует гамма-глобулиновые антитела с чрезвычайно высокой скоростью, примерно 2000 молекул в секунду. В свою очередь, антитела секретируются в лимфу и переносятся в циркулирующую кровь. Этот процесс продолжается в течение нескольких дней или недель до тех пор, пока в итоге не произойдет истощение и гибель плазматических клеток.
Формирование клеток памяти. Различие между первичным и вторичным ответами. Небольшое число лимфобластов, сформированных при активации определенного клона В-лимфоцитов, не превращается в плазматические клетки, а образуют умеренное количество новых В-лимфоцитов, подобных клеткам исходного клона. Другими словами, В-клеточная популяция специфически активированного клона сильно увеличивается, и новые В-лимфоциты добавляются к исходным лимфоцитам того же клона. Они также циркулируют по телу, заселяя все лимфоидные ткани; иммунологически, однако, эти лимфоциты не используются до тех пор, пока вновь не будут активированы новой порцией того же антигена. Эти лимфоциты называют клетками памяти. Последующее повторное воздействие того же антигена вызовет гораздо более быструю и мощную реакцию образования антител, поскольку число клеток памяти значительно превышает количество исходных В-лимфоцитов специфического клона.
Рис. 9. Временной ход изменения концентрации антител в циркулирующей крови в ответ на первичное введение антигена и на вторичное его введение через несколько месяцев
На рис. 9 показаны различия между формированием антител в процессе первичного ответа, возникающего при первом воздействии специфического антигена, и вторичного ответа, происходящего после второй встречи организма с тем же антигеном. Видно, что первичный ответ появляется с задержкой в 1 нед, его мощность — слабая, а продолжительность — короткая. Вторичный ответ, наоборот, начинается быстро (часто в течение нескольких часов), его мощность — гораздо выше, а формирование антител осуществляется в течение многих месяцев, а не нескольких недель. Увеличенная мощность и длительность вторичного ответа объясняют, почему при иммунизации антиген обычно вводится многократными дозами с промежутками между инъекциями длительностью от нескольких недель до нескольких месяцев.
ПРИРОДА АНТИТЕЛ
Антитела представляют собой гамма-глобулины, называемые иммуноглобулинами (сокращенно Ig), с молекулярной массой между 160000 и 970000. Они обычно составляют примерно 20% из всех плазменных белков.
Все иммуноглобулины представляют собой комбинацию легких и тяжелых полипептидных цепочек. Большинство иммуноглобулинов состоят из двух легких и двух тяжелых цепочек, как показано ниже на рис. 10. Однако некоторые из них содержат много цепочек, вплоть до 10 тяжелых и 10 легких, давая начало высокомолекулярным иммуноглобулинам. Во всех иммуноглобулинах один конец каждой тяжелой цепочки располагается параллельно легкой цепочке, благодаря чему формируется тяжело-легкая пара, и всегда имеется, по крайней мере, от 2 до 10 таких пар в каждой молекуле иммуноглобулина.
Рис. 10. Структура типичного антитела IgG, демонстрирующая, что оно состоит из двух тяжелых и двух легких полипептидных цепочек. Антиген прикрепляется к двум разным местам на вариабельных участках цепочек
На рис. 10 овалом выделены концы каждой легкой и тяжелой цепочки, называемые вариабельным участком; остальная часть каждой цепи называется константным участком. Вариабельный участок различается для антител каждой специфичности, и именно этот участок прикрепляется к особому типу антигена. Константный участок антитела определяет другие его свойства в тканях, например сцепление антитела со специфическими структурами в тканях, прикрепление его к комплексу комплемента, легкость, с которой антитело проходит через мембраны, и другие его биологические свойства.
Специфичность антител. Каждое антитело специфично для определенного антигена; это связано с уникальной структурной организацией аминокислот в вариабельных участках его легких и тяжелых цепочек. Аминокислотная организация имеет разную пространственную конфигурацию для каждой антигенной специфичности, поэтому когда антиген вступает в контакт с антителом, многочисленные простетические группы антигена как зеркальное изображение соответствуют таким же группам антитела, благодаря чему между антителом и антигеном осуществляется быстрое и плотное связывание. Если антитело высокоспецифично и имеется много мест связи, происходит мощное сцепление между антителом и антигеном посредством: (1) гидрофобных связей; (2) водородных связей; (3) ионного притягивания; (4) ван-дер-ваальсовых сил. Комплекс антиген-антитело также подчиняется термодинамическому закону действия масс.
На рис. 10 представлено антитело, имеющее два вариабельных участка для прикрепления антигенов; антитела такого типа называют бивалентными. Небольшая часть антител с числом комбинаций легких и тяжелых цепочек вплоть до 10 имеет до 10 связывающих мест.
Классы антител. Существуют пять основных классов антител, соответственно называемых IgM, IgG, IgA, IgD и IgE. Ig — сокращенное обозначение иммуноглобулинов, а другие пять букв означают соответствующие классы.
Для целей данного краткого обсуждения особенно важны два класса антител: IgG, являющийся бивалентным антителом и составляющий примерно 75% антител здорового человека, и IgE, представляющий лишь небольшой процент антител, но имеющий особое отношение к аллергии. Класс IgM также интересен, поскольку большая доля антител, формируемых во время первичного ответа, относится к этому типу. Эти антитела имеют 10 связывающих мест, что делает их чрезвычайно эффективными в защите организма против патогенных агентов, несмотря на то, что количество антител IgM невелико.
МЕХАНИЗМЫ ДЕЙСТВИЯ АНТИТЕЛ
Для защиты организма против внедрившихся агентов антитела действуют главным образом двумя путями: (1) прямой атаки патогенного агента; (2) активации системы комплемента, которая имеет множество своих собственных способов для разрушения внедрившегося в организм агента.
Рис. 11. Связывание молекул антигена друг с другом бивалентными антителами
Прямое действие антител на внедрившиеся в организм агенты. На рис. 11 показаны антитела (обозначенные красными Y-образными полосками), реагирующие с антигенами (обозначенными затененными объектами). В связи с бивалентной природой антител и множеством антигенных участков на большинстве внедряющихся агентов антитела могут инактивировать их одним из следующих способов.
Этих прямых действий антител, атакующих антигенные патогенные агенты, часто недостаточно, чтобы играть главную роль в защите организма против внедряющихся микроорганизмов. Более мощная защита обеспечивается путем усиливающих эффектов системы комплемента, изложенных далее.
СИСТЕМА КОМПЛЕМЕНТА ДЛЯ ДЕЙСТВИЯ АНТИТЕЛ
Комплемент — собирательный термин для системы примерно из 20 белков, многие из которых являются предшественниками ферментов (проферментами). Главными действующими факторами этой системы являются 11 белков, обозначаемых С1-С9, В и D, показанных на рис. 12. Все они присутствуют в норме среди белков плазмы крови, как и среди белков, просочившихся из капилляров в тканевые пространства. Проферменты в норме не активны, но они могут активироваться так называемым классическим путем.
Рис. 12. Каскад реакций при активации классического пути комплемента [Alexander J.W.. Good R.A. Fundamentals of Clinical Immunology. Philadelphia: WB Saunders, 1977]
Классический путь. Классический путь инициируется реакцией антиген-антитело. Это значит, что при связывании антитела с антигеном на константном участке антитела раскрывается или «активируется» специфическая реактивная зона. Эта зона, в свою очередь, непосредственно связывается с молекулой С1 системы комплемента, приводя в действие каскад последовательных реакций, показанных на рис. 12, начиная с активации самого профермента С1. Сформированные при этом ферменты С1 активируют последовательно возрастающие количества ферментов более поздних этапов системы, и происходит чрезвычайно большое «умножение» реакции, незначительной в начале. Формируются множество конечных продуктов, как показано справа на рисунке, и некоторые из них вызывают важные эффекты, помогающие предупредить повреждение тканей тела внедрившимися микроорганизмами или токсинами.
Наиболее значимыми являются следующие эффекты.
2.5. ОСОБЫЕ СВОЙСТВА Т-ЛИМФОЦИТАРНОЙ СИСТЕМЫ: АКТИВИРОВАННЫЕ Т-КЛЕТКИ И КЛЕТОЧНО-ОПОСРЕДОВАННЫЙ ИММУНИТЕТ
Видео: Цитотоксические T-лимфоциты
Если видео не отображается, оно доступно по ссылке →
Выделение активированных Т-клеток из лимфоидной ткани и формирование клеток памяти. При контакте с соответствующим антигеном, представленным прилежащими макрофагами, Т-лимфоциты специфического клона размножаются, выделяя большое число активированных, специфически реагирующих Т-клеток, что соответствует выделению антител активированными В-клетками. Основное различие состоит в том, что в лимфу выделяются не антитела, а целые активированные Т-клетки. Затем они выходят в кровоток и распределяются по телу, проходя через капиллярные стенки в тканевые пространства, оттуда — назад в лимфу и снова в кровь, циркулируя так по всему телу иногда в течение месяцев или даже лет.
Формируются также лимфоцитарные Т-клетки памяти, подобно тому, как формируются В-клетки памяти в системе антител. Это означает, что, когда антиген активирует клон Т-лимфоцитов, многие из вновь образованных лимфоцитов сохраняются в лимфоидной ткани, становясь дополнительными Т-лимфоцитами данного специфического клона; эти клетки памяти равномерно распределяются по лимфоидной ткани всего тела. При последующем появлении того же антигена в любой части тела активированные Т-клетки выделяются гораздо быстрее и в большем количестве, чем во время первого воздействия.
Антиген-представляющие клетки, белки ГКГ и рецепторы для антигенов на Т-лимфоцитах. Реакции Т-клеток в высшей степени антигенспецифичны, как и реакции антител, выделяемых В-клетками, и так же важны в защите против инфекции. Действительно, Т-клетки необходимы как для запуска реакций приобретенного иммунитета, так и для ликвидации внедрившихся патогенов.
Рис. 13. Активация Т-клеток требует взаимодействия их рецепторов с антигеном (чужеродным белком), который транспортируется к поверхности антиген-представляющей клетки белком главного комплекса гистосовместимости (ГКГ). Белки межклеточной адгезии позволяют удерживать Т-клетку в связи с антиген-представляющей клеткой
В-лимфоциты распознают интактные антигены, в то время как Т-лимфоциты реагируют на антигены только после их связи со специфическими молекулами, называемыми белками ГКГ, на поверхности антиген-представляющих клеток в лимфоидных тканях (рис. 13). К трем главным типам антиген-представляющих клеток относятся макрофаги, В-лимфоциты и дендритные клетки. Дендритные клетки, наиболее мощные из антиген-представляющих клеток, локализуются в теле повсюду, и единственная известная их функция — представлять антигены Т-клеткам. Для осуществления активации Т-клеток их связь с антиген-представляющими клетками должна быть достаточно продолжительной, и решающее значение для реализации этого условия имеет взаимодействие белков клеточной адгезии.
Белки ГКГ кодируются большой группой генов, которую называют главным комплексом гистосовместимости. Белки ГКГ связывают пептидные фрагменты антигенных белков, разрушающихся внутри антиген-представляющих клеток, и затем транспортируют их к клеточной поверхности. Существует два типа белков ГКГ: (1) белки ГКГ-I, представляющие антигены цитотоксическим Т-клеткам; (2) белки ГКГ-II, представляющие антигены Т-хелперам. Специфические функции цитотоксических Т-клеток и Т-хелперов обсуждаются далее.
Антигены на поверхности антиген-представляющих клеток связываются с рецепторными молекулами на поверхностях Т-клеток так же, как они связываются с белковыми антителами плазмы. Эти рецепторные молекулы состоят из вариабельного элемента, подобного вариабельному участку гуморального антитела, но в этом случае стволовой участок вариабельного элемента прочно связан с клеточной мембраной Т-лимфоцита. На одиночной Т-клетке может быть до 100000 рецепторных участков.
ОСНОВНЫЕ ТИПЫ Т-КЛЕТОК И ИХ ФУНКЦИИ
Сейчас ясно, что существуют много типов Т-клеток. Их подразделяют на три основных группы: (1) Т-хелперы; (2) цитотоксические Т-клетки; (3) супрессорные Т-клетки. Функции каждой группы клеток различны.
Рис. 14. Регуляция иммунной системы; демонстрируется центральная роль Т-хелперов. ГКГ – главный комплекс гистосовместимости
Т-ХЕЛПЕРЫ. ИХ РОЛЬ В ОБЩЕЙ РЕГУЛЯЦИИ ИММУНИТЕТА
Общепризнано, что Т-хелперы — наиболее многочисленные Т-лимфоциты, они обычно составляют более 75% всех Т-клеток. Согласно названию, эти клетки помогают функциям иммунной системы. Фактически они являются главным регулятором почти всех иммунных функций, как показано на рис. 14. Такое действие Т-хелперов связано с формированием ими ряда белковых медиаторов, называемых лимфокинами, которые действуют на другие клетки иммунной системы, а также на клетки костного мозга. Далее перечислены важные лимфокины, секретируемые Т-хелперами:
• интерлейкин-2;
• интерлейкин-3;
• интерлейкин-4;
• интерлейкин-5;
• интерлейкин-6;
• гранулоцитарно-моноцитарный колониестимулирующий фактор;
• интерферон-у.
Специфические регуляторные функции лимфокинов. При отсутствии лимфокинов, выделяемых Т-хелперами, остальная иммунная система почти парализована. Действительно, именно Т-хелперы инактивируются или разрушаются вирусом синдрома приобретенного иммунодефицита, который оставляет организм почти полностью незащищенным против инфекционных заболеваний, что является причиной хорошо известных в настоящее время ослабляющих здоровье и губительных для организма эффектов СПИД. Некоторые из специфических регуляторных функций изложены далее.
Стимуляция роста и размножения цитотоксических и супрессорных Т-клеток. При отсутствии Т-хелперов клоны, формирующие цитотоксические и супрессорные Т-клетки, большинством антигенов активируются лишь незначительно.
Лимфокин интерлейкин-2 обладает особо сильным стимулирующим влиянием на рост и размножение цитотоксических и супрессорных Т-клеток. Некоторые другие лимфокины также имеют влияние, но менее мощное.
Активация макрофагальной системы. Лимфокины влияют также на макрофаги. Во-первых, они замедляют или прекращают миграцию макрофагов после их хемотаксического притяжения в область воспаленной ткани, в результате здесь происходит значительное скопление макрофагов. Во-вторых, лимфокины активируют макрофаги, резко увеличивая эффективность фагоцитоза, что позволяет макрофагам атаковать и разрушать большее количество внедрившихся бактерий или других агентов, повреждающих ткани.
Стимулирующее влияние на Т-хелперы по принципу обратной связи. Некоторые из лимфокинов, особенно интерлейкин-2, оказывают прямое влияние, стимулирующее активацию самих Т-хелперов по принципу положительной обратной связи. Это значит, что лимфокин действует как усилитель, дополнительно увеличивая реакцию Т-хелперов, а также весь иммунный ответ на внедрившийся агент.
ЦИТОТОКСИЧЕСКИЕ Т-КЛЕТКИ
Цитотоксические Т-клетки способны непосредственно атаковать и уничтожать микроорганизмы, а иногда даже собственные клетки организма. По этой причине их называют клетками-киллерами. Благодаря рецепторным белкам на поверхностях цитотоксических клеток они плотно связываются с микроорганизмами или клетками, содержащими соответствующий специфический антиген. Затем атакуемая клетка уничтожается способом, показанным на рис. 15. После связывания цитотоксическая Т-клетка секретирует так называемые перфорины (белки, формирующие отверстия в мембране атакуемой клетки). Через эти отверстия из интерстициального пространства в клетку быстро течет жидкость. Кроме того, цитотоксическая Т-клетка выделяет токсические вещества прямо в атакуемую клетку. Почти немедленно атакуемая клетка сильно разбухает и обычно вскоре после этого разрушается.
Рис. 15. Прямое разрушение патогенной клетки активированными лимфоцитами (цитотоксическими Т-клетками)
Особенно важно, что после перфорации мембраны и выделения цитотоксических веществ эти клетки-киллеры могут отрываться от подвергшихся атаке клеток и нападать на другие клетки, уничтожая их. Некоторые цитотоксические клетки сохраняются в тканях на протяжении месяцев.
Часть цитотоксических Т-клеток особенно губительна для тканевых клеток, пораженных вирусами, поскольку многие вирусные частицы захватываются мембранами тканевых клеток, и к ним притягиваются Т-клетки в ответ на вирусную антигенность. Цитотоксические Т-клетки также играют важную роль в разрушении раковых клеток, клеток трансплантированного сердца или других клеток, чужеродных собственному телу человека.
СУПРЕССОРНЫЕ Т-КЛЕТКИ
О супрессорных Т-клетках известно гораздо меньше, чем о других Т-клетках. Они способны угнетать функции и цитотоксических Т-клеток, и Т-хелперов. Полагают, что целью этих подавляющих функций является предупреждение излишней активации цитотоксическими Т-клетками иммунных реакций, которые могут быть повреждающими для собственных тканей тела. По этой причине супрессорные Т-клетки, как и Т-хелперы, считаются регуляторными Т-клетками. Вероятно, система супрессорных Т-клеток играет важную роль в ограничении способности иммунной системы атаковать собственные ткани тела человека, т.е. в увеличении так называемой иммунологической толерантности.
2.6. ТОЛЕРАНТНОСТЬ СИСТЕМЫ ПРИОБРЕТЕННОГО ИММУНИТЕТА К СОБСТВЕННЫМ ТКАНЯМ ЧЕЛОВЕКА. РОЛЬ ПРЕДВАРИТЕЛЬНОЙ ОБРАБОТКИ В ТИМУСЕ И КОСТНОМ МОЗГЕ
Если бы у человека развивался иммунитет к его собственным тканям, процесс приобретенного иммунитета разрушил бы их. Однако в норме механизм иммунитета «распознает» собственные ткани организма как отличающиеся от бактерий или вирусов, и иммунная система человека практически не формирует антител или активированных Т-клеток против его собственных антигенов.
ОСНОВНАЯ ЧАСТЬ ТОЛЕРАНТНОСТИ ВОЗНИКАЕТ В РЕЗУЛЬТАТЕ ОТБОРА КЛОНОВ ВО ВРЕМЯ ПРЕДВАРИТЕЛЬНОЙ ОБРАБОТКИ
Полагают, что основная часть толерантности развивается во время предварительной обработки Т-лимфоцитов в тимусе и В-лимфоцитов — в костном мозге. Причиной такого представления является тот факт, что введение в плод сильного антигена в период, когда лимфоциты проходят предварительную обработку в этих двух областях, предупреждает развитие специфичных для введенного антигена клонов лимфоцитов в лимфоидной ткани. Эксперименты показали, что под воздействием сильного антигена специфические незрелые лимфоциты в тимусе становятся лимфобластными, значительно пролиферируют, затем вступают в соединение со стимулирующим антигеном. Считают, что в результате такие лимфоциты разрушаются эпителиальными клетками тимуса прежде, чем смогут мигрировать к общей лимфоидной ткани тела и заселить ее.
Предполагают, что во время предобработки лимфоцитов в тимусе и костном мозге все или большинство клонов лимфоцитов, специфичных для повреждения собственных тканей тела, саморазрушаются в связи с постоянным воздействием на них антигенов тела.
НЕДОСТАТОЧНОСТЬ МЕХАНИЗМА ТОЛЕРАНТНОСТИ ВЫЗЫВАЕТ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ
Иногда люди теряют иммунологическую толерантность к их собственным тканям. Чем старше становится человек, тем в большей степени это проявляется. Обычно это происходит после разрушения некоторых собственных тканей тела, в результате освобождается значительное количество аутоантигенов, которые циркулируют по телу и, предположительно, вызывают приобретенный иммунитет в форме либо активированных Т-клеток, либо антител.
В результате аутоиммунитета возникают, например, следующие специфические заболевания: (1) ревматизм, при котором организм иммунизируется против тканей суставов и сердца, особенно сердечных клапанов, после воздействия особого типа стрептококкового токсина, имеющего в молекулярной структуре эпитоп, подобный структуре некоторых из собственных аутоантигенов тела; (2) один из типов гломерулонефрита, при котором человек становится иммунизированным против основных мембран клубочков; (3) миастения, связанная с развитием иммунитета против белков-рецепторов для ацетилхолина в нервно-мышечном соединении, что ведет к параличу; (4) красная волчанка, при которой человек иммунизируется против различных тканей тела одновременно. Болезнь вызывает обширное поражение и часто быстро приводит к смерти.
2.7. ИММУНИЗАЦИЯ
ИММУНИЗАЦИЯ ПУТЕМ ВВЕДЕНИЯ АНТИГЕНОВ
Иммунизация в течение многих лет используется для создания приобретенного иммунитета против специфических болезней. Человека можно иммунизировать путем введения мертвых микроорганизмов, которые больше не способны вызывать болезнь, но еще сохранили некоторые из своих химических антигенов. Этот тип иммунизации используют для защиты против брюшного тифа, коклюша, дифтерии и многих других типов бактериальных болезней.
Иммунитет можно выработать против токсинов, обработанных химическими веществами, подавившими их токсичность, но сохранившими интактными антигены, вызывающие иммунитет. Такой метод используют для иммунизации против столбняка, ботулизма и других подобных токсических болезней.
Наконец, человека можно иммунизировать путем инфицирования живыми, но предварительно ослабленными микроорганизмами. Их либо выращивали в специальных культуральных средах, либо проводили через ряд животных, пока микроорганизмы не изменились в достаточной степени, чтобы не вызывать болезни, но нести специфические антигены, необходимые для иммунизации. Данный метод используют для защиты против полиомиелита, желтой лихорадки, кори, оспы и многих других вирусных болезней.
ПАССИВНЫЙ ИММУНИТЕТ
Как обсуждалось ранее, приобретенный иммунитет является активным иммунитетом. Это значит, что собственный организм человека вырабатывает антитела или активированные Т-клетки в ответ на внедрение в тело инородного агента. Однако временный иммунитет может быть создан у человека без введения какого-либо антигена. Вместо этого вводят антитела, активированные Т-клетки или то и другое из крови другого человека или какого-либо животного, которые были активно иммунизированы против данного антигена.
Антитела остаются в теле реципиента в течение 2-3 нед, и в течение этого времени человек защищен против поразившей его болезни. Если активированные Т-клетки вводят от другого человека, то они сохраняются несколько недель, а если они взяты от животного, то в течение от нескольких часов до нескольких дней. Такое введение антител или Т-лимфоцитов с целью создания иммунитета называют пассивным иммунитетом.
2.8. АЛЛЕРГИЯ И ГИПЕРЧУВСТВИТЕЛЬНОСТЬ
Важным нежелательным побочным эффектом иммунитета является развитие при некоторых условиях аллергии или других типов иммунной гиперчувствителъности. Существуют несколько типов аллергии и других проявлений повышенной чувствительности, некоторые из них встречаются только у людей, имеющих специфическую аллергическую предрасположенность.
АЛЛЕРГИЯ, СВЯЗАННАЯ С АКТИВИРОВАННЫМИ Т-КЛЕТКАМИ. АЛЛЕРГИЧЕСКИЕ РЕАКЦИИ ЗАМЕДЛЕННОГО ТИПА
Аллергические реакции замедленного типа вызываются активированными Т-клетками, а не антителами. Например, токсин ядовитого плюща (сумах укореняющийся) сам по себе не наносит большого вреда тканям. Однако при повторном воздействии он вызывает образование активированных Т-хелперов и цитотоксических Т-клеток. Затем после следующего воздействия того же токсина ядовитого плюща в течение примерно суток активированные Т-клетки в больших количествах диффундируют из циркулирующей крови в кожу, реагируя с этим токсином. В то же время эти Т-клетки вызывают клеточно-опосредованный тип иммунной реакции. Учитывая, что этот тип иммунитета сопровождается освобождением многих токсических веществ из активированных Т-клеток, а также обильным наводнением тканей макрофагами с соответствующими последующими эффектами, легко понять, что конечным результатом аллергической реакции замедленного типа может быть серьезное повреждение тканей. Обычно повреждение происходит в тканевых областях, где присутствует провоцирующий антиген, например в коже (в случае ядовитого плюща) или в легких с развитием отека легких или приступа астмы (при воздействии некоторых воздушных антигенов).
АЛЛЕРГИИ У ЛЮДЕЙ, ИМЕЮЩИХ ИЗБЫТОК АНТИТЕЛ IGE
Некоторые люди имеют аллергическую предрасположенность. Такие аллергии называют атоническими, поскольку они связаны с неординарной реакцией иммунной системы. Аллергическая предрасположенность генетически передается от родителей к ребенку и характеризуется наличием большого количества антителIgE в крови. Эти антитела называют реагинами, или сенсибилизирующими антителами, в отличие от более распространенных антител IgG. Когда аллерген (т.е. антиген, специфически реагирующий с особым типом IgE) попадает в организм, осуществляется реакция аллерген-реагин, лежащая в основе аллергических проявлений.
Особым свойством реагинов IgE является выраженная склонность прикрепляться к тучным клеткам и базофилам. Одиночная тучная клетка или базофил могут связывать до полумиллиона молекул антител IgE. Когда антиген (аллерген), имеющий многочисленные места связи, соединяется с несколькими антителами IgE, уже прикрепленными к тучной клетке или базофилу, это вызывает немедленное изменение в мембране тучной клетки или базофила, вероятно, в результате физической деформации клеточной мембраны под влиянием молекул антитела. Многие тучные клетки и базофилы разрываются, другие — немедленно или спустя некоторое время после разрыва выделяют особые агенты, среди которых — гистамин, протеаза, медленно действующая анафилактическая субстанция (смесь токсических лейкотриенов), эозинофильная хемотаксическая субстанция, нейтрофильная хемотаксическая субстанция, гепарин и тромбоцитарные активирующие факторы. Эти вещества вызывают такие эффекты, как локальное расширение кровеносных сосудов, привлечение эозинофилов и нейтрофилов к месту реакции, увеличение проницаемости капилляров с выходом жидкости в ткани и сокращение местных гладкомышечных клеток. Следовательно, в зависимости от типа ткани, в которой осуществляется реакция аллерген-реагин, может развиться несколько различных реакций.
Анафилаксия. Когда специфический аллерген вводится прямо в кровь, он может реагировать с базофилами крови и тучными клетками в тканях, расположенных снаружи мелких кровеносных сосудов, если эти клетки уже активированы прикрепленными к ним реагинами IgE. Следовательно, широко распространенная аллергическая реакция происходит по ходу всей сосудистой системы и прилежащих тканей. Эту реакцию называют анафилаксией. В циркулирующую кровь выделяетсягистамин, который вызывает повсеместное расширение сосудов, а также повышает проницаемость капилляров с результирующим выходом плазмы из крови в ткани. Без лечения адреналином, способным противостоять эффектам гистамина, человек, у которого развивается такая реакция, умирает от циркуляторного шока в течение нескольких минут.
Из активированных базофилов и тучных клеток выделяется также смесь лейкотриенов, которую называют медленно действующей анафилактической субстанцией. Эти лейкотриены могут вызывать спазм гладких мышц бронхиол, приводя к приступу, похожему на астму, иногда со смертельным исходом из-за удушья.
Крапивница. Крапивница развивается под действием антигена, который внедряется в специфические кожные области и вызывает локальные анафилактоидные реакции. Местно выделяемый гистамин ведет к: (1) расширению сосудов, что приводит к немедленному покраснению; (2) повышенной проницаемости капилляров, что сопровождается появлением ограниченных областей припухлости на коже в течение следующих нескольких минут. Припухлости обычно называют крапивницей. Введение человеку антигистаминных препаратов перед воздействием антигена предупредит крапивницу.
Поллиноз (сенная лихорадка). При поллинозе реакция аллерген-реагин происходит в носу. Гистамин, выделяемый в ответ на реакцию, вызывает локальное расширение сосудов слизистой носа, в результате повышается капиллярное давление, а также проницаемость капилляров. Оба эффекта вызывают быстрое просачивание жидкости в носовые полости и прилежащие к ним глубже расположенные ткани носа; слизистая носа становится отечной и выделяет секрет. В этом случае использование антигистаминных препаратов также может предупредить реакцию набухания слизистой. Но другие продукты реакции аллерген-реагин могут вызывать раздражение носа, приводя к типичному синдрому чихания.
Астма. Астма часто развивается у человека «аллергического» типа. При этом реакция аллерген-реагин осуществляется в бронхиолах легких. Полагают, что важным продуктом реакции является высвобождаемая из тучных клеток медленно действующая анафилактическая субстанция, вызывающая спазм гладких мышц бронхиол. Следовательно, до тех пор, пока действующие продукты аллергической реакции не будут устранены, человек испытывает приступ затруднения дыхания. Введение антигистаминных препаратов оказывает менее выраженное влияние на течение астмы, поскольку гистамин, по-видимому, не является главным фактором, вызывающим астматическую реакцию.
В заключение стоит отметить, что представленная в разделе информация является вспомогательной, т.к. по умолчанию, при публикации на нашем сайте результатов различных «микробиомных» исследований, мы исходим из того, что читатель знаком с основными понятиями и механизмами работы иммунной системы и ее клеток. Тема иммунитета довольно сложная, поэтому разъясняющей информации никогда не бывает много.
К разделу:
Продолжение по теме см.: