Укол спинраза что это такое
Спинраза (Spinraza)
Владелец регистрационного удостоверения:
Произведено и расфасовано:
Вторичная упаковка и выпускающий контроль качества:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Спинраза
Раствор для интратекального введения прозрачный, бесцветный, свободный от легко обнаруживаемых нерастворенных частиц.
| 1 мл | |
| нусинерсен натрия | 2.53 мг |
| что соответствует содержанию нусинерсена* | 2.4 мг |
* нусинерсен (свободная кислота)
Вспомогательные вещества: натрия дигидрофосфата дигидрат, динатрия гидрофосфат безводный, натрия хлорид, калия хлорид, кальция хлорида дигидрат, магния хлорида гексагидрат, 1М раствор натрия гидроксида, 1М раствор хлористоводородной кислоты, вода д/и.
× дополнительно могут иметь контроль первого вскрытия в виде стикера.
Фармакологическое действие
Нусинерсен увеличивает долю транскриптов матричной РНК (мРНК) с включением экзона 7 гена SMN2, связываясь с интронным сайленсером сплайсинга (intronic splice silencing site- ISS N1), расположенным в интроне 7 предшественника мРНК (rпре-мРНК) гена SMN2. Связываясь с ним, АСО вытесняет факторы сплайсинга, в норме подавляющие его. Вытеснение этих факторов приводит к сохранению экзона 7 в мРНК SMN2. После синтеза мРНК SMN2 может происходить ее трансляция в белок SMN с полной длиной цепи и сохранённой функциональной активностью.
Фармакодинамические эффекты соответствуют биологическим эффектам нусинерсена.
Фармакокинетика
Интратекальные инъекции нусинерсена в спинномозговую жидкость обеспечивают полное распределение нусинерсена по всей спинномозговой жидкости в ткани ЦНС, являющиеся мишенями его терапевтического действия.
Средние минимальные остаточные концентрации нусинерсена в спинномозговой жидкости увеличивались примерно в 1.4-3 раза после многократного введения, достигая равновесного состояния примерно в течение 24 мес. При дополнительных введениях препарата после достижения равновесного состояния дальнейшего накопления в спинномозговой жидкости или в тканях ЦНС не ожидается.
После интратекального введения нусинерсена минимальные остаточные концентрации в плазме крови были относительно низки, по сравнению с остаточными концентрациями в спинномозговой жидкости. Медиана значений Т mаx в плазме крови составляла от 1.7 до 6 ч. Наблюдалось пропорциональное дозе увеличение средних значений С mах и AUC в плазме в пределах изученного диапазона доз. После многократных введений не наблюдалось признаков кумуляции со стороны показателей, отражающих системные уровни в плазме (С mах и AUC).
Нусинерсен характеризуется широким распределением с достижением терапевтических концентраций в тканях спинного мозга, представляющих собой терапевтическую мишень. Кроме того, продемонстрировано наличие нусинерсена в нейронах и прочих клеточных популяциях спинного и головного мозга, а также в периферических тканях, в частности, в скелетных мышцах, печени и в почках.
Нусинерсен медленно метаболизируется под воздействием гидролиза, опосредованного экзонуклеазами (3’ и 5’); он не является субстратом, ингибитором или индуктором ферментов цитохрома Р450.
Регистрационный номер:
Торговое наименование:
Международное непатентованное наименование:
Лекарственная форма:
раствор для интратекального введения
Состав
1 мл раствора содержит:
Действующее вещество: нусинерсен натрия 2,53 мг, в пересчете на нусинерсен (свободная кислота) 2,4 мг.
Вспомогательные вещества: натрия дигидрофосфата дигидрат, динатрия гидрофосфат безводный, натрия хлорид, калия хлорид, кальция хлорида дигидрат, магния хлорида гексагидрат, 1 М раствор натрия гидроксида, 1 М раствор хлористоводородной кислоты, вода для инъекций.
Описание
Прозрачный бесцветный раствор, свободный от легко обнаруживаемых нерастворенных частиц.
Фармакотерапевтическая группа:
Прочие препараты для лечения заболеваний костно-мышечной системы
Код ATX:
Фармакологические свойства
Механизм действия
Препарат Спинраза представляет собой антисмысловой олигонуклеотид (АСО), структура которого специально разработана для лечения спинальной мышечной атрофии (СМА), представляющей собой прогрессирующее нервно-мышечное заболевание с аутосомно-рецессивным типом наследования, причиной развития которого являются мутации в длинном плече хромосомы 5 (5q). Эти мутации приводят к утрате функции гена SMN1 (survival motor neuron 1 – гена 1, отвечающего за выживание двигательных нейронов), следствием чего является дефицит белка SMN. За выработку белка SMN также отвечает ген SMN2, однако количество функционального белка, образуемого при участии SMN2, низкое. СМА представляет собой спектр различных клинических состояний, при этом тяжесть заболевания зависит от возраста дебюта и количества копий гена SMN2.
Препарат Спинраза увеличивает долю транскриптов матричной рибонуклеиновой кислоты (мРНК) с включением экзона 7 гена SMN2, связываясь с интронным сайленсером сплайсинга (intronic splice silencing site – ISS N1), расположенным в интроне 7 предшественника матричной рибонуклеиновой кислоты (пре-мРНК) гена SMN2. Связываясь с ним, АСО вытесняет факторы сплайсинга, в норме подавляющие его. Вытеснение этих факторов приводит к сохранению экзона 7 в мРНК SMN2. После синтеза мРНК SMN2 может происходить её трансляция в белок SMN с полной длиной цепи и сохранённой функциональной активностью.
Фармакодинамика
Фармакодинамические эффекты соответствуют биологическим эффектам нусинерсена. Образцы тканей спинного мозга в грудных отделах, полученные при вскрытии младенцев, получавших терапию, содержали более высокие уровни матричной рибонуклеиновой кислоты (мРНК) SMN2 с экзоном 7, по сравнению с младенцами с СМА, не получавшими такую терапию.
Фармакокинетика
Фармакокинетика нусинерсена после однократных и многократных интратекальных инъекций определялась у педиатрических пациентов с диагнозом СМА.
Абсорбция
Интратекальные инъекции нусинерсена в цереброспинальную жидкость (ЦСЖ) обеспечивают полное распределение нусинерсена по всей ЦСЖ в ткани центральной нервной системы (ЦНС), являющиеся мишенями его терапевтического действия.
Средние минимальные остаточные концентрации нусинерсена в ЦСЖ увеличивались примерно в 1,4-3 раза после многократного введения, достигая равновесного состояния примерно в течение 24 месяцев. При дополнительных введениях препарата после достижения равновесного состояния дальнейшего накопления в ЦСЖ или в тканях ЦНС не ожидается.
После интратекального введения нусинерсена минимальные остаточные концентрации в плазме крови были относительно низки, по сравнению с остаточными концентрациями в ЦСЖ. Медиана значений Тmax в плазме крови составляла от 1,7 до 6,0 часа. Наблюдалось дозопропорциональное увеличение средних значений Сmax и площади под кривой концентрация-время (AUC) в плазме в пределах изученного диапазона доз. После многократных введений не наблюдалось признаков кумуляции со стороны показателей, отражающих системные уровни в плазме (Сmax и AUC).
Распределение
Согласно материалам вскрытия пациентов (n=3), отмечается широкое распределение нусинерсена, введённого интратекально, в ЦНС, с достижением терапевтических концентраций в тканях спинного мозга, представляющих собой терапевтическую мишень. Кроме того, продемонстрировано наличие нусинерсена в нейронах и прочих клеточных популяциях спинного и головного мозга, а также в периферических тканях, в частности, в скелетных мышцах, печени и в почках.
Биотрансформация
Нусинерсен медленно метаболизируется под воздействием гидролиза, опосредованного экзонуклеазами (3’ и 5’); он не является субстратом, ингибитором или индуктором ферментов цитохрома Р450.
Выведение
Средний расчётный терминальный период полувыведения из ЦСЖ составляет 135-177 дней. Наиболее вероятный основной способ выведения – экскреция нусинерсена и его метаболитов с мочой.
Особые популяции пациентов
Пациенты с нарушением функции почек и печени
Фармакокинетика нусинерсена у пациентов с нарушением функции почек или печени не изучена.
Половая принадлежность
Популяционный фармакокинетический анализ говорит об отсутствии влияния пола на фармакокинетику нусинерсена.
Показания к применению
Препарат Спинраза показан для лечения спинальной мышечной атрофии (СМА).
Противопоказания
Гиперчувствительность к действующему или любому из вспомогательных веществ.
Меры предосторожности при применении
Процедура люмбальной пункции
Процедура люмбальной пункции сопровождается риском возникновения нежелательных реакций, таких как, головная боль, боль в спине, рвота. Потенциальные сложности могут возникнуть при введении препарата пациентам в ранней возрастной группе и пациентам со сколиозом. По решению врача может быть использованы ультразвуковой или иные визуализационные техники для облегчения интратекального введения препарата Спинраза.
Тромбоцитопения и нарушения свертываемости крови
Тромбоцитопения и случаи нарушения свертываемости крови, включая острую тяжёлую тромбоцитопению, наблюдались после подкожного или внутривенного введения других АСО. При наличии клинических показаний, рекомендовано выполнять лабораторные тесты для определения количества тромбоцитов и показателей свертываемости крови перед введением препарата Спинраза.
Нефротоксичность
Нефротоксичность наблюдалась после подкожного или внутривенного введения других АСО. При наличии клинических показаний, рекомендовано выполнять количественное определение белка в моче (предпочтительно в первой утренней порции мочи). В случае стабильного повышения содержания белка в моче рекомендуется дальнейшее обследование.
Гидроцефалия
Сообщалось о гидроцефалии, не связанной с менингитом и кровотечением, у пациентов, получающих нусинерсен. Некоторым пациентам был имплантирован вентрикулоперитонеальный шунт. Следует провести оценку развития гидроцефалии у пациентов со сниженным сознанием. Преимущества и риски лечения нусинерсеном пациентов с вентрикулоперитонеальным шунтом в настоящее время неизвестны, и необходимо тщательно оценить необходимость в продолжении лечения.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении препарата Спинраза у женщин во время беременности отсутствуют. Должна быть проведена оценка соотношения пользы и риска лечения у женщин детородного возраста или женщин во время беременности.
Период грудного вскармливания
Данные о применении препарата Спинраза у женщин в период грудного вскармливания отсутствуют.
Фертильность
В токсикологических исследованиях на животных не обнаружено влияния на репродуктивные органы, фертильность мужских или женских особей, развитие эмбриона и плода.
Способ применения и дозы
Лечение должно проводиться медицинскими работниками, обладающими опытом выполнения люмбальных пункций.
Препарат Спинраза предназначен для интратекального введения посредством люмбальной пункции.
Режим дозирования
Рекомендованная доза составляет 12 мг (5 мл). Следует начинать терапию препаратом Спинраза как можно раньше после постановки диагноза.
Режим введения препарата Спинраза:
• в первый день лечения (день 0)
• в 14, 28, 63 день лечения
В случае задержки или пропуска введения дозы препарат Спинраза следует ввести как можно ранее, при этом интервал между дозами должен быть не менее 14 дней; далее следует продолжить введения с назначенной частотой.
• Далее дозу следует вводить 1 раз в 4 месяца.
В случае задержки или пропуска введения дозы препарат Спинраза следует ввести как можно ранее, и далее продолжить введения с назначенной частотой.
Препарат Спинраза должен применяться постоянно и длительно. Необходимость в продолжении терапии должна оцениваться лечащим врачом на основании клинического состояния пациента.
Инструкции по приготовлению и введению дозы
Дети (до 18 лет)
Эффективность и безопасность применения Спинраза изучалась у детей в возрасте от 0 до 17 лет.
Взрослые пациенты
Опыт применения у пациентов старше 18 лет ограничен.
Пожилые пациенты (старше 65 лет)
Опыт применения у пожилых пациентов старше 65 лет отсутствует.
Пациенты с нарушением функции почек
Применение препарата Спинраза у пациентов с нарушением функции почек не изучено.
Пациенты с нарушением функции печени
Применение препарата Спинраза у пациентов с нарушением функции печени не изучено. Препарат Спинраза не метаболизируется ферментной системой цитохрома Р450, в связи с чем маловероятно, чтобы при нарушении функции печени потребовалась коррекция дозы.
Побочное действие
Оценка безопасности препарата Спинраза основывалась на результатах двух клинических исследованиях 3 фазы с участием младенцев (CS3B) и детей (CS4) с СМА, а также на результатах открытых исследований с участием младенцев с генетически диагностированной СМА до появления симптомов, а также младенцев и детей с СМА. Из 260 пациентов, получавших препарат Спинраза на протяжении максимум 4 лет, 154 пациента получали его в течение как минимум 1 года.
Нежелательные явления изложены по классам систем органов и согласно категориям частоты, основываясь на следующих определениях: очень часто (≥1/10); неизвестно (на основании имеющихся данных оценить частоту невозможно).
Таблица 1: Нежелательные реакции, связанные с люмбальной пункцией, зарегистрированные в исследовании CS4 (поздняя манифестация СМА), наблюдавшиеся с частотой как минимум на 5% выше у пациентов, получавших препарат Спинраза, по сравнению с пациентами из контрольной группы, получавшими плацебо
| Класс систем органов MedDRA | Термин предпочтительного употребления MedDRA | Категория частоты в группе препарата Спинраза, n = 84 |
| Нарушения со стороны нервной системы | Головная боль* | Очень часто |
| Нарушения со стороны желудочно-кишечного тракта | Рвота* | Очень часто |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | Боль в спине* | Очень часто |
* Нежелательные явления, которые расценивались как связанные с процедурой люмбальной пункции. Эти нежелательные явления могут быть расценены как проявления постпункционного синдрома.
Пострегистрационное применение
В пострегистрационном периоде применения препарата Спинраза выявлен ряд нежелательных реакций. У пациентов, которым препарат Спинраза вводился посредством люмбальной пункции, наблюдались серьезные инфекции, например, менингит. Также имелись сообщения о случаях гидроцефалии. Частота возникновения подобных реакций неизвестна, поскольку все они наблюдались в пострегистрационном периоде.
Описание серьезных нежелательных реакций
При введении препарата Спинраза посредством люмбальной пункции наблюдались нежелательные реакции. Большинство подобных реакций зарегистрировано в течение 72 часов после процедуры. Частота возникновения и степень тяжести подобных явлений соответствует прогнозируемой частоте нежелательных явлений, возникающих при выполнении люмбальной пункции. Серьезные осложнения люмбальной пункции, например, серьезные инфекции, в клинических исследованиях препарата Спинраза не наблюдались.
Некоторые нежелательные явления, часто сопровождающие люмбальную пункцию (например, головная боль и боль в спине), невозможно оценить в популяции младенцев, которым вводится препарат Спинраза ввиду ограниченных коммуникативных возможностей данной возрастной группы.
Иммуногенность
Иммуногенные реакции на нусинерсен изучались на 229 пациентах, у которых проводилась оценка образцов плазмы, взятых до и после начала введения препарата, на содержание антилекарственных антител (АЛА). В целом, частота формирования АЛА была низкой, лишь у 13 (6%) появились АЛА на фоне лечения, из них у 2 пациентов они были транзиторными, у 5 были охарактеризованы как персистирующие, а у 6 не были подтверждены. При этом не выявлено достоверное влияние формирования АЛА на клинический ответ, нежелательные явления или фармакокинетический профиль нусинерсена.
Передозировка
Случаев передозировки, связанных с нежелательными реакциями, в клинических исследованиях не было.
В случае передозировки препаратом Спинраза пациенту следует дать указания обратиться за медицинской помощью при появлении любых признаков или симптомов, свидетельствующих о развитии нежелательных реакций.
Взаимодействие с другими лекарственными средствами и другие виды лекарственного взаимодействия
Клинических исследований взаимодействия с другими лекарственными средствами не проводилось.
Нусинерсен метаболизируется нуклеазами, а не ферментами цитохрома Р450.
Результаты исследований in vitro говорят о том, что нусинерсен не является индуктором или ингибитором метаболизма, опосредованного ферментами цитохрома Р450.
Результаты исследований in vitro говорят о низкой вероятности взаимодействия нусинерсена с другими препаратами на уровне конкуренции за связывание с белками плазмы крови или за использование транспортных систем, либо в связи с ингибированием активности транспортных систем.
Влияние на способность управлять транспортными средствами и другими механизмами
Исследований влияния терапии препаратом Спинраза на способность управлять транспортными средствами или другими механизмами не проводилось.
Форма выпуска
Раствор для интратекального введения, 2,4 мг/мл.
По 5 мл раствора во флаконе из стекла типа I, укупоренном пробкой из бромбутилового каучука и алюминиевым колпачком с пластмассовой крышкой. По 1 флакону вместе с инструкцией по медицинскому применению в пачке картонной. Пачка картонная может дополнительно иметь контроль первого вскрытия в виде стикера.
Условия хранения
При температуре 2-8 °С в оригинальной упаковке (флакон в пачке) для защиты от света. Не замораживать.
Допускается хранение в оригинальной упаковке (флакон в пачке) при температуре не выше 30 °С в течение не более 14 дней. В случае неиспользования в течение этих 14 дней повторное хранение при температуре 2-8 °С не допускается.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Держатель (владелец) регистрационного удостоверения
Биоген Айдек Лимитед, Великобритания
Biogen Idee Limited, United Kingdom
Innovation House, 70 Norden Road, Maidenhead, Berkshire SL6 4A Y, United Kingdom
Производитель, фасовщик (первичная упаковка)
Патеон Италия С.п.А., Италия
2. Трав. СКС Виа Мороленсе, 5, 03013 Ферентино (Фрозиноне), Италия
Patheon Italia S.p.A., Italy
2° Trav. SX Via Morolense, 5, 03013 Ferentino (FR), Italy
или
Веттер Фарма-Фертигунг ГмбХ и Ко. КГ, Германия
Айзенбанштрассе 2-4, 88085 Лангенарген, Германия
Vetter Pharma-Fertigung GmbH & Co. KG, Germany
Eisenbahnstr. 2-4, 88085 Langenargen, Germany
Упаковщик (вторичная (потребительская) упаковка), выпускающий контроль качества
Биоген (Денмарк) Манюфекчуринг АпС, Дания
Биоген Алле 1, 3400 Хиллерод, Дания
Biogen (Denmark) Manufacturing ApS, Denmark
Biogen Alle I, 3400 Hillerpd, Denmark
Организация, уполномоченная держателем (владельцем) РУ принимать сведения о рекламациях, нежелательных лекарственных реакциях и предоставлять потребителям дополнительные данные о препарате:
ООО «Джонсон & Джонсон», Россия, 121614, г. Москва, ул. Крылатская, д. 17 корп. 2
Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
Главная » Лекарства и исследования » Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
В марте 2020 года в научном журнале The Lancet Neurology была опубликована статья «Применение Нусинерсена для лечения взрослых с проксимальной (5q) спинальной мышечной атрофией: наблюдательное, многоцентровое исследование» (авторский коллектив Hagenacker T, et al). В статье представлены результаты независимого исследования реальной практики применения препарата Нусинерсен (торговое наименование – Спинраза) у подростков и взрослых со СМА в 10 клинических центрах Германии.
Описанные результаты наблюдения за эффективностью и безопасностью применения Спинраза показали значительные клинически значимые улучшения моторной функции у взрослых больных СМА, получавших лечение. Эта публикация вносит значительный вклад в понимание значимости терапии у взрослых пациентов, данные о применении терапии у которых ранее были крайне ограничены. На сегодняшний момент – эта публикация содержит результаты наблюдения за самой большой на сегодня когортой взрослых больных со СМА, получавших лечение и вносит значительный вклад в свидетельства, поддерживающие применение терапии Спинраза для взрослых пациентов.
Исследование содержит данные от 124 взрослых больных СМА (в основном, 2 и 3 типов), получавших лечение в 10 нервно-мышечных центрах Германии и основано на оценке двигательных функций с помощью нескольких шкал: Хаммерсмит (HFMSE), RULM и 6-минутного теста ходьбы (6MWT).
Учитывая факт медленного функционального ухудшения состояния у взрослых пациентов со СМА при естественном течение заболевания (без лечения), полученные данные позволяют говорить о том, что лечение взрослых больных со СМА с помощью нусинерсен позволяет достичь значимых клинически улучшений двигательной функции или стабилизации состояния взрослых больных СМА. При этом, не выявлено зависимости и взаимосвязи возраста пациентов и эффективности терапии.
Описание исследования
Несмотря на одобрение применения нусинерсена (Спинраза) для всех групп пациентов, независимо от возраста и типа заболевания большинством регуляторов, однако, данные по эффективности и безопасности применения препарата у взрослых больных со СМА оставались фрагментарными. Единственное ранее опубликованное исследование описывает применение Спинраза у 19 взрослых пациентов со СМА 3 типа и описывает значительное улучшение моторной функции после 300 дней применения нусинерсен.
Исследовательский коллектив поставил целью выяснить безопасность и эффективность применения Спинраза у широкой и разнородной группы взрослых пациентов со СМА. Для этого в наблюдательное исследование были включены 10 нервно-мышечных центров Германии, в которых проходили лечение пациенты от 16 до 65 лет с генетически подтвержденным диагнозом СМА в период с 13 июля 2017 года до 1 мая 2019 года. Все взрослые пациенты, которые получали лечение в этих 10 центрах были включены в исследование. Для оценки результата лечения влючались только пациенты, получавшие лечение в течение, как минимум, 6 месяцев с продолжением наблюдения вплоть до 14 месяцев на терапии.
173 пациента были скринированы для участия в исследовании, из которых 139 (80%) подошли для анализа данных. Из них, 124 пациента (89%) были включены в срез данных 6 месячного интервала получения терапии, 92 пациента (66%) – 10-месячного, и 57 (41%) в 14-месячный анализ. Из анализа были исключены пациенты, для которых отсутствовали данные оценок по шкалам при начале терапии, а также в связи с отказом пациентов от участия (2 человека) и в связи с возникшими побочными реакциями на фоне приема препарата (отказ от продолжения лечения – 2 человека).
Основные результаты:
Основным инструментом оценки была шкала Хаммерсмит (HFMSE), которая состоит из 33 пунктов оценки моторной функции для оценки повседневной активности. По каждому пункту может быть выставлено от 0 до 2 баллов, таким образом, максимальный балл по данной шкале – 66. Уровень в 3 балла по данной шкале считается клинически значимым.
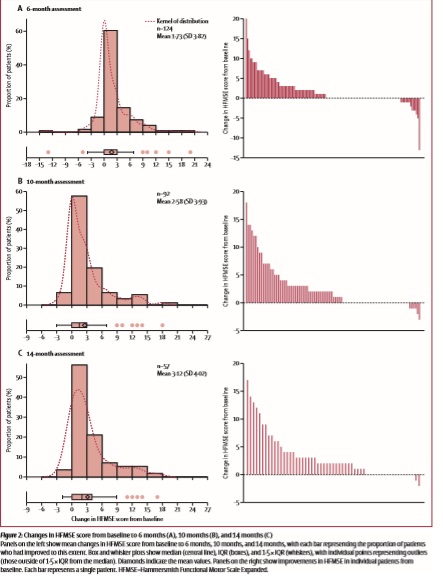
Средние оценки по шкале Хаммерсмит (HFMSE) значительно повысились по сравнению с оценками перед началом терапии, средняя разница в 6-месячный анализ данных составила 1.73 балла, в 10-месячный – 2.58 балла, в 14-месячный – 3.2 балла.
Клинически значимые улучшения моторной функции (по данной шкале служит отметка в более чем 3 балла) наблюдались у 35 (28%) из 124 пациентов через 6 мес после начала лечения, у 33 (35%) из 92 пациентов через 10 мес после начала лечения, и у 23 (40%) из 57 пациентов через 14 мес после начала лечения.
За исключением 2 пациентов, все пациенты, у который отмечались улучшения более чем в 3 балла по HFMSE к 10 мес с начала лечения – сохранили набранные баллы и к 14-месяцам и далее. У 5 пациентов было установлено улучшение в более чем 10 баллов (3 ходящих и 2 неходячих пациентов со СМА 3 типа с 3 или 4 копиями SMN2, возраст пациентов от 48 до 59 лет). 14 пациентов не смогли показать улучшений на терапии, продолжая ухудшаться. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по HFMSE и возрастом пациентов.
Дополнительно оценивалась функция верхних конечностей по шкале RULM, которая включает 20 разделов, максимально возможное количество баллов по этой шкале – 37, при этом уровень в 2 балла по данной шкале считается клинически значимым.
Функция рук также значительно улучшалась по сравнению с состоянием до начала терапии. Так, у 28 (23%) из 120 пациентов через 6 мес после начала лечения отмечено улучшение функции по шкале RULM как минимум на 2 балла (т.е. клинически значимо), в то время как у 74 (61%) пациентов не отмечено улучшений, у 18 (15%) пациентов отмечалось ухудшение на 1 балл или более, а у 10 (8%) пациентов ухудшение составило 2 балла или более. 28 (23%) пациентов сохранили полную функциональность (37 из 37 возможных баллов на протяжении 6 мес после начала лечения. 21 (75%) пациент из 28 сохранили полную функциональность к 14-месячной отметке после начала терапии. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по RULM и возрастом пациентов.
Также производилась оценка (у ходящих пациентов) по 6-минутному тесту ходьбы (измерение дистанции, которую пациент может преодолеть за 6 минут). Значительные улучшения были установлены у пациентов при анализе после 6-ти, 10-ти и 14-ти мес после начала терапии.
Помимо общего анализа был также проведен дополнительный анализ в разных субгруппах пациентов.
Так, при сравнении групп взрослых пациентов со СМА 2 и СМА 3 типов:
— клинически значимые улучшение по шкале HMFSE (более 3 баллов) были установлены:
у 23 (30%) пациентов из 77 после 6 мес. после начала лечения; 18 (32%) из 60 пациентов после 10 мес.; 15 (41%) из 37 пациентов после 14 мес. лечения в группе больных со СМА3 типа.
У 1 (2%) из 45 пациентов после 6 мес. после начала лечения; 2 (7%) из 30 пациентов после 10 мес.; 1 (5%) из 20 пациентов после 14 мес. лечения в группе больных со СМА2 типа.
— клинически значимые улучшения функции рук по шкале RULM были отмечены на всех трех анализируемых интервалах у пациентов со СМА2 типа, а у пациентов со СМА3 типа только после 14-мес периода наблюдения.
При сравнении групп взрослых пациентов из подгруппы неамбулаторных (неходячих) и амбулаторных (ходячих) улучшения были отмечены во всех временных интервалах у обоих групп, при этом более значительные изменения уровня моторной функции наблюдались в группе ходячих по сравнению с неходячими пациентами.
При сравнении между группами пациентов имеющих перед началом терапии высокий балл по HMFSE (более 35) и низкий балл (ниже 35) было отмечено, что улучшения у пациентов с более высокими изначально баллами были значительнее.
При сравнении групп пациентов с неоперированным позвоночником (96 пациентов) и пациентов с металлоконструкцией в позвоночнике(28 пациентов) – не было отмечено значительного различия в улучшениях баллов по HMFSE. Но при этом отмечается, что эффект от лечения нусинерсен у пациентов с металлоконструкцией был несколько ниже, что, вероятно, связано с предшествующей тяжестью состояния и выражается в более низких баллах HMFSE у таких пациентов до начала терапии.
Безопасность
За 14-месячный период наблюдения не было отмечено каких-либо новых, не выявленных ранее побочных эффектов. При этом, у 82 (47%) пациентов отмечались какие-либо побочные реакции. Наиболее частые побочные реакции на лечение: головные боли у 61 (35%) пациентов, боли в спине 38 (22%) пациентов и тошноту у 19 (11%) пациентов, другие встречались более редко.
Выводы исследования:
Данные, полученные в результате этого исследования показывают значительное улучшение двигательной функции у взрослых пациентов со СМА после начала терапии через 6,10 и 14 мес. После начала терапии. Наибольшее улучшение моторной функции коррелирует с меньшей тяжестью состояния пациента до начала терапии.
В целом, пропорция пациетов со значимым улучшением по шкале HMFSE в группе взрослых пациентов со СМА 3 типа, чем в группе СМА2, но не было установлено никакой корреляции между возрастом пациента и уровнем улучшения моторной функции (т.е. не зависит от времени, прошедшего с момента начала заболевания). А также данные указывают, что более высокий результат показывают пациенты с более чем 35 баллами по HMFSE до начала терапии.
Данные естественного течения заболевания свидетельствуют о том, что взрослые со СМА в среднем ежегодно теряют 0,5-1 балл HMFSE. Конечно, с учетом индивидуальных особенностей пациентов, фазы клинических ухудшений сменяются периодами стабилизации, поэтому эта оценка потери функции – усредненная. Тем не менее, учитывая эти факты, результаты полученные в данном исследовании, подтверждают значительный эффект от терапии нусинерсен у взрослых пациентов.
В части безопасности, не было выявлено никаких не описанных ранее осложнений. Примерно у пятой части пациентов возникали боль в спине и пост-пункционные головные боли, это количество совпадает с общим процентом осложнений при проведении люмбальной пункции (8-25%) в целом.
В исследовании не оценивалось влияние терапии на функцию глотания и дыхания, это потребует дополнительных исследований в будущем. Также дополнительных исследований потребует получение данных наблюдения за долгосрочной эффективностью применением нусинерсен, а также индивидуальых схем применения нусинерсен с учетом режима дозирования и перерывов в лечении.
Данный материал носит исключительно информационный характер и не может служить рекламой препарата. Рекомендации относительно индивидуального применения лекарственного препарата следует получать у вашего лечащего врача.
Источник: The Lancet