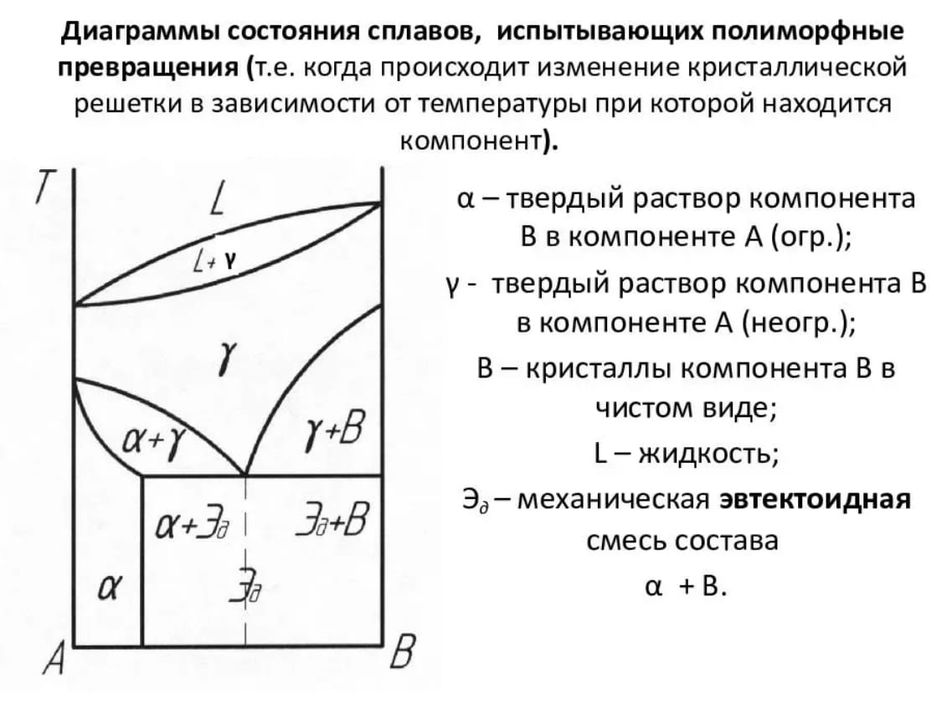
Укажите с чем связаны полиморфные превращения железа
Полиморфное превращение в железе.
Во многих металлах при изменении температуры происходит перегруппировка атомов, кристаллическая решетка одного вида переходит в другой. Это явление называется аллотропией или полиморфизмом, а различные кристаллические формы одного вещества называют полиморфными модификациями.
Полиморфные модификации обозначаются греческими буквами α, β, γ, δ и т.д., причем α соответствует модификации, существующей при наиболее низкой температуре.
Суть полиморфного превращения заключается в том, что при нагревании в твердом металле возникают новые центры кристаллизации, что приводит к образованию новой решетки. При формировании кристаллической решетки температура остается постоянной, так как при нагревании формирование происходит с поглощением тепла, а при охлаждении – с выделением тепла. Полиморфное превращение – это кристаллизационный процесс и на кривой нагревания (охлаждения) изображается горизонтальной линией.
В результате полиморфного превращения образуются зерна, имеющие другой размер и форму по сравнению с исходными зернами. При переходе из одной полиморфной модификации в другую меняются все свойства металлов.
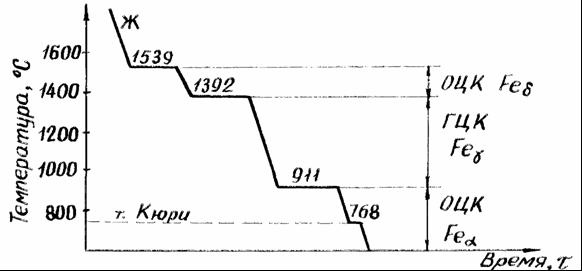
Важнейшее значение в технике имеют полиморфные превращения в железе (Рис. 5). Железо может существовать в нескольких модификациях.
Рисунок 5. Кривая охлаждения чистого железа.
До температуры 1539ºС железо остается жидким. При температуре 1539ºС начинается кристаллизация и образуется δ-железо, имеющее кубическую объемно-центрированную решетку. Между температурами 1400 и 910ºС происходит перестройка этой решетки в новую модификацию – γ-железо с образованием кубической гранецентрированной решетки. Ниже температуры 910ºС железо переходит в новую форму – α-железо с кубической объемно-центрированной решеткой. При температуре 768ºС происходит последняя температурная остановка с образованием магнитной формы α-железа, в которой сохраняется объемно-центрированная решетка.
Подобные полиморфные превращения происходят и с другими металлами, но при иных критических температурах.
Железо, его совйства, полиморфные превращения чистого железа
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al[2]). Считается также, что железо составляет бо́льшую часть земного ядра.
Свойства: Оно пластично, легко куется как в холодном, так и нагретом состоянии, поддается прокатке, штамповке и волочению. Способность растворять углерод и других элементы служит основой для получения разнообразных железных сплавов. Железо может существовать в виде двух кристаллических решеток: α- и γ-объемноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910°С устойчиво α-Fe с ОЦК-решеткой (а = 2,86645Å при 20 °С). Между 910 °С и 1400°С устойчива γ-модификация с ГЦК-решеткой (а = 3,64Å). Выше 1400°С вновь образуется ОЦК-решетка δ-Fe (a = 2,94Å), устойчивая до температуры плавления (1539 °С). α-Fe ферромагнитно вплоть до 769 °С (точка Кюри). Модификации γ-Fe и δ-Fe парамагнитны.
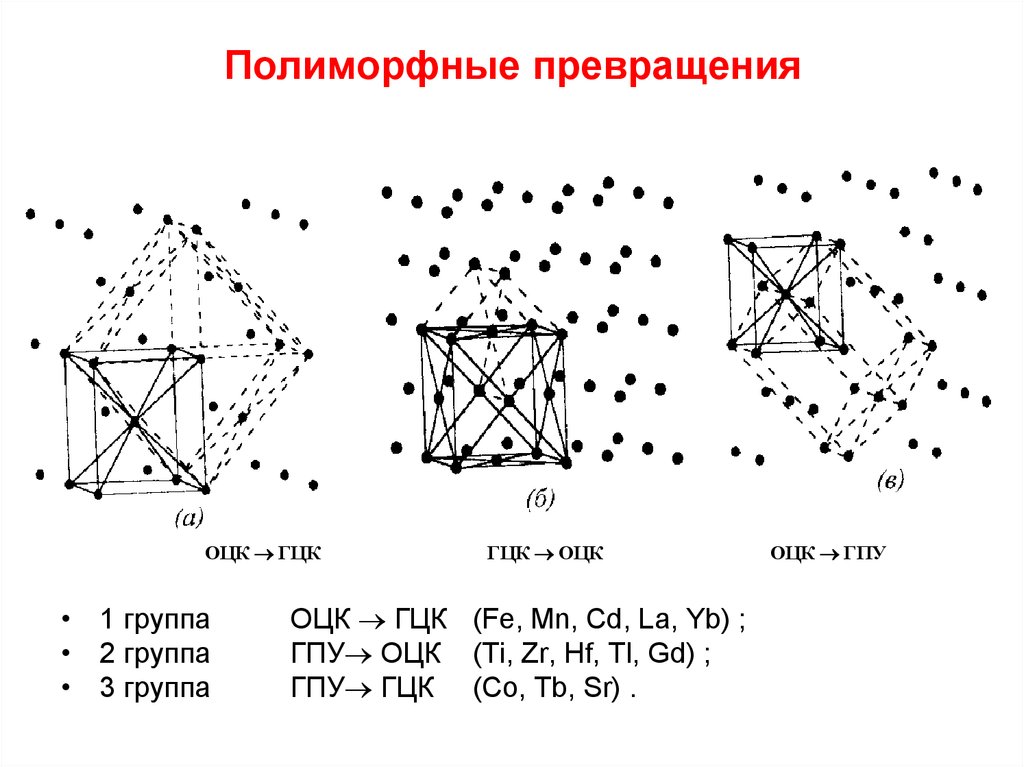
Некоторые металлы (железо, титан, кобальт, цирконий и др.) при разных температурах имеют различные кристаллические решетки. Такое явление называется полиморфизмом или аллотропией. Процесс перехода из одного кристаллического строения в другое называется полиморфным (аллотропическим) превращением.
Строение, получающееся в результате полиморфного превращения, называется аллотропической формой. Аллотропическая форма, устойчивая при более низкой температуре, обозначается индексом a, при более высокой – b, g и т. д.
Температура, при которой происходит переход решетки из одного вида в другой, называется температурой полиморфного превращения или температурой перекристаллизации. При этом изменяются свойства металла (плотность, теплопроводность, теплоемкость и др.).
Аллотропические превращения при нагревании происходят с поглощением тепла, а при охлаждении – с его выделением. Как при нагревании, так и при охлаждении аллотропические превращения происходят с некоторым запаздыванием. Так, температура превращения a-модификации в b-модификацию, происходящего при нагревании, будет всегда выше температуры превращения b в a, происходящего при охлаждении. Такое явление называется гистерезисом.
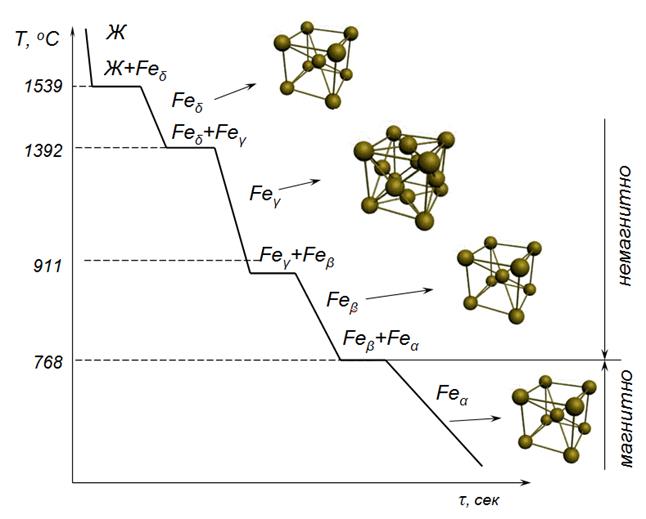
До температуры 1539 °С происходит охлаждение жидкого железа. При 1539 °С на кривой охлаждения появляется площадка. При этой температуре железо затвердевает, и выделяется скрытая теплота кристаллизации. По окончании кристаллизации и до температуры 1392 °С железо имеет объемно-центрированную кубическую решетку (Fea ).При 1392 °С на кривой появляется вторая площадка, связанная с аллотропическим превращением a-железа (Fea) в g-железо (Feg), имеющее гранецентрированную кубическую решетку.При аллотропическом превращении исчезают старые зерна и появляются новые. Такое превращение аналогично процессу кристаллизации: вначале образуются зародыши, а затем идет рост зерен новой модификации. Такое превращение является перекристаллизацией. Следующая площадка наблюдается на кривой охлаждения при температуре 911 °С по причине превращения Feg в Fea. Кристаллическая решетка превращается из гранецентрированной опять в объемно-центрированную кубическую, которая сохраняется до самых низких температур.Площадка на кривой охлаждения, соответствующая температуре 768 °С, связана не с перестройкой кристаллической решетки, а с перестройкой электронных оболочек атомов и изменением магнитных свойств. Ниже 768 °С железо магнитно, а выше – немагнитно.Иногда немагнитное железо Fea называют Feβ, а высокотемпературную модификацию Fea (в интервале 1392…1539 °С) – Fed. Полиморфные превращения протекают как в чистых металлах, так и в сплавах.
Fe-Fe3C
Первичная кристаллизация сплавов системы железо-углерод начинается по достижении температур, соответствующих линии ABCD (линии ликвидус), и заканчивается при температурах, образующих линию AHJECF (линию солидус).При кристаллизации сплавов по линии АВ из жидкого раствора выделяются кристаллы твердого раствора углерода в α-железе (δ-раствор). Процесс кристаллизации сплавов с содержанием углерода до 0,1 % заканчивается по линии АН с образованием α (δ)-твердого раствора. На линии HJB протекает перитектическое превращение, в результате которого образуется твердый раствор углерода в γ-железе, т. е. аустенит. Процесс первичной кристаллизации сталей заканчивается по линии AHJE.При температурах, соответствующих линии ВС, из жидкого раствора кристаллизуется аустенит. В сплавах, содержащих от 4,3 % до 6,67 % углерода, при температурах, соответствующих линии CD, начинают выделяться кристаллы цементита первичного. Цементит, кристаллизующийся из жидкой фазы, называется первичным. B точке С при температуре 1147°С и концентрации углерода в жидком растворе 4,3 % образуется эвтектика, которая называется ледебуритом. Эвтектическое превращение с образованием ледебурита можно записать формулой ЖР4,3Л[А2,14+Ц6,67]. Процесс первичной кристаллизации чугунов заканчивается по линии ECF образованием ледебурита.Таким образом, структура чугунов ниже 1147°С будет: доэвтектических – аустенит+ледебурит, эвтектических – ледебурит и заэвтектических – цементит (первичный)+ледебурит. Превращения, происходящие в твердом состоянии, называются вторичной кристаллизацией. Они связаны с переходом при охлаждении γ-железа в α-железо и распадом аустенита.Линия GS соответствует температурам начала превращения аустенита в феррит. Ниже линии GS сплавы состоят из феррита и аустенита.Линия ЕS показывает температуры начала выделения цементита из аустенита вследствие уменьшения растворимости углерода в аустените с понижением температуры. Цементит, выделяющийся из аустенита, называется вторичным цементитом. В точке S при температуре 727°С и концентрации углерода в аустените 0,8 % образуется эвтектоидная смесь состоящая из феррита и цементита, которая называется перлитом. Перлит получается в результате одновременного выпадения из аустенита частиц феррита и цементита. Процесс превращения аустенита в перлит можно записать формулой А0,8П[Ф0,03+Ц6,67].Линия PQ показывает на уменьшение растворимости углерода в феррите при охлаждении и выделении цементита, который называется третичным цементитом. Следовательно, сплавы, содержащие менее 0,008% углерода (точкаQ), являются однофазными и имеют структуру чистого феррита, а сплавы, содержащие углерод от 0,008 до 0,03% – структуру феррит+цементит третичный и называются техническим железом.Доэвтектоидные стали при температуре ниже 727ºС имеют структуру феррит+перлит и заэвтектоидные – перлит+цементит вторичный в виде сетки по границам зерен. В доэвтектических чугунах в интервале температур 1147–727ºС при охлаждении из аустенита выделяется цементит вторичный, вследствие уменьшения растворимости углерода(линия ES). По достижении температуры 727ºС (линия PSK) аустенит, обедненный углеродом до 0,8% (точка S), превращаясь в перлит. Таким образом, после окончательного охлаждения структура доэвтектических чугунов состоит из перлита, цементита вторичного и ледебурита превращенного (перлит+цементит).Структура эвтектических чугунов при температурах ниже 727ºС состоит из ледебурита превращенного. Заэвтектический чугун при температурах ниже 727ºС состоит из ледебурита превращенного и цементита первичного.
Лекция 7. Диаграмма состояния с полиморфным превращением на примере системы железо-углерод, основные фазы.



Тема 6. Система сплавов Fe –C
Основные фазы. Превращения в железоуглеродистых сплавах при нагреве и охлаждении. Углеродистые стали. Критические точки в сталях. Влияние содержания углерода на механические свойства сталей. Влияние примесей на эксплуатационные свойства сталей. Хладноломкость сталей. Чугуны;(6ч)
Лекция 7. Диаграмма состояния с полиморфным превращением на примере системы железо-углерод, основные фазы.
Железоуглеродистые сплавы (стали и чугуны) важнейшие металлические сплавы современной техники.
Представление о строении сплавов железоуглеродистых сплавов дает диаграмма системы Fe – C, начало изучения, которой было положено работами Д.К. Чернова в 1868 году.
Железо в твердом состоянии может находиться в двух полиморфных модификациях: Feα
Ниже 910 ºC и выше 1392 ºC устойчиво α-железо с ОЦК решеткой. В интервале температур 910-1392 ºC устойчиво γ-железо с кристаллической решеткой ГЦК (рис.7.1).
Рис.7.1. Кривая нагрева – охлаждения железа
Железо при 768ºC испытывает магнитное превращение. Выше 768ºC железо становится немагнитным.
Углерод образует с железом твердые растворы внедрения. Растворимость углерода в железе зависит от кристаллической модификации железа.
Диаметр поры кристаллической решетки ОЦК (свободное место в середине ребер) равен 0,062нм, что значительно меньше, чем диаметр поры решетки ГЦК, равной 0,102нм, а диаметр атома ( иона) углерода-0,154нм. Поэтому α-железо способно растворять углерод в очень малом количестве, а растворимость углерода в γ-железе существенно больше.
Железо не только растворяет углерод, но и образует с ним химическое соединение цементит (Fe3C).
В системе железо-углерод возможно присутствие следующих фаз: жидкой фазы, твердых растворов на базе Feα (феррита) и на базе Feγ (аустенита), химического соединения Fe3C (цементита).
Феррит (Ф)- твердый раствор внедрения углерода в Feα.. При 727 ºC наблюдается максимальная растворимость углерода в феррите, составляющая 0,02%; при 20 ºC в феррите растворяется около 0,006% С. Высокотемпературная модификация Feα.( называется Feδ) с предельной растворимостью углерода 0,1 % при температуре 1499 o С (точка J). Свойства феррита близки к свойствам чистого железа. Область феррита на диаграмме состояния железо-углерод расположена левее линии GPQ и AHN.
Аустенит (А) – твердый раствор внедрения углерода в Feγ. Растворимость углерода в аустените зависит от температуры. При 1147 ºC аустенит может растворять до 2,14 %С, при 727 ºC – 0,8%С. Область аустенита на диаграмме – NJESGN.
Цементит (Ц) – карбид железа Fe3C, в котором содержится 6,67 %С. Температура плавления цементита 1252 ºC. Обладает высокой твердостью ( 8000 МПа НВ ), легко царапает стекло. Цементит очень хрупок, имеет практически нулевую пластичность, сложную орторомбическую решетку с плотной упаковкой атомов.
Диаграмма состояния железо-углерод приведена на рис.3.2.
Линия ABCD- линия ликвидус, линия AHJECF – солидус. Точка А соответствует температуре плавления железа (1539 ºC), точка D – температуре плавления цементита (1252ºC). Точки N и G соответствуют температурам полиморфного превращения железа.
Рис. 7.2. Диаграмма состояния системы Fe – C
Три горизонтальные линии на диаграмме Fe – C (рис.2) – HJB, ECF и PSK указывают на протекание нонвариантных реакций.
При 1499ºC (линия HJB) протекает перитектическая реакция:
По линии ECF при 1147 ºC происходит эвтектическое превращение:
Образующая эвтектика называется ледебуритом.
Ледебурит (Л)- механическая смесь аустенита и цементита, содержащая 4,3%С.
По линии PSK при 727 ºC происходит эвтектоидное превращение:
В результате которого из аустенита, содержащего 0,8%С, образуется механическая смесь феррита и цементита. Эвтектоидное превращение происходит аналогично кристаллизации эвтектики, но не из жидкости, а из твердого раствора. Образующийся эвтектоид называется перлитом.
Перлит (П) – механическая смесь феррита и цементита, содержащая 0,8%С. Зерно перлита состоит из параллельных пластинок цементита и феррита, на травленом шлифе напоминает перламутр, отсюда и называется – перлит.
Аустенит, входящий в состав ледебурита, при 727 ºC также испытывает эвтектоидное превращение. Поэтому ниже 727 ºC ледебурит состоит из механической смеси перлита и цементита.
На рис.7.3 приведены кривые охлаждения сплавов: 0,02; 0,5; 0,8; 1,7; 3,5; 4,3; 5,5%С.
Сплав 1, содержащий менее 0,02%С, фактически, представляет собой технически чистое железо. Точка 1 соответствует началу кристаллизации аустенита, точка 2 – окончанию кристаллизации. При охлаждении от точки 2 до точки 3 никаких превращений в образовавшемся аустените не происходит.
В точке 3 начинается, а в точке 4 заканчивается перестройка кристаллической решетки аустенита (ГЦК) в кристаллическую решетку феррита (ОЦК). При охлаждении в интервале температур 3-4 состав аустенита меняется по линии GS, а состав феррита – по линии GP. От точки 4 до точки 5 превращений не происходит, образовавшийся феррит просто охлаждается. Линия PQ соответствует линии переменной растворимости.
Ниже этой линии сплав пересыщен углеродом, происходит выделение избыточного углерода, образующего химическое соединение с железом, т.е. цементит. При охлаждении цементит выделяется непрерывно, и концентрация углерода в феррите уменьшается по линии PQ, составляя при комнатной температуре
Учебные материалы
Некоторые элементы могут изменять свое кристаллическое строение, т.е. тип кристаллической решетки, в зависимости от внешних условий — температуры и давления.
Существование одного элемента в нескольких кристаллических формах (кристаллических модификациях) называется полиморфизмом или аллотропией.
Каждая полиморфная модификация имеет свою область температур, при которых она устойчива. Превращение одной кристаллической формы в другую происходит при постоянной температуре с выделением значительного количества тепла при охлаждении, что связано с затратой определенной энергии на перестройку кристаллической решетки и поглощением тепла при нагреве.
Перестройка кристаллической решетки в твердом состоянии называется вторичной кристаллизацией.
Как и при первичной кристаллизации для полиморфных превращений необходимы переохлаждение или перегрев относительно равновесной температуры. По своему механизму это кристаллизационный процесс, осуществляемый путем образования зародышей (как правило, на границах зерен) и последующего их роста. В результате образуются новые кристаллические зерна, имеющие другой размер и форму. Скачкообразно изменяются все свойства: удельный объем, теплоемкость, теплопроводность, механические и химические свойства.
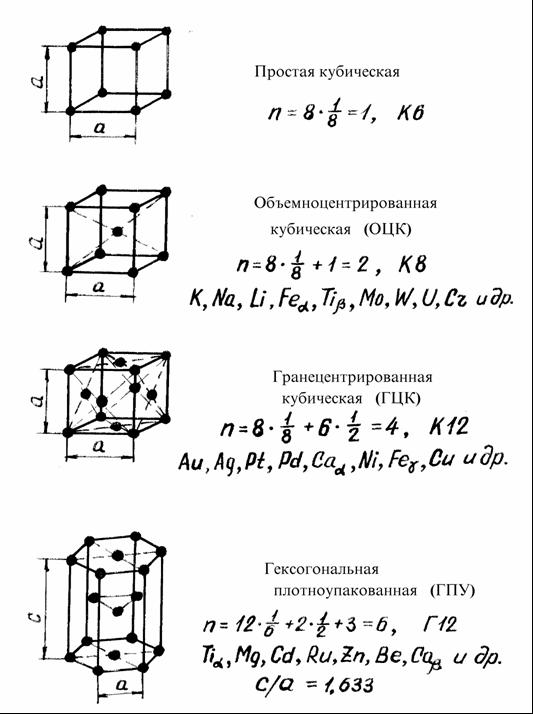
Рисунок 2 – Виды элементарных кристаллических ячеек
Железо является основным компонентом сталей, чугунов и обладает полиморфизмом. На рисунке 3 приведена кривая охлаждения железа с температурами полиморфных превращений.
Рисунок 3 — Кривая охлаждения железа
Точка Кюри — это температура, соответствующая переходу из ферромагнитного состояния в парамагнитное.
Примером полиморфного превращения, обусловленного изменением температуры и давления, является изменение кристаллического строения углерода. В обычных условиях он находится в виде модификации графита, а при нагреве до 2000 0 С и давлении порядка 10 10 Па образуется модификация алмаза.
В середине восьмидесятых годов прошлого века открыта третья форма углерода в виде замкнутых сферических или сфероидальных молекул, состоящих из пяти- и шестиугольников — фуллерены. В зависимости от количества объединенных атомов углерода существуют фуллерены С28…С960. Наиболее стабильными являются молекулы С60 и С70. Полиморфные модификации углерода приведены на рисунке 4.
Уважаемые студенты!
Специалисты нашего сайта готовы оказать помощь в учёбе по разным предметам:
✔ Решение задач
✔ Выполнение учебных работ
✔ Помощь на экзаменах
Механизм полиморфных превращений в металлах
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.