Углеводороды это что такое простыми словами
Углеводороды и их роль в жизни человека
Углеводороды
Этот класс веществ объединяет самые разные соединения, большинство из которых давно и успешно используются для своих целей человеком. Это объясняется тем, что углерод очень легко образует химические связи, особенно с водородом, поэтому и наблюдается такое разнообразие. Без этого была бы невозможна жизнь в том виде, в котором мы ее знаем. Углеводороды – это вещества, состоящие из двух элементов: углерода и водорода. Их молекулы могут быть не только линейными, но и разветвленными, а также образовывать замкнутые циклы.
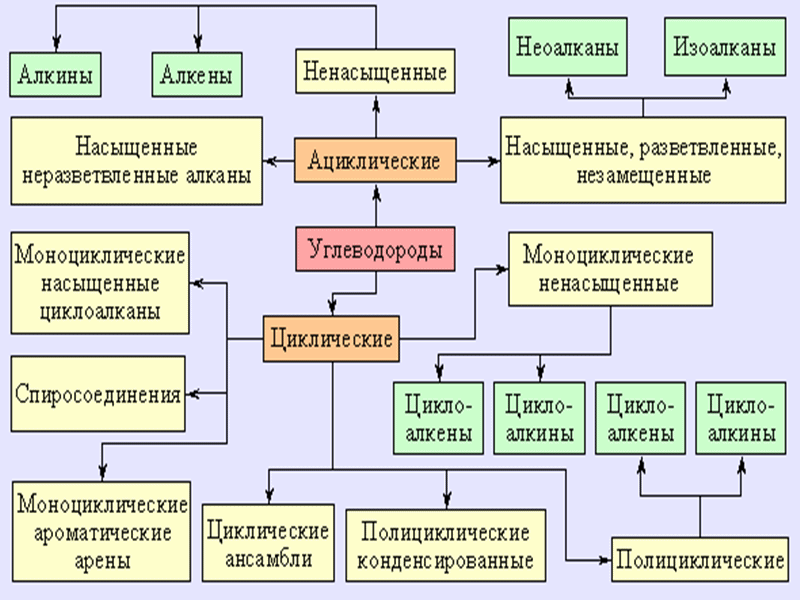
Классификация углеводородов
Углерод образует четыре связи, а водород – одну. Но это не значит, что их соотношение всегда равно 1 к 4. Дело в том, что между атомами углерода могут быть не только одинарные, но и двойные, а также тройные связи. По этому критерию различают классы углеводородов. В первом случае эти вещества называются предельными (или алканами), а во втором – ненасыщенными или непредельными (алкенами и алкинами для двух и трех связей соответственно).
Еще одна классификация предусматривает рассмотрение молекулы. В этом случае различают алифатические углеводороды, структура которых линейна, и карбоциклические, в виде замкнутой цепи. Последние в свою очередь делятся на алициклические и ароматические.
Помимо этого, углеводороды часто подвергаются полимеризации – процессу присоединения одинаковых молекул одна к другой. В результате получается совершенно новый материал, не похожий на базовый. Примером может служить полиэтилен, получающийся из просто этилена. Это возможно только когда речь идет о ненасыщенных углеводородах.
Структуры, которые также относятся к классу непредельных, могут с помощью своих свободных радикалов присоединять и новые атомы, отличные от водорода. В этом случае получаются другие органические вещества: спирты, амины, кетоны, эфиры, белки и т. д. Но это уже совершенно отдельные темы в химии.
Примеры углеводородных соединений
Углеводороды – это огромное разнообразие веществ даже с учетом классификации. Но все же стоит кратко перечислить наименования соединений, входящих в этот многочисленный класс.
Свойства углеводородов
Как уже было упомянуто выше, углеводороды – это огромное количество самых разных веществ. Поэтому говорить об их общих свойствах несколько странно, ведь таковых просто нет.
Одинаковой чертой у всех углеводородов может считаться разве что состав. А также тот факт, что в начале каждого ряда, по мере увеличения количества атомов углерода, происходит переход от газообразной и жидкой формы к твердой.
Есть и еще одна схожесть: все углеводороды обладают хорошей горючестью. При этом выделяется много тепла, образуются углекислый газ и вода.
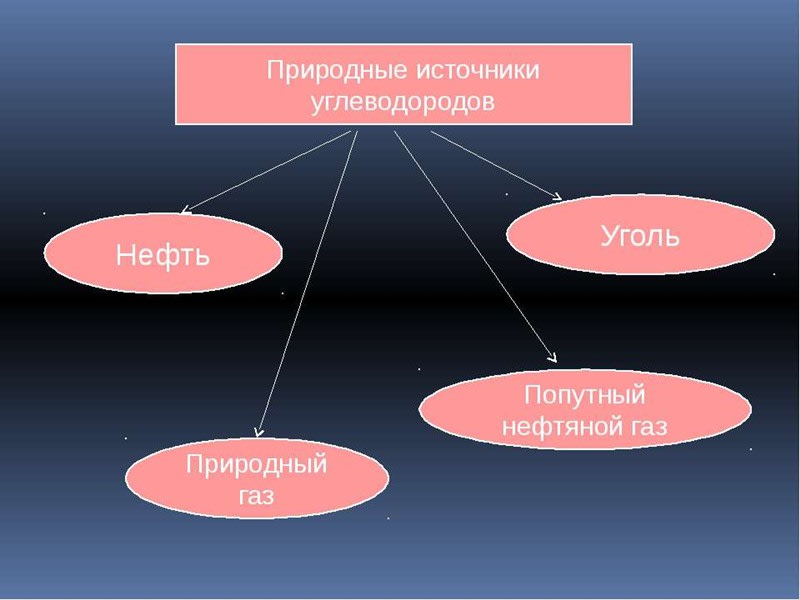
Природные источники углеводородов
Другие источники углеводородов – лаборатории. Те вещества, которые не встречаются в природе, могут быть синтезированы из других соединений с помощью химических реакций.
Использование углеводородов
Углеводороды играют огромную роль в современной жизни человечества. Нефть и газ стали очень ценными ресурсами, ведь они служат в качестве топлива и энергоносителей. Но это не единственные способы применения соединений из данного класса. Углеводороды – это буквально все, что окружает людей в быту. С помощью полимеризации удалось получить новые материалы, из которых изготавливаются разные виды пластмасс, тканей и т. д. Керосин, растворители, лакокрасочные изделия, парафины, асфальт, гудрон, битум, и это не считая основных продуктов нефтепереработки – бензина и дизельного топлива.
Значение этих веществ огромно. Как непредельные, так и предельные углеводороды – это сотни и тысячи вещей, к которым каждый человек привык и не может без них обходиться в самых простых ситуациях. Отказаться от их использования крайне сложно даже с учетом того, что запасы нефти и газа иссякнут, как предрекают аналитики. Уже сейчас человечество ведет активный поиск альтернативных источников энергии, но ни один из вариантов пока не показал такой же эффективности и универсальности, как углеводороды.
Роль углеводородов в организме человека
По характеру воздействия на организм человека различают две группы углеводородов: раздражающие и канцерогенные.
Раздражающие углеводороды оказывают наркотическое воздействие на центральную нервную систему и влияют на слизистые оболочки. К ним относятся альдегиды, все непредельные и предельные соединения углерода с водородом, не относящиеся к ароматическим соединениям.
Наибольшую опасность для человека представляют углеводородные соединения канцерогенной группы: 1,2-бензантрацен, 3,4-бензпирен (С20Н12), 1,2-бензпирен (C2oHi2), 3,4-бензфлуорантен (С2оН14). Особо опасен 3,4-бензпирен, являющийся своего рода индикатором присутствия в смеси других канцерогенов.
Читайте также:
Влияние кофе на печень
Влияние пчелиного подмора на поджелудочную железу
Влияние пива на поджелудочную железу
Влияние алкоголя на печень и поджелудочную железу
Влияние антибиотиков на поджелудочную железу
Углеводороды, виды и их классификация
Углеводороды, виды и их классификация.
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Они служат фундаментальной основой органической химии
Углеводороды:
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Углеводороды служат фундаментальной основой органической химии – молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Атом углерода имеет 4 электрона на внешней оболочке, а потому способен образовывать четыре химические связи с другими атомами. Поэтому атом углерода является стабильным только в том случае, если все из этих связей – все четыре связи используются.
Существует огромное количество совершенно различных соединений углеводородов, которые различаются количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе Земли встречаются в сырой нефти. Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация и виды углеводородов:
При систематизации (классификации) углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
В зависимости от строения углеродного скелета углеводороды подразделяют на ациклические и карбоциклические.
Ациклические соединения (ациклические углеводороды) – класс органических соединений, в молекулах которых отсутствуют циклы (кольца), и все атомы углерода соединены между собой в прямые или разветвлённые (открытые) цепи.
Ациклические соединения также в литературе называются алифатическими соединениями.
Карбоциклические соединения (карбоциклические углеводороды) – класс органических соединений, характеризующихся наличием колец (циклов) из атомов углерода. Карбоциклические соединения отличаются от гетероциклических соединений отсутствием в кольцах каких-либо других атомов, помимо атомов углерода.
В зависимости от кратности углерод-углеродных связей ациклические углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены) углеводороды. Предельные ациклические углеводороды также называются насыщенными, а непредельные – ненасыщенными.
В свою очередь циклические углеводороды в зависимости от кратности углерод-углеродных связей подразделяются на алициклические (циклоалканы, циклоалкены, циклоалкины) и ароматические (арены) углеводороды.
Предельные (насыщенные) ациклические углеводороды:
Насыщенными алканы называются потому, что они содержат максимально возможное число атомов водорода для заданного числа атомов углерода.
Непредельные (ненасыщенные) ациклические углеводороды:
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°. Связи C=C представляют собой π-связи. Длина связи C=C составляет 0,134 нм.
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены образуют гомологический ряд, также называемый рядом этилена. К алкенам относятся: этен (этилен) C2H4, пропен (пропилен) C3H6, бутен (бутилен) C4H8, пентен C5H10, гексен C6H12, гептен C7H14, октен C8H16, нонен C9H18, децен C10H20 и т.д., которые имеют формулу CnH2n.
Алкены, число атомов углерода в которых больше двух (т.е. кроме этилена), имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкины (также именуемые ацетиленовые углеводороды) – ациклические непредельные углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют валентный плоский угол 180°. Таким образом у алкинов связь С≡С линейна (угол 180°) и находится в одной плоскости. Связи C≡C образованы одной σ-связью и двумя π-связями. Длина связи C≡C составляет 0,121 нм.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Алкины образуют гомологический ряд, также называемый рядом ацетилена. К алкинам относятся: этин (ацетилен) C2H2, пропин C3H4, бутин C4H6, пентин C5H8, гексин C6H10, гептин C7H12, октин C8H14, нонин C9H16, децин C10H18 и т.д., которые имеют формулу CnH2n-2.
Алкины, число атомов углерода в которых больше трех (т.е. кроме ацетилена и пропина), имеют изомеры. Для алкинов характерны изомерия углеродного скелета, положения тройной связи и межклассовая. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Диены (именуемые также алкадиены) – ациклические непредельные углеводороды, содержащие две двойных связи между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы:
– сопряжённые диены, в которых двойные связи разделены одинарной (1,3-диены)
– аллены с кумулированными двойными связями (1,2-диены)
– диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
По номенклатуре IUPAC названия диенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-диен»; положение двух двойных связей указывается двумя арабскими цифрами.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации. Связи C=C представляют собой π-связи. В сопряженных диенах длина связи C=C составляет 0,137 нм, а C-C – 0,146 нм.
Диены образуют гомологический ряд. К диенам относятся: пропадиен (С3Н4), бутадиен (С4Н6), пентадиен (С5Н8), гексадиен (С6Н10), гептадиен (С7Н12), октадиен (С8Н14), нонадиен (С9Н16), декадиен (С10Н18) и т.д., которые имеют формулу CnH2n-2.
Диены, число атомов углерода в которых больше четырех (т.е. кроме пропадиена и бутадиена), имеют изомеры. Для диенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная, цис-транс-изомерия). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алициклические углеводороды:
Алициклические углеводороды – циклические углеводороды, молекулы которых содержат замкнутые кольца из атомов углерода (но не имеющие ароматического кольца), которые являются частично или полностью насыщенными. Алициклические соединения классифицируют по числу атомов в кольце, по числу колец, по наличию или отсутствию кратных связей.
К алициклическим углеводородам относятся циклоалканы, циклоалкены, циклоалкины.
Алициклические углеводороды имеют изомеры. Для них характерны изомерия углеродного скелета (кольца и боковых цепей), положения заместителей в цепи, положения двойной или тройной связи, межклассовая и геометрическая (пространственная, оптическая, цис-транс-изомерия, конформационная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Циклоалканы (именуемые также полиметиленовые углеводороды, нафтены, цикланы, циклопарафины) – насыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие только простые (одиночные) связи между атомами углерода и образующие гомологический ряд с общей формулой CnH2n (n⩾3).
По номенклатуре IUPAC названия циклоалканов образуются от названий соответствующих алканов добавлением приставки «цикло-».
Атомы углерода при С-С связи находятся в состоянии sp 3 гибридизации.
Циклоалканы образуют гомологический ряд. К циклоалканам относятся: циклопропан C3H6, циклобутан C4H8, циклопентан C5H10, циклогексан C6H12, циклогептан C7H14, циклооктан C8H16, циклононан C9H18, циклодекан C10H20 и т.д., которые имеют формулу CnH2n.
Циклоалкены (также именуемые циклоолефины) – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну двойную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-2 (n⩾3).
По номенклатуре IUPAC названия циклоалкенов образуются от названий соответствующих алкенов добавлением приставки «цикло-».
Циклоалкены образуют гомологический ряд. К циклоалкенам относятся: циклопропен C3H4, циклобутен C4H6, циклопентен C5H8, циклогексен C6H10, циклогептен C7H12 и т.д., которые имеют формулу CnH2n-2.
Циклоалкины – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну тройную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-4 (n⩾5).
По номенклатуре IUPAC названия циклоалкинов образуются от названий соответствующих алкинов добавлением приставки «цикло-».
Циклоалкины образуют гомологический ряд. К циклоалкинам относятся: циклопентин C5H6, циклогексин C6H8, циклогептин C7H10 и т.д., которые имеют формулу CnH2n-4.
Ароматические углеводороды:
Ароматические углеводороды (арены) – циклические углеводороды, которые имеют в своём составе ароматическую систему.
Ароматическая система – это электронная система молекулы, содержащая (в кольце), в соответствии с правилом Хюккеля, 4n+2 электронов (где n = 0, 1, 2, …).
Различают бензоидные (арены и структурные производные аренов, которые содержат бензольные ядра) и небензоидные (все остальные) ароматические углеводороды.
Состав аренов с одним бензольным кольцом отвечает общей формуле CnH2n-6 (n⩾6).
Атомы углерода в бензольном кольце находятся в состоянии sp 2 гибридизации и имеют валентный угол 120°. Каждый атом углерода образует 3 σ-связи. Бензольное кольцо имеет плоскую форму и образуют шестигранник. У каждого атома есть негибридная р-обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости и поэтому все 6 π-электронов образует единую π-электронную систему. Длина связи между атомами углерода в бензольном кольце составляет 0,139 нм.
Ароматические углеводороды имеют множество изомеров.
УГЛЕВОДОРОДЫ
УГЛЕВОДОРОДЫ (УВ) — органические соединения, молекулы которых состоят только из атомов углерода и водорода. Являются важнейшими компонентами нефти и природного газа, продуктов их переработки. Широко применяют как сырье в промышленности, как топливо и др. Различают алифатические (или ациклические) и циклические (алициклические и ароматические) УВ.
Алифатические галоидированные УВ ( АлГУВ ) — органические соединения линейной или разветвленной «открытой» цепи, в которых один или несколько атомов водорода замещены галогеном (т. е. фторированные, хлорированные, бромированные или йодированные). Получают: прямым галоидированием в жидкой или газовой фазе — соответствующих алканов, спиртов, альдегидов или кетонов; гидрогалоидированием — алкенов и алкинов; оксихлорированием — алкенов; дегидрированием — насыщенных галоидзамещенных УВ. АлГУВ используются в производстве каучука, пластмасс, лаков, красок, при обработке металлов, в медицине и текстильной промышленности как растворители, вулканизаторы резины, промежуточные продукты для органического синтеза, компоненты пламегасящих составов, как фумиганты и инсектициды, хладагенты, теплоносители и др.
Содержание алифатических галоидированных
углеводородов в воздухе рабочей зоны
Наименование вещества,
№ CAS, синонимы
Бромоформ [75-25-2]
Трибромметан
Тетрабромид углерода [558-13-4]
Тетрахлорид углерода [56-23-5]
Бромистый этил [74-96-4]
Бромэтан
Хлористый этил [75-00-3]
Хлорэтан
Аллилхлорид [107-05-1]
3-Хлорпропен-1
2-Хлор-1,3-бутадиен [126-99-8]
β-Хлоропрен
3-Хлор-2-метилпропен [563-47-3]
γ-Хлоризобутилен
1,4-Дихлор-2-бутен [764-41-0]
1,4-Дихлорбутен-2
1,3-Дихлорпропен [542-75-6]
3-Хлораллилхлорид
1,3-Гексахлорбутадиен [87-68-3]
1, 2, 3, 4, 5,5-Перхлорбута-1,3-диен
Винилхлорид [75-01-4]
Хлорэтилен, хлорэтен
Винилиденхлорид [75-35-4]
1,1-Дихлорэтилен
Сокращения и обозначения: ПДК — предельно допустимая концентрация в воздухе рабочей зоны (по ГН 2.2.5.686—98); п — пары; а — аэрозоль; класс — класс опасности вещества согласно ГОСТ 12.1.007—76; «+» — требуется специальная защита кожи и глаз; К — канцероген.
Как правило, АлГУВ проникают через неповрежденную кожу, выделяются через легкие в неизменном виде, могут накапливаться в организме, проникать через гематоэнцефалический и плацентарный барьеры. Образуют токсичные метаболиты, вызывающие клинические симптомы интоксикации. Некоторые АлГУВ рассматриваются как инертные вещества (см. Фреоны).
Фторированные алканы и алкены. Токсические свойства возрастают с повышением температуры кипения. В ряду фторзамещенных алканов (метана, этана и бутана) и алкенов токсичность снижается при увеличении атомов фтора в молекуле; для фторпроизводных пропана наблюдается обратная зависимость. Высокотоксичны дифторалканы, перфторизобутен. Присутствие в молекуле разных галогенов повышает токсичность вещества. Фторалкены токсичнее фторалаканов. Яды поражают нервную систему, легкие, печень. При попадании на кожу вызывают некроз тканей (по типу обморожения), при попадании в глаз — помутнение роговицы. Перфторированные УВ, несмотря на химическую инертность, изменяют показатели микросомальной системы биотрансформации чужеродных веществ в печени.
Клинические симптомы острой интоксикации (затрудненное дыхание, боль за грудиной, кашель, одышка, слабость, акроцианоз, тахикардия, тахипноэ, признаки нарушения коронарного кровообращения на ЭКГ, эритроцитоз; лейкоцитоз; возможен отек легких) развиваются быстро и держатся в течение 2 суток. Выздоровление наступает через 1 неделю (при отравлении средней тяжести без осложнений). При тяжелых отравлениях с осложнениями указанные признаки сохраняются до 4 недель.
Хронические интоксикации у работающих характеризуются функциональными нарушениями нервной системы (астении, неврастении), раздражением слизистых оболочек верхних дыхательных путей, изменениями картины крови (нейтрофильный лейкоцитоз, анемия и др.). Диффузные изменения миокарда являются осложнением хронического отравления. Провоцируются заболевания желудка, печени, желчевыводящих путей. Ингаляционное воздействие пыли или продуктов термоокислительной деструкции фторопласта может вызвать «фторполимерную лихорадку» (озноб, признаки раздражения верхних дыхательных путей, гипертермия, тахикардия, одышка, лейкоцитоз в крови). Хлорпроизводные алканов вызывают наркотический эффект, сила которого для водных растворов в целом возрастает с увеличением числа атомов хлора, однако на активность влияет и степень растворимости УВ в воде (пары хлороформа активнее паров четыреххлористого углерода). Приводят к поражению ЦНС, жировой инфильтрации печени (наиболее выражены при отравлении четыреххлористым углеродом, тетра- и пентахлорэтаном, 1,2-дихлорэтаном, хлороформом), нарушению функции и структуры почек, поджелудочной железы, сердечной мышцы, зрительного анализатора (хлорметан), кожных покровов и слизистых оболочек, изменению картины периферической крови.
При комбинированном поступлении в организм хлоралканов с этанолом токсический эффект усиливается, с др. алифатическими спиртами или др. хлорзамещенными УВ — потенцируется.
Хлорпроизводные непредельных УВ. Острые отравления не характерны (быстрая потеря сознания, наркоз, судороги). Высокотоксичные соединения, хорошо проникают через неповрежденную кожу, накапливаются в организме, обладают политропным действием при всех путях поступления: поражают центральную (стволовая ретикулярная формация, гипоталамус, сосудодвигательный центр) и периферическую нервную систему, кости (акроостеолиз), соединительную ткань (склеродермия), дыхательную систему, печень, почки, кожный покров (дерматиты, экземы, длительно не заживающие язвы), иммунную систему, вызывают отдаленные последствия (хлорэтилен).
Бромзамещенные алканов. В гомологическом ряду токсичность бромалканов снижается с увеличением длины углеродной цепи. Хорошо проникают через кожу. Большинство бромзамещенных обладает узкой зоной токсического действия при любых путях поступления в организм. Клинические признаки интоксикации могут проявляться после периода относительного благополучия. Вызывают тяжелые, длительно текущие поражения нервной системы и заболевания почек и печени (снижение рефлексов, похудение, гипотония, нарушение фильтрационной функции почек, болезненность печени, нервных стволов конечностей, полиневриты, расстройства чувствительности, увеличение щитовидной железы, психотические реакции).
Йодзамещенные алканов. Наркотическое действие выражено слабее, а нейротоксическое — сильнее по сравнению с др. галоидзамещенными. Йодметан занимает особое место, вызывая тяжелые хронические отравления даже при воздействии низких концентраций.
Ароматические УВ (АУВ) — преимущественно жидкости, частью твердые вещества с характерным запахом. Температура кипения соединений в гомологическом ряду возрастает; у изомеров различия незначительны; растворимость в воде — низкая, но выше, чем у соответствующих УВ парафинового ряда. Бензольное кольцо весьма стойко по отношению к окислителям; у гомологов бензола окисляются обычно боковые цепи. Главным источником АУВ являются перегонка угля и ряд нефтехимических процессов. Соединения ароматического ряда широко используются для синтеза пластмасс, синтетического каучука, красителей, взрывчатых веществ, пестицидов, детергентов, духов и лекарств, но гл. обр. как компонент растворителей и состава горючего, в качестве высокооктановых компонентов моторных топлив.
Пары АУВ в высоких концентрациях обладают наркотическим действием. Наблюдается заметное различие между 2 группами АУВ. К одной группе относятся бензол и его производные с 2 алкильными группами в пара-положении. Эти АУВ вызывают у животных тремор, переходящий в судороги всего тела, остальные АУВ — постепенно нарастающее угнетение, изредка клонические судороги. Рефлексы при действии большинства АУВ сохраняются почти до самой смерти, наступающей от паралича дыхательного центра. Продолжительность наркотического действия увеличивается с удлинением и разветвлением боковой цепи. Соединения с разветвленной боковой цепью более токсичны, чем с прямыми цепями; однозамещенные действуют сильнее, чем соответствующие дву- и трехзамещенные. Хроническое отравление АУВ характеризуется поражением гл. обр. нервной, сердечно-сосудистой, кроветворной систем, а также печени и почек, однако могут отмечаться изменения и в др. органах и системах. Основные пути поступления АУВ в организм: ингаляционный, через желудочно-кишечный тракт и неповрежденную кожу.
Содержание ароматических углеводородов в воздухе рабочей зоны
Наименование вещества,
№ CAS, синонимы
Толуол [108-88-3]
Метилбензол
Псевдокумол [95-63-6]
1,2,4-Триметилбензол
Мезитилен [108-67-8]
1,3,5-триметилбензол
Кумол [98-82-8]
Изопропилбензол
Дурол [95-93-2]
1, 2, 4, 5-Тетраметилбензол
Стирол [100-42-5]
Винилбензол
α-Метилстирол [98-83-9]
Метилвинилбензол
Сокращения и обозначения: а — аэрозоль; п — пары; К — канцероген; «+» — требуется специальная защита кожи и глаз; класс — класс опасности; 150/50 — максимальная разовая концентрация / среднесменная концентрация; ПДК — предельно допустимая концентрация в воздухе рабочей зоны.
Бензол (Б.) является ядром политропного действия, вызывающим острое и хроническое отравления. При торможении гемопоэза снижается количество стволовых клеток в кроветворных органах. Наиболее достоверным изменением в составе периферической крови при хронической интоксикации является лейкопения, которая обусловлена в основном абсолютным снижением содержания нейтрофилов; затем — тромбоцитопения и подавление эритропоэза. Хроническая интоксикация Б. довольно часто сопровождается гемморрагическими проявлениями, интенсивность которых, как правило, нарастает соответственно тяжести отравления и степени выраженности тромбоцитопении.
Самым опасным проявлением бензольной интоксикации является возникновение лейкозов. При хронической интоксикации Б. возникают: перестройка костной ткани, остеопороз, мелкоочаговый склероз, разволокнение кортикального слоя. Локализация костных изменений совпадает с зонами активного кроветворения — в длинных трубчатых костях, в дистальных метадиафизах бедренных и большеберцовых костей. Установлена связь поражения скелета с изменениями костно-мозгового кроветворения.
При легкой и средней (степени) интоксикации желудочная секреция повышена, кислотность понижена. При тяжелой — кислотность и переваривающая способность понижены. Изменения желудочной секреции могут наблюдаться до развития типичного симптомокомплекса интоксикации. Поражение печени с нарушением ее функциональной способности наряду с гематологической симптоматикой следует считать одним из клинических проявлений хронической интоксикации. Изменения функции печени развиваются на ранних стадиях отравления. В концентрациях на уровне 20 мг/м 3 Б. способен оказывать модифицирующее влияние на рост и развитие злокачественных новообразований (по количеству образовавшихся опухолей и по величине латентного периода их развития). Имеются сведения об индукции аберраций хромосом у работающих в контакте с Б. Установлено, что у рабочих, длительное время соприкасающихся с Б. (стаж 8—19 лет), в моче имеются метаболиты с мутагенной активностью (по тесту Эймса).
Нарушения нервной системы при воздействии Б. наступают как в результате его непосредственного действия, так и при опосредованном влиянии через систему кроветворения. Изменения нервной системы обратимы, однако нередко процесс приобретает стойкий характер, а у отдельных лиц может прогрессировать.
При бензольной интоксикации наблюдается определенная зависимость между гематологическими и аутоиммунными изменениями. Продукция антител является следствием, а не причиной интоксикации. При попадании Б. на слизистые оболочки возникают: жжение, нарушение обоняния, глотания, временное нарушение дыхания, кровь в слюне и носовой слизи. При частом соприкосновении рук с Б. наблюдаются: сухость кожи, трещины, зуд, краснота, отечность, пузырьковые высыпания. Иногда из-за кожных поражений рабочие вынуждены бросать работу.
Толуол (Т.). В высоких концентрациях наркотический и раздражающий эффекты более выражены, чем у бензола. Действие Т. на кровь несравненно слабее бензола. Т. попадает в организм гл. обр. через дыхательные пути, в меньшей степени — через кожу. Выявлены следующие симптомы: головная боль, чувство усталости, потеря аппетита, тошнота, неприятный вкус во рту, анорексия, дрожь, резкая слабость, выраженная потеря координации движений. В производственных условиях при длительном воздействии относительно высоких концентраций Т. характерно раздражение слизистых оболочек, общие жалобы на головную боль, головокружение, слабость, раздражительность. Функциональные расстройства нервной системы укладываются в картину неврастенического синдрома с вегетативной дисфункцией. При контакте с кожей вызывает сухость, трещины, реже дерматиты. Наблюдаемые в отдельных случаях полиневриты связывают с действием Т., проникающего через кожу.
Изопропилбензол — вещество преимущественно нейротропного действия. При остром отравлении действует сильнее, чем бензол и толуол; наркоз наступает медленно и длится дольше. В условиях хронического отравления нарушает углеводную, белковообразовательную, антитоксическую функции печени, вызывает изменения системы крови, органов дыхания, почек. У рабочих на производстве диагностированы проявления неврастенического и астеновегетативного синдромов. Изменения крови проявляются в виде гиперхромной анемии, лейкоцитоза, переходящего в лейкопению с увеличением срока интоксикации, ретикулоцитоза; более выражены у женщин.
Стирол обладает общетоксическим, кожно-резорбтивным действием; вызывает наркоз. Раздражающий эффект более выражен, чем у бензола и толуола.
Одним из наиболее характерных (как по распространенности, так и по выраженности симптомов) является «печеночный» синдром с нарушениями антитоксической, белковообразовательной, пигментной функций печени. В процесс вовлекается и сердечно-сосудистая система — жалобы на одышку при физических напряжениях. Объективно: глухость тонов сердца, артериальная сосудистая гипотония; со стороны крови умеренная лейкопения, относительный лимфоцитоз, повышение количества макроформ, увеличение среднего диаметра эритроцитов, диспротеинемия, билирубинемия, снижение протромбинового времени. При попадании на слизистые носа, глаз и глотки паров и аэрозоля — раздражение (соливация, лакримация). При случайном попадании в глаз — гиперемия конъюнктивы; возможно легкое повреждение роговицы. При повторных воздействиях на кожу — экземы, трещины, утолщения кожи кистей, сухость.
Нафталин поражает нервную систему, желудочно-кишечный тракт, почки. Характерны изменения в крови: гемолиз эритроцитов, лейкоцитоз, анемия. Вызывает катаракту, а также накопление аммиака в головном мозге, с чем связывается нарушение функции ЦНС. Концентрация 250—280 мг/м 3 быстро вызывает головную боль, непереносимое жжение в глазах, слезотечение; 15 мг/м 3 переносится без жалоб 5—6 ч. Отравление возможно при вдыхании паров и пыли, при проникновении через кожу. Метилнафталин несколько менее токсичен. Практически достижимые в воздухе концентрации не вызывают четких проявлений эффекта; отмечается незначительное раздражение верхних дыхательных путей, кашель; при попадании в глаза и на кожу — явления легкого раздражения.
Ароматические галоидированные УВ (АрГУВ) — вещества, содержащие один или более атомов галогенов (фтор, бром, хлор, йод) и бензольное кольцо (ядро). Широко применяются в народном хозяйстве, в т. ч. в промышленности, сельском хозяйстве и в быту.
Хлордериваты бензола (хлорбензол, дихлорбензол, трихлорбензол) необходимы в различных отраслях органического синтеза в качестве полупродуктов и растворителей, как исходное сырье в синтезе красителей, взрывчатых веществ, ядохимикатов, лекарственных препаратов, в производстве полисульфонопластмассы с высокой устойчивостью к внешним воздействиям, как растворители в производстве перхлорвиниловой смолы, жиров, нитроцеллюлозы и др. Обладают в основном однотипным характером действия, вызывая изменения в функциональном состоянии нервной системы, в составе периферической крови (нерезкая лейкопения, относительный лимфоцитоз, умеренная тромбоцитопения); поражение печени (гепатит). Степень токсичности соединений нарастает с увеличением атомов галогена в ядре. При воздействии в концентрациях 60—600 мг/м 3 у работающих отмечаются акроспастические реакции в виде акропарестезии, судоржных сокращений мышц пальцев рук, гиперстезии кистей, побеления одного или нескольких пальцев рук и ног; проявления вегетососудистой дистонии. К начальным признакам интоксикации на высшие отделы ЦНС относятся изменения ЭЭГ. При хронической интоксикации — поражение сердечно-сосудистой системы с дистрофией миокарда разной степени; признаки поражения печени. Возможно также развитие хронических гастритов гипоацидного типа, в отдельных случаях — умеренно выраженный бронхит. Действуют на кожу подобно бензолу, но слабее; могут вызывать экземы.
Хлорированные нафталины применяются в качестве заменителей воска и смол; для изготовления конденсаторов, при прецизионном литье. В промышленности обычно применяют смеси, характеризуемые различным содержанием хлора, чаще всего смесь три- и тетрахлорнафталинов. Общие отравления и кожные поражения происходят в результате паров расплавленных нафталинов или мелкой пыли, образующейся при их конденсации. Возможны отравления через кожу. Острые отравления маловероятны из-за низкой летучести. Характерный симптом хронического отравления — поражение печени (токсический гепатит, в тяжелой степени отравления — желтая острая атрофия печени). Страдают и др. паренхиматозные органы — почки, поджелудочная железа, сердце. Очень характерны поражения кожи — узелковые гнойниковые образования, фотодерматиты, пигментация.
Содержание ароматических галоидированных
углеводородов в воздухе рабочей зоны
Наименование вещества,
№ CAS, синонимы