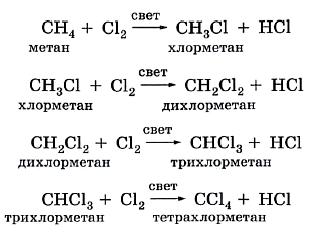Углеводороды алифатические предельные что это
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия : Алифатические предельные углеводороды и их строение
Оставшиеся валентности углеродного атома, не затраченные на связь с другими атомами углерода, полностью насыщены водородом. Поэтому предельные (насыщенные) углеводороды содержат в молекуле максимальное число водородных атомов.
2) рассмотреть строение и номенклатуру углеводородов ряда метана;
3) обозначить химические свойства предельных углеводородов;
4) изучить применение и получение предельных углеводородов;
5) рассмотреть особенности циклопарафинов.
В молекуле метана химические связи атомов водорода с атомом углерода имеют ковалентный характер. Если перекрывающиеся попарно электронные облака при образовании связей обозначить двумя точками или валентной черточкой, строение метана можно выразить формулами:
Когда в органической химии стало развиваться учение о пространственном строении молекул, было выяснено, что молекула метана в действительности имеет тетраэдрическую форму, а не плоскую, как мы изображаем на бумаге.
Выясним, почему же молекула метана представляет собой тетраэдр. Мы должны исходить, очевидно, из строения атома углерода. Но здесь мы сталкиваемся с противоречием. У атомов углерода четыре валентных электрона, два из них являются спаренными s-электронами, они не могут образовывать химических связей с атомами водорода. Химические связи могут установиться только за счет двух неспаренных p-электронов. Но тогда молекула метана должна иметь формулу не CH4, а CH2, что не соответствует действительности. Такое противоречие устраняется следующей трактовкой образования химических связей.
Когда атом углерода вступает во взаимодействие с атомами водорода, s-электроны наружного слоя в нем распариваются, один из них занимает вакантное место третьего p-электрона и образует при своем движении облако в виде объемной восьмерки, перпендикулярное по отношению к облакам двух других p-электронов. Атом при этом переходит, как говорят, в возбужденное состояние. Теперь все четыре валентных электрона стали неспаренными, они могут образовать четыре химические связи. Но возникает новое противоречие. Три p-электрона должны образовать три химические связи с атомами водорода во взаимно перпендикулярных направлениях, т.е. под углом 90°, а четвертый атом водорода мог бы присоединяться в произвольном направлении, так как облако s-электрона имеет сферическую форму и эти связи, очевидно, отличались бы по свойствам. Между тем известно, что все связи C-H в молекуле метана одинаковы и расположены под углом 109°28′. Разрешить это противоречие помогает представление о гибридизации электронных облаков.
Угол между осями гибридных электронных облаков оказывается равным 109°28′, что позволяет им, как одноименно заряженным, максимально удалиться друг от друга. Будучи вытянутыми к вершинам тетраэдра, такие облака могут значительно перекрываться с электронными облаками водородных атомов, что ведет к большему выделению энергии и образованию прочных, одинаковых по свойствам химических связей (рис.1А).
Рис.1 Ковалентные химические связи в молекуле метана: А — перекрывание электронных облаков атома углерода с атомами водорода; Б — образование общих электронных облаков связей C—H.
Тетраэдрическая форма молекулы метана обусловливается, следовательно, тетраэдрическим направлением четырех гибридных электронных облаков атома углерода в химическом соединении.
2. Строение и номенклатура углеводородов ряда метана
Строение углеводородов. В природном газе и особенно в нефти содержится много углеводородов, сходных с метаном по строению и свойствам.
Первые четыре вещества этого ряда имеют исторически сложившиеся названия. Названия углеводородов, начиная с пентана, образованы преимущественно от греческих названий чисел.
Все предельные углеводороды нерастворимы в воде, но могут растворяться в органических растворителях.
Рассматривая молекулярные формулы веществ, можно заметить постоянную разницу в составе молекул при переходе от одного члена ряда к другому на группу атомов CH2 (эта группа называется метиленом). Если число атомов углерода в молекуле принять за n, то состав всех этих углеводородов можно выразить общей формулой CnH2n+2.
Зная число атомов углерода в молекуле, легко найти молекулярную массу вещества. Например, если в молекуле содержатся пять атомов углерода, молекулярная масса Mr = 12×5 + 2×5 + 2 = 72. И, наоборот, зная молекулярную массу предельного углеводорода, по общей формуле можно определить его молекулярную формулу. Например, если Mr = 100, то, решая уравнение с одним неизвестным: 100 = 12n + 2n + 2, найдем n = 7, следовательно, формула углеводорода C7H16.
С образованием новых веществ в результате количественного изменения состава мы встречаемся в химии постоянно. Вспомните, например, различия в составе молекул и свойствах кислорода и озона, оксидов азота, оксидов углерода. На примере углеводородов это явление проявляется особенно ярко.
Атомы углерода в молекулах углеводородов расположены не по прямой линии, как мы пишем в структурных формулах, а зигзагообразно. Причина этого в тетраэдрическом направлении валентных связей атомов углерода.
Предположим, что к одному атому углерода присоединился другой атом углерода. У этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра. Следующий атом углерода может присоединяться, очевидно, только в одном из этих направлений. Углеродная цепь в таком случае неизменно принимает зигзагообразную форму. Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана, 109°28′.
Зигзагообразная цепь атомов углерода может принимать различные пространственные формы. Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг химических связей. Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов). Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга.
Замечательное свойство атомов углерода соединяться друг с другом в длинные цепи связано с положением элемента в периодической системе химических элементов Д.И. Менделеева и строением его атомов.
Углерод находится во втором малом периоде и возглавляет собой главную подгруппу IV группы элементов. Радиус его атома сравнительно невелик, в наружном электронном слое атом имеет четыре электрона. При химической реакции у атома углерода трудно полностью оторвать четыре валентных электрона, равно как и присоединить к нему столько же электронов от других атомов до образования полного октета. Поэтому углерод почти не образует ионных соединений. Но он легко образует ковалентные связи. Поскольку свойство отдавать и притягивать электроны при установлении ковалентных связей у него выражено примерно одинаково, такие связи образуются и между атомами углерода.
Обозначая двумя точками перекрывающиеся электронные облака при образовании ковалентных связей, можно следующим образом изобразить электронные формулы предельных углеводородов:
которые не передают их зигзагообразного строения.
При разрыве связей молекулы углеводородов могут превращаться в свободные радикалы. При отрыве одного атома водорода от молекулы они образуют одновалентные радикалы с одним неспаренным электроном, например:
Зная строение углеводородов, можно понять зависимость их физических свойств от молекулярной массы. С ростом углеводородной цепи возрастают силы притяжения между молекулами, и поэтому требуется все более высокая температура для преодоления этих сил, чтобы могло произойти плавление или кипение веществ. Физические свойства зависят и от пространственного строения молекул. Например, углеводороды с разветвленной цепью атомов кипят при более низкой температуре, чем их изомеры неразветвленного строения. Такому явлению можно дать следующее объяснение. Молекулы неразветвленного строения плотнее примыкают друг к другу и сильнее взаимодействуют между собой, чем молекулы разветвленного строения, поэтому для преодоления межмолекулярных сил в первом случае требуется более сильное нагревание; чем больше разветвлены молекулы вещества, тем меньше межмолекулярное взаимодействие и тем ниже его температура кипения.
Номенклатура углеводородов. Когда мы встречаемся с явлением изомерии, то названия углеводородов, которыми пользовались до сих пор, оказываются недостаточными. Возникает необходимость дать изомерным веществам индивидуальные названия с учетом строения их углеродного скелета.
Существуют различные системы номенклатуры органических соединений.
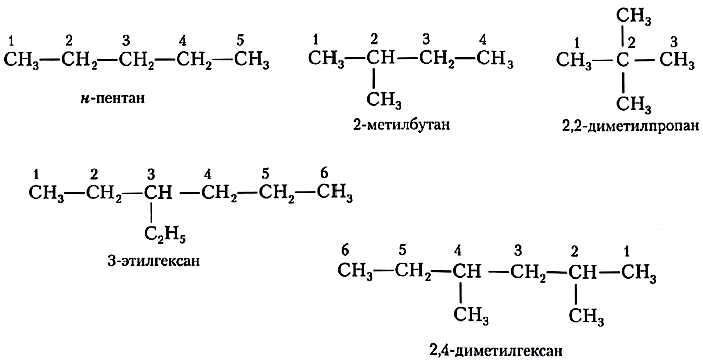
Чтобы составить название углеводорода с разветвленной цепью, его рассматривают как продукт замещения атомов водорода в нормальном углеводороде углеводородными радикалами. Порядок действий здесь может быть такой:
а) выделяют в структурной формуле наиболее длинную цепь атомов углерода и нумеруют эти атомы, начиная с того конца, к которому ближе разветвление;
б) в названии вещества цифрой указывают, при каком атоме углерода находится замещающая группа (радикал);
в) если замещающих групп несколько, цифрами отмечают каждую из них;
3. Химические свойства предельных углеводородов
Частицы, имеющие неспаренные электроны и обладающие в связи с этим неиспользованными валентностями, называются свободными радикалами.
Из вышесказанного видно, что реакция метана с хлором протекает по свободнорадикалъному механизму. Радикал метил (который обладает очень высокой реакционной способностью) реагирует с другой молекулой хлора, разрывает в ней связи между атомами и отщепляет свободные атомы хлора с неспаренными электронами. Таким образом, рождаются новые химически активные частицы, которые вызывают дальнейшие превращения.
Реакции, в результате которых происходит цепь последовательных превращений, называются цепными реакциями.
СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
При сильном нагревании (выше 1000 °С) без доступа воздуха предельные углеводороды разлагаются:
Эта реакция дегидрирования (отщепления водорода) имеет большое промышленное значение, так же как и дегидрирование других предельных углеводородов, в том числе этана С2Н6:
Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения:
4. Применение и получение предельных углеводородов
Реакции горения и разложения метана используются в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука. С этой целью в специальные печи вместе с метаном подают такое количество воздуха, чтобы сгорела лишь часть газа. Под действием развивающейся при горении высокой температуры другая часть разлагается, образуя тонкодисперсную сажу.
Для некоторых синтезов используется непосредственно образующаяся смесь газов. Если же для последующих процессов нужен чистый водород (как в случае получения аммиака), оксид углерода (II) окисляют водяным паром, используя катализаторы.
Реакцией хлорирования получают хлорпроизводные метана. Все они находят практическое применение.
При хлорировании метана образуется много хлороводорода. Растворяя его в воде, получают соляную кислоту.
В последнее время из метана получают ацетилен, необходимый для синтеза многих органических веществ.
Из гомологов метана при реакции изомеризации получают углеводороды разветвленного строения. Они используются в производстве каучуков и высококачественных сортов бензина. Высшие углеводороды служат исходными веществами для получения синтетических моющих средств.
Путем химической переработки предельные углеводороды часто превращают в непредельные углеводороды, химически более активные, из которых синтезируют многочисленные органические вещества.
Получение углеводородов. Предельные углеводороды в больших количествах содержатся в природном газе и нефти. Из этих природных источников и извлекают их для использования в качестве топлива и химического сырья.
В теоретическом отношении интересна реакция синтеза метана, так как она показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора:
Сопоставляя эту реакцию с термическим разложением метана, мы должны сделать вывод, что она обратима.
Учитывая тепловой эффект реакции, можно записать следующее уравнение:
C + 2H2 CH4 + 75 кДж
На основании данного уравнения можно высказать предположение о том, какие условия способствуют сдвигу равновесия в сторону получения метана, а какие будут вызывать его разложение.
Атомы углерода в циклопарафинах (циклоалканах), как и в алканах, находятся в sp3-гибридизованном состоянии и все их валентности полностью насыщены.
Остальные циклы имеют неплоское строение вследствие стремления атомов углерода к образованию тетраэдрических валентных углов.
По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки «цикло» (циклопропан, циклобутан, циклопентан, циклогексан и т.д.). При наличии в цикле заместителей нумерацию атомов углерода в кольце проводят так, чтобы ответвления получили возможно меньшие номера. Так, соединение
следует назвать 1,2-диметилциклобутан, а не 2,3-диметилциклобутан, или 3,4-диметилциклобутан.
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы.
Структурные формулы циклоалканов обычно изображаются сокращенно в виде правильных многоугольников с числом углов, соответствующих числу атомов углерода в цикле Роговин З.А. Основы химии.- М: Хи-мия, 2001. С. 89..
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (при нагревании или облучении УФ-светом). При этом может произойти или разрыв связи С-Н с последующим замещением атома водорода на другой атом или группу атомов, или же разрыв молекулы по связи С-С. Несмотря на то что энергии этих связей равны соответственно 415-420 (для первичных углеродных атомов) и 350 кДж/моль, разрыв предпочтительнее идет по связи С-Н. Это связано с тем, что связь С-Н более доступна для реагента.
Углеводороды алифатические предельные что это
Углеводороды, молекулы которых не содержат кратных связей, называют предельными или насыщенными.
Своё название предельные углеводороды получили потому, что все валентности углеродных атомов в их молекулах насыщены атомами водорода до предела.
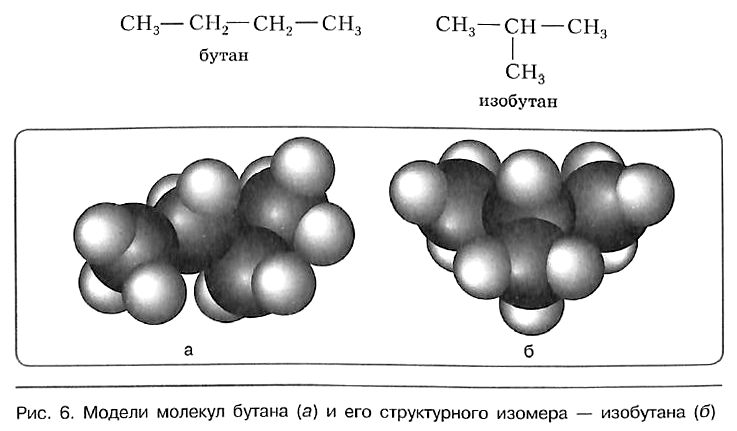
Сокращённая структурная формула пропана СН3—СН2—СН3. Для бутана возможно написание двух структурных формул: в одной углеродная цепь имеет линейное, а в другой — разветвлённое строение:
Свойства бутана и изобутана различны: бутан имеет более низкие температуры кипения и плавления. По отношению друг к другу бутан и изобутан являются изомерами, различающимися строением углеродной цепи. Изомерия углеродной цепи — вариант структурной изомерии.
| Алканы — это предельные углеводороды с общей формулой С n Н2 n +2, в молекулах которых все атомы соединены простыми (одинарными) связями. |
В молекулах алканов углеродные цепи открытые, т. е. незамкнутые. Но предельными могут быть и углеводороды, имеющие замкнутую углеродную цепь. Этот класс соединений называют циклоалканами. Некоторые циклоалканы, например циклогексан С6Н12, входят в состав нефти.
| Ряд расположенных в порядке возрастания относительных молекулярных масс веществ, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп СН2 (гомологическую разность), называют гомологическим рядом. Вещества такого ряда называют гомологами. |
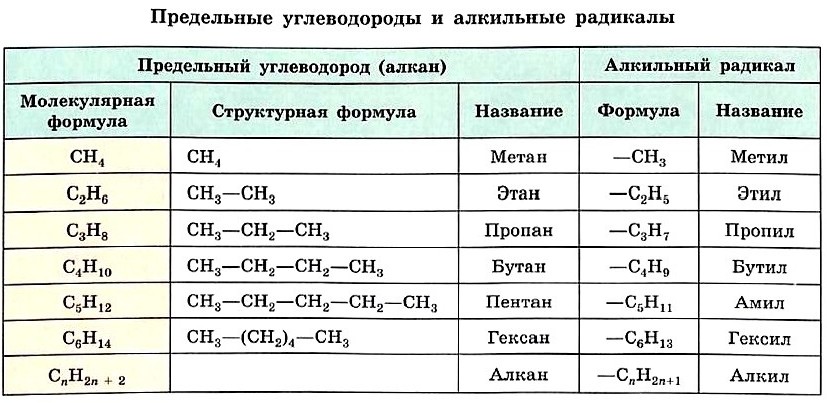
Формулу каждого последующего члена гомологического ряда легко получить из формулы предыдущего, заменив один атом водорода в молекуле на группу СН3. Так, второй гомолог ряда алканов — этан — имеет формулу СН3—СН3. Формулы и названия первых шести представителей алканов с неразветвлённой цепью атомов углерода приведены в таблице.
Если от молекулы алкана мысленно отщепить один атом водорода, мы получим частицу со свободной валентностью у атома углерода — радикал.
Название радикала, соответствующего предельному углеводороду, т. е. алкильного радикала, строится так: суффикс -ан заменяют на -ил, а состав будет подчиняться общей формуле С n Н2 n +1. Формулы и названия алкильных радикалов, приведённые в таблице, нужно запомнить, чтобы уметь называть органические вещества с разветвлённой углеродной цепью.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Номенклатура алканов
Для построения названий органических веществ, в частности предельных углеводородов, используют свод правил — номенклатуру. В соответствии с так называемой международной, или систематической, номенклатурой при составлении названий алканов руководствуются следующими правилами:
Проиллюстрируем эти правила примерами названий алканов.
Физические и химические свойства алканов
Метан и его газообразные гомологи (до бутана включительно) содержатся в природном и попутном нефтяном газах. Жидкие алканы — основная часть нефти. Твёрдые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
При обычных условиях алканы не реагируют с концентрированными кислотами и щелочами, не окисляются сильными окислителями, такими как перманганат калия.
Однако при нагревании химическое поведение алканов резко меняется. Все алканы горят бледно-голубым пламенем с образованием углекислого газа и воды:
Горение алканов сопровождается выделением большого количества теплоты, что определяет их использование в качестве топлива.
Следует помнить, что углеводороды относятся к пожаро- и взрывоопасным веществам. Утечка бытового газа грозит страшными последствиями. Для того чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом — одоранты. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в экстренную службу по телефону 104, проветрить помещение и ни в коем случае не пользоваться открытым огнём или электроприборами. В случае пожара службу спасения вызывают по телефону 101 или 112 (с сотового телефона бесплатно).
Предельные углеводороды используют не только как топливо, но и в качестве сырья для химической промышленности, поскольку их свойства отнюдь не ограничиваются реакцией горения.
В предельных углеводородах атомы водорода могут замещаться другими атомами или группами, в частности атомами галогенов (хлора и брома). Эти реакции замещения протекают ступенчато при освещении смеси газов:
Галогенпроизводные алканов — прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют бытовые холодильники и промышленные холодильные установки), реагенты для органического синтеза.
Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, то они не выдерживают такого воздействия и разлагаются. Например, из метана при нагревании свыше 1000 °С образуется два ценных продукта — сажа (углерод) и водород:
Сажу, полученную таким образом, используют для изготовления автомобильных шин и резины, она входит в состав красок и туши.
Алканы с неразветвлённой цепью углеродных атомов при нагревании превращаются в более устойчивые соединения с разветвлённой цепью. Например, из н-бутана можно получить изобутан:
Поскольку состав исходного вещества и продукта реакции одинаков, эти соединения являются изомерами. Именно поэтому такой процесс получил название реакция изомеризации.
При нагревании в присутствии катализатора алканы способны вступать в реакцию отщепления. Что же могут отщеплять молекулы предельных углеводородов? Если предположить, что углеродная цепь остаётся без изменения, то отщепляться могут только молекулы водорода.
| Реакцию, при которой от молекулы органического вещества отщепляется молекула водорода, называют реакцией дегидрирования . |
При дегидрировании этана образуются два продукта — этилен и водород:
Этилен С2Н4 — представитель непредельных углеводородов, о которых пойдёт речь в следующем параграфе.
Таблица «Предельные углеводороды
(алканы, парафины)»
Конспект урока по химии «Предельные углеводороды. Алканы«. В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: