Угдф в медицине что
3.10.3.6. Синдром полиорганной недостаточности
Синдром полиорганной недостаточности (СПОН) представляет собой одно из наиболее тяжелых осложнений послеоперационного периода. Пусковым механизмом развития полиорганной недостаточности любого генеза является синдром системной воспалительной реакции (SIRS) [Лейдерман И.Н. и др., 1997; Сета F., 1991]. Процесс ее формирования не является специфичным и не зависит от этиологии критического состояния.
К исходным (дооперационным) факторам риска развития СПОН относятся:
• тяжелое состояние пациентов;
• возраст более 60 лет;
• дыхательная недостаточность с обструктивно-рестриктивными нарушениями и снижением оксигенирующей функции легких.
СПОН может развиваться при возникновении во время операции и в раннем послеоперационном периоде следующих осложнений:
• синдром массивной кровопоте-ри и гемотрансфузии;
• шок различной этиологии;
• синдром острого повреждения легких и респираторный дистресс-синдром;
• длительный период искусственного кровообращения.
В поздние сроки послеоперационного периода на первый план выступает сепсис как системный воспалительный ответ на инвазию микроорганизмов [Габриэлян Н.И. и др., 1984].
Больничная летальность зависит от стадии процесса и числа вовлеченных органов. У пациентов с недостаточностью одной системы, продолжающейся более одного дня, она составляет 40 %, с недостаточностью двух систем — 60 %, а для больных с недостаточностью трех и более систем летальность возрастает до 84—98 % [Zimmerman J.E. et al., 1996].
Клинические проявления СПОН:
• сердечная или сердечно-сосудистая недостаточность;
• дыхательная недостаточность (РДС или СОПЛ);
• постгипоксическое повреждение ЦНС (энцефалопатия, кома);
• угнетение иммунитета и кроветворения;
• синдром кишечной недостаточности.
Терапия системного воспалительного ответа и СПОН носит комплексный характер и направлена прежде всего на ликвидацию их причины. В основе диагностики лежат кардиореспираторный мониторинг, лабораторные и дополнительные методы исследования. Интенсивная терапия СПОН включает регулируемую медикаментозную защиту головного мозга от гипоксии и стрессорных факторов, искусственную вентиляцию и различные режимы вспомогательной вентиляции легких, проводимую как инвазивными, так и неинвазивными способами, кардиотоническую поддержку, нормализацию кислотноосновного баланса и энергетического обмена. Большое внимание уделяется увеличению клиренса ци-токинов путем экстракорпоральной детоксикации, прежде всего ультрагемодиафильтрацией (УГДФ) и плазмаферезом в сочетании с ультрафиолетовым облучением крови.
УГДФ получила признание как метод коррекции системного воспалительного ответа, поскольку способна элиминировать медиаторы воспаления, а также частично протезировать функцию почек.
Показания к проведению плазма-фереза:
• острый гемолиз крови;
• гипербилирубинемия, гиперами-лаземия, гиперферментемия (АсАТ, АлАТ, КФК, ЛДГ);
• в качестве превентивной терапии при синдроме массивной кро-вопотери и гемотрансфузии;
• сепсис (плазмаферез в сочетании с УФО крови).
Плазмаферез используют для одновременного создания изоволеми-ческой гемодилюции и снижения активности ДВС крови за счет замены плазмы (до 20—35 % ОЦК) инфузионными растворами коллоидов и альбумина 5 %, а также СЗП с гепарином, которая содержит достаточное количество AT-III и его активированный комплекс с гепарином. Плазмаферез выполняется курсами, состоящими из 3—5 сеансов (1 сеанс в сутки), в течение нескольких дней до достижения эффекта снижения активности ДВС крови, подтвержденного лабораторно и клинически.
Показания к проведению ультрагемодиафильтрации:
• расстройства метаболизма (метаболический и лактат-ацидоз, повышение уровня средних молекул), не корригируемые медикаментозной терапией;
• дисбаланс электролитного состава плазмы (гиперкалиемия и ги-пернатриемия);
• респираторный дистресс-синдром и синдром острого повреждения легких;
• почечная недостаточность с высокой концентрацией мочевины и креатинина плазмы крови и гипергидратацией тканей;
Неоценимое значение в лечении сепсиса и SIRS имеют иммуномодуляция и иммуностимуляция, а также антибактериальная терапия с учетом чувствительности посевов микрофлоры.
Активно используются мероприятия, направленные на предупреждение развития СПОН, такие как поддержание гемодинамики на должном уровне, своевременная коррекция гомеостаза, применение протекторных препаратов для защиты органов и тканей организма от гипоксии и интоксикации, раннее начало экстракорпоральной детоксикации и профилактика внутрибольничной инфекции.
Полиорганная недостаточность ( Синдром полиорганной недостаточности )
Полиорганная недостаточность – одновременное или последовательное поражение нескольких систем с первоначальным преобладанием симптомов отказа одной из них. Определяющими признаками являются цианоз, одышка, отеки, анурия, гипотония, шоковое состояние. Диагноз устанавливается на основании клинической картины, данных лабораторного и аппаратного обследования. Специфическое лечение: поддержка дыхания и сердечной деятельности, стабилизация гемодинамики, устранение патогенетического фактора (борьба с инфекцией, коррекция метаболических нарушений, восстановление ОЦК, нормализация гемостаза), искусственная и естественная детоксикация.
МКБ-10
Общие сведения
Полиорганная недостаточность (ПОН) – патология, возникающая преимущественно у пациентов реанимационных отделений. Как самостоятельная нозологическая единица впервые была описана в 1973 году, до этого считалась сочетанием двух и более не связанных между собой нарушений. Частота встречаемости составляет около 5-10% от общего количества больных. Смертность в этой группе приближается 60%. Чаще погибают пациенты, имеющие сбои в работе трех органов. Состояние развивается на 3-5 сутки после успешного восстановления сердечной деятельности, при тяжелых сочетанных травмах, отравлениях, эндотоксикозах. В основе развития лежит синдром системного воспалительного ответа.
Причины полиорганной недостаточности
ПОН возникает в результате патологических изменений, происходящих в организме после остановки и последующего восстановления работы сердца. Кроме того, она может формироваться на фоне тяжелой политравмы, инфекционно-токсического шока, сепсиса, перитонита. Чаще развивается, если один из органов, вовлеченных в процесс, ранее был поражен хронической патологией или изменен в результате воздействия первичного фактора (контузия легкого при ДТП, снижение сократительной способности миокарда при остром коронарном синдроме). В число этиофакторов включают:
Патогенез
Полиорганная деструкция имеет несколько механизмов развития, основным из которых является ишемическое повреждение органов. Часть клеток отмирает, остальные переходят в анаэробный режим гликолиза. Основные повреждения возникают при восстановлении кровотока. В этот период образуется большое количество свободных радикалов, вызывающих перикисное окисление тканей. Вторым патогенетическим механизмом является интенсивное тромбообразование на начальной стадии ДВС-синдрома. Образующиеся микроэмболы нарушают проходимость капиллярной сети, что усиливает ишемию.
Отеки в результате повышенной проницаемости сосудов приводят к накоплению жидкости в брюшной полости, усилению внутриабдоминальной компрессии. Происходит механическое сжатие органов живота, подъем диафрагмы с ограничением подвижности легких. Отмечается рост внутригрудного давления, уменьшение рабочего пространства сердца. Нарушается отток крови от мозга. В процесс вовлекается центральная нервная система, развивается церебральный отек с появлением неврологической симптоматики.
Классификация
Деление ПОН на группы производится по результатам оценки деятельности органов и систем, общего состояния пациента. Для этого может быть использована шкала Apache II или Д. Маршалла, созданная в 1995 году специально для работы с больными, страдающими полиорганной недостаточностью. На практике более актуальным является метод А. Л. Левита, представленный в 2000 году. Согласно ему, каждая из систем может находиться в компенсированном, субкомпенсированном или декомпенсированном состоянии. Полиорганная недостаточность определяется как тяжелая при декомпенсации двух систем, как крайне тяжелая – при значительных изменениях в трех органах. Оценка проводится отдельно по каждому органу.
Симптомы полиорганной недостаточности
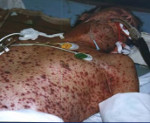
Клиническая картина зависит от наличия поражения тех или иных структур. Обычно на первый план выходят признаки изменений со стороны дыхательной системы. Отмечается одышка, диффузный цианоз, включение вспомогательной мускулатуры в процесс вдоха, потливость, психомоторное возбуждение. Пациенты, способные самостоятельно передвигаться, занимают вынужденное положение сидя с упором руками в кровать. Позднее активность сменяется заторможенностью, угнетением сознания.
Полиорганная недостаточность с поражением сердца проявляется загрудинными болями, нестабильностью гемодинамики, накоплением жидкости в мягких тканях за счет усиления пролиферации плазмы сквозь сосудистую стенку. Может возникать отек легких, сопровождающийся появлением розоватой пены изо рта. Выявляется компенсаторная тахикардия до 180 уд./мин, позднее сменяющаяся брадикардией с урежением ЧСС до 40 и ниже. На терминальной стадии происходит снижение чувствительности к инотропным средствам и альфа-адреномиметикам.
При почечно-печеночной разновидности болезни объем диуреза заметно снижается. Затем возникает анурия, требующая проведения гемодиализа. Обнаруживается гипогликемия, влекущая за собой нарушения сознания. У пациента развивается асцит, диспепсия, белковые отеки. Кожа и слизистые оболочки желтеют, возможна геморрагическая сыпь. Через несколько часов или дней обнаруживаются признаки печеночной энцефалопатии: больной не отдает себе отчет в своих действиях, не понимает, где находится, что с ним происходит.
Поражения ЖКТ характеризуются признаками обструкции, обусловленной механическим сдавлением кишечника. Определяется боль, вздутие, асимметрия передней брюшной стенки, задержка стула и газов, рвота. Отсутствует толерантность к кормлению. Возможно развитие стрессовой язвы и кишечной геморрагии, которая проявляется снижением уровня Hb, бледностью пациента, падением АД, возникновением или усилением ДВС синдрома при массивной кровопотере.
Осложнения
При успешном купировании полиорганное поражение может завершаться развитием отсроченных заболеваний. У 5% пациентов, повторно обратившихся за помощью в ЛПУ, диагностируют хроническую почечную недостаточность, примерно 2% больных испытывают симптомы ишемической болезни сердца или имеют признаки ХСН. Легочные изменения отмечаются в 3% случаев. В остром периоде осложнением является фибрилляция желудочков на фоне токсического поражения миокарда и тахикардии с ЧСС выше 160-180/мин. Возможно повреждение проводящей системы сердца с формированием СА или АВ блокады. Ишемия мозга нередко приводит к снижению умственных способностей, энцефалопатии, парезам, параличам.
Диагностика
Диагностика осуществляется по результатам клинического, лабораторного и инструментального обследования. Курировать пациентов должен анестезиолог-реаниматолог, однако провести первичный осмотр и установить предварительный диагноз для направления больного в профильное отделение может врач любой специальности, в том числе сотрудник бригады СМП. Дифференциальную диагностику проводят с сочетанной патологией нескольких систем организма, этиологически не связанной с механизмами развития рассматриваемого заболевания. Полная программа обследования включает:
Лечение полиорганной недостаточности
Терапия направлена на восстановление ОЦК, нормализацию реологических свойств крови, поддержку витальных функций, предотвращение последствий отсроченного характера. Полиорганная недостаточность должна быть купирована на стадии компенсации, это увеличивает вероятность полного восстановления. Применяются следующие лечебные воздействия на больного:
Прогноз и профилактика
Полиорганная недостаточность имеет благоприятный исход при раннем начале лечения. По мере прогрессирования процесса в организме накапливаются необратимые изменения, повышающие риск возникновения осложнений. Декомпенсированная форма болезни имеет неблагоприятный прогноз, в 60% случаев приводит к гибели пациента. Профилактика заключается в предотвращении ПОН. Следует купировать очаги инфекции, при объемных травмах начинать массивную инфузию еще на догоспитальном этапе, своевременно устранять имеющиеся нарушения гемодинамики и сердечного ритма. Важным моментом является контроль диуреза пациента, находящегося на лечении в ОРИТ. Разница между употребленной и выделенной жидкостью не должна составлять более 100-200 мл в сутки.
Угдф в медицине что
Вот уже несколько десятилетий синдром полиорганной недостаточности (СПОН) остается одной из актуальных проблем современной медицины. Летальный исход при СПОН имеет место более чем у 50-80% кардиохирургических больных, и этот показатель не проявляет тенденции к снижению. Значительное место занимает вопрос о возникновении системного воспалительного ответа (СВО), а в последующем СПОН у больных, перенесших искусственное кровообращение (ИК). Летальность при СПОН во многом зависит от числа вовлеченных в патологический процесс систем органов [2, 4, 5, 7, 9, 12].
Основными задачами при лечении СПОН являются снижение влияния интраоперационных факторов риска (длительное ИК, массивная кровопотеря и гемотрансфузия, нарушение системы коагуляции), оптимизация транспорта и потребления кислорода, нутритивная поддержка, иммунокоррекция, коррекция гиперметаболизма и синдрома кишечной недостаточности, экстракорпоральная детоксикация [1, 2, 4-7]
Материал и методы
В РНЦХ им. акад. Б.В. Петровского в течение
10 лет проводилось исследование, целью которого было изучение этиологии, патогенеза, клинико-лабораторной диагностики, методов профилактики и лечения СПОН у больных после кардиоваскулярных операций в условиях искусственного кровообращения (ИК).
Проведен анализ наблюдений за 4383 больными в возрасте от 16 до 75 лет (77% мужчин и 23% женщин), оперированными в условиях ИК.
Среди этих больных у 224 (52,1%) в послеоперационном периоде отмечена дисфункция органов и систем, у 206 (47,9%) дисфункция органов переросла в полиорганную недостаточность.
Таким образом, СПОН отмечалась у 4,7% больных, перенесших операции в условиях ИК.
Описанные выше причины приводили к активации системного воспалительного ответа (СВО), одним из признаков которого является стимуляция выработки про- и противовоспалительных цитокинов, а также нарушение их баланса.
Сравнительная характеристика больных со СПОН и без СПОН (группы сопоставимы по полу, возрасту и виду выполненных оперативных вмешательств) представлена в табл. 1.
Активация СВО при операциях в условиях ИК
Подводя итог анализу степени тяжести течения послеоперационного периода у больных со СПОН после операций с ИК, можно сделать заключение, что основными причинами возникновения органной дисфункции следует считать не отдельно взятое осложнение, а чаще всего параллельно возникающий каскад нарушений гомеостаза, тип оперативного вмешательства, число заинтересованных систем органов.
У больных с ПОН патогенетически обоснованным является применение экстракорпоральных методов детоксикации (ЭКМД) [3, 9].
Была отмечена высокая эффективность применения раннего и превентивного ПФ в первые 6-8 ч после операции у больных при наличии абсолютных (выраженные аллергические реакции, включая
анафилактический шок, наличие внутрисосудистого гемолиза крови более 150 мг%, развитие ДВС-синдрома) и относительных (длительный, более 160 мин период ИК, массивная кровопотеря с гемотрансфузией, комбинация длительного ИК и массивной кровопотери, сохраняющееся в динамике увеличение уровня лактата артериальной крови, СОПЛ) показаний (табл. 3).
У больных с поражением 5-6 систем органов и тяжестью состояния 13,5 балла и более по Маршаллу применяли комбинированную терапию.
Как видно из табл. 4, 
Соблюдение предложенных условий позволило нам в группе больных со СПОН получить снижение частоты летальных исходов на 8,5% (с 67,8 до 59,3%).
Дальнейшими перспективами в диагностике и лечении СПОН являются поиск и изучение биомаркеров, активное использование сорбционных методов детоксикации, сертификация технологий лечения ПОН, создание единой базы данных по ПОН.
Таким образом, после кардиоваскулярных операций в условиях искусственного кровообращения уровень про- и противовоспалительных цитокинов значительно повышается у всех больных независимо от наличия синдрома полиорганной недостаточности (СПОН) в послеоперационном периоде. У больных со СПОН отмечается дисбаланс между про- и противовоспалительными цитокинами за счет преобладания активности провоспалительного звена системного ответа.
Синдром полиорганной недостаточности, метаболические основы. Часть 1
Опубликовано в журнале:
Вестник интенсивной терапии »» № 2 ’99 (Лекция. Часть 1)
И.Н.Лейдерман
Кафедра анестезиологии и реаниматологии Уральской государственной медицинской Академии.
Городская клиническая больница скорой медицинской помощи. ГМПО «Сангвис». Екатеринбург
Впервые термин «полиорганная недостаточность» (ПОН) вошел в клиническую практику после публикации работы N.Тylney и сотр. (1973) «Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешенная проблема послеоперационного лечения». Позже А.Baue (1975), а далее B.Eisman (1977) и D.Fry (1980-1982) окончательно сформировали особенности этого состояния и его дефиниции.
В нашей стране большой вклад в изучение патогенеза и разработку методов диагностики, профилактики и лечения ПОН внесли Е.С.Золотокрылина, Ю.Н.Шанин, А.П.Зильбер, В.Л.Кассиль, В.А. Гологорский, Б.Р.Гельфанд, О.А.Долина, Р.Н.Лебедева и другие.
По данным северо-американских исследователей, ПОН уже в течение 20 лет остается основной причиной смерти среди пациентов палат интенсивной терапии и реанимации хирургических стационаров и занимает около 75-80 % общей летальности. При этом средняя длительность пребывания больного с ПОН в хирур-гических палатах интенсивной терапии составляет 21 день, а затраты на лечение порядка 85 000 амери-канских долларов. Общие финансовые вложения у вы-живших и прошедших реабилитацию пациентов приближаются к сумме в 300 000 американских дол-ларов. По этиологии ПОН подразделяют на два основных вида:
В развитии синдрома ПОН выделяют три основных фазы:
Индукционную фазу, результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа;
Каскадную фазу, сопровождающуюся развитием острого легочного повреждения, активацией каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свертывающей системы крови и других;
Фазу вторичной аутоагресии, предельно выраженной органной дисфункции и стабильного гипер-метаболизма, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза;
Таблица 1.1 Медиаторы ПОН
В настоящее время известно уже около 200 таких медиаторов. Основными из них являются:
Основными факторами, усугубляющими «медиаторно-цитокиновую бурю», являются гипоксия и дизоксия, глубокие нарушения микроциркуляции, аномально высокие концентрации промежуточных и конечных продуктов обмена веществ, циркулирующих имунных комплексов, биогенных аминов, продуктов перекисного окисления.
К сожалению, очень мало в современной литературе освещаются особенности морфологии различных тканей организма при развитии ПОН. Большой интерес представляют единичные исследования, показывающие универсальный характер патоморфологических изме-нений у больных, умерших от прогрессирования ПОН. Основными признаками явились дегенерация, дест-рукция, отек, геморрагии и микротромбозы в тканях основных органов у пациентов с клиникой сердечной, дыхательной, почечной, печеночной недостаточности.
Выделяют три стадии развития ССВО:
Стадия 1. Локальная продукция цитокинов в ответ на травму или инфекцию. Цитокины способны выполнять ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов.
Стадия 2. Выброс малого количества цитокинов в системный кровоток. Даже малые количества медиаторов способны активизировать макрофаги, тромбоциты, продукцию гормона роста. Развивающаяся острофазовая реакция контролируется провоспалительными медиаторами и их эндогенными антагонистами, такими как антагонисты интерлейкина-1, 10, 13; фактор некроза опухоли. За счет баланса между цитокинами, антагонистами медиаторных рецепторов и антителами в нормальных условиях создаются предпосылки для заживления ран, уничтожения патогенных микроорганизмов, поддержания гомеостаза.
Стадия 3. Генерализация воспалительной реакции. В том случае, если регулирующие системы не способны поддерживать гомеостаз, начинают доминировать деструктивные эффекты цитокинов и других медиаторов, что приводит к нарушению проницаемости и функции эндотелия капилляров, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции.
ССВО представляет собой симптомокомплекс характеризующий выраженность воспалительной реакции в системе эндотелиоцитов, а, следовательно, и направленность воспалительного ответа на повреждение.
Ряд исследований подтвердил, что основу патогенеза ПОН составляет именно диссеминированная воспалительная реакция, сопровождающаяся активацией и выбросом большого количества биологически активных соединений.
Синдром ПОН следует рассматривать как наиболее тяжелую степень ССВО-генерализованное воспаление вызывающее повреждение органной функции.
В свете современных представлений о системной воспалительной реакции выделяют два основных пути развития ПОН. Первичная ПОН является прямым результатом воздействия определенного повреждающего фактора любой этиологии. При этом признаки органной дисфункции проявляются рано. Примером такого вида ПОН может явиться полиорганная дисфункция при политравме, тяжелых ожогах.
Вторичная ПОН развивается после латентной фазы и является результатом генерализованного системного ответа организма на повреждающий фактор. Септический вариант ПОН можно рассматривать как классическую вторичную органную недостаточность, проявление крайне тяжелого системного ответа на инфекционную инвазию.
Слизистая кишечника постоянно обновляется, имеет высокую степень метаболической активности и, таким образом, является более уязвимой для ишемии и атрофии. Если эпителиоциты лишены номинального притока питательных веществ, то имеет место снижение активности репродукции и миграции клеток, а также синтеза ДНК и барьерной функции кишечника.
Было доказано, что гипоксическое повреждение слизистой желудочно-кишечного тракта приводит к перемещению эндотоксинов и бактерий в мезентериальные лимфатические узлы, а затем в кровеносные сосуды. Транслокация эндотоксина может грубо повреждать физиологические процессы, что проявляется развитием септического состояния. В наиболее тяжелой форме это проявляется в виде синдрома ПОН.
Начиная с 1950 года, с момента создания Д. Бароном первой энтеральной диеты ведутся исследования по возможностям раннего энтерального питания как фактора, снижающего выраженность стрессовой реакции и защищающего слизистую кишечника при критических состояниях. Разработка в 70-80 х годах новой генерации энтеральных смесей, состоящих из ди- и тримерных молекул липидов, углеводов и протеинов, дало толчок к проведению многоцентровых испытаний по оценке эффективности питания этими диетами. Первое рандомизированное исследование, проведенное в 1980 г. У. Александером, выявило снижение летальности у детей с ожоговой травмой. Позже статистически достоверно было доказано снижение частоты инфекционных осложнений, сроков ИВЛ, длительности пребывания в отделении реанимации и стационаре у пациентов с политравмой и у больных после плановых хирургических вмешательств, что значительно снижало затраты на лечение. Раннее энтеральное питание онкологических пациентов позволило добиться более быстрого прироста уровней альбумина и ретинол-связывающего протеина, повышало активность фагоцитоза по сравнению с контрольной группой. Экспериментальные работы показали снижение бактериальной транслокации, уровней глюкагона, цитокинов, лактата, С- реактивного белка у животных, получавших энтеральные среды.
Таблица 1.2 Изменения метаболизма при синдроме системного воспалительного ответа (SIRS) по Ackerman M. e. a. (1994)
Расстройства обмена протеинов характеризуются перераспределением белков в организме. Ускоренный распад протеинов является донатором предшественников для активного печеночного глюконеогенеза и синтеза острофазовых белков. Однако имеющий место синтез белка не позволяет компенсировать возросший катаболизм мышечных и висцеральных протеинов, что приводит к отрицательному азотистому балансу. Притом в течение ближайших суток потери азота достигают 20 г в сутки и проявляется прогрессирующей потерей массы тела. Банальное введение белковых препаратов не позволяет корригировать имеющиеся сдвиги из-за критических нарушений в нормальных физиологических цепочках обмена белков.
Липиды являются наиболее расходуемым при критических состояниях источником энергии. Жировая ткань распадается на жирные кислоты, попадающие в системный кровоток, а затем и в печень. Неадекватная перфузия ткани тормозит липолиз. Выброс цитокинов способствует снижению утилизации жирных кислот и триглицеридов за счет подавления активности липопротеинлипазы.
Впервые клинические проявления метаболического ответа на стресс-фактор (сепсис) были описаны в 1942 году и состояли из двух фаз: EBB приходится на первые 12-24 часа и характеризуется снижением кислородного транспорта, гипотермией и вазоконстрикцией. Фаза FLOW (со 2-х суток до 14-21 дня) характеризуется активацией симпатоадреналовой системы, гипердина-мией, высоким потреблением кислорода, мышечным протеолизом.
Эволюция данных взглядов позволила сформировать представление о комплексных изменениях в метабо-лизме липидов, протеинов, углеводов, возникающих при синдроме системного воспалительного ответа (ССВО – SIRS) (табл. 1.2). Наиболее часто возникающим расстройством является спонтанная гипергликемия. При этом выработка глюкозы в печени увеличивается в ответ на выброс адреналина, норадреналина, глюкагона и кортизола. На фоне гипергликемии, тем не менее, наблюдается глюконеогенез, рефрактерный к введению экзогенной глюкозы. Аминокислоты мобилизуются из скелетной мускулатуры и транспортируются в печень для синтеза глюкозы и медиаторов системного повреждения.
Важнейшую роль в развитии системных расстройств метаболизма играют медиаторные системы и, в первую очередь, цитокины. Наиболее выражены метаболические эффекты у интерлейкина-6 и фактора некроза опухоли, получившего ранее название «кахектина», то есть вызывающего истощение (кахексию) у больных. (таб.1.3). Воздействие TNF на органы и ткани во многом подобно изложенным в таблице 2 особенностям обмена веществ при системном воспалительном ответе.