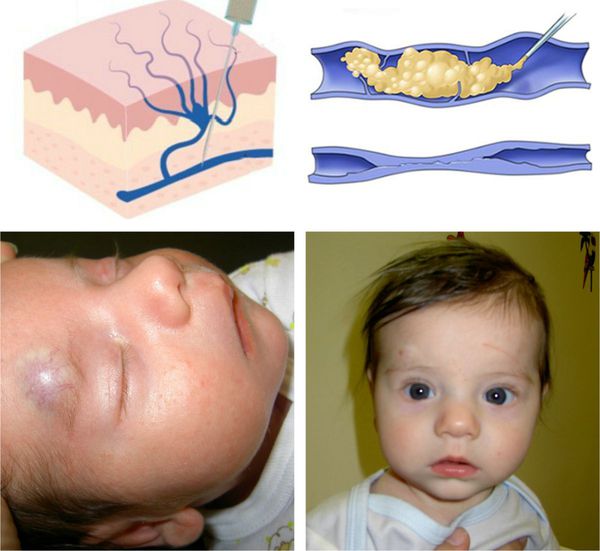
У ребенка на голове красная шишка что это
Кефалогематомы у детей

По данным мировой литературы частота регистрации кефалогематом у новорожденных детей составляет 0,2–4,0%. Кефалогематомы наиболее часто развиваются после применения вакуум-экстракции. Большинство поднадкостничных кровоизлияний у детей разрешается самостоя
According to world literature, the frequency of registration of cephalogemate in newborns is 0,2–4,0%. Cephalohematomas most often develop after applying vacuum extraction. Most subperiosteal hemorrhages in children are resolved on their own. In 2–5% of cases, resorption of cephalohematomas does not occur and complications may occur in the form of suppuration and calcination. Routine puncture and aspiration with cephalogemate in children should not be carried out.
Кефалогематома, или кефалгематома, — это кровоизлияние под надкостницу плоских костей свода черепа [1–5]. В Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра применяется формулировка «P12.0. Кефалгематома при родовой травме» [5–8]. По данным мировой литературы частота регистрации кефалогематом у детей составляет от 0,2% до 4,0% и не имеет существенной тенденции к снижению [9–15]. Изучение факторов риска, механизмов формирования, клинических особенностей и лечения кефалогематом у детей является актуальным вопросом в неонатологии и педиатрии [1, 2, 9, 10, 16, 17].
Целью настоящей работы было провести обзор публикаций по вопросам этиологии, механизмам формирования, клиническим особенностям и лечению кефалогематом у детей. Обзор проведен в онлайновых базах данных, включая Medline, Web of Science, PubMed, Scopus и Кокрейновском центральном регистре контролируемых испытаний за последние 7 лет (с 2012 по 2019 гг.).
Факторы риска
По данным обзора факторы риска формирования кефалогематом можно разделить на три основные группы: материнские, родовые и плодовые [18, 19]. Многие из них совпадают с причинами развития других натальных травм у детей [1, 2, 15, 19]. К материнским факторам относят возраст женщины (до 16 лет и старше 35 лет), аномалии таза, хронические заболевания матери [1, 2, 4, 19–21]. Чаще кефалогематомы регистрируются при родах у первобеременных и первородящих женщин, а также у женщин с инфантилизмом [18–21]. Сердечно-сосудистые, эндокринные и другие хронические заболевания у матери вызывают снижение адаптационных возможностей плода [19–21]. Плохо контролируемый сахарный диабет у женщины является одной из основных причин макросомии плода и, как следствие, развития кефалогематом [19, 21]. Рутинное назначение антикоагулянтов и антиагрегантов беременным женщинам влияет на механизм свертывания крови у плода и может тем самым способствовать формированию кефалогематом [15, 19, 21]. К родовым факторам риска относятся состояние родовых путей матери, метод родоразрешения, затяжные и быстрые роды, маловодие, применение акушерских пособий и инструментальных методик [1, 2, 5, 13–15, 18, 19, 22]. Кефалогематомы чаще регистрируются у детей, рожденных через естественные родовые пути [15, 18, 22]. Частота развития кефалогематом связана с квалификацией и навыками медицинского персонала, оказывающего пособие в родах [2, 5, 13, 14, 18, 20]. Использование вакуумной экстракции и акушерских шипцов приводит к увеличению риска развития кефалогематом в 3–4 раза [11, 18, 20, 23]. К плодовым факторам риска относят недоношенность, переношенность, тазовое или ягодичное предлежание, аномалии развития, большой размер головки и макросомию [1, 2, 5, 13, 14, 18, 20]. Кефалогематомы чаще регистрируются у мальчиков по сравнению с девочками [5, 19, 21]. Вес ребенка 4,0–4,5 кг при рождении связан с двукратным увеличением риска родовой травмы. Этот риск увеличивается в 3 раза, если вес при рождении составляет от 4,5–5,0 кг, и более чем в 4,5 раза, если новорожденный весит более 5 кг [18, 20]. Многие авторы отмечают, что кефалогематома может сформироваться и вне прямой связи с предрасполагающими факторами и доля таких случаев составляет 30–32% [5, 7, 13, 14, 21].
Механизм формирования кефалогематом
При сильном сдавлении костей черепа во время прохождения головки по родовому каналу происходит сдвигание надкостницы и ее отслойка. Это приводит к повреждению и разрыву кровеносных сосудов, вследствие чего кровь собирается в поднадкостничном пространстве [1, 2, 4, 8, 11]. Отслойка надкостницы происходит при выраженной конфигурации головки, а также при использовании акушерских щипцов и вакуум-экстракции [2, 18, 21, 22]. В 5–25% случаев кефалогематома может формироваться при трещинах и переломах костей черепа [17, 20]. Так как при кефалогематоме кровотечение возникает в ограниченном поднадкостничном пространстве, и при увеличении объема кефалогематомы кровеносные сосуды пережимаются и сдавливаются, что способствует самостоятельной остановке кровотечения [1, 2, 4].
Клинические особенности
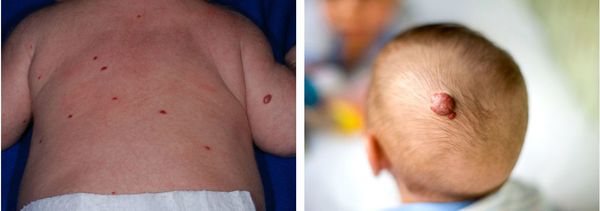
Формирование кефалогематомы обычно происходит в течение первых 24–72 часов жизни новорожденного ребенка. Сразу после рождения ребенка диагностировать поднадкостничное кровоизлияние достаточно сложно из-за наличия родовой опухоли [1–5, 11]. Кефалогематома может располагаться на любой кости свода черепа: теменной, затылочной, височной, лобной [1–5]. Наиболее часто кефалогематома формируется в области теменных костей из-за того, что на них оказывается наиболее сильное воздействие во время родов [4, 9]. На втором месте по частоте встречаемости находится затылочная кость, на третьем месте — височная кость [5, 14]. В области теменных костей встречается 83–88% кефалогематом, а в области затылочной кости регистрируется только 6–12% [8, 19, 21]. По данным С. В. Баринова частота встречаемости односторонних кефалогематом составляет 89%, двусторонних — 11,0% [21]. Формирование нескольких кефалогематом у одного ребенка происходит наиболее часто в области правой и левой теменной кости [5, 8, 18, 23]. Поднадкостничное кровоизлияние, как правило, округлой или овальной формы, с четко определяемыми границами, плотной, упругой, напряженной консистенции [5, 18, 20]. Кефалогематома никогда не переходит на соседнюю кость [1, 2, 4, 11, 14]. Поднадкостничное кровоизлияние не пульсирует, безболезненно. Поверхность кожных покровов над кефалогематомой, как правило, не изменена, но иногда могут быть мелкие кровоизлияния, петехии [1, 2, 4, 11, 14]. Увеличение размеров кровоизлияния может происходить в течение первых 3 суток жизни [1–3, 5, 11, 18, 20]. По размеру кефалогематомы разделяют на малые или 1-й степени (размер до 4 см), средние или 2-й степени (от 4,1 до 8 см) и большие или 3-й степени (размер более 8,1 см). При оценке размеров учитывается максимальный диаметр кровоизлияния. Чаще у детей встречаются кефалогематомы 2-й степени (до 65%), реже регистрируются кефалогематомы 1-й степени (до 25%) и 3-й степени (до 10%) [1, 2, 9, 21, 24]. При больших кровоизлияниях из-за секвестрации крови может возникать гипотония, анемия, желтуха [1, 2, 4]. По данным В. А. Прилуцкой гипербилирубинемия регистрируется в 11% случаев [24]. У детей необходимо контролировать уровень гематокрита, гемоглобина, гемодинамические показатели, коагулограмму, общебиохимические показатели, в том числе уровень билирубина [1, 2, 4]. Кефалогематома может быть одним из клинических проявлений геморрагической болезни новорожденных детей, тромбопатии, гемофилий А, В и С, гипофибриогенемии, афибриногениемии и дисфибриногенемий, а также других наследственных коагулопатий [1–4, 19, 21, 24]. Резорбция кефалогематомы начинается к 10–14 суткам жизни. С началом резорбции центр ее становится несколько утопленным, а по краям кровоизлияния начинает образовываться плотный валик [1–3, 5, 9, 11, 18, 20]. Полная резорбция большинства поднадкостничных кровоизлияний наступает к 6–8 неделе жизни ребенка. В 2–5% случаев резорбция кефалогематомы не происходит и могут возникать осложнения в виде нагноения и кальцинации [1, 2, 9, 11].
Кальцинация кефалогематомы
Длительно сохраняющаяся кефалогематома может кальцинироваться. В литературе это осложнение часто называется оссификацией или окостенением кефалогематомы [5, 8, 14]. Частота развития кальцинации кефалогематом составляет 2–5% [8, 11, 14, 24]. Кальцинированные кефалогематомы изменяют контур свода черепа, что приводит к стойкой деформации и асимметрии головы у ребенка [1, 5, 8, 9, 11, 22]. Кальцинированные кефалогематомы предложено делить на два типа [5, 8]. Кефалогематомы с кальцинацией по 1-му типу характеризуются тем, что внутренняя пластинка имеет нормальный контур и не вдавлена в сторону полости черепа. При кальцинации по 2-му типу происходит вдавление внутренней пластинки в полость черепа [5, 8, 11]. 1-й тип кальцинированных кефалогематом возникает при небольших размерах кровоизлияния. 2-й тип регистрируется при больших размерах поднадкостничного кровоизлияния [8]. Деление кальцинированных кефалогематом на варианты важно для определения хирургической тактики ведения таких детей [5, 11]. При 1-м типе кальцинированной кефалогематомы проводится поднадкостничное удаление оссифицированной гематомы. При 2-м типе может потребоваться проведение краниопластики для восстановления свода черепа [8, 11].
Нагноение кефалогематомы
Развитие нагноения кефалогематомы является редким, но очень опасным осложнением [16, 25]. В зарубежной литературе это осложнение часто называется инфицированием кефалогематомы [16, 18, 25, 26]. К факторам риска развития нагноения относят длительный безводный период, инструментальные пособия в родах, ссадины и повреждения кожных покровов на голове, бактериемию, применение электродов при внутриутробном мониторинге [16, 25]. Первичная инфекция возникает в результате повреждения кожных покровов в области головы. Вторичная инфекция появляется в результате бактериемии, а также при сепсисе или менингите [16]. При микробиологическом исследовании нагноившихся кефалогематом наиболее часто выделяется кишечная палочка [16, 18, 25, 26]. На втором месте находится золотистый стафилококк, на третьем месте — протей [16, 18, 25, 26]. При нагноении кефалогематомы появляются локальные и системные признаки инфекции [16]. К локальным признакам относят эритему, флюктуацию, болезненность, изменения кожных покровов, гнойное отделяемое [1, 2, 16, 25, 26]. Системными признаками являются нарушения терморегуляции, беспокойство, раздражительность, а также возможны вялость, отказ от еды, плохое сосание, нарастание желтухи и бледности [16, 25]. Может быть лейкоцитоз и повышение уровня С-реактивного белка [25]. Инфицирование кефалогематомы часто приводит к развитию сепсиса, менингита, остеомиелита и смерти [16, 18, 25, 26]. При нагноении кефалогематомы менингит развивается у 26% детей, сепсис у 42% [16]. Показатели смертности при развитии сепсиса составляют 35,7% [26]. Основным методом лечения нагноившегося поднадкостничного кровоизлияния является аспирация и дренирование, а также назначение антибактериальной терапии с учетом чувствительности возбудителя [16, 25, 26].
Наблюдение и лечение
Дети с поднадкостничными кровоизлияниями обычно не нуждаются в какой-либо медикаментозной терапии. Для большинства кефалогематом характерна самостоятельная резорбция и полное разрешение в течение нескольких недель или месяцев. [1–4]. У пациентов предлагается проводить только динамическое клиническое наблюдение [5, 14]. При наличии болевого синдрома необходимо проведение немедикаментозного и медикаментозного обезболивания [1]. В настоящее время большинство авторов считает, что проведение пункции и аспирации кефалогематом не показано. При пункции кефалогематомы имеется высокий риск возникновения тяжелых инфекционных осложнений [1–3, 5, 9]. Аспирация гематом может способствовать возникновению повторных кровотечений [1–3, 5, 9]. Большой интерес вызывают клинические алгоритмы по ведению детей с кефалогематомами, которые используются в других странах. В Республике Казахстан в 2017 г. утвержден клинический протокол диагностики и лечения кефалогематом у новорожденных. Согласно протоколу, ребенок с кефалогематомой 1-й степени (размер до 4 см) не нуждается в госпитализации в стационар. Госпитализация в стационар показана только детям с большими кефалогематомами, с длительно сохраняющимися кефалогематомами (больше 10 дней), а также при развитии анемии, гипербилирубинемии и появлении признаков инфицирования кефалогематомы. Хирургическое вмешательство проводится только при нагноении кефалогематомы [9].
Литература
А. Ф. Киосов, кандидат медицинских наук
ГБУЗ ОКБ № 2, Челябинск
Кефалогематомы у детей/ А. Ф. Киосов
Для цитирования: Лечащий врач № 10/2019; Номера страниц в выпуске: 52-55
Теги: акушерские щипцы, вакуум-экстракция, родовая травма, осложнения.
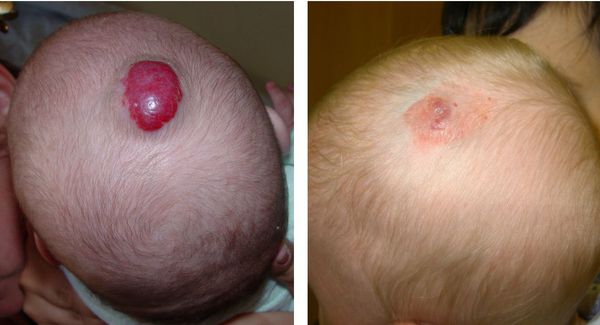
Что такое гемангиома у детей? Причины возникновения, диагностику и методы лечения разберем в статье доктора Подшивалова О. А., детского хирурга со стажем в 14 лет.
Определение болезни. Причины заболевания
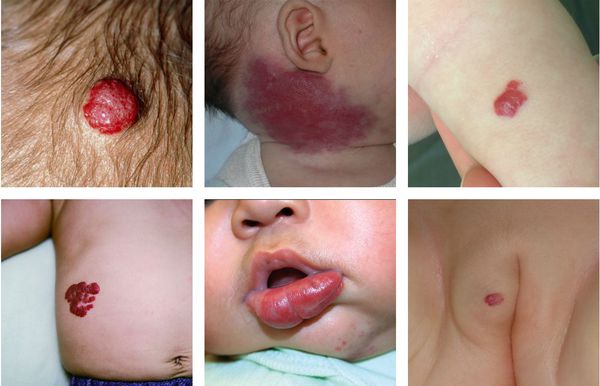
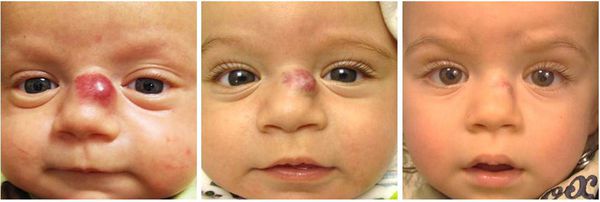
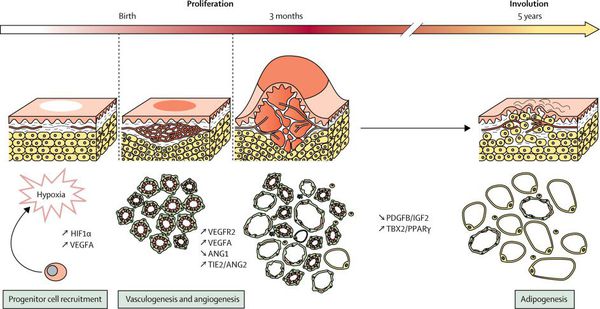
Младенческая гемангиома — это доброкачественная опухоль, возникающая в первые месяцы жизни ребёнка. Она состоит из самостоятельно инволюционирующих клеток, которые формируют кровеносные сосуды. Для неё характерны определённые фазы развития — пролиферация (рост), стабилизация и инволюция (обратное развитие).
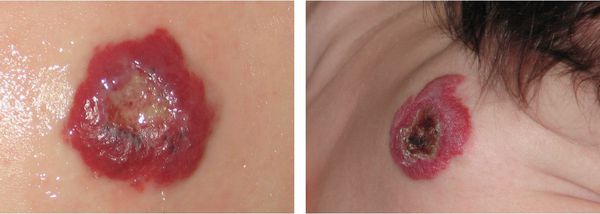
Хотя гемангиома проходит самостоятельно, в ряде случаев она может стать причиной артериального кровотечения и менее опасных осложнений, таких как косоглазие, язвы, разрушение хрящей в области век, носа, губ или ушных раковин. Иногда она может быть признаком других заболеваний, например синдромов PHACE или LUMBAR. А при расположении на видимом участке тела (например, на лице) гемангиома может значительно усложнить социализацию ребёнка в коллективе, что приведёт к психологическому дискомфорту, трудностям в общении со сверстниками и депрессии.
Именно поэтому не следует ждать, пока гемангиома пройдёт сама, а показать ребёнка специалисту. После осмотра врач подберёт оптимальный метод лечения, если оно необходимо, а при подозрении на сопутствующие заболевания назначит дополнительные методы исследования.
Наличие более 4-5 младенческих гемангиом на коже при отсутствии очагов в печени, селезёнки или других внутренних органах определяется как «доброкачественный неонатальный гемангиоматоз». Наличие таких очагов не только на коже, но и во внутренних органах (прежде всего в печени) определяется как «диффузный неонатальный гемангиоматоз».
К возможным провоцирующим факторам образования гемангиомы относят:
По статистике, дети с младенческими гемангиомами чаще рождаются у первородящих молодых мам (до 30 лет).
Симптомы гемангиомы у детей
Некоторая часть младенческих гемангиом у детей обнаруживается при рождении в виде единичных сосудистых образований кожи или подкожно-жировой клетчатки. Но большинство гемангиом возникают вскоре после рождения, в основном в первые недели жизни ребёнка, растут, но со временем постепенно инволюционируют.
Патогенез гемангиомы у детей
Младенческая гемангиома возникает на 6-10 неделе беременности, когда происходит нарушение закладки тканей (сосудов). Существует около 10 теорий развития младенческих гемангиом: фиссуральная, неврологическая, травматическая, эмбриональная, гипоксическая и пр. Среди современных теорий можно выделить теорию циркулирующих эндотелиальных клеток-предшественников, плацентарную теорию (нарушение плаценты во время беременности) и др. Однако в настоящее время нет ни одной общепризнанной, подтверждённой теории, которая могла бы достоверно объяснить появление младенческих гемангиом.
Патогенез младенческой гемангиомы изучен не до конца, проводится дальнейшее изучение данного процесса. Есть теория клеточного происхождения из собственных внутренних эндотелиальных клеток-предшественников (endothelialprogenitorcells — EPCs) или ангиобластов плаценты. Также считается, что имеет значение воздействие внутренних (ангио- и васкулогенез) и внешних факторов (тканевая гипоксия и нарушения тканевого развития).
После возникновения младенческая гемангиома претерпевает ряд изменений, которые можно разделить на несколько этапов:
Рост опухоли происходит за счёт быстрой клеточной пролиферации (разрастания) эндотелиальных клеток. Капиллярный эндотелий этих опухолей приобретает способность к неоангиогенезу (формированию новых кровеносных сосудов) в присутствии абиогенных факторов, которые секретируются клетками самой гемангиомы. К таким факторам относится фактор роста фибробластов (FGF-2, bFGF) и эндотелия сосудов (VEGF), коллагеназы IV типа, урокиназы и антигена пролиферации клеток.
Классификация и стадии развития гемангиомы у детей
По классификации Международного общества по изучению сосудистых аномалий (ISSVA) 2018 года заболевание относится к сосудистым опухолям. Оно делится на следующие виды:
Также младенческие гемангиомы разделяют п о объёму поражения кожи:
Гемангиоматоз бывает двух видов:
До настоящего времени по отношению к заболеванию используются устаревшие термины, такие как «кавернозная», «капиллярная», «утёсовидная» гемангиома, «клубничное врождённое пятно» и другие. Использование этих неверных терминов усложняет процесс диагностики и вносит определённую путаницу в общение между специалистами. Например, под термином «капиллярная гемангиома» может скрываться как младенческая гемангиома, так и капошиформная гемэндотелиома.
Гемангиома может быть одним из симптомов различных синдромов:
PHACE(s) — это синдром, при котором наличие сегментарной младенческой гемангиомы в области иннервации тройничного нерва сочетается с одной или более аномалиями: патологией задней черепной ямки, артериальной цереброваскулярной патологией, пороком сердца или магистральных сосудов, сердечной недостаточностью, глазными или эндокринными патологиями, расщелиной грудины или грыжей белой линии живота.
Осложнения гемангиомы у детей
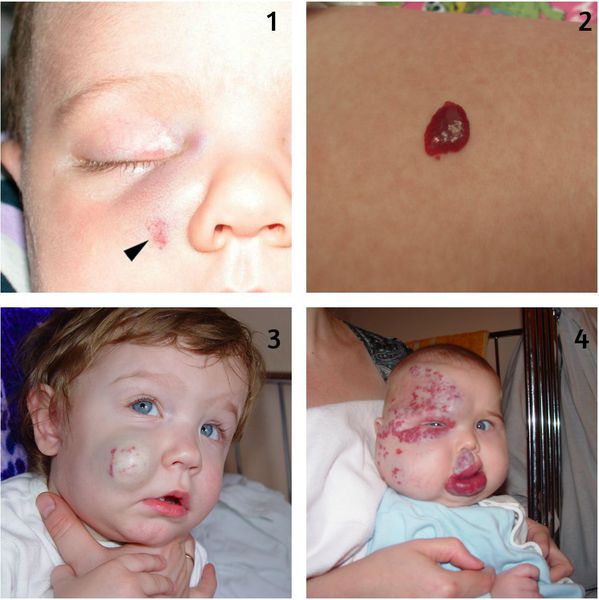
Кровотечение из гемангиомы является вторым по частоте осложнением, которое возникает вследствие травмирования или на фоне появления раневого дефекта (изъязвления). Оно может быть обильным и трудно останавливаемым. В некоторых случаях не помогает даже гемостатическая губка.
Если опухоли располагаются в зонах сложной анатомической локализации, то при быстром росте они могут нарушить работу близлежащего органа:
У детей с обширными младенческими гемангиомами и большим артериовенозным шунтированием (сбросом) может возникнуть застойная сердечная недостаточность. При обширных младенческих гемангиомах, расположенных в области лица, может возникнуть гипотиреоидизм (недостаточная функция щитовидной железы, сопровождающаяся снижением выработки гормонов).
Диагностика гемангиомы у детей
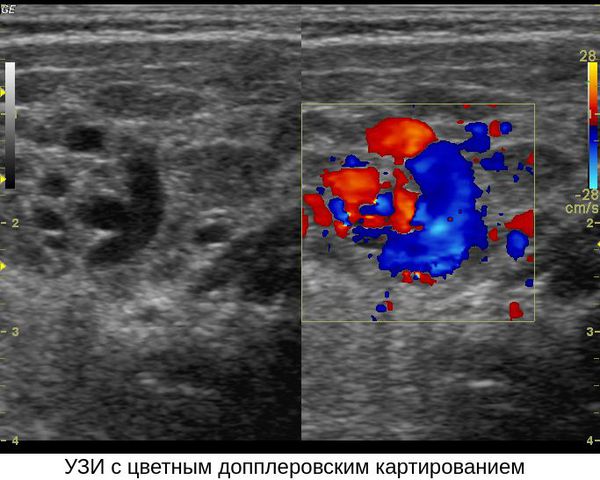
Для постановки диагноза «младенческая гемангиома» достаточно проведения специалистом грамотного осмотра и ультразвукового исследования (УЗИ).
Также для подтверждения диагноза возможно выполнение магнитно-резонансной томографии (МРТ), иногда с внутривенным контрастированием. Но поскольку данный метод требует проведения наркоза, его также не следует использовать рутинно для диагностики младенческой гемангиомы.
Проведение компьютерной томографии (КТ) и ангиографии для диагностики младенческой гемангиомы является избыточным, поскольку КТ связано с высокой лучевой нагрузкой. Кроме того, для проведения КТ нужно выполнить внутривенное контрастирование. Маленьким детям КТ также проводится под наркозом.
Лечение гемангиомы у детей
В настоящее время есть различные способы лечения младенческих гемангиом. Многие из них уже утратили своё значение, другие успешно используются и в настоящее время. Основной вектор лечения — активное наблюдение или проведение того или иного вида терапии уже с момента установки диагноза.
При выборе тактики лечения следует руководствоваться несколькими факторами:
Оценочная шкала для определения показаний к системному медикаментозному лечению младенческих гемангиом бета-адреноблокаторами
Врач проводит осмотр пациента, оценивает указанные критерии и суммирует баллы. При наборе от 9 до 14 баллов показано системное медикаментозное лечение, а при наборе от 4 до 8 баллов медикаментозная терапия не требуется.
Во время оценки расположения гемангиомы необходимо учитывать не только косметический дефект, но и риск появления различных осложнений. К таким «критическим зонам» относятся область ушей, носа, губ и век (орбиты глаза). Например, при разрушении хряща уха возникнет стойкая деформация ушной раковины, для коррекции которой потребуется пластическая операция. При расположении младенческих гемангиом в области промежности и ягодиц часто появляются изъязвления, которые трудно заживают, поэтому такая локализация также является критической.
Большой размер опухоли указывает на активный процесс пролиферации, что сопровождается риском дальнейшего роста гемангиомы и высокой вероятностью появления различных осложнений.
В тактике лечения младенческой гемангиомы также необходимо учитывать наличие глубокого (подкожного) компонента опухоли. Он не поддаётся местному лечению и воздействию лазера, что приводит к прогрессии опухоли в глубоких слоях подкожно-жирового слоя. Поэтому в данном случае рекомендуется прибегать к медикаментозной терапии.
Чем больше количество гемангиом на коже, тем сложнее проводить местную терапию. Наличие более пяти сосудистых опухолей существенно повышает риск появления гемангиомы во внутренних органах (диффузного неонатального гемангиоматоза).
Все методы лечения младенческих гемангиом условно можно разделить на две категории:
Консервативное (неинвазивное) лечение
Данное лечение широко практиковалось до появления бета-адреноблокаторов. Сейчас к данному методу также можно прибегать, но необходимо учитывать: чем младше ребенок, тем выше риск роста опухоли. Выжидательная тактика требует частых и систематических контрольных осмотров для определения возможного роста гемангиомы.
Медикаментозное лечение
Бета-адреноблокаторы. В 2008 году французский дерматолог Лате-Лабрез (C. Leaute-Labreze) открыла действие пропранолола на младенческие гемангиомы. С этого периода начался «золотой век» бета-адреноблокаторов в терапии младенческих гемангиом. Учитывая низкий риск побочных эффектов и высокую эффективность лечения, они стали «первой линией» лечения данной болезни.
До настоящего времени неизвестен точный механизм действия бета-адреноблокаторов. Предположительно, он включает сужение сосудов, подавление VEGF-A (фактора роста эндотелия сосудов), стимуляцию апоптоза (естественного «разбора» патологических тканей). Исследования выявили наличие β2-адренергических рецепторов и VEGF-A в капиллярах разрастающейся младенческой гемангиомы, которые уменьшаются при подавлении β2-адренергических рецепторов.
Сравнение фармакологической активности препаратов Пропранолол и Атенолол.
Стероидные гормоны — о дин из самых старых способов медикаментозного лечения младенческих гемангиом. Данный метод используется с 1960 года по настоящее время и является «второй линией» терапии. До 2008 года он был основным способом лечения гемангиом, особенно при активном росте опухоли.
Механизм влияния глюкокортикостероидов на младенческую гемангиому до сих пор до конца не ясен. Однако известно, что стероидные гормоны оказывают влияние на адипогенез, угнетают образование новых сосудов и снижают выработку проангиогенных белков (VEGF-A и пр.).
Стероидные гормоны в таблетках можно применять в виде системного медикаментозного лечения. У читывая высокий риск побочных эффектов глюкокортикостероидов и появление бета-адреноблокаторов, данный метод стал применяться гораздо реже. Основные показания к его назначению — осложнённые гемангиомы и невосприимчивость образования к лечению бета-адреноблокаторами. Средний курс лечения — от 4 до 12 недель (максимальная доза). Иногда терапия стероидными гормонами может продолжаться до 9-12 месяцев жизни ребёнка.
Цитостатики (Цитоксан, Винбластин и Авастин), как утверждают зарубежные авторы, способствуют прекращению деления опухолевых клеток в метафазе. Однако в России этот метод не нашёл применения, так как Цитоксан действует на рост чувствительных, быстро пролиферирующих клеток, тем самым угнетая эритроцитарный росток крови и развитие яйцеклетки. Также существует мнение, что после применения Цитоксана возникает риск развития вторичной злокачественной опухоли — ангиосаркомы.
Винкристин — это цитостатический препарат, алкалоид растения розовый барвинок (Vincarosea). Он вызывает апоптоз (регулируемый процесс клеточной гибели) эндотелиальных клеток, уменьшает выработку их факторов роста. Как правило, лечение Винкристином проводится при сосудистой патологии, которая не является истинной младенческой гемангиомой, а сопряжена с капошиформной гемэндотелиомой или пучковой ангиомой с синдромом Казабаха — Мерритта. Лекарство вводится еженедельно через центральный катетер.
Данный метод лечения может быть полезен при отсутствии эффекта терапии стероидными гормонами. Его назначение проводится при непосредственном участии онкологов. К побочным действиям препарата относятся раздражение кожи и появление сыпи, нейротоксичность, запоры, параличи черепных нервов, боль в костях, алопеция, мышечная слабость. Как правило, побочные эффекты кратковременны.
Интерфероны (Интерферон-альфа-2а, Интерферон-альфа-2b и Имиквимод — 5% мазь Алдара) стимулируют секрецию интерферонов, которые подавляют факторы роста эндотелия и фибробластов, а также способствуют некрозу опухоли. Они применяются при неэффективности стероидной терапии. Действие этих препаратов заметно только после четырёх месяцев применения.
Поскольку интерфероны вызывают массу осложнений (анемию, нейтропению, гипотиреоидизм, лихорадку, нейроплегию), их применение при лечении детей младшего возраста не оправданно.
Лазерная коррекция
Для лечения сосудистой патологии используются лазеры с длиной волны 532 и 585 нм, реже 1064 нм. Данные лазеры не повреждают кожный покров, поэтому относится к консервативному лечению.
Работа лазеров основана на теории селективного фототермолиза, которая была описана в 1980 году. Лазерное излучение имеет постоянную длину волны, но поглощается тканями по-разному. Это объясняется наличием в коже хромофоров (воды, меланина и гемоглобина). Результатом такого поглощения энергии является нагревание ткани. Например, длина волны 532 и 585 нм лучше всего поглощается оксигемоглобином, за счёт чего происходит изолированное нагревание сосуда, приводящее к повреждению его эндотелия без вреда для окружающих тканей. В результате происходит закрытие сосуда.
После лазерной обработки не остаются шрамы и рубцы.
Оперативное (инвазивное) лечение
Склерозирование гемангиомы
Криодеструкция (удаление жидким азотом)
Разрушить очаг опухоли можно благодаря жидкому азоту температурой −195,6 °C. Он представляет собой жидкость без цвета и запаха, которая стерильна, нетоксична, инертна по отношению к биологическим тканям и не воспламенима. Во время прижигания гемангиомы жидким азотом чётко отграничивается очаг опухоли, который к 21-30 дню после криовоздействия замещается органотипическим регенератом.
Хирургический метод лечения
Хирургическому удалению подлежат не все гемангиомы: его следует использовать только при наличии жизнеугрожающих состояний, например, при кровотечении или при перекрытии дыхательных путей, но чаще всего к нему прибегают на завершающей стадии инволюции, когда кровотока в гемангиоме уже почти нет — чаще всего в 4-5 лет.
Устаревшие методы лечения
Лучевая терапия (БФРТ)
Суть данного метода заключается в облучении участка кожи рентгеновскими лучами с небольшого расстояния. Такое излучение поглощается преимущественно в поверхностных тканях и эффективно только при младенческих гемангиомах, расположенных исключительно на поверхности кожи.
Прогноз. Профилактика
Детям с младенческими гемангиомами медотвод от проведения вакцинации не даётся. Такие пациенты должны получать прививки согласно национальному календарю. До настоящего времени нет доказательств влияния вакцины на рост гемангиомы.