Тяжелый гестоз при беременности что это
ГЕСТОЗ У БЕРЕМЕННЫХ Вопросы диагностики и акушерской тактики
Является ли гестоз беременных самостоятельным заболеванием? От чего зависит течение гестоза? Какие степени нефропатии принято различать? Какую патогенетическую терапию назначают при гестозе беременных? Гестоз беременных представляет собой синдр
Является ли гестоз беременных самостоятельным заболеванием?
От чего зависит течение гестоза?
Какие степени нефропатии принято различать?
Какую патогенетическую терапию назначают при гестозе беременных?
Гестоз беременных представляет собой синдром полиорганной функциональной недостаточности, который развивается в результате беременности или обостряется в связи с беременностью. Основные его симптомы: патологическое увеличение массы тела, отеки, артериальная гипертензия, протеинурия, приступы судорог и/или кома. Гестоз беременных — не самостоятельное заболевание, это синдром, обусловленный несоответствием возможностей адаптационных систем организма матери адекватно обеспечить потребности развивающегося плода. Реализуется это несоответствие через различную степень выраженности перфузионно-диффузионной недостаточности плаценты.
Выделяя отдельно гипертонию и протеинурию в группе гестозов, большинство зарубежных авторов при сочетании симптомов (отеки, протеинурия, гипертензия), независимо от степени их выраженности, определяют подобное состояние как преэклампсию. Таким образом подчеркивается трудность определения степени тяжести гестоза.
В нашей стране принята классификация, включающая четыре клинические формы гестоза: водянку, нефропатию, преэклампсию и эклампсию. Некоторые авторы признают существование еще одной моносимптомной клинической формы — гипертонии беременных, а также делят поздний гестоз на «чистый» и «сочетанный», т. е. развивающийся на фоне существовавших до беременности хронических заболеваний.
Распространенность гестоза остается высокой (около 12—27%) и не имеет тенденции к снижению. Его течение во многом зависит от предшествующих заболеваний, в связи с чем выделяют неосложненные и сочетанные (осложненные) формы гестоза.
Тяжело и с неблагоприятными последствиями для плода и новорожденного протекает гестоз на фоне заболеваний почек. В последние годы отмечен рост числа случаев почечной патологии у беременных. Так, гестационный пиелонефрит определяется у 6—8% беременных, гломерулонефрит — у 0,1-0,2%.
Гестоз на фоне заболеваний почек развивается с 18—22 недели беременности. Раннее начало гестоза всегда должно настораживать — речь может идти о сочетанной форме заболевания. Наличие этого диагноза следует уточнить, так как лечение сочетанных форм имеет свои, очень существенные особенности. У беременных с заболеваниями почек и гестозом, особенно при выраженной гипертензии, нередко (5-6%) отмечается преждевременная отслойка нормально расположенной плаценты с тяжелыми последствиями для здоровья матери и плода.
Как правило, тяжело протекает гестоз на фоне гипертонической болезни. Даже нейроциркуляторная дистония по гипертоническому типу в сочетании с гестозом у некоторых женщин определяет тяжелое течение заболевания.
Гестоз, видимо, развивается в результате дисбаланса между материнскими антителами и антигенной структурой плода. При беременности, осложненной гестозом, увеличивается выработка антител и количество циркулирующих иммунных комплексов. Отложение этих комплексов на поверхности эндотелия вызывает агрегацию тромбоцитов, повреждение тканей, отложение фибрина. Кроме прямого повреждающего действия антител, они снижают синтез простациклина и тем самым нарушают способность сосудистой стенки предупреждать сосудистый спазм, агрегацию тромбоцитов и внутрисосудистый тромбоз. Снижение простациклина происходит параллельно повреждению эндотелиальных клеток. Возникают иммунные васкулиты с хориондецидуальными повреждениями, высвобождением тканевого тромбопластина, фибрина, фибриногена. Повреждение эндотелия вызывает ряд негативных последствий, которые наиболее ярко проявляются в виде гипертензии, протеинурии и отеков. Повреждение эндотелия довольно распространено, что позволяет отнести тяжелый гестоз в группу заболеваний эндотелия и обосновать неизбежность развития полиорганной недостаточности при этой патологии беременности.
Способность эндотелиальных клеток вырабатывать простациклин уменьшается при гипертонической болезни, сахарном диабете, ожирении, поэтому гестоз быстрее возникает на фоне сопутствующей экстрагенитальной патологии и всегда сопровождается тяжелой полиорганной недостаточностью. У беременных с пиелонефритом повышается уровень эндотоксина в крови с одновременным снижением антиэндотоксиновых антител. На фоне иммунного васкулита снижается выработка простациклина и увеличивается количество тромбоксана, что с ростом легочного и периферического сосудистого сопротивления ведет к повышению тонуса артериол, спазму сосудов головного мозга, агрегации тромбоцитов и ДВС-синдрому.
Существенный момент — определение степени тяжести гестоза. Не вызывает сомнения, что сочетанная форма гестоза может считаться наиболее тяжелой. Раннее начало гестоза и его наличие в течение более чем трех недель должны учитываться как неблагоприятные прогностические признаки.
Принято различать III степени нефропатии. При I степени возникают отеки ног, артериальное давление повышено на 25—30% (около 150/90 мм рт. ст.), отмечается умеренная протеинурия (до 1,0 г/л). При II степени заболевания выявляются выраженные отеки ног, брюшной стенки, артериальное давление повышается на 40% по отношению к начальному уровню (170/100 мм рт. ст.), протеинурия более выражена (от 1,0 до 3,0 г/л). Для III степени характерны резко выраженные отеки ног, брюшной стенки, лица, повышение артериального давления по отношению к его начальному уровню более чем на 40% (выше 170/100 мм рт. ст.) и выраженная протеинурия с содержанием белка в моче (более 3,0 г/л). Это деление не всегда оправдывает себя на практике, так как и при нефропатии II степени (а иногда и I степени) возможны тяжелые осложнения и развитие в преэклампсии и эклампсии. Поэтому многие акушеры выделяют легкую и тяжелую формы нефропатии. Тяжелая нефропатия может рассматриваться как преэклампсия; больные при этом нуждаются в интенсивной терапии, а при недостаточной ее эффективности — в немедленном родоразрешении.
Классическая «триада» симптомов наблюдается в 28—50% случаев. В настоящее время клиническое течение гестоза характеризуют стертость течения и увеличение числа малосимптомных, атипичных форм заболевания. Однако эти формы гестозов не менее опасны, чем осложнение с выраженными симптомами.
Диагноз заболевания и определение степени его тяжести должны быть основаны на оценке изменений сердечно-сосудистой системы, функции печени, почек, легких, нервной системы и состояния плода. Основной признак гестоза — гипертензивный синдром. Важны не абсолютные цифры максимального и минимального артериального давления, а повышение давления по сравнению с исходным, а также изучение его в динамике.
Особое значение имеют повышение диастолического и уменьшение пульсового давления (до 30 мм рт. ст. и ниже). Выявлена зависимость между тяжестью гестоза и степенью асимметрии артериального давления: чем выраженнее асимметрия, тем тяжелее протекает гестоз. Уже при нетяжелом течении гестоза существенно нарушается центральная гемодинамика. Снижается объем циркулирующей крови, центральное и периферическое венозное давление, уменьшается величина сердечного выброса, повышается периферическое сосудистое сопротивление, отмечаются метаболические нарушения в миокарде. Высокие показатели гематокрита (более 0,42 мг/л) свидетельствуют о тяжелой степени гестоза.
О степени тяжести гестоза можно судить по нарушению функции почек. Для определения выраженности протеинурии целесообразно исследование суточной порции мочи, так как выделение белка в течение суток может значительно варьировать. Раньше других страдает концентрационная функция почек. Параллельно нарастанию тяжести гестоза снижается суточный диурез. О нарушении азотовыделительной функции почек при гестозе судят по повышению концентрации мочевины и креатинина в крови.
Наиболее характерными признаками поражения печени является нарушение ее белково-образовательной и антитоксической функции. Количество белка в плазме крови у больных с гестозом значительно снижается, так же как и величина коллоидно-онкотического давления плазмы. Наиболее резко уменьшается содержание альбумина. Гипопротеинемия является не только следствием нарушения белково-образовательной функции печени, но и зависит от потери белка во внеклеточное пространство и выделения его с мочой за счет повышенной проницаемости сосудистой стенки.
Изменения центральной и периферической нервной системы могут возникать периодически и быстро исчезать, но в ряде случаев они носят стойкий патологический характер. Головная боль, нарушение зрения, тошнота, рвота, различной степени нарушения сознания являются признаками гипертензивной энцефалопатии.
Прогрессирующий гестоз с длительным нарушением микроциркуляции в конечном счете приводит к развитию внутричерепной гипертензии, острым нарушениям мозгового кровообращения, появлению судорожной готовности, развитию эклампсии и коматозного состояния.
У больных с тяжелыми формами гестоза наблюдаются нарушения функции дыхания, причем при эклампсии может развиться острая дыхательная недостаточность, проявляющаяся двигательным возбуждением, цианозом, одышкой, расстройством ритма дыхания.
Тромбоцитопения разной степени тяжести отмечается почти у 1/3 беременных с гестозом. Более того, тромбоцитопения может на несколько недель «опережать» другие проявления этого осложнения. Чем тяжелее гестоз, тем более выражено уменьшение количества тромбоцитов. Тромбоцитопения может отмечаться и при отсутствии выявляемых изменений в системе свертывания. Поэтому рекомендуется обязательно сделать анализ на содержание тромбоцитов в рамках общего обследования с целью оценки состояния беременных и ухода за ними в поздние сроки беременности. Степень тромбоцитопении соответствует степени риска для плода, независимо от тяжести клинического состояния больной.
Характерные для гестоза сосудистые нарушения влекут за собой ухудшение доставки кислорода и других метаболитов к тканям матери и плода. Отмечается прямая зависимость между степенью нарушения кислородного снабжения тканей, состоянием плода и тяжестью гестоза. Наблюдаются выраженные дистрофические изменения эндотелия сосудов (облитерирующий ангиит), отек и склероз стромы ворсин, а также тромбоз их сосудов и межворсинчатого пространства, ишемические нефриты, кровоизлияния в децидуальную оболочку и строму ворсин, ретроплацентарная гематома, некроз отдельных ворсин, утолщение базальной мембраны трофобласта. Одновременно в плаценте снижается содержание эстрогенных гормонов и прогестерона, что, вероятно, обусловлено ее гипоксией (при выраженной ишемии плаценты синтез прогестерона блокируется). Наряду с деструктивными поражениями в плаценте при гестозе обнаруживаются такие компенсаторно-приспособительные изменения, как гиперваскуляризация, полнокровие ворсин, пролиферация эпителия, развитие новых ворсин. Однако, несмотря на увеличение массы плаценты, в полной мере эти изменения предупредить гипоксию плода не могут.
При гестозах наблюдается активация процессов перекисного окисления липидов (ПОЛ). Продукты ПОЛ являются высокотоксичными веществами, повреждающими мембраны. Известно, что имеющаяся при гестозе гипоксия матери и плода создает благоприятные условия для так называемого оксигеназного пути утилизации кислорода. Кроме того, гестоз сопровождается снижением содержания таких эндогенных антиоксидантов, как витамины, особенно витамина Е. Поэтому в комплексную терапию гестоза целесообразно включать витамины.
Диффузионная недостаточность плаценты в основном связана с утолщением синцитикапиллярной мембраны (отек, воспалительная инфильтрация), что, безусловно, затрудняет газообмен через плаценту и существенно ухудшает ее негазообменные функции (барьерную, фильтрационно-очистительную, терморегуляционную, метаболическую, эндокринную, иммунную и др.) либо изменяет физико-химические характеристики ткани, входящей в состав плацентарной мембраны (фиброз и т. д.). Нарушения перфузии и диффузии тесно связаны друг с другом. Но существует и плацентарная перфузионно-диффузионная недостаточность с синдромом мозаичного поражения плаценты, с тромбозом и ишемией на одном участке, с геморрагией и отеком — на другом.
Важным аспектом являются показания к родоразрешению беременных с различной степенью тяжести гестоза. Длительное течение гестоза часто оказывается более неблагоприятным фактором для матери и плода, чем выраженность его клинических проявлений. При длительном течении заболевания неизбежны хроническая гипоксия, хронические нарушения периферического кровообращения с развитием синдрома ДВС. Чем тяжелее заболевание, тем менее длительным должно быть его лечение, тем раньше нужно ставить вопрос о родоразрешении. Нередко родоразрешение является основным методом лечения гестоза, а иногда и единственной возможностью спасения матери и плода.
Родоразрешение для больных с гестозом представляет дополнительную нагрузку, в связи с чем больную следует готовить к нему, применяя интенсивную терапию и тщательно оценивая ее эффективность. Нужно помнить, что родоразрешение является одним из элементов комплексной терапии и осуществляется гораздо бережнее при соответствующей подготовке.
Немедленное родоразрешение необходимо обеспечить при эклампсии, тяжелых осложнениях гестоза (эклампсическая кома, острая почечно-печеночная недостаточность, кровоизлияние в мозг, отслойка сетчатки глаза).
Срочное родоразрешение показано при отсутствии эффекта от интенсивной терапии преэклампсии в течение 4—6 ч, тяжелой нефропатии — 1-2 дней, нефропатии средней тяжести — 5—7 дней, легкой нефропатии — 12—14 дней. Дополнительным показанием к родоразрешению являются признаки фетоплацентарной недостаточности (внутриутробная гипоксия и гипотрофия плода). При необходимости родоразрешения у беременных с нефропатией и готовности организма к родам (при биологической «зрелости» шейки матки) методом выбора является родовозбуждение после амниотомии. При отсутствии родовой деятельности в течение 2-3 ч после амниотомии следует приступить к родовозбуждению путем внутривенного капельного введения окситоцина, простагландина или их сочетания. При «незрелой» шейке матки для родовозбуждения целесообразнее использовать простагландины. При невозможности вызвать роды вопрос решается в пользу абдоминального родоразрешения.
У некоторых больных с гестозом оперативное родоразрешение путем кесарева сечения наиболее целесообразно. При решении вопроса о производстве кесарева сечения у больных с тяжелыми формами гестоза следует тщательно оценивать состояние матери, плода, эффективность интенсивной терапии. Кесарево сечение целесообразно производить у женщин с тяжелой нефропатией при неподготовленных родовых путях, при отсутствии эффекта от интенсивной терапии в течение суток. Оно показано также при отсутствии эффекта от родовозбуждения у больной с тяжелой нефропатией, а также при возникновении аномалий родовой деятельности; у больной с эклампсией в родах при отсутствии условий для быстрого родоразрешения через естественные родовые пути. Кесарево сечение является методом выбора при преэклампсии, не поддающейся интенсивной терапии в течение 3-5 ч, при невозможности родоразрешения через естественные родовые пути.
Во время родов течение гестоза, как правило, усугубляется, и нетяжелая нефропатия может приобретать признаки тяжелой с сомнительным прогнозом и возможностью тяжелых осложнений. В связи с этим особого внимания заслуживают детали ведения родов у больных гестозом.
При родах необходимо проводить тщательный контроль за состоянием гемодинамики, дыхания, функции почек, печени и биохимических показателей, родовой деятельности и состоянием плода.
В случае утомления роженицы и недостаточной эффективности родовой деятельности показано применение лечебного акушерского сна.
Частью патогенетической терапии является обезболивание родов, которое должно быть тщательным и адекватным. Выбор способа обезболивания родов зависит от степени тяжести гестоза. При нефропатии I степени достаточно использование промедола в сочетании со спазмолитическими и седативными средствами. При нефропатии II-III степени методом выбора является длительная перидуральная анестезия.
Опасность возникновения эклампсии, кровоизлияния в мозг, сетчатку глаза особенно увеличиваются во втором периоде родов в связи с резко возрастающей во время потуг физической и эмоциональной нагрузкой, ведущей к повышению артериального и внутричерепного давления. Для обезболивания во втором периоде родов можно применять ингаляцию закисью азота с кислородом и пудендальную анестезию.
Применяющиеся с целью лечения гестозов седативные, аналгезирующие, ганглиоблокирующие и спазмолитические средства одновременно регулируют сократительную деятельность матки, поскольку приводят к нормализации нарушенных нейродинамических процессов в высших отделах ЦНС, являющихся одной из основных причин аномалии родовых сил. В то же время нужно помнить, что чрезмерное использование большого количества седативных и наркотических средств может стать причиной нарушения ауторегуляции с последующим ухудшением таких жизненно важных процессов, как гемодинамика, дыхание, эндокринная регуляция и др. Подобное состояние на современном этапе трудно контролировать. С целью снижения внутриматочного и внутрибрюшного давления показано раннее вскрытие плодного пузыря.
Гипотензивная терапия при родах осуществляется внутривенным введением серно-кислого магния, дибазола, спазмолитических препаратов. По мере развития родовой деятельности гипотензивную терапию следует проводить более интенсивно, поскольку артериальное давление имеет тенденцию к повышению.
При подъеме артериального давления и отсутствии эффекта от примененных ранее гипотензивных средств целесообразно использование ганглиоблокаторов под постоянным контролем артериального давления. Снижение артериального давления под воздействием ганглиоблокаторов является следствием увеличения сосудистого русла. В результате уменьшения периферического сопротивления происходит перераспределение крови в мелкие сосуды большого круга кровообращения.
Появление неврологической симптоматики (головная боль, тошнота, рвота), нечувствительность роженицы к медикаментозной терапии, признаки угрожающей асфиксии плода являются показаниями к окончанию родов с помощью акушерских щипцов или экстракции плода за тазовый конец (при мертвом плоде — плодоразрушающей операции) под наркозом. При гестозе не используют вакуум-экстракцию плода, так как она не отвечает основной цели — исключению потуг — и может привести к травматизации плода.
В настоящее время расширены показания к кесареву сечению при эклампсии. К ним относятся — отсутствие быстрого эффекта от применения комплексной интенсивной терапии у беременных и рожениц в первом периоде родов (в течение 1-2 ч), неподготовленные родовые пути у беременных даже при наличии достаточного эффекта от проведения комплексной интенсивной терапии, осложненное течение родов (нарушение сократительной деятельности матки, острая гипоксия плода и др.).
При подготовленных родовых путях и доношенной беременности возможно родовозбуждение путем амниотомии и введения окситоцина и простагландинов. Во втором периоде показано выключение потуг с помощью акушерских щипцов. При незрелом плоде решение об оптимальном времени родоразрешения беременной с эклампсией проводиться с учетом определения степени риска недоношенности и, с другой стороны, опасности продолжения беременности как для матери, так и для плода.
В последние годы тактика превентивного кесарева сечения у беременных с эклампсией пересматривается благодаря наличию методов мониторного контроля за функциональным состоянием жизненно важных органов и систем матери и плода. Установлено, что сократительная деятельность матки после перенесенных судорожных припадков у большинства женщин не нарушается, следовательно, проведение родов через естественные родовые пути на фоне вспомогательной вентиляции и комплексной интенсивной терапии возможно.
Противосудорожная и гипотензивная терапия с применением адекватной аналгезии должна продолжаться на протяжении всего родового акта. Больной необходимо находиться в положении на боку для профилактики развития синдрома нижней полой вены. Перидуральная анестезия может быть использована только при необходимости и проводиться лишь опытным анестезиологом.
В третьем периоде и сразу после родов артериальное давление часто повышается вследствие увеличения периферического сопротивления, вызванного прекращением маточно-плацентарного кровотока и аутотрансфузией крови в матке. Для предотвращения осложнений в течение первых 60 мин после родов всех больных с тяжелой формой гипертензии необходимо обследовать; величину АД и частоту сердечных сокращений следует измерять каждые 15 мин. При тенденции к артериальной гипертензии дозу гипотензивных препаратов повышают и продолжают антисудорожную терапию в течение 24 ч после родоразрешения.
С практической точки зрения опасна не степень тяжести артериальной гипертензии, а связанные с резкими колебаниями АД осложнения, которые и являются причиной смерти плода, отставания его в развитии, гипоксии, преждевременных родов, преждевременной отслойки нормально расположенной плаценты. Поэтому при выявлении стойкой гипертензии беременных госпитализируют и назначают следующее лечение:
В. Н. Кузьмин, доктор медицинских наук, профессор
МГМСУ, Москва
Что такое преэклампсия (гестоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Дубового А. А., акушера со стажем в 13 лет.
Определение болезни. Причины заболевания
Преэклампсия — это осложнение беременности, при котором из-за увеличения проницаемости стенки сосудов развиваются нарушения в виде артериальной гипертензии, сочетающейся с потерей белка с мочой (протеинурией), отеками и полиорганной недостаточностью. [1]
Сроки развития преэклампсии
Причины преэклампсии
По сути, причина преэклампсии — беременность, именно при ней возникают патологические события, в конечном счете приводящие к клинике преэклампсии. У небеременных преэклампсии не бывает.
В научной литературе описывается более 40 теорий происхождения и патогенеза преэклампсии, а это указывает на отсутствие единых взглядов на причины ее возникновения.
Факторы риска
Установлено, что преэклампсии чаще подвержены молодые и нерожавшие женщины (от 3 до 10%). [2] У беременных с планируемыми вторыми родами риск ее возникновения составляет 1,4-4%. [3]
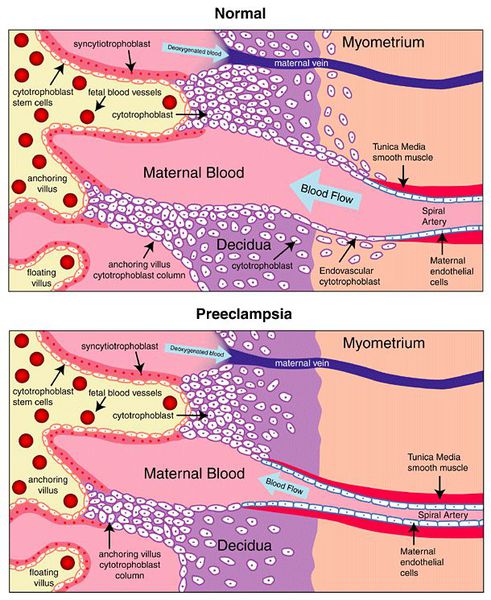
Пусковым моментом в развитии преэклампсии в современном акушерстве считается нарушение плацентации. Если беременность протекает нормально, с 7 по 16 неделю эндотелий (внутренняя оболочка сосуда), внутренний эластичный слой и мышечные пластинки участка спиральных артерий, вытесняется трофобластом и фибриносодержащим аморфным матриксом (составляющие предшественника плаценты — хориона). Из-за этого понижается давление в сосудистом русле и создается дополнительный приток крови для обеспечения потребностей плода и плаценты. Преэклампсия связана с отсутствием или неполным вторжением трофобласта в область спиральных артерий, что приводит к сохранению участков сосудистой стенки, имеющей нормальное строение. В дальнейшем воздействие на эти сосуды веществ, вызывающих вазоспазм, ведет к сужению их просвета до 40% от нормы и последующему развитию плацентарной ишемии. При нормальном течении беременности до 96% из 100-150 спиральных артерий матки претерпевают физиологические изменения, при преэклампсии же — всего 10%. Исследования подтверждают, что наружный диаметр спиральных артерий при патологической плацентации вдвое меньше, чем должно быть в норме. [4] [5]
Симптомы преэклампсии
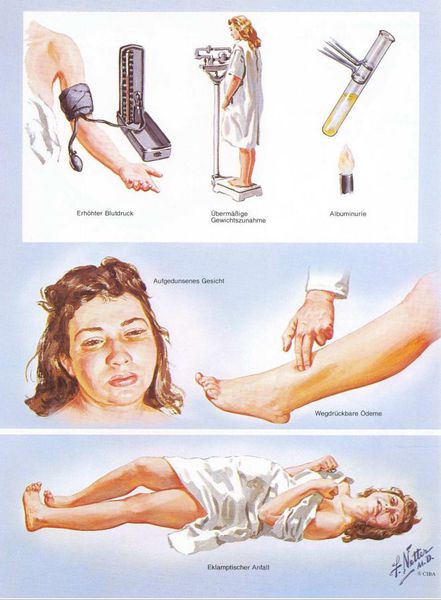
Раньше в отечественном акушерстве то, что сейчас называется термином «преэклампсия», называлось «поздний гестоз», а непосредственно под преэклампсией при беременности понимали тяжелую степень позднего гестоза. Сегодня в большинстве регионов России перешли на классификацию, принятую ВОЗ. Ранее говорили о так называемом ОПГ-гестозе (отеки, протеинурия и гипертензия).
1. Артериальная гипертензия
Преэклампсия характеризуется систолическим АД>140 мм рт. ст. и/или диастолическим АД>90 мм рт. ст., измеряется дважды с интервалом 6 часов. По меньшей мере два повышенных значения АД являются основанием для диагностики АГ во время беременности. Если есть сомнения, рекомендуется провести суточное мониторирование АД (СМАД).
2. Протеинурия
Чтобы диагностировать протеинурию, необходимо выявить количественное определение белка в суточной порции (в норме при беременности — 0,3 г/л). Клинически значимая протеинурия во время беременности определена как наличие белка в моче ≥ 0,3 г/л в суточной пробе (24 часа) либо в двух пробах, взятых с интервалом в 6 часов; при использовании тест-полоски (белок в моче) — показатель ≥ «1+».
Умеренная протеинурия — это уровень белка > 0,3 г/24 часа или > 0,3 г/л, определяемый в двух порциях мочи, взятой с интервалом в 6 часов, или значение «1+» по тест-полоске.
Выраженная протеинурия — это уровень белка > 5 г/24 часа или > 3 г/л в двух порциях мочи, взятой с интервалом в 6 часов, или значение «3+» по тест-полоске.
Чтобы оценить истинный уровень протеинурии, нужно исключить наличие инфекции мочевыделительной системы, а патологическая протеинурия у беременных является первым признаком полиорганных поражений. [1]
3. Отечный синдром
Триада признаков преэклампсии, описанная Вильгельмом Цангемейстером в 1912 г. (ОПГ-гестоз), сегодня встречается лишь в 25-39%. Наличие отеков в современном акушерстве не считается диагностическим критерием преэклампсии, но важно, когда нужно оценить степень ее тяжести. Когда беременность протекает нормально, отеки встречаются в 50-80% случаев, амбулаторное ведение безопасно для лёгкого отечного симптома. Однако генерализованные, рецидивирующие отеки зачастую являются признаком сочетанной преэклампсии (нередко на фоне патологии почек). [6]
Американский врач-хирург и художник-иллюстратор Фрэнк Генри Неттер, которого справедливо прозвали «Микеланджело медицины», очень наглядно изобразил основные проявления преэклампсии. [7]
Патогенез преэклампсии
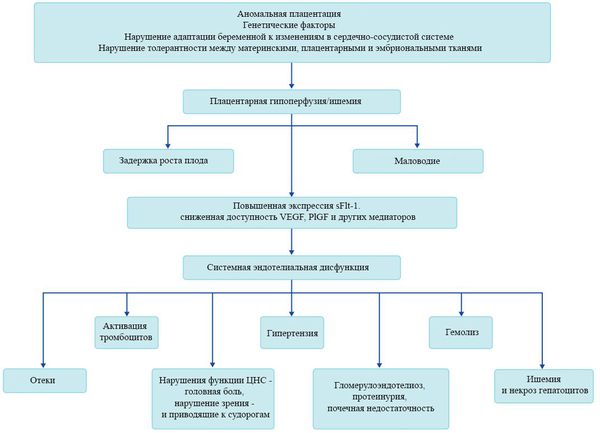
В ответ на ишемию при нарушении имплантации (см. рисунок) начинают активно вырабатываться плацентарные, в том числе антиангиогенные факторы и медиаторы воспаления, повреждающие клетки эндотелия. [8] Когда компенсаторные механизмы кровообращения на исходе, плацента с помощью прессорных агентов активно «подстраивает» под себя артериальное давление беременной, при этом временно усиливая кровообращение. В итоге этого конфликта возникает дисфункция эндотелия. [9]
При развитии плацентарной ишемии активируется большое количество механизмов, ведущих к повреждению эндотелиальных клеток во всем организме, если процесс генерализуется. В результате системной эндотелиальной дисфункции нарушаются функции жизненно важных органов и систем, и в итоге мы имеем клинические проявления преэклампсии.
Нарушение плацентарной перфузии из-за патологии плаценты и спазма сосудов повышает риск гибели плода, задержки внутриутробного развития, рождения детей малых для срока и перинатальной смертности. [10] Кроме того, состояние матери нередко становится причиной прерывания беременности на раннем этапе — именно поэтому дети, родившиеся от матерей с преэклампсией, имеют более высокий показатель заболеваемости респираторным дистресс-синдромом. Отслойка плаценты очень распространена среди больных преэклампсией и связана с высокой перинатальной смертностью.
Классификация и стадии развития преэклампсии
В Международной классификации болезней (МКБ-10) преэкслампсия кодируется как О14. Выделяют умеренную и тяжёлую форму заболевания.
Эклампсия – состояние, при котором в клинических проявлениях преэклампсии преобладают поражения головного мозга, сопровождаемые судорожным синдромом, который не может быть объяснен другими причинами, и следующим после него периодом разрешения. Эклампсия может развиться на фоне преэклампсии любой степени тяжести, а не является проявлением максимальной тяжести преэклампсии.
Осложнения преэклампсии
Основные осложнения при преэклампсии у беременных:
Диагностика преэклампсии
Диагностика преэклампсии заключается прежде всего в установлении наличия указанных выше симптомов. В ряде случаев представляет сложность дифференциальная диагностика преэклампсии и существовавшая до беременности артериальная гипертензия.
Дифференциальная диагностика гипертензивных осложнений беременности
| Клинические признаки | Хроническая гипертензия | Преэклампсия |
|---|---|---|
| Возраст | часто возрастные (более 30 лет) | часто молодые ( [1] |
2. Антигипертензивная терапия
Цель лечения — поддерживать АД в пределах, которые сохраняют на нормальном уровне показатели маточно-плодового кровотока и снижают риск развития эклампсии.
Антигипертензивную терапию следует проводить, постоянно контролируя состояние плода, потому что снижение плацентарного кровотока провоцирует у него прогрессирование функциональных нарушений. Критерием начала антигипертензивной терапии является АД ≥ 140/90 мм рт. ст.
Основные лекарственные средства, используемые для лечения АГ в период беременности:
3. Профилактика и лечение судорог
Для профилактики и лечения судорог основным препаратом является сульфат магния (MgSO4). Показанием для противосудорожной профилактики является тяжелая преэклампсия, если есть риск развития эклампсии. При умеренной преэклампсии — в отдельных случаях решает консилиум, потому что при этом повышается риск кесарева сечения и есть ряд побочных эффектов. Механизм действия магния объясняется нарушением тока ионов кальция в гладкомышечную клетку.
Кроме того, необходимо контролировать водный баланс, уделять внимание лечению олигурии и отека легких при их возникновении, нормализации функции ЦНС, реологических свойств крови, улучшение плодового кровотока.
Прогноз. Профилактика
Сегодня до 64% смертей от преэклампсии предотвратимы.
Основные факторы качественной и своевременной помощи:
К сожалению, сегодня нет достаточно чувствительных и специфичных тестов, которые бы обеспечивали раннюю диагностику/выявление риска развития преэклампсии.
Факторы риска развития преэклампсии: [2]
1. антифосфолипидный синдром;
2. заболевания почек;
3. преэклампсия в анамнезе;
4. предстоящие первые роды;
5. хроническая гипертензия;
7. жительницы высокогорных районов;
8. многоплодная беременность;
9. сердечно-сосудистые заболевания в семье (инсульты/инфаркты у близких родственников);
10. системные заболевания;
12. преэклампсия в анамнезе у матери пациентки;
13. возраст 40 лет и старше;
14. прибавка массы тела при беременности свыше 16 кг.
Установлено, что для преэклампсии характерен недостаточный ангиогенез — процесс образования сосудов. [11] В нем участвуют около 20 стимулирующих и 30 ингибирующих ангиогенез факторов, их список постоянно пополняется. Наиболее изучен и представляют особый интерес с точки зрения исследования патогенеза преэклампсии два проангиогенных фактора: сосудисто-эндотелиальный фактор роста (VEGF) и плацентарный фактор роста (PlGF), антиангиогенный фактор — Fms-подобная тирозинкиназа (Flt-1) и ее растворимая форма (sFlt-1).
Повышение содержания этого sFlt-1 с одновременным снижением VEGF и PlGF начинается за 5-6 недель до клинических проявлений преэклампсии. [12] Данный факт позволяет прогнозировать развитие преэклампсии у женщин из группы риска в первом триместре беременности. Однако другими исследователями отмечено, что несмотря на высокую чувствительность теста (96%), изолированное определение sFlt-1 не может быть использовано при диагностике преэклампсии из-за низкой специфичности. Таким образом, обнаружение изменений в соотношении уровня PlGF и sFlt-1 в течение беременности может сыграть важную вспомогательную роль для подтверждения диагноза преэклампсии.
Сегодня существуют коммерческие наборы, которые позволяют проводить иммуноферментное исследование, чтобы определить вероятность развития преэклампсии, на основании определения содержания PlGF (DELFIA Xpress PlGF kit, PerkinElmer; США), предложены скрининговые тесты для прогнозирования и ранней диагностики преэклампсии, основанные на определении соотношения sFlt-1 и PlGF (Elecsys sFlt-1/PlGF, Roche, Швейцария).
Из-за нарушения инвазии трофобласта увеличивается сосудистое сопротивление в маточной артерии и снижается перфузия плаценты. Повышение пульсационного индекса и систолодиастолического отношения в маточной артерии в 11-13 недель беременности является лучшим предиктором преэклампсии, и его настоятельно рекомендуется использовать в клинической практике у беременных из группы риска.
Профилактика преэклампсии
Из-за того, что исчерпывающая информация об этиологии и патофизиологии преэклампсии отсутствует, разработка эффективных профилактических мер представляет определенные трудности.
Сегодня доказан прием только 2 групп препаратов для профилактики преэклампсии: [1] [2]
• Аспирин в низких дозах (75 мг в день), начиная с 12 недель до родоразрешения. При этом необходимо брать письменное информированное согласие пациентки, поскольку согласно инструкции по применению, прием аспирина противопоказан в первом триместре.
• Беременным с низким потреблением кальция (