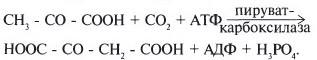первичная структура мрнк кодирует только одну последовательность аминокислот в белке можно ли исходя
ответы на вопросы по биохимии: 5. Репликация, ее механизм и биологическое значение. Повреждение и репарация ДНК 12. Первичная структура мРНК кодирует только одну последовательность аминокислот в белке. Можно ли, исходя из строения белкового гормона глюкагона (29 аминокислот), предсказать нуклеотидную последовательность мРНК, кодирующую белок? Для объяснения ответа вспомните свойства генетического года и, используя N-концевой участок гормона H2N-Гис-Сер- Гли- …., объясните способ кодирования белков в молекулах ДНК и РНК. 26. Больной жалуется на сильные боли в правом подреберье. Отмечается желту
Важно! При покупке готовой работы
сообщайте Администратору код работы:
Соглашение
* Готовая работа (дипломная, контрольная, курсовая, реферат, отчет по практике) – это выполненная ранее на заказ для другого студента и успешно защищенная работа. Как правило, в нее внесены все необходимые коррективы.
* В разделе «Готовые Работы» размещены только работы, сделанные нашими Авторами.
* Всем нашим Клиентам работы выдаются в электронном варианте.
* Работы, купленные в этом разделе, не дорабатываются и деньги за них не возвращаются.
* Работа продается целиком; отдельные задачи или главы из работы не вычленяются.
С условиями соглашения согласен (согласна)
Цена: 400 р. Купить эту работу
Содержание
5. Репликация, ее механизм и биологическое значение. Повреждение и репарация ДНК
12. Первичная структура мРНК кодирует только одну последовательность аминокислот в белке. Можно ли, исходя из строения белкового гормона глюкагона (29 аминокислот), предсказать нуклеотидную последовательность мРНК, кодирующую белок? Для объяснения ответа вспомните свойства генетического года и, используя N-концевой участок гормона H2N-Гис-Сер- Гли- …., объясните способ кодирования белков в молекулах ДНК и РНК.
41. Пиридоксин – витамин В6 (активные формы, участие в биохимических процессах, недостаточность алиментарная, врожденные нарушения).
55. Соматотропин. Регуляция синтеза и секреции, механизмы действия, эффекты.
66. Биологическая роль кальция и фосфора. Регуляция фосфорно-кальциевого обмена паратгормоном, тиреокальцитонином и витамином Д. Рахит.
70. Понятие о лекарствах как чужеродных соединениях. Всасывание лекарст- венных веществ. Распределение и выведение лекарственных веществ из ор- ганизма.
85. Два больных сахарным диабетом в бессознательном состоянии доставлены в клинику. После инъекции глюкозы один их них пришел в сознание, другой остался без сознания. Какие причины вызвали потерю сознания у этих больных? Что нужно сделать, чтобы привести в сознание второго больного?
Цена: 400 р. Купить эту работу
Последовательность аминокислот в белке
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Многообразие форм жизни объясняется разнообразием белковых молекул, которые наделены особыми биологическими функциями. Структуру белка определяет состав аминокислот и последовательность их расположения в пептидных цепях. Состав и последовательность аминокислот в цепи пептида закодированы в ДНК посредством генетического кода.
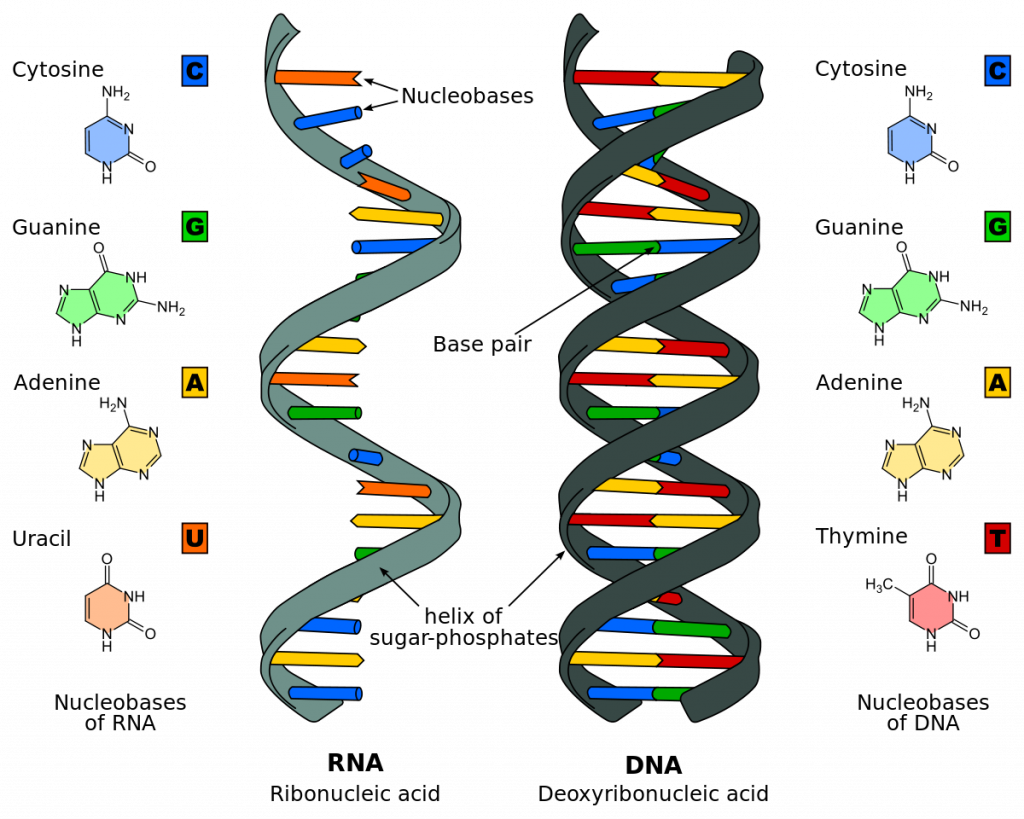
Внимание! Генетический код – это всеобщая система записи наследственной информации в виде последовательности нуклеотидов в молекулах ДНК либо мРНК, которая определяет порядок расположения аминокислот в структуре белка.
Связь между ДНК, РНК и белком
Белок, ДНК и РНК – это единая система, которая определяет специфичность организма и передает наследственные признаки. Каждый белок имеет строго определенную последовательность аминокислот в пептидной цепи и конкретную пространственную структуру. Последовательность аминокислот в белковой цепи соответствует первичной структуре. Всего их 4 – первичная, вторичная, третичная и четвертичная.
В организме свободную аминокислоту активирует фермент. тРНК (транспортная) переносит ее от фермента к иРНК (информационная). иРНК и рРНК (рибосомальная) отвечают за синтез из аминокислот белка со строго заданной ДНК последовательностью. Для каждой аминокислоты в клетке предусмотрены собственные ферменты и тРНК.
Как пишется и определяется аминокислотная последовательность
Аминокислотная последовательность – это цепочка аминокислот в молекуле пептида либо белка. Она записывается с N-конца со свободной аминогруппой к C-концу со свободной карбоксильной группой.
Пептидная последовательность иногда называют белковой. Это первичная структура всех белков в момент синтеза. Посредством посттрансляционных модификаций первичная структура видоизменяется, образуя зрелый белок.
Аминокислотная последовательность проистекает из последовательности мРНК. А она определяется в результате транскрипции гена, в котором нуклеотидный порядок в кодирующей последовательности определяет итоговый белок.
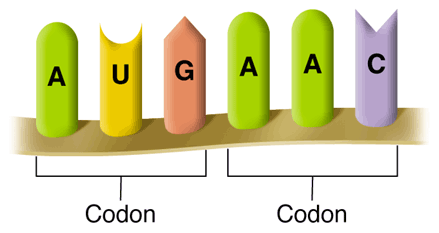
Три нуклеотида образуют кодон, определяющий аминокислоту. Каждая группа из трех нуклеотидных оснований ДНК является кодом для аминокислоты. Так, нуклеотидная последовательность ДНК CTG кодирует лейцин.
Всего существует 64 вероятных кодона для определения 20 аминокислот. В результате уникальная последовательность аминокислот образует уникальный белок.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Первичная структура мрнк кодирует только одну последовательность аминокислот в белке можно ли исходя
1. Трансляция матричной РНК.
Определите аминокислотные последовательности пептидов, синтезируемых рибосомами на основе последовательностей мРНК, при условии, что рамка считывания начинается с первых трех оснований в каждой последовательности.
2. Скольким разным последовательностям мРНК может соответствовать одна аминокислотная последовательность?
Напишите все возможные последовательности мРНК, кодирующие трипептид Lеu-Меt:-Туr. На основании вашего ответа вы сможете оценить, сколько вариантов мРНК могут кодировать один полипептид.
3. Можно ли предсказать последовательность мРНК исходя из аминокислотной последовательности ее полипептидного продукта?
Определенная последовательность оснований мРНК будет кодировать одну и только одну последовательность аминокислот в полипептиде, если определена рамка считывания. Можно ли, исходя из определенной последовательности остатков аминокислот в белке, например, цитохроме с, предсказать последовательность оснований в единственной мРНК, кодирующей этот белок? Ответ обоснуйте.
4. Кодирование полипептида ДНК-дуплексом.
Матричная цепь участка ДНК-дуплекса содержит последовательность
(5′) CTTAACACCCCTGACTTCGCGCCGTCG (3′)
а) Какая последовательность оснований мРНК может транскрибироваться с этой цепи?
б) Какая аминокислотная последовательность может кодироваться молекулой мРНК, определенной вами в пункте (а) (начиная с 5′-конца)?
в) Если комплементарная (нематричная) цепь этой ДНК транскрибируется и транслируется, будет ли образуемая аминокислотная последовательность такой же, как в (б)? Объясните биологическое значение своего ответа.
5. Метионину соответствует только один кодон.
Метионин — одна из двух аминокислот, которым соответствует только по одному кодону. Как единственный кодон для метионина может кодировать и первый аминокислотный остаток, и внутренние остатки метионина в пептидах, синтезируемых клетками Е. coli.
6. Синтетические молекулы мРНК.
Генетический код был расшифрован благодаря полирибонуклеотидам, синтезированным в лаборатории ферментативным или химическим путем. Учитывая современные знания о генетическом коде, как бы вы синтезировали полирибонуклеотид, который мог бы служить в качестве мРНК, кодирующий большое количество остатков Phe и немного остатков Leu и Ser? Какие еще аминокислоты кодировал бы этот полирибонуклеотид, но в еще меньшем количестве?
7. Энергетическая стоимость биосинтеза белка.
Определите минимальную энергетическую стоимость (в эквивалентах АТР) биосинтеза β-цепи гемоглобина (146 остатков) при наличии всех необходимых аминокислот, АТР и GTP. Сравните результат с энергетическими затратами на биосинтез линейной цепи гликогена из 146 остатков глюкозы, связанных α1 —> 4-связью, при наличии глюкозы, UTP и АТР (см. гл. 15 в т. 2). Исходя из полученного результата оцените дополнительные энергетические затраты на образование пептида, в котором все остатки выстраиваются в определенной последовательности, по сравнению с затратой энергии на синтез полисахарида, содержащего то же количество остатков, но не несущего информационного содержания?
Помимо прямой затраты энергии на синтез белка, есть и косвенные затраты — на производство ферментов, необходимых для синтеза белка. Сравните уровень косвенных затрат эукариотической клетки на биосинтез линейных (α1 —> 4) цепей гликогена и на биосинтез полипептидов с учетом количества участвующих ферментов.
8. Зная кодоны, определите антикодоны.
Большинство аминокислот кодируется несколькими кодонами и связывается с несколькими тРНК — каждая со своим антикодоном. Напишите все возможные антикодоны для четырех кодонов глицина: (5’) GGU, GGC, GGA и GGG.
а) На основании своего ответа определите, какие положения в антикодонах наиболее важны для определения соответствующих кодонов в случае глицина?
б) Какие основания кодона и антикодона образуют «качающиеся» пары?
в) В каких парах кодон/антикодон все три позиции связаны уотсон-криковскими водородными связями?
9. Влияние однонуклеотидной замены на аминокислотную последовательность белка.
Многие важные подтверждения генетического кода были получены путем анализа изменений аминокислотной последовательности мутантных белков после замены единственного основания в генах этих белков. Какие из следующих аминокислотных замен могут быть вызваны заменой одного основания? Какие изменения не могут быть вызваны заменой одного основания? Почему?
а) Phe —> Leu д) Ile —> Leu
б) Lys —> Ala е) His —> Glu
в) Ala —> Thr ж) Pro —> Ser
10. Причина серповидноклеточной мутации.
Гемоглобин серповидных эритроцитов содержит остаток Val в положении 6β-цепи вместо остатка Glu, содержащегося в нормальном гемоглобине А. Какое изменение произошло в кодоне для глутамата, в результате которого остаток Glu был заменен на Val?
11. Корректирующая функция аминоацил- тРНК-синтетаз.
Изолейцил-тРНК-синтетаза имеет корректирующую активность, которая обеспечивает точность аминоацилирования, а гистидил-тРНК-синтетаза такой активности не имеет. Объясните этот факт.
12. Значение «второго генетического кода».
Некоторые аминоацил-тРНК-синтетазы не распознают и не связывают антикодон соответствующих тРНК, и специфичность их связывания основана на распознавании других элементов молекул тРНК. По-видимому, к этой категории относятся тРНК для аланина.
а) Какие элементы тРНКAl а распознаются Аlа-тРНК-синтетазой?
в) Какие другие типы мутаций могут оказывать аналогичное действие?
г) Мутации такого типа не были обнаружены в естественных популяциях организмов. Почему? Подсказка. Подумайте, что может произойти с отдельными белками и с организмом в целом.
13. Точность синтеза белка.
Химические механизмы, обеспечивающие точность синтеза белка, отличаются от механизмов, обеспечивающих точность репликации ДНК. ДНК-полимеразы имеют корректирующую 3′ —> 5′-экзонуклеазную активность, позволяющую удалить аномально встроенные основания из растущей цепи ДНК. У рибосом нет аналогичной корректирующей функции, и присоединяющиеся с помощью тРНК аминокислоты никогда не идентифицируются. Гидролиз пептидной связи уже после того, как неправильная аминокислота встроилась в растущий полипептид (по аналогии с этапом коррекции последовательности ДНК- полимеразами), оказался бы невыгодным. Почему? Подсказка. Вспомните, как в процессе элонгации поддерживается связь между растущим полипептидом и мРНК. См. рис. 27-20 и 27-30.
14. Предсказание клеточной локализации белка.
Ген эукариотического полипептида из 300 аминокислотных остатков изменен таким образом, что распознаваемая SRP сигнальная последовательность находится на N-конце полипептида, а сигнал ядерной локализации (NLS) находится внутри, начиная с позиции 150. В каком отделе клетки может оказаться этот белок?
15. Что требуется для переноса белка через мембрану?
У секретируемого бактериального белка ОmрА есть предшественник, ProOmpA, который содержит необходимую для секреции N-концевую сигнальную последовательность. Если денатурировать очищенный ProOmpA с помощью 8 М мочевины и затем мочевину удалить (например, быстро пропустить раствор белка через колонку для гель-фильтрации), белок переносится через выделенные внутренние бактериальные мембраны in vitro. Однако транслокация не происходит, если ProOmpA предварительно инкубировать несколько часов в отсутствие мочевины. Кроме того, способность к транслокации сохраняется дольше, если ProOmpA предварительно инкубировать в присутствии другого бактериального белка, называемого триггерным фактором. Опишите возможную функцию этого фактора.
16. Способность вирусной ДНК кодировать белок.
Геном бактериофага φХ 174, состоящий из 5386 п. н., содержит 10 белков, обозначаемых от А до К, их размеры приведены ниже в таблице. Сколько ДНК нужно для кодирования этих 10 белков? Как соотносится размер генома φХ174 с объемом его кодирующих последовательностей?
Количество остатков аминокислот
Количество остатков аминокислот
Анализ экспериментальных данных
17. Конструирование белков на основании случайных последовательностей генов.
Изучение аминокислотных последовательностей и соответствующих трехмерных структур природных и мутантных белков позволило многое узнать о тех закономерностях, которые лежат в основе сворачивания белков. Для тестирования полученной информации полезно было сконструировать белок на основании этих закономерностей и проверить, соответствует ли его трехмерная структура предсказанной структуре.
Камтекар с коллегами (1993) использовали знание генетического кода для конструирования случайных белковых последовательностей с определенным расположением гидрофильных и гидрофобных остатков. Их подход к изучению факторов, определяющих трехмерную структуру белка, был основан на знании свойств аминокислот и генетического кода.
Исследователи сконструировали ряд белков с простой структурой, состоящей из четырех α-спиралей (см, ниже, справа; α-спирали изображены в виде цилиндров), соединенных участками с неупорядоченной спиральной структурой (розовые). Каждая α-спираль обладала амфифильными свойствами: на одной стороне спирали R-группы были только гидрофобными (желтые), а на другой стороне только гидрофильными (голубые). Предполагалось, что белок, состоящий из четырех таких спиралей, соединенных нерегулярными спиральными последовательностями, образует трехмерную структуру, в которой гидрофильные поверхности спиралей обращены в сторону раствора.
а) Какие силы или взаимодействия удерживают вместе четыре α-спирали в данном пучке?
На рис. 4-4, а (т. 1) представлен участок α-спирали, состоящий из 10 аминокислотных остатков.
б) Пронумеруйте R-группы на рис. 4-4, а сверху (N-конец; 1) вниз (С-конец; 10). R-группы с какими номерами выступают слева, а какие справа?
в) Предположим, вам нужно сконструировать участок амфифильной спирали из 10 аминокислотных остатков, в котором слева были бы расположены гидрофильные остатки, а справа — гидрофобные. Предложите последовательность из 10 аминокислот, которые могли бы образовать такую спираль. Учтите, что правильных ответов на этот вопрос может быть несколько.
г) Приведите пример последовательности двухцепочечной ДНК, которая могла бы кодировать аминокислотную последовательность, предложенную вами в ответе на вопрос (в). (Это внутренняя последовательность, так что нет необходимости вводить в нее стартовый кодон и стоп-кодон.)
Камтекар с коллегами синтезировали белки не с определенной последовательностью, а с почти случайной последовательностью, в которой в определенных позициях находились гидрофобные и гидрофильные аминокислотные остатки. Для этой цели ученые воспользовались интересными особенностями генетического кода, что позволило им создать библиотеку искусственных молекул ДНК с почти случайными последовательностями, выстроенными определенным образом.
Для создания последовательности ДНК, которая кодировала бы случайную последовательность гидрофобных аминокислотных остатков, исследователи начали с вырожденного кодона NТN, в котором N может означать А, G, С или Т. Для синтеза молекул ДНК с различными нуклеотидами в позиции N они использовали эквимолярную смесь оснований А, G, С и Т (см. рис. 8-35 вт. 1). Аналогичным образом, для создания случайной последовательности полярных аминокислот они начали с вырожденного кодона NAN и использовали для синтеза эквимолярную смесь А, G и С (в этом случае без Т).
д) Какие аминокислоты может кодировать триплет NTN? Все ли аминокислоты из этого набора гидрофобные? Входят ли в этот набор все гидрофобные аминокислоты?
е) Какие аминокислоты может кодировать триплет NAN? Все ли они полярные? Входят ли в этот набор все полярные аминокислоты?
ж) Почему при синтезе кодонов NAN реакционная смесь не должна содержать основание Т?
Камтекар с коллегами клонировали библиотеку случайных последовательностей ДНК на плазмидах, отобрали 48 вариантов с правильным расположением гидрофильных и гидрофобных аминокислотных остатков и экспрессировали их в клетках Е. coli. Далее предстояло определить, соответствует ли укладка белков предсказанной структуре. Экспрессировать и кристаллизовать каждый белок, а затем определять его трехмерную структуру было бы слишком трудоемким делом. Вместо этого исследователи использовали процессинг в клетках Е. coli для отсева наиболее дефектных вариантов белков. После этого первичного скрининга они сохранили лишь те клоны, в которых по данным SDS-электрофореза в полиакриламидном геле была белковая полоса с ожидаемой молекулярной массой (см. рис. 3-18 в т. 1).
з) Почему белки с очень сильными нарушениями структуры не образуют при электрофорезе полосу с ожидаемой молекулярной массой?
Этот первичный тест прошли несколько белков, и дальнейшие исследования показали, что они имели предсказанную структуру из четырех спиралей.
и) Почему не все белки со случайной последовательностью, прошедшие первичный скрининг, могли образовывать структуру из четырех спиралей?
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2021 Все права на дизайн сайта принадлежат С.Є.А.
Otvety_na_ekzamenatsionnye_zadachi_iz_zadachnika (2)
№ 4.6 У больного с повышенной концентрацией фенилаланина (Фен) в крови установлена нормальная структура фермента фенилаланингидроксилазы. Дальнейшее обследование позволило выявить мутацию по типу замены нуклеотида в гене фермента дигидробиоптеринредуктазы. Объясните, почему мутация по типу замены нуклеотида в гене этого фермента может стать причиной фенилкетонурии. Для этого:
а) Напишите реакцию метаболизма Фен, которая идет при участии дигидробиоптеринредуктазы
Фенилкетонурия – наследственное заболевание, связанное с нарушением фермента фенилаланилгидроксилазы (классическая фенилкетонурия) или с нарушением перехода H4БП ↔ H2БП (вариантная фенилкетонурия)
Регенерация H2БП происходит при участии дигидробиоптеринредуктазы с использованием NADPH + H +
№ 4.7 В яйцеклетке в смысловой части гена, кодирующего строение фермента диоксигеназы гомогентизиновой кислоты, произошла замена 7-го нуклеотида с образованием терминирующего кодона. Какие изменения в структуре фермента произойдут в ходе трансляции мутантного белка? Для ответа на этот вопрос:
а) Изобразите схему синтеза белка на рибосоме и покажите, какой продукт будет образовываться в ходе трансляции мутантной мРНК
б) Вспомните, в каком процессе участвует диоксигеназа гомогентизиновой кислоты и к каким фенотипическим проявлениям приведет эта мутация.
Синтезируется неактивный фермент.
б) Метаболизм тирозина в печени.
Проявления – заболевание алкаптонурия.
Строение мРНК мы представить не сможем, так как генетический код вырожден.
Свойства генетического кода:
№ 4.9 В химиотерапии опухолей широко используется антибиотик дауномицин, который внедряется между основаниями ДНК, и аналог фолиевой кислоты – метотрексат. Активность каких процессов снижается при использовании этих препаратов? При ответе на этот вопрос:
а) Укажите различие в механизме действия этих препаратов на синтез ДНК
а) Дауномицин – интеркалирует между парами оснований ДНК и нарушает репликацию и транскрипцию опухолевых клеток, нарушает биосинтез белка, клетка гибнет.
Метотрексат – ингибирует дигидрофолатредуктазу, превращающую дигидрофолиевую кислоту, подавляет синтез ДНК. Наиболее чувствительны клетки опухолей, костного мозга эмбриона и слизистых оболочек полости рта, кишечника.
Эти одноуглеродные ферменты используются:
2. В синтезе пуриновых оснований – А, Г
3. В синтезе пиримидиновой кислоты (пиримидинов)
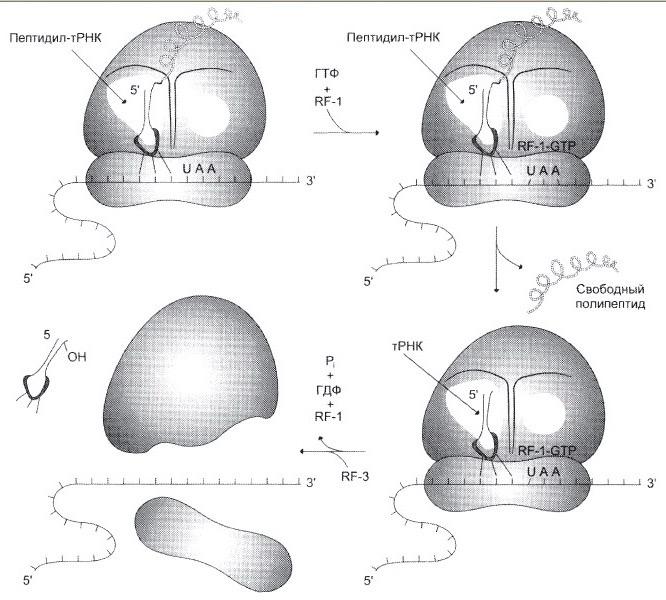
№ 4.10 Основные симптомы бактериальных заболеваний вызваны действием токсинов и белков, продуцируемых микроорганизмами. Так, дифтерийный токсин вызывает АДФ—рибозилирование фактора элонгации (EF2) в эукариотических клетках и нарушает синтез белка. На какой стадии роста полипептидной цепи участвует EF2? Для ответа на этот вопрос:
а) Представьте схему событий на рибосоме и отметьте стадию, на которой произойдет остановка белкового синтеза
EF2 участвует на стадии элонгации.
Остановится на стадии элонгации, так как дифтерийный токсин вызывает АДФ-рибозилирование фактора элонгации (EF2)
Терминация – процесс, когда в A-центр попадает стоп-кодон UGA, UAG, UAA
EF2 участвует на стадии транслокации.
Остановка произойдёт на стадии транслокации.
б) После воздействия токсина возможна остановка синтеза белка, гибель клетки и некроз ткани
а) Назовите матричный процесс, который ускоряется первично при действии гормона
а) Альдостерон увеличивает скорость транскрипции
№ 4.12 Действие стероидного гормона кортизола на печени приводит к увеличению количества ключевых ферментов, участвующих в синтезе глюкозы. Какой матричный процесс кортизола индуцирует первично? Отвечая на поставленный вопрос:
а) Изобразите схему и напишите суммарное уравнение этого процесса
б) Укажите, каким модификациям подвергается вновь синтезированная нуклеиновая кислота, чтобы служить матрицей для последующего синтеза белков.
а) Транскрипция увеличивается при действии кортизола.
mАТФ + nУТФ + kЦТФ + l ГТФ → РНК + (m+n+k+l)H4P2O7
б) Посттранскрипционные модификации – сплайсинг.
№ 4.13 Весь набор ферментов, участвующих в синтезе мочевины, присутствует только в клетках печени и его нет в клетках других органов. Как можно объяснить эти различия в белковом составе органов и тканей? При ответе на этот вопрос:
а) Вспомните механизмы, с помощью которых формируются транскрипционно неактивные участки хроматина
б) Объясните, когда в хроматине клеток возникают зоны стойкой репрессии и существует ли различная в них локализации в разных тканях
а) Факторы, обеспечивающие формирование зон стойкой репрессии:
1. Фермент ДНК-метилаза (метилирование азотистых оснований).
2. Связывание с гистонами и образование нуклеосом
3. Негистоновые белки (+)
Набор генов во всех клетках организма одинаков, а зоны стойкой репрессии затрагивают разные участки генома – в результате ткани по-разному дифференцированы.
У эукариот регуляции транскрипции осуществляется с помощью энхансеров (белки-активаторы) и сайленсеров (белки-репрессоры).
Гетерохроматин находится в высококонденсированном состоянии.
а) Используя таблицу генетического кода, укажите, какие изменения в кодоне гена этого фермента привели к появлению указанных вариантов
б) Объясните, что такое полиморфизм белков и каковы причины его возникновения
мРНК GAU GAC AAU AAC
ДНК CTA CTG TTA TTG
Мутация по типу замены нуклеотида
б) Полиморфизм белков – это устойчивое существование в популяции нескольких вариантов одного и того же белка, которые возникли в результате мутаций и рекомбинаций в копиях одного и того же гена.
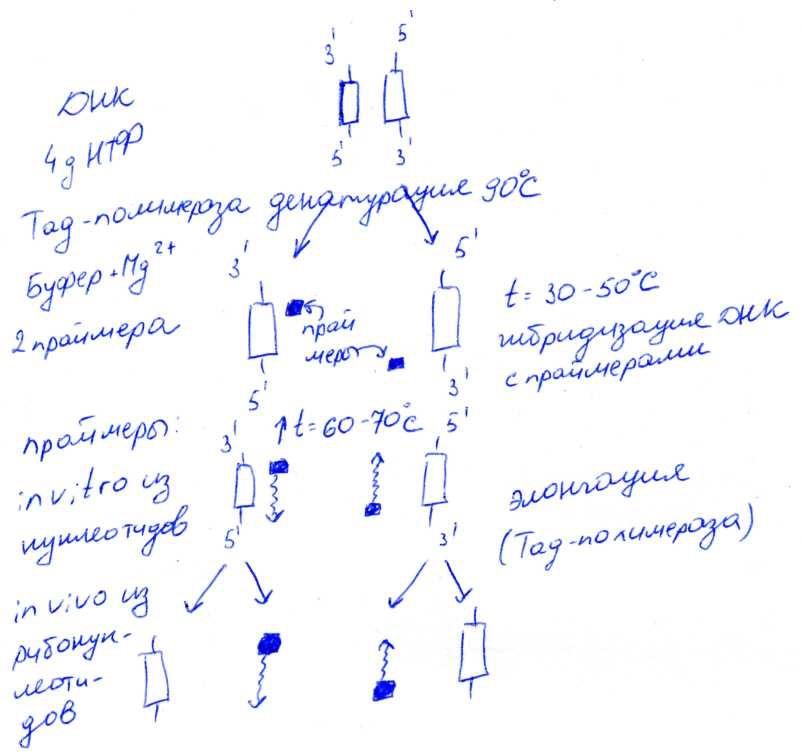
№ 4.15 Результаты генетического обследования семьи (методом ПЦР), в которой являются носителями гена серповидно—клеточной анемии, представлены на рис. На основании полученных результатов объясните, кто из детей этой большой семьи здоров, болен, является носителем гена серповидно—клеточной анемии. Укажите, на чем основан принцип метода, каковы необходимые компоненты и условия проведения ПЦР.
ПЦР – полимеразная цепная реакция
Полученный материал подвергается фракциванию методом электрофорез в агазорном или полиакриламидном геле.
1. Идентифицировать вирусную и бактериальную ДНК в составе ДНК человека
2. Проводить пренатальную диагностику наследственных заболеваний
3. Выявить гетерозиготных носителей дефектных генов
4. Определить точную локализацию генов в ДНК человека
5. Идентифицировать дефектные гены, нарушающие регуляцию пролиферации клеток и вызывающие развитие опухолевых заболеваний
6. Проводить анализ препаратов, содержащих сильно деградированную ДНК
Ребёнок 1 болен серповидно-клеточной анемией
Ребёнок 3 является носителем (гетерозиготен)
Ребёнок 4 является носителем (гетерозиготен)
№ 4.16 В ходе проверки семьи на носительство гена HbS методом ПЦР студент, проведя электрофорез, получил результаты, представленные на рис. Какие выводы должен сделать студент на основе результатов анализа? В ходе ответа:
а) Объясните, на чем основан метод и чем различаются условия проведения и состав ферментов при синтезе ДНК в ходе ПЦР и в клетках организма
б) Укажите, какие дополнительные области использования этого метода вам известны
ПЦР – полимеразная цепная реакция
Полученный материал подвергается фракциванию методом электрофорез в агазорном или полиакриламидном геле.
1. Идентифицировать вирусную и бактериальную ДНК в составе ДНК человека
2. Проводить пренатальную диагностику наследственных заболеваний
3. Выявить гетерозиготных носителей дефектных генов
4. Определить точную локализацию генов в ДНК человека
5. Идентифицировать дефектные гены, нарушающие регуляцию пролиферации клеток и вызывающие развитие опухолевых заболеваний
6. Проводить анализ препаратов, содержащих сильно деградированную ДНК
Мать и отец являются носителями гена, отвечающего за развитие серповидно-клеточной анемии. Они гетерозиготны. Ребёнок здоров.
б) Дополнительные области использования:
1. Использовать микроорганизмы в качестве продуктов веществ, необходимых для человека
2. Создавать новые полезные для человека виды растений и животных
3. Лечить наследственные болезни путём введения в клетки утраченных генов или замены дефектных генов.
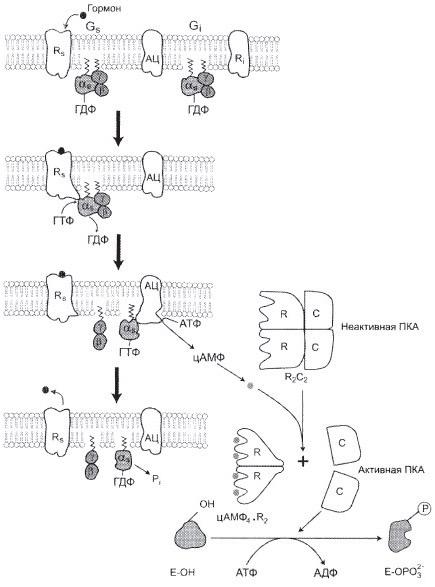
№ 5.1 Для изучения аденилатциклазной системы был использован холерный токсин, вырабатываемый возбудителем холеры (V. cholerae). Холерный токсин в условиях эксперимента стойко повышает активность аденилатциклазы практически в любой клетке эукариотов. Объясните действие холерного токсина. Для этого:
а) Приведите схему трансмембранной передачи сигнала
б) Назовите белок аденилатциклазной системы, который подвергается модификации при действии холерного токсина на клетку
в) Укажите, почему модификация этого белка приводит к длительному повышению активности аденилатциклазы.
в) Холерный токсин действует на α-протомер G-белка, не даёт ему дефосфорилироваться, следовательно, повышается активность АЦ (аденилатциклазы).
№ 5.2 Исследователям аденилатциклазной системы удалось выделить мутантные клетки мышиной лимфомы, способные связывать гормон и содержащие нормальное количество фермента аденилатциклазы. Однако присоединение гормона не приводило к повышению концентрации цАМФ. Какой белок отсутствовал в цитоплазматической мембране мутантных клеток? Для ответа на вопрос:
а) Приведите схему трансмембранной передачи сигнала
в) Объясните, какую роль играет этот белок в функционировании аденилатциклазной системы.
б) Gs-белок состоит из трёх протомеров α, β, γ. β и γ определяют место нахождения α-протомера на мембране и образуют вместе (α, β, γ) неактивный комплекс.
а) Какую роль играет оксалоацетат в этом процессе
Количество оксалоацетата не увеличится.
Оксалоацетат на первой стадии взаимодействует с ацетил-КоА
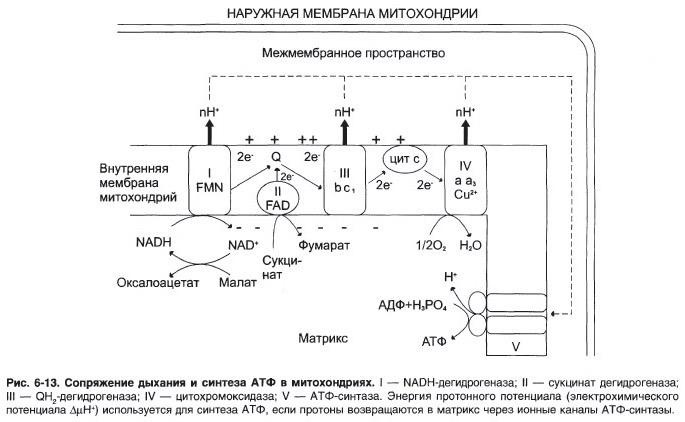
№ 6.2 В эксперименте с изолированными митохондриями в качестве окисляемого субстрата использовали малат. Чему равен коэффициент Р/О для этой реакции? Представьте схему ЦПЭ для малата и объясните:
Если бы малат вступил в ЦПЭ, то P/O=3
а) При добавлении амитала натрия (ингибитора NADH-дегидрогеназы) ингибируется I комплекс, следовательно P/O = 0
б) При добавлении вместе с амилатом сукцината, ингибируется I комплекс, но при этом сукцинат запускает II комплекс и P/O=2
№ 6.3 В эксперименте с изолированными митохондриями в качестве окисляемого субстрата использовали цитрат. Чему равен коэффициент Р/О для этой реакции? Представьте схему ЦПЭ, определите коэффициент Р/О и объясните:
б) Как изменятся эти параметры, если вместе с амиталом добавить сукцинат
в) Чему будет равен коэффициент Р/О при добавлении вместе с ингибитором аскорбиновой кислоты, восстанавливающей цитохром С.
Цитрат относится к NAD-зависимым ДГ (дегидрогеназам), проходит 3 комплекса, следовательно P/O=3.
а) Если добавить амитал натрия (ингибитор NADH-дегидрогеназы), то P/O уменьшится до 0, так как ингибируется I комплекс, скорость реакции уменьшается.
б) Если добавить сукцинат, то пройдёт 2 комплекса, P/O=2, скорость реакции увеличится.
в) Если добавить аскорбиновую кислоту, восстанавливающую цитохром C, то P/O=1.
№ 6.4 Суспензию митохондрий печени крыс инкубировали в аэробных условиях при оптимальных температуре и рН. Интенсивность дыхания измеряли по поглощению О2 после добавления к суспензии цитрата, АФ, 2,4-динитрофенола. Как изменится поглощение О2 при добавлении каждого из указанных веществ и почему? Для ответа на вопрос:
а) Изобразите схему окислительного фосфорилирования
б) Объясните механизм действия добавляемых веществ
б) Добавление цитрата ведёт к активации NADH-ДГ, следовательно, P/O=3, следовательно, ЦПЭ ускоряется, следовательно, поглощение кислорода увеличивается.
АДФ ускоряет окислительное фосфорилирование, следовательно, ускоряется дыхание, следовательно, поглощение кислорода увеличивается.
2,4-дигидрофенол – разобщитель – разобщает работу ЦПЭ, протон не проходит в АТФ-синтазе, в результате АДФ не переходит в АТФ. Основная энергия выделяется в виде тепла. Дыхание учащается, следовательно, поглощение кислорода увеличивается.
№ 6.5 В эксперименте с изолированными митохондриями в качестве окисляемого субстрата использовали α—кетоглутарат. Интенсивность дыхания измеряли по поглощению О2 после добавления к суспензии амитала натрия (барбитурат), АДФ, цианида. В присутствии каких из перечисленных веществ будет тормозиться окисление α—кетоглутарата и почему? Для ответа нарисуйте схему ЦПЭ и укажите механизм действия этих веществ.
При добавлении барбитурата NADH-ДГ ингибируется, следовательно P/O=0, интенсивность дыхания уменьшается.
При добавлении АДФ окислительное фосфорилирование ускоряется, следовательно, дыхание учащается.
При добавлении цианида – ингибитора цитохромоксидазы – дыхание уменьшается, P/O=0
№ 6.6 Если к суспензии митохондрий, использующих в качестве единственного субстрата дыхания пировиноградную кислоту, добавить малоновую кислоту, то поглощение О2 митохондриями резко снизится, в то же время увеличится концентрация одного из метаболитов цитратного цикла. Какой метаболит ЦТК накапливается? Для объяснения:
Малоновая кислота является ингибитором СДГ (субстратный аналог конкурирует за фермент с сукцинатом), поэтому идёт накопление сукцината.
№ 6.7 Промежуточные продукты цитратного цикла могут использоваться для синтеза различных соединений. Какой из метаболитов должен быть в избытке, чтобы восполнить утечку промежуточных продуктов из цитратного цикла?
а) Убыль метаболитов из ЦТК восполняется за счёт реакции синтеза оксалоацетата из пирувата:
б)
1. Оксалоацетат → аспартат → аспарагин
2. Цитрат → жирные кислоты
3. α-кетоглутарат → Глу, Глн, Про
4. Сукцинил-КоА → гем
№ 6.8 Синтез гема происходит в ретикулоцитах. Для синтеза одного пиррольного кольца требуется 2 моля глицина и 2 моля сукцинил—КоА. Сколько молей пирувата необходимо затратить для синтеза 1 пиррольного кольца и молекулы гема? Используя схему реакций ОПК, объясните:
а) Какой из предшественников гема образуется в цитратном цикле
б) Какое количество пирувата необходимо для синтеза предшественника
в) Какой из метаболитов ОПК должен быть в избытке, чтобы выполнить утечку промежуточных продуктов из цитратного цикла
а) Сукцинил-КоА – предшественник гема
б) 1 моль пирувата необходимо для синтеза сукцинил-КоА
в) Оксалоацетат должен быть в избытке
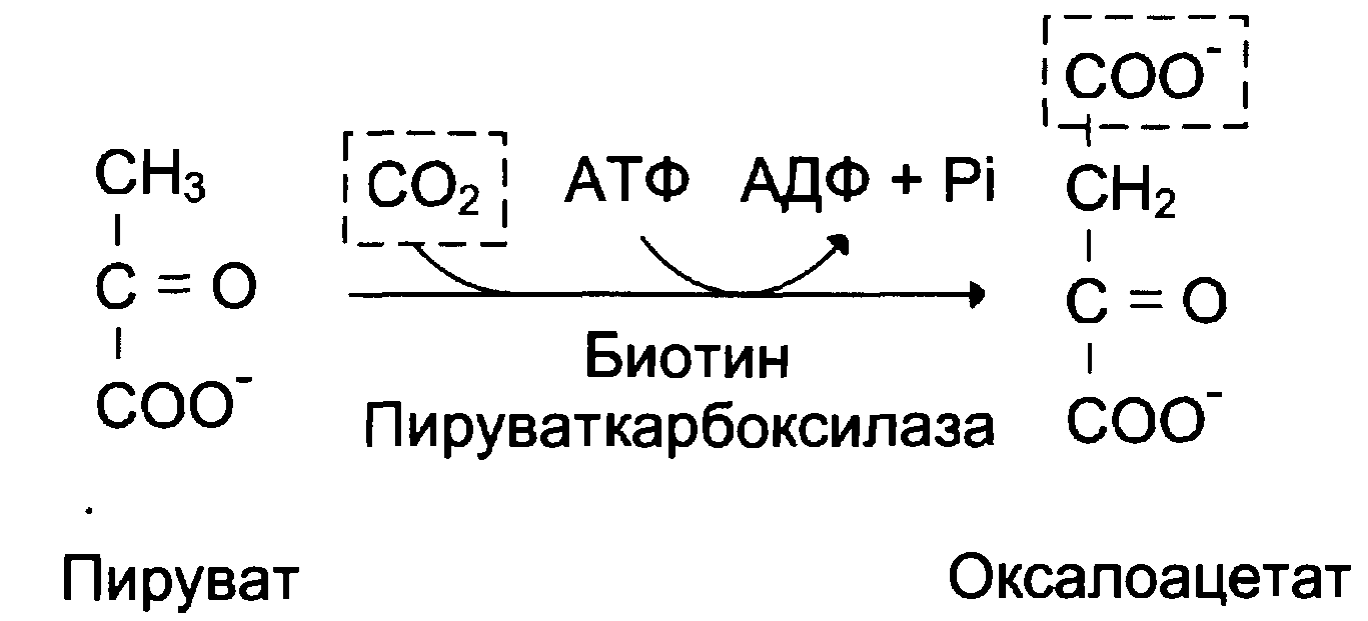
№ 6.9 У пациента выявлен генетический дефект пируваткарбоксилазы. К каким последствиям может привести такой дефект? Для ответа на этот вопрос:
б) Назовите и напишите схемы процессов, в которых участвует продукт этой реакции
а) Реакции синтеза оксалоацетата из пирувата:
№ 7.1 Укажите различия в углеводном обмене двух братьев: один в 3-й день ничего не ест, чтобы похудеть, другой после короткой пробежки и ужина отдыхает. Приведите схемы метаболических путей, которые преобладают в углеводном обмене этих людей.
В первом случае (3-ий день ничего не ест) – это II фаза голодания.
К концу первой фазы (24 часа) увеличивается секреция глюкагона и кортизола.
Ускоряются процессы глюконеогенеза и β-окисления.
Во втором случае (после короткой пробежки) – адреналин в печени и мышцах – ИФС (α1-рецепторы), глюкагон в печени – АЦС (через β2-рецепторы).Также после ужина увеличивается секреция инсулина, а значит синтез гликогена.
Также Схема регуляции обмена гликогена инсулином (см. в след. задаче)
АЦС смотрите выше, а схема ИФС ниже:
№ 7.2 Опишите различия в обмене углеводов у двух студентов, один из которых лежит после ужина на диване, другой вместо ужина совершает 20-минутную пробежку. Какие процессы преобладают у них в углеводном обмене? Для ответа на вопрос:
а), б) После ужина идёт синтез гликогена. Это активирует инсулин.
Синтез гликогена Передача сигнала инсулина в клетку 1
Схема регуляции обмена гликогена инсулином
Передача сигнала инсулина в клетку 2 (рисовать после первой схемы)
Действует адреналин и глюкагон.
ИФС ( через α1-рецепторы), глюкагон в печени – АЦС (через α1, β1 β2-рецепторы)
Схему ИФС смотрите в предыдущей задаче
№ 7.3 На дистанции два бегуна: спринтер завершает стометровку, стайер бежит 10-й километр. Укажите различия в энергетическом обеспечении работы мышц у этих бегунов. Приведите схемы метаболических путей, которые являются источником энергии у стайера и спринтера.
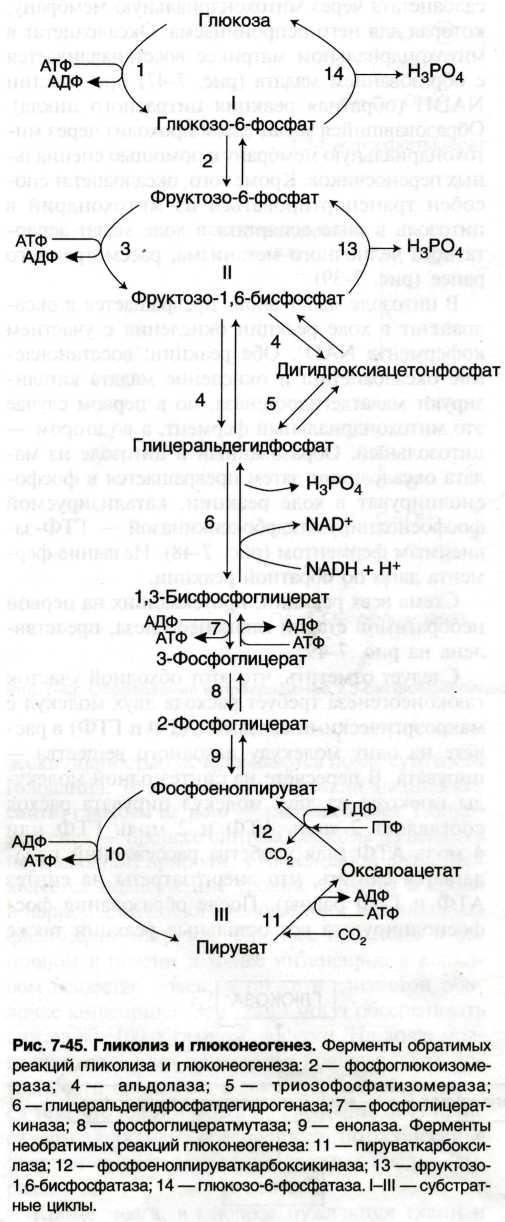
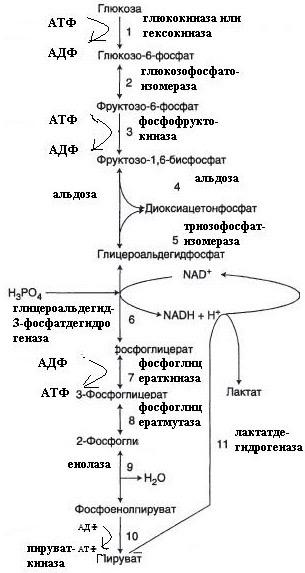
У спринтера происходит анаэробный гликолиз, так как невозможно так быстро обеспечить мышцы необходимым количеством кислорода. У стайера функционирует аэробный гликолиз, глюкогенолиз.
У стайера – аэробный гликолиз и β—окисление жирных кислот
Аэробное окисление глюкозы до CO2 и воды
Глюкоза → 2 пирувата.
АТФ АТФ NADH АТФ АТФ ЦТК
У спринтера – анаэробный гликолиз.
№ 7.4 Человек выполняет интенсивную физическую работу. В каком направлении смены реакции, катализируемые ЛДГ в скелетных мышцах и в печени? Обоснуйте свой ответ:
б) Напишите схемы процессов, включающих в себя эту реакцию в скелетных мышцах и в печени. Укажите физиологические значение этих процессов.
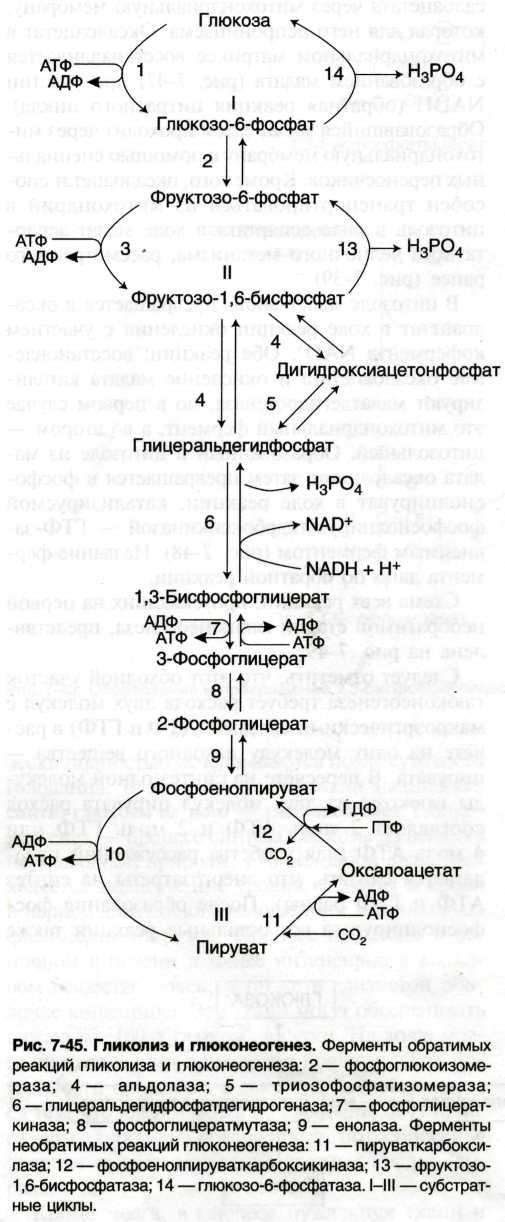
б) В мышцах при начале физической работы идёт анаэробный гликолиз
В печени и скелетных мышцах реакция смещена в сторону пирувата, идёт глюконеогенез.
а) Напишите схемы синтеза и распада гликогена
б) Укажите ферменты, катализирующие образование и гидролиз гликозидных связей в местах разветвления молекулы
б) Синтез гликогена – фермент «ветвления»
Распад гликогена олигосахарид-трансфераза
в) Синтез гликогена – в абсорбтивный период
Распад гликогена – постабсорбтивный период, при голодании, при фической нагрузке
Синтез гликогена под действием инсулина
Схема регуляции обмена гликогена инсулином
Распад гликогена под действием адреналина и глюкагона.
ИФС ( через α1-рецепторы), глюкагон в печени – АЦС (через α1, β1 β2-рецепторы) АЦС
№ 7.6 Срезы печени инкубировали в буферном растворе с добавлением лактата или без него. Через 2 ч в растворе определили концентрацию веществ, указанных в таблице. Обоснуйте полученные результаты. Для этого:
а) Укажите различия между контрольной и опытной пробами
а) Разница контрольной и опытной пробами в том, что в контрольной концентрация глюкозы и аланина ниже, а мочевины и аммиака выше.
В контрольной идёт глюконеогенез из аланина, а в опытной из лактата. Аланин в контрольной пробе предварительно дезаменируется, поэтому увеличивается количество аммиака и мочевины.
№ 7.7 При остром алкогольном отравлении нередко наблюдается гипогликемия. Укажите причину наблюдаемого симптома. Ответ поясните. Для этого:
б) Покажите, как изменится скорость процесса при остром алкогольном отравлении и почему
б) При остром алкогольном отравлении этанол поступает в печень, окисляется там, восстанавливая почти весь NAD + до NADH
Высокая концентрация NADH смещает равновесие в реакции лактат-пируват в сторону лактата, что в итоге подавляет глюконеогенез
В результате получаем лактоацидоз и гипогликемию.
№ 7.8 Алкалоид кофеин, содержащийся в кофе, вызывает гипергликемию и оказывает возбуждающее действие, хотя не влияет на адреналиновые рецепторы (кофеин угнетает действие фермента фосфодиэстеразы). Объясните, почему кофеин вызывает гипергликемию. Ответ иллюстрируйте схемой действия адреналина на процесс в клетках печени приводящий к гипергликемии.
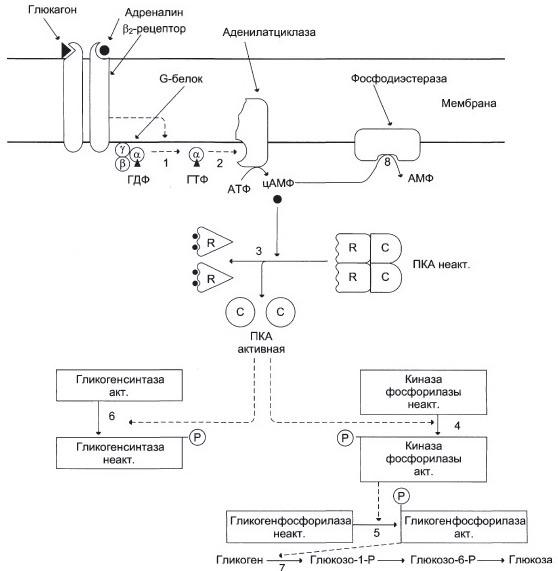
Алкалоид кофеин ингибирует фосфодиэстеразу, которая ревращает цАМФ в АМФ, следовательно, увеличенная концентрация цАМФ сохраняется, увеличенная активность ПКА сохраняется, повышается скорость мобилизации гликогена в печени (распада), повышается концентрация глюкозы в крови.
№ 7.9 На препаратах печеночной ткани изучали метаболизм этанола и возможность его превращения в гликоген. Внесение этанола в инкубационную среду не приводило к синтезу гликогена. Почему невозможно превращение этанола в глюкозу? Для обоснования ответа:
б) Напишите схему глюконеогенеза и укажите субстраты этого процесса.
а) Этанол поступает в печень, окисляется там, восстанавливая почти весь NAD + до NADH
Высокая концентрация NADH смещает равновесие в реакции лактат-пируват в сторону лактата, что в итоге подавляет глюконеогенез
Субстраты: глицерол, лактат и аминокислоты.
а) Укажите содержание глюкозы в крови в норме
б) Укажите, уровень какого гормона повышается в крови студента в данной ситуации и опишите механизм действия этого гормона.
в) Напишите схему процесса, повышение скорости которого приводит к изменению концентрации глюкозы в крови.
а) Концентрация глюкозы в норме: 3,3-5,5 ммоль/л (60-100 мг/дл).
б) Повышается уровень адреналина (в печени через α1 и β2 – адренорецепторы)
1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6 — протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс α-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
Важно, что в печени есть фермент глюкозо-6-фосфатаза, который превращает глюкозо-6-фосфат в глюкозу, которая идёт в кровь.
В мышцах данного фермента нет, поэтому глюкозо-6-фосфат идёт в гликолиз
№ 7.11 Человек совершает срочную физическую работу (например, убегает от опасности) через 30 мин после обеда, состоявшегося преимущественно из углеводов. В этой ситуации в скелетных мышцах происходит синтез гликогена или его распад? Напишите схему выбранного процесса и объясните:
а) Какой гормон переключает пути обмена гликогена в описанной ситуации
б) Схему механизма действия гормона на этот процесс
б) После обеда под действием инсулина идёт синтез и запасание гликогена. Но под действием адреналина (гормон стресса) пойдёт распад гликогена в печени до глюкозы и в мышцах до глюкозо-6-фосфата.
Поэтому в данной ситуации пойдёт именно распад гликогена.
1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6 — протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс α-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
№ 7.12 При добавлении АТФ к гомогенату мышечной ткани скорость гликолиза снизилась, концентрация глюкозо-6-фосфата и фруктозо-6-фосфата увеличилась, а концентрация всех других метаболитов гликолиза была при этом ниже. Укажите, активность какого фермента может подавляться при добавлении АТФ. Ответ аргументируйте. Для этого:
б) Укажите реакцию, которую катализирует этот фермент, особенности его строения и способ регуляции активности этого фермента с помощью АТФ.
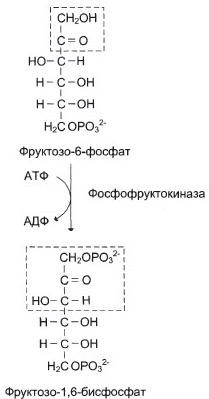
Эта реакция фосфорилирования, является регуляторной. Регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
№ 7.13 Если препарат скелетной мышцы обработан йодацетатом (ингибитор глицеральдегидфосфатдегидрогеназы), то мышца теряет способность сокращения в ответ на электростимуляцию. Если препарат скелетной мышцы обработан ротеноном (ингибитор NADH—дегидрогеназы), то способность к сокращению сохраняется. Объясните результаты опытов. Объяснение аргументируйте, написав схему процесса, который служит источником энергии для сокращения мышцы в присутствии ротенона.
При действии йодацетата ингибируется ГАФ-ДГ (глицероальдегилфосфатдегидрогеназа), и не идёт ни аэробный, ни анаэробный гликолиз, а следовательно, мышца не сокращается.
При действвии ротенона ингибируется NADH-ДГ, следовательно, аэробный гликолиз не идёт, но может идти анаэробный.
б) Укажите, скорость каких реакций этого процесса будет снижена и почему
Глюконеогенез протекать будет, но его скорость будет очень снижена.
Субстраты: глицерол, лактат и аминокислоты.
б) Если ингибируется ЦТК и ЦПЭ, то не образуется АТФ, необходимая для глюконеогенеза, следовательно, тормозится синтез глюкозы из лактата, глицерола и аминокислот. Тормозятся реакции, идущие с затратой АТФ:
2. 1,3-БФГ → 3-фосфоглицерат
3. Глицерол → глицерол-3-фосфат
№ 7.15 В эксперименте к клеточному гомогенату печени добавили авидин (яблочный белок), который является сильным специфическим ингибитором биотиновых ферментов. Активность какого фермента, участвующего в метаболизме глюкозы, может снижать авидин? Ответ поясните:
в) Укажите последствия подавления этого процесса авидином
в) Ингибируется глюконеогенез
б) Укажите, в каких клетках этот процесс происходит даже при отсутствии мышечной активности
Концентрация лактата в крови никогда не равна нулю, так как анаэробный гликолиз постоянно идёт в эритроцитах, так как в эритроцитах нет митохондрий. Конечным продуктом анаэробного гликолиза является лактат.
№ 7.17 В эксперименте на гомогенатах мышцы и печени изучили превращения глюкозы в рибозо-5-фосфат окислительным путем. В качестве субстрата использовали глюкозу с радиоактивной меткой по первому углеродному атому. Будет ли метка обнаруживаться в пентозе? В какой ткани – печени или мышцах – скорость процесса будет выше? Для решения задачи:
а) Напишите схему окислительного этапа пентозофосфатного пути превращения глюкозы
б) Укажите значение этого процесса для клетки
Метка на первом углеродном атоме глюкозы обнаруживаться в пентозе не будет, так как уходит CO2. Скорость процесса будет выше в печени.
2. При избытке пентоз пополнение гексоз
3. Промежуточные продукты в гликолиз, следовательно источник для синтеза АТФ
4. Восстановление NADP + до NADPH
№ 8.1 У больных гиперлипопротеинемией I типа сыворотка крови имеет “молочный” вид, при хранении сыворотки при 4˚С на ее поверхности появляются жирные хлопья. Объясните наблюдаемое явление. Для этого:
б) Укажите возможные причины снижения скорости этой реакции
На поверхности сыворотки больного гиперлипопротеинемией I типа при стоянии на холоде всплывают белые жирные хлопья, представляющие собой хиломикроны.
1. Изменение конформации апо С II
2. Не работает ЛП-липаза
3. Нарушение переноса апо С II с ЛПВП на хиломикроны
в) Снизить количество жировой пищи
№ 8.2 У больного длительно нарушен отток желчи в просвет двенадцатиперстной кишки. При обследовании обнаружены повышенная кровоточивость, увеличение времени тромбообразования. Объясните возможные причин этого явления. Для этого:
а) Укажите, дефицит каких незаменимых факторов питания может развиться у больного
б) Объясните биологические функции этих факторов
в) Объясните возможные причины нарушения свертывания крови
а) Может возникнуть гиповитаминоз A, D, E, K
б) Витамин А участвует в процессе зрения, а также роста и дифференцировки клеток. Доказана его способность угнетать рост некоторых видов опухолей (особенно лёгких)
Витамин К участвует в образовании активных факторов свёртывания крови.
Витамин D регулирует обмен кальция.
Витамин E – антиоксидант, ингибирует образование свободных радикалов и таким образом противодействует повреждению клеток в результате перекрёстного окисления липидов.
Из витаминов образуются коферменты, следовательно, при недостатке витаминов уменьшается активность определённых ферментов.
в) Недостаточность белков свертывающей системы крови, мутация гена фактора 8, заболевание гемофилия
Причиной нарушения свёртываемости крови является недостаток витаминов A, K, D
б) Укажите, какие дополнительные биохимические анализы мочи и крови необходимо провести, чтобы выяснить причину кетонурии
Причины кетонурии: увеличенный синтез кетоновых тел, который происходит при голодание, сахарный диабет, длительная физическая нагрузка
б) Анализ крови и мочи:
1. При уменьшении глюкозы – голод.
2. При увеличении глюкозы – сахарный диабет
в) Голодание, сахарный диабет, интенсивная физическая работа
№ 8.4 У мальчика 4 лет снижена способность к выполнению физической работы. При исследовании биоптата мышц обнаружено, что концентрация карнитина в ткани меньше нормы в 4 раза. В цитозоле клеток мышц обнаружены вакуоли жира. Каковы возможные причины такого состояния? Для ответа на вопрос:
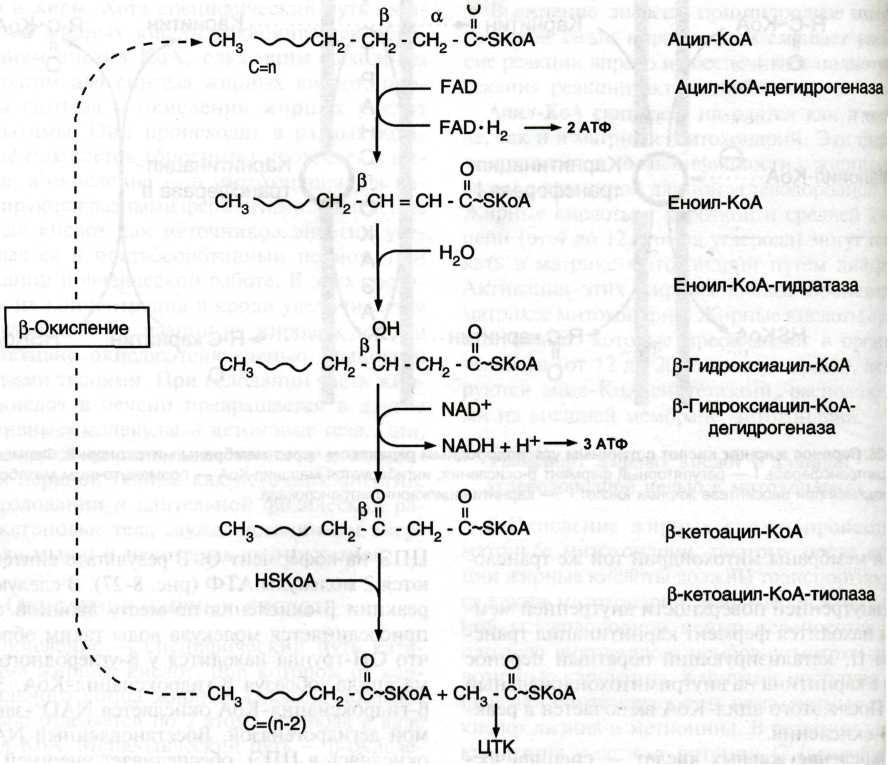
У мальчика нарушен перенос жирных кислот через мембрану митохондрий, а следовательно, замедляется β-оксиление жирных кислот
б) Карнитин – переносчик ацильной группы через мембрану митохондрий
№ 8.5 У экспериментального животного определяли разницу в концентрации жирных кислот в крови, поступающей в интенсивно работающую скелетную мышцу, и в крови, оттекающей от этой мышцы, на 1-й и 30-й минуте работы. В каком случае эта разница будет больше? Аргументируйте ответ, написав реакции соответствующего метаболического пути.
На 30-ой минуте разница в концентрации жирных кислот в крови, поступающей в интенсивно работающую скелетную мышцу, и в крови оттекающей от этой мышцы будет больше, так как в это вреям уже создаются аэробные условия для β-окисления жирных кислот, совмещённого с ЦПЭ, следовательно, более энергетически выгодный процесс.
№ 8.6 Воздействие различных токсических веществ может привести к развитию ожирения печени. Объясните возможные механизмы этого явления. Для этого:
б) Опишите процесс выведения синтезированных жиров из печени
в) Объясните, почему метионин используется при лечении ряда заболеваний печени, в частности в качестве вещества, уменьшающего риск развития ожирения печени.
В крови ЛПОНП превращаются в ЛПНП, главным компонентом которых является холетерол.
б) Синтезированные жиры удаляются из печени в составе ЛПОНП в кровь, где они подвергаются гидролизу под действием ЛП-липазы. В результате ЛПОНП переходят в ЛПНП (50 % которого составляют холестерол и его эфиры), таким образом увеличивается количество холестерола в крови.
Фосфатидилхолин используется для восстановления мембран, для формирования ЛПОНП.
№ 8.7 Обычно при голодании состоянию гипоглекимии сопутствует кетонемия. В случае какого наследственного заболевания возможно сочетание симптомов гипогликемии и отсутствие кетонемии. Для объяснения:
В случае дефектакарнитина-ацил-трансферазы.
б) Исходный субстрат ацетил-КоА получаем при β-окислении жирных кислот.
№ 8.8 При атеросклерозе и угрозе образования тромба профилактически назначают аспирин. Объясните механизм действия аспирина, ответив на вопросы:
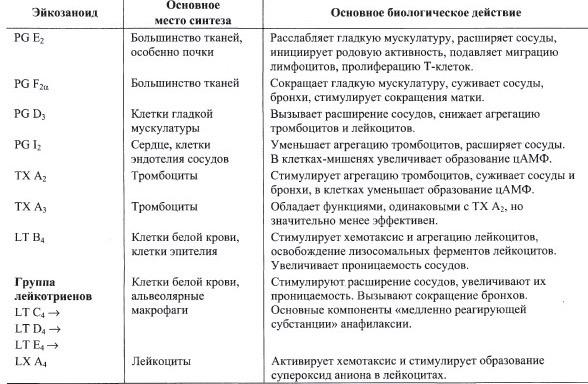
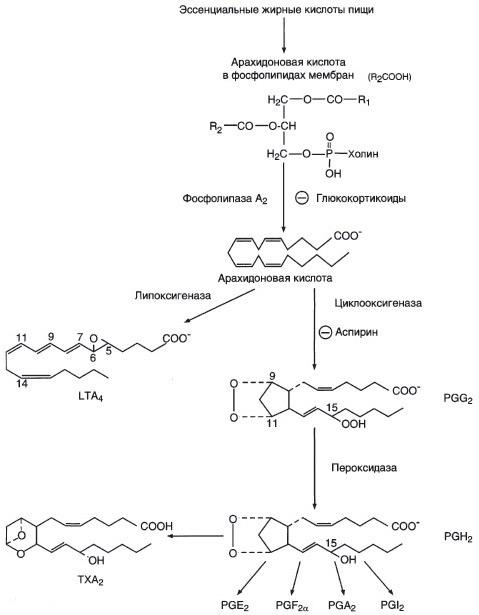
а) Каковы функции разных типов эйкозаноидов в свертывании крови
б) Какая реакция в синтезе эйкозаноидов ингибируется аспирином и по какому механизму.
Аспирин ингибирует реакцию:
Арахидоновая кислота PGG2 по типу аллостерической регуляции.
№ 8.9 У некоторых людей после приема аспирина может развиться приступ астмы (так называется аспириновая астма). Объясните возможную причину этого явления. Для этого:
а) Напишите схему синтеза эйкозаноидов из арахидоновой кислоты
б) Аспирин ингибирует реакцию:
Арахидоновая кислота PGG2 по типу аллостерической регуляции.
в) Аспирин и другие противовоспалительные препараты нестероидного действия ингибируют только циклооксигеназный путь.
У таких больных увеличен синтез лейкотриенов, которые стимулируют расширение сосудов, увеличивают их проницаемость, вызывают сокращение бронхов.
№ 8.10 Пациент А в течение нескольких дней получал высококалорийную пищу, пациент Б – низкокалорийную пищу. Опишите разницу в метаболизме этих люде, ответив на вопросы:
а) Соотношение инсулин.глюкагон выше у студента А (высококалорийная пища)
б) Активность и количество ацетил-КоА-карбоксилазы выше у пациента А (высококалорийная пища), так как идёт синтез жира в абсорбтивный период.
Фермента Ацетил—КоА—карбоксилаза катализирует реакцию превращения ацетил-КоА в малонил-КоА
№ 8.11 Объясните различия в обмене жиров у двух людей: один поужинал и лег отдохнуть, а другой вместо ужина совершает получасовую пробежку. Для этого:
а) Напишите схемы соответствующих метаболических путей
а), б) У первого человека происходит усиленное выделение инсулина, а у второго – адреналина.
№ 8.12 У людей, длительно болеющих сахарным диабетом, может развиться ацидоз. Повышение концентрации каких соединений вызывает отклонение рН крови от нормы? Для ответа на вопрос:
б) Напишите схемы метаболических путей, повышение активности которых приведет к ацидозу
в) Объясните причины повышения активности этих процессов у больных сахарным диабетом
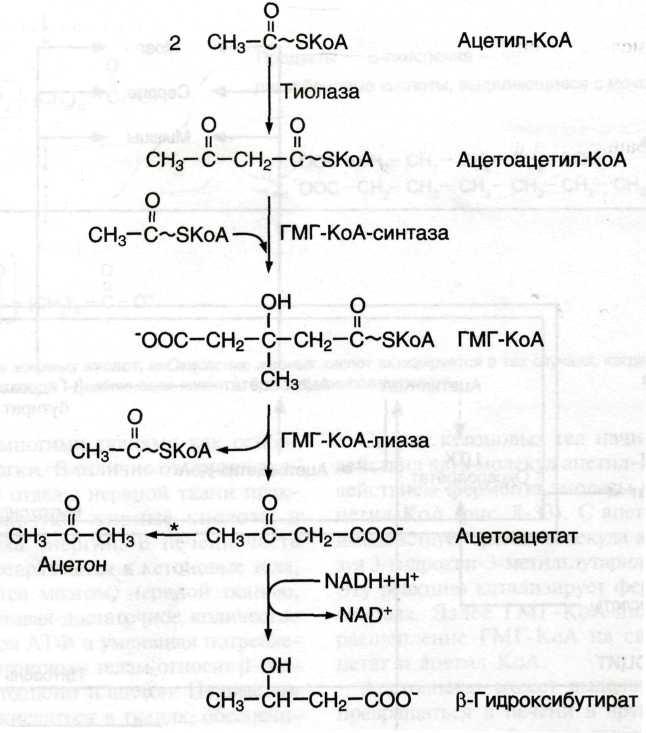
а) Кетоновые тела (они являются низкомолекулярными кислотами, диссоциирующими при отклонении pH крови, поэтому их накопление приводит к развитию ацидоза)
Синтез кетоновых тел
в) При сахарном диабете: 1. Глюкоза не депонируется в качестве гликогена. 2. В адипоцитах уменьшается скорость синтеза и депонирования жиров. 3. Ускоряется катаболизм жиров, а следовательно увеличивается концентрация жирны кислот в крови, а следовательно печень окисляет их до Ацетил-КоА, а следовательно образуются ацетоуксусная кислота и β-гидроксибутират, что приводит к кетонемии. 4. ГЛЮТ-4 не перемещается из цитозоля в мембрану (в мышечных клетках и адипоцитах), а следовательно глюкоза не проходит в клетки. 5. Усиливается катаболизм белков, образующиеся аминокислоты подвергаются дезаминированию в печени, безазотистые остатки включаются в глюконеогенез, а оставшийся аммиак включается в орнитиновый цикл, наступают азотемия, азотурия.
Причины Сахарного диабета I типа: Разрушение β-клеток поджелудочной железы в результате аутоиммунных реакций, провоцирующие цитотропными вирусами, например, оспа, краснуха.
Причины Сахарного диабета II типа – нарушение секреции инсулина, нарушение превращения проинсулина в инсулин, повышение скорости катаболизма инсулина, повреждение механизмов передачи инсулинового сигнала, образование антител к рецепторам инсулина, генетический дефект пострецепторного аппарата иинсулинзависимых тканей, нарушение регуляции секреции инсулина.
№ 8.13 Диета с пониженным количеством углеводов и жиров является профилактической гиперхолестеролемии. Объясните влияние такого питания на концентрацию холестерола в крови. Для этого напишите схему:
а) Катаболизма глюкозы, обеспечивающего образование исходного субстрата для синтеза холестерола, и укажите роль инсулина в регуляции этого процесса
Инсулин индуцирует синтез ферментов: цитратлиазы, малик-фермента, ацетил-КоА-карбоксилазы, синтазы жирных кислот, глюкозо-6-фосфат-дегидрогеназы, глюкокиназы, фосфофруктокиназы, пируваткиназы
Регуляция синтеза холестерола
№ 8.14 В крови двух пациентов содержание общего холестерола составляют 260 мг/дл. Можно ли говорить о равной предрасположенности этих людей к атеросклерозу? Для ответа на вопрос:
а) Опишите роль разных типов липопротеинов в транспорте холестерола
1. Хм – транспорт липидов из клеток кишечника.
2. ЛОНП – транспорт липидов, синтезируемых в печени.
3. ЛППП – промежуточная форма превращения ЛОНП → KYG под действием ЛП-липазы.
4. ЛПНП – транспорт холестерола вткани
5. ЛПВП – удаление избыточного холестерола из клеток и других липопротеинов, донор апопротеинов А, C-II.
Kа = 80 = 2,25 – НОРМА
б) Напишите схему регуляции синтеза холестерола
в) Объясните происхождение субстратов для синтеза холестерола
г) Объясните роль различных липопротеинов в транспорте холестерола.
1. Хм – транспорт липидов из клеток кишечника.
2. ЛОНП – транспорт липидов, синтезируемых в печени.
3. ЛППП – промежуточная форма превращения ЛОНП → KYG под действием ЛП-липазы.
4. ЛПНП – транспорт холестерола вткани
5. ЛПВП – удаление избыточного холестерола из клеток и других липопротеинов, донор апопротеинов А, C-II.
Незрелые ЛПВП-предшественники обогащаются хопестеролом, который поступает в ЛПВП при участии фермента ЛХАТ с поверхности клеток и других липопротеинов, содержащих холестерол. Незрелые ЛПВП, обогащаясь холестеролом, превращаются в ЛПВП3 — частицы сферической формы и большего размера. ЛПВП3обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП при участии «белка, переносящего эфиры холестерола»*. ЛПВП3 превращается в ЛПВП2, размер которых увеличивается за счёт накопления триа-цилглицеролов. ЛПОНП и ЛППП под действием ЛП-липазы превращаются в ЛПНП, которые доставляют холестерол в печень. Часть ЛПВП захватывается клетками печени, взаимодействуя со специфическими для ЛПВП рецепторами к апоА-1. На поверхности клеток печени фосфолипиды и триацилглицеролы ЛППП, ЛПВП2 гидролизуются печёночной ЛП-липазой**, что дестабилизирует структуру поверхности ЛП и способствует диффузии холестерола в гепатоциты. ЛПВП2 в результате этого опять превращаются в ЛПВП3 и возвращаются в кровоток. X — холестерол, ЭХ — эфиры холестерола, ФЛ — фосфолипиды, ЛХАТ — лецитин-холестеролацилтрансфераза, А-1 — апопротеин, активатор ЛХАТ.
в) Объясните механизм его токсического действия на нервную ткань
в) Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
• Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции трансаминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.); гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность а-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
• Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
• Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез γ-аминомаслянной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
г) Рекомендована малобелковая диета в введение метаболитов орнитинового цикла.