ортофен при подагре можно или нет
Ортофен: для уменьшения болей, жара и воспалений
Недорогой, но эффективный Ортофен быстро улучшает физическое самочувствие при различных патологиях, снимая болезненные симптомы. Применять его необходимо с осторожностью, так как медикамент имеет много побочных эффектов.
Состав и лекарственные формы
Ортофен содержит одно активное вещество — диклофенак, обладающее выраженным болеутоляющим, противовоспалительным и умеренным жаропонижающим действием. Препарат имеет несколько форм выпуска для системного и местного применения:
таблетки: белого цвета, плоскоцилиндрические, с дозировкой 25 мг, вспомогательные компоненты: повидон, крахмал, стеарат магния и другие;
гель: прозрачная, слегка вязкая жидкость с содержанием 5% диклофенака, пакуется во флаконы объемом 100 мл, содержит воду, этиловый спирт, пропиленгликоль и другие связующие соединения;
мазь Ортофен: 20-процентный препарат в виде однородной вязкой массы, выпускается в тубах объемом 30 и 50 мл;
инъекционный раствор на водной основе: жидкость в ампулах объемом 3 мл с содержанием 25 мг. диклофенака в 1 мл.
Как действует Ортофен
Механизм действия всех форм препарата определяется содержащемся в них нестероидным противовоспалительным активным компонентом. Инъекционный раствор и таблетки обладают системным эффектом, снимают признаки лихорадки и острый болевой синдром. Диклофенак неизбирательно угнетает активность болевых и воспалительных простагландинов, обладает антиагрегантным свойством — увеличивает текучесть крови. После введения внутримышечно или приема внутрь лекарство распределяется во всех жидкостях и тканях организма. В трансформации и фильтрации метаболитов препарата принимают участие печень и почки.
Средства местного применения: мазь и гель Ортофен обладают умеренными анальгезирующими свойствами, применяются для уменьшения болей в мышцах и суставах. Часть лекарственного средства всасывается внутрь через кожные покровы. При длительном использовании возможно накопление активного вещества в крови и воздействие его на ткани внутренних органов.
Показания к применению Ортофена
Препарат назначают при умеренном и сильном болевом синдроме различного происхождения, который сопровождает травмы, дегенеративные процессы, воспалительные патологии. Основная сфера применения: заболевания суставов и мышечной системы:
артриты, деформирующий артроз, спондилоартроз;
тендениты, растяжения и разрывы связок;
боли невралгического характера;
люмбаго, ишиас, бурсит.
Ортофен помогает устранять болезненность при интенсивно протекающих инфекционных патологиях, заболеваниях внутренних органов и центральной нервной системы. В том числе:
при мигрени, головной боли напряжения;
при гинекологических патологиях;
при почечных коликах;
при ушибах, вывихах.
Жаропонижающий эффект Ортофена выражен слабее, чем анальгезирующий и противовоспалительный, поэтому при высокой температуре рекомендуется применять другие виды НПВС.
Противопоказания и побочные эффекты
Препарат неприменим при высокой чувствительности к салицилатам, воспалительных и эрозивных поражениях слизистой пищеварительного тракта, тяжелых заболеваниях печени, мочевыводящих путей. К числу противопоказаний относятся также:
склонность к внутренним кровотечениям, сниженная свертываемость крови;
беременность на всех сроках;
период грудного вскармливания.
Ортофен запрещен также для лечения детей младше 6 лет. Обширный список противопоказаний объясняется высокой токсичностью. На фоне его применения возможны различные нежелательные реакции:
ухудшение аппетита, изменение вкуса, боли в эпигастрии, брюшной полости, обострение гастрита и патологий ЖКТ, диарея;
воспаление почек, нарушение диуреза;
головокружения, астенический синдром, бессонница;
С осторожностью Ортофен следует применять при заболеваниях сердца и сосудов, бронхиальной астме, сахарном диабете. Возможные признаки передозировки лекарства: резкая головная боль, рвота, нарушение координации движений, ухудшение слуха и зрения.
Применение: инструкция
Ортофен в таблетках принимают одной или несколькими дозами в сутки:
по 1 таблетке однократно и до 3–4 раз в день, после употребления пищи либо одновременно с ней, максимальное количество средства — 150 мг;
при сильном болевом синдроме со второго дня терапии рекомендуется снижать количество таблеток до 2–3 штук, чтобы избежать нежелательных последствий для организма;
более 5 дней подряд таблетки принимать не рекомендуется.
Уколы Ортофен показаны внутримышечно. Их вводят однократно, в дозе не более 75 мг. активного вещества. После однократной инъекции следует продолжать терапию, принимая препарат в таблетках.
Гель и мазь применяют наружно, обрабатывая поверхность кожи в области повреждения или воспаления сустава. Средство в количестве 2–3 г. наносят на чистые покровы, втирая до полного впитывания лекарства. При необходимости укутывают часть тела в тепло. Рекомендуется применять мазь Ортофен на ночь или в состоянии покоя. В сутки без последствий для здоровья разрешено использовать до 8 г. препарата местного действия.
Важно: используя одновременно системную и наружную форму медикамента требуется учитывать общее его количество, обсуждая его с врачом.
При использовании уколов и таблеток требуется отказаться от других НПВС, тщательно выверять дозировку антикоагулянтов, глюкокортикоидов, так как они увеличивают токсичность Ортофена.
Аналоги и стоимость
Сходным терапевтическим действием обладают медикаменты Раптен, Диклофенак, Кетанов, Зеродол, Диклоберл, Кеторолак, Панопсен, Наклофен.
Купить Ортофен в аптеках можно по невысоким ценам. Стоимость упаковки таблеток и инъекционных ампул не превышает 70 рублей. Мазь обойдется в 60–130 рублей.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Разумный выбор НПВП при сочетанной патологии: заболеваниях суставов и гипертонической болезни
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением а
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением активности циклооксигеназы-2 (ЦОГ-2) в очаге воспаления — ключевого фермента синтеза простагландинов провоспалительной активности, а подавление изоформы ЦОГ-1 приводит к нарушению физиологических реакций: в частности, к нарушению синтеза простагландинов класса Е в слизистой оболочке желудка и развитию НПВП-гастропатии.
Большинство «стандартных» НПВП способно подавлять активность обеих изоформ ЦОГ, поэтому их применение часто ограничено из-за развития побочных эффектов, в первую очередь — со стороны желудочно-кишечного тракта (ЖКТ). Субъективные симптомы со стороны ЖКТ встречаются примерно у трети больных, а в 5% случаев представляют серьезную угрозу жизни пациентов. Именно поэтому в последние годы особо пристальное внимание привлекает проблема безопасного применения НПВП. Полагают, что препараты более селективные в отношении ЦОГ-2 реже вызывают развитие НПВП-гастропатии. Изучение механизмов действия НПВП послужило толчком к созданию новых препаратов, обладающих всеми положительными свойствами стандартных НПВП, но менее токсичных, — это специфические ингибиторы ЦОГ-2 [3, 4, 13].
В последние годы особую актуальность приобрела проблема взаимодействия НПВП и гипотензивных препаратов, а также связи между применением НПВП и развитием гипертонической болезни (ГБ). Неселективные НПВП могут привести к повышению АД (преимущественно диастолического) не только у больных артериальной гипертензией (АГ), но и у лиц с нормальным АД за счет ингибиции системного и локального, внутрипочечного синтеза простагландинов. Известно, что постоянный прием НПВП вызывает у пациентов увеличение АД в среднем на 5,0 мм рт. ст. Характерным свойством НПВП является также взаимодействие с гипотензивными препаратами, в основе гипотензивного действия которых лежат преимущественно простагландин-зависимые механизмы. Назначение НПВП пациентам, получающим по поводу АГ β-адреноблокаторы, ингибиторы АПФ и диуретики, приводит к снижению гипотензивного эффекта [8, 9].
Нимесулид был разработан еще в 1985 г. и является одним из первых НПВП, при изучении которого продемонстрирована более высокая селективность в отношении ЦОГ-2 и накоплен большой клинический опыт. В многочисленных исследованиях in vitro и in vivo было показано, что нимесулид примерно в 5–20 раз более селективно ингибирует ЦОГ-2, чем ЦОГ-1. Большой интерес представляет и тот факт, что нимесулид обладает широким спектром ЦОГ-независимых эффектов, которые могут определять его противовоспалительную, анальгетическую и хондропротективную активность [1, 2, 5, 7, 11, 12].
Нимесулид хорошо переносится больными и редко вызывает развитие серьезных побочных эффектов, требующих отмены препарата. По результатам ряда исследований, частота побочных эффектов, развивающихся на фоне приема нимесулида, достоверно не отличается от плацебо или ниже, чем при приеме других НПВП. Например, по данным мета-анализа, у больных, получавших нимесулид, общая частота побочных реакций со стороны ЖКТ была значительно ниже (8,7%), чем при назначении других НПВП (16,8%). Низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2-селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [6, 10, 13].
Таким образом, нимесулид относится к селективным ингибиторам ЦОГ-2, сравним по эффективности с «классическими» НПВП, но отличается более благоприятным профилем токсичности. Фармакоэкономический анализ свидетельствует о преимуществах нимесулида по сравнению с диклофенаком, в первую очередь в связи с более низкой частотой поражения ЖКТ.
Целью нашего исследования явилось изучение эффективности и переносимости найза (нимесулида) у больных РА в сравнении с ортофеном (диклофенаком).
Материалы и методы
Оба НПВП назначались случайным способом 40 больным с момента первого установления диагноза РА, согласно критериям Американской коллегии ревматологов. Найз применялся в виде таблеток по 100 мг дважды в день, ортофен — в виде таблеток по 25 мг в суточной дозе 150 мг. Одновременно всем больным проводилась базисная терапия, преимущественно метотрексатом или сульфасалазином. Эффективность и переносимость НПВП оценивались через 3 нед. от начала лечения, т. е. в те сроки, когда эффект базисных препаратов еще не имел клинической значимости.
В I группе из 20 пациентов, получавших найз, было 14 женщин и 6 мужчин, средний возраст пациентов составил 55,1 года, длительность суставного синдрома к моменту установления диагноза — от 3 до 14 мес., в среднем — 7,25 мес. Во II группе из 20 больных, получавших ортофен, было 18 женщин и 2 мужчин, средний возраст больных — 42,75 года, длительность суставного синдрома — от 2 до 14 мес., в среднем — 5,65 мес. Клиническая характеристика обеих групп представлена в таблице 1.
Результаты лечения оценивались по динамике показателей суставного синдрома (суставной индекс Ричи (СИ), счет болезненных суставов (СБС), счет припухших суставов (СПС), продолжительность утренней скованности (мин), выраженность боли по визуально-аналоговой шкале (ВАШ)) и на основании общей оценки эффективности лечения, по мнению врача и больного. Кроме того, у всех больных оценивалась динамика АД на фоне лечения НПВП.
Результаты
В I группе на фоне лечения найзом в суточной дозе 200 мг за 3 нед. лечения достигнута достоверная динамика показателей суставного синдрома. При этом эффективность терапии оценена 17 пациентами (85%) как хорошая и 3 (15%) — как удовлетворительная. По мнению врача, в 16 случаях (80%) наблюдалась хорошая эффективность препарата, в 4 случаях (20%) — удовлетворительная (рис. 1). Переносимость найза у 85% была хорошей, только у 2 больных (10%) отмечались изжога и гастралгии, у 1 больного (5%) — чувство тяжести в эпигастральной области. Однако при фиброгастроскопии у этих пациентов не выявлено эрозивного повреждения слизистой оболочки желудка. В группе больных, принимавших найз, не потребовалось отмены препарата ни у одного больного.
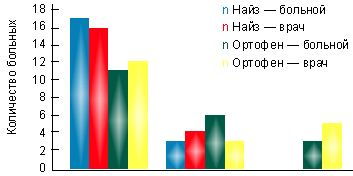 |
| Рисунок. Оценка эффективности препаратов на основании мнения больного и врача |
Во II группе на фоне терапии ортофеном в суточной дозе 150 мг через 3 нед. также отмечена существенная динамика показателей суставного синдрома. Однако оценка эффективности терапии показала, что только 11 пациентов (55%) оценили эффективность препарата как хорошую, 6 (30%) — как удовлетворительную и трое больных (15%) признали ее неудовлетворительной. По мнению лечащего врача, достаточная эффективность ортофена, соответствующая градации «хорошая», отмечалась в 12 случаях (60%), удовлетворительная — в 3 (15%) и неудовлетворительная — в 5 (25%) случаях (рис.).
Переносимость препарата ортофен была хуже, чем у найза: у 9 пациентов (45%) отмечались симптоматические побочные эффекты, причем у 3 больных (15%) потребовалась отмена препарата через 2 нед. от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. В целом из побочных эффектов чаще отмечались изжога — у 7 (35%) пациентов, гастралгии — у 8 (40%), тошнота — у 4 (20%) и диарея — у 2 (10%) больных.
Особый интерес представляет влияние исследуемых НПВП на уровень АД, так как из 40 больных у 15 имелась сопутствующая ГБ, по поводу которой проводилась гипотензивная терапия. Динамика уровня АД в обеих группах на фоне лечения найзом и ортофеном представлена в таблице 2. Следует отметить, что терапия найзом не требовала усиления проводимой гипотензивной терапии (β-блокаторами, ингибиторами АПФ, диуретиками) и не вызывала повышения АД у ранее нормотензивных пациентов. В то же время лечение ортофеном потребовало коррекции доз гипотензивных препаратов у 4 (66,7%) из 6 больных ГБ и вызвало повышение АД у 5 (25%) женщин в постменопаузе с исходно высоконормальным АД. Данный эффект неселективного НПВП — ортофена — следует считать предсказуемым, особенно с учетом характера проводимой гипотензивной терапии. Все больные ГБ получали в разных комбинациях β-адреноблокаторы, ингибиторы АПФ и диуретики; при этом ни одному пациенту не был назначен дигидропиридиновый антагонист Са — амлодипин, который является препаратом выбора для лечения АГ в условиях терапии НПВП.
Таким образом, результаты открытого клинического исследования показали, что препарат найз у больных РА проявляет выраженную противовоспалительную активность, превосходящую диклофенак. При этом найз характеризуется хорошей переносимостью, малым числом симптоматических побочных эффектов и превосходит с этой точки зрения наиболее широко применяемый в клинической практике ортофен. Дополнительным преимуществом препарата найз можно считать менее выраженное влияние на уровень АД. При назначении найза не требовалось увеличения дозы гипотензивных препаратов. С учетом высокой распространенности эссенциальной гипертензии в популяции, взаимодействие НПВП с наиболее часто используемыми гипотензивными средствами представляется актуальной проблемой. Ревматические заболевания, требующие постоянной терапии НПВП, часто сочетаются с АГ. При этом у большинства больных ГБ коррекция АД может достигаться только благодаря комбинированной антигипертензивной терапии, а монотерапия дигидропиридиновыми антагонистами Са признается недостаточно эффективной. Следовательно, в большинстве случаев при лечении воспалительных ревматических заболеваний у лиц, страдающих ГБ, невозможно полностью нивелировать отрицательное взаимодействие «стандартных» НПВП с основными кардиологическими препаратами — β-адреноблокаторами, ингибиторами АПФ и диуретиками. В такой ситуации представляется рациональным выбор для проведения противовоспалительной терапии специфических ингибиторов ЦОГ-2, представителем которых является найз.
Литература
И. М. Марусенко, кандидат медицинских наук
Н. Н. Везикова, кандидат медицинских наук, доцент
В. К. Игнатьев, доктор медицинских наук, профессор
Петрозаводский университет, кафедра госпитальной терапии
Артериальная гипертензия у больных подагрой: возможности лечения
Внастоящее время подагра рассматривается как важная общемедицинская проблема, что связано не только с увеличением распространенности болезни, но и с полученными данными о влиянии гиперурикемии на прогрессирование атеросклеротического поражения сосудов.
Внастоящее время подагра рассматривается как важная общемедицинская проблема, что связано не только с увеличением распространенности болезни, но и с полученными данными о влиянии гиперурикемии на прогрессирование атеросклеротического поражения сосудов [1, 2]. По мнению экспертов, подагра является метаболическим заболеванием [3, 4], а гиперурикемия — одним из важнейших компонентов метаболического синдрома. Еще в 60-е годы прошлого века была обнаружена тесная взаимосвязь между нарушениями пуринового обмена и гипертриглицеридемией [6]. По результатам 8-летнего исследования доказана связь между гиперурикемией и инсулинорезистентностью [5]. Гиперурикемия является независимым фактором риска сердечно-сосудистых заболеваний [1, 2, 7], поэтому диагностика и лечение подагры, гиперурикемии, а также осложнений заболевания являются актуальной проблемой терапии.
Помимо непосредственного патологического влияния повышенного уровня мочевой кислоты на стенку сосудов важное значение у больных подагрой приобретает воздействие повышенного артериального давления (АД), которое чрезвычайно часто встречается у данной категории пациентов [8]. Артериальная гипертензия (АГ), в свою очередь, значительно увеличивает риск кардиоваскулярных катастроф [8, 9]. Актуальной проблемой является применение патогенетически обоснованной, безопасной гипотензивной терапии, обеспечивающей адекватный контроль АД в течение суток. У больных подагрой, страдающих АГ, необходимо учитывать взаимосвязь сложных метаболических процессов, чтобы не увеличить риск терапевтически-индуцированной подагры [3]. Важнейшее значение приобретает метаболическая безопасность препаратов, применяемых для лечения АГ у больных подагрой. Под метаболической нейтральностью препаратов понимают влияние их не только на липидный и углеводный обмен, но и на уровень мочевой кислоты [3]. Кроме того, адекватная гипотензивная терапия подразумевает выбор препарата, обладающего возможностью дополнительного снижения риска сердечно-сосудистых осложнений, уменьшения выраженности эндотелиальной дисфункции. Далеко не все препараты, входящие в стандарты лечения сердечно-сосудистых заболеваний, удовлетворяют этим условиям у пациентов, страдающих подагрой. Так, диуретики считаются средствами первого ряда для длительной терапии больных с АГ. Все классы мочегонных препаратов противопоказаны при подагре. Показано, что не существует безопасного класса диуретиков. Все препараты данной группы ингибируют экскрецию мочевой кислоты, приводя к гиперурикемии; β-адреноблокаторы также не являются препаратами выбора при сочетании подагры и АГ, так как они увеличивают инсулинорезистентность, гиперинсулинемию, усугубляя гиперурикемию [4].
В настоящее время известно, что метаболически нейтральными препаратами, обеспечивающими оптимальный контроль АД, являются антагонисты кальция дигидропиридинового ряда длительного действия (амлодипин), ингибиторы ангиотензинпревращающего фермента [4], блокатор АТ1-рецепторов ангиотензина II (лозартан) [10]. Среди указанных групп препаратов особое место принадлежит антагонистам кальция. Механизм действия связан с блокированием медленных кальциевых каналов и препятствованием внутриклеточной гиперкальциемии, с расслаблением гладких мышц и снижением периферического сосудистого сопротивления. Период полувыведения амлодипина равен 35–50 ч. В многочисленных многоцентровых исследованиях (NORDIL, INSIGHT, VHAT, HOT, ALLHAT) показано снижение риска сердечно-сосудистых осложнений на фоне терапии антагонистами кальция пролонгированного действия. Неоспоримым преимуществом препаратов является возможность использования их у пациентов с метаболическим синдромом, так как они не обладают отрицательным влиянием на углеводный, липидный, пуриновый обмены [11, 12].
Несмотря на большое количество исследований, посвященных диагностике, тактике выбора препаратов при АГ, вплоть до настоящего времени недостаточно данных об особенностях суточного профиля АД у больных подагрой, влиянии пролонгированных антагонистов кальция при сочетании подагры и АГ.
Целью нашего исследования явилось изучение циркадных ритмов АД, эффективности применения амлодипина при сочетании подагры и АГ.
Материал и методы
В исследование были включены 40 больных первичной подагрой — основная группа (ОГ) (32 мужчины и 8 женщин), средний возраст 52,88 ± 2,08 года (от 30 до 76 лет). Диагноз подагры был определен на основании классификационных критериев, предложенных Wallace и соавторами, рекомендованных ARA в 2001 г. Критериями невключения являлись наличие ассоциированных с АГ состояний (в том числе сахарный диабет, ишемическая болезнь сердца), сопутствующие хронические болезни в стадии обострения, острый приступ подагрического артрита. Все обследованные пациенты страдали АГ (длительность болезни от 1 года до 30 лет), риск был расценен как высокий и очень высокий.
Группу сравнения (ГС) составили 20 пациентов с артериальной гипертензией, сопоставимых по возрасту, полу, сопутствующей патологии. В контрольную группу (КГ) было включено 20 клинически здоровых лиц. Всем обследованным лицам проводилось общеклиническое исследование, суточное мониторирование АД в условиях стационара, определение антитромбогенной активности сосудистой стенки.
У больных подагрой проводились исследования, необходимые для подтверждения диагноза, выявления особенностей течения заболевания, поражения различных органов и систем (мочевая кислота сыворотки крови и суточной мочи, рентгенография пораженных суставов, пункция суставов, ультразвуковое исследование почек). Наиболее часто поражались суставы нижних конечностей. У подавляющего большинства больных (87%) вовлечение суставов начиналось с артрита плюснефалангового сустава I пальца стопы. Средняя длительность заболевания составила 9,65 ± 2,03 года (от 0,6 до 32 лет), обращались к врачу в среднем на 10 год болезни. У 68% пациентов диагностирована тофусная подагра, к которой относили подкожные, внутрикостные тофусы (симптом «пробойника»), нефролитиаз. Гиперурикемия выявлена у 73% больных подагрой. Артериальная гипертензия у данной категории пациентов клинически отличалась малосимптомностью, в связи с чем более половины пациентов не контролировали АД и не принимали регулярно гипотензивные препараты. На амбулаторном этапе 46% обследованных больных подагрой с гипотензивной целью принимали иАПФ, антагонисты кальция, адреноблокаторы, диуретики (10%), комбинированные препараты, на фоне терапии целевой уровень АД был достигнут лишь у 15% больных.
При поступлении в стационар всем обследованным лицам проводилось суточное мониторирование АД с частотой 15 мин в дневные часы и 30 мин в ночные часы. Оценивались следующие показатели: среднее АД, максимальное, минимальное АД, вариабельность АД, гипертонический индекс времени АД. Все параметры определялись как для систолического АД (САД), так и для диастолического АД (ДАД).
Всем пациентам в качестве гипотензивной терапии назначался амлодипин (Амловас) в начальной дозе 5 мг/сут. Титрование дозы препарата проводилось через 3–5 дней пребывания в стационаре с увеличением до 10 мг/сут при необходимости или комбинирование с иАПФ. Через 3 месяца регулярного приема гипотензивных препаратов проводилось повторное суточное мониторирование АД. В течение этого времени контроль эффективности терапии, наличия побочных эффектов осуществлялся при ежемесячных визитах пациентов.
Статистический анализ проводился с помощью пакета прикладных программ STATISTICA 6.0, описательной статистики. Результаты расценивались как статистически значимые при величинах достигнутого уровня достоверности (p) менее 0,05.
Результаты
Усредненные данные суточного мониторирования АД у больных подагрой и пациентов, страдающих АГ, представлены в табл.
У больных подагрой отмечены более высокие показатели среднего систолического, диастолического, пульсового АД, максимального и минимального АД, индекса времени гипертензии, вариабельности АД, хотя данные различия по сравнению с аналогичными параметрами у лиц группы сравнения не достигали статистически значимых.
Однако существенные отличия были в степени снижения АД в ночное время. Так, у большинства больных подагрой (73,7%) выявлен суточный профиль с недостаточной степенью снижения АД (Non-dipper), у 21% пациентов регистрировалось устойчивое повышение АД в ночные часы (Night-peaker), нормальную степень снижения АД имели лишь 5% больных (Dipper). Тогда как у больных АГ преимущественно (62,5%) наблюдался профиль Dipper, в 25% случаев — Non-dipper, у 12,5% пациентов — Night-peaker. Таким образом, среди больных подагрой достоверно чаще регистрировался профиль Non-dipper по сравнению с лицами, страдающими АГ (р
А. П. Ребров, доктор медицинских наук, профессор
Н. А. Магдеева
СГМУ, Саратов