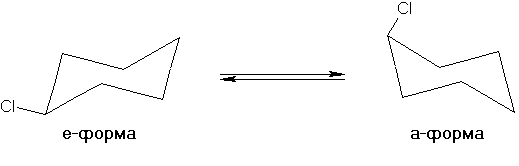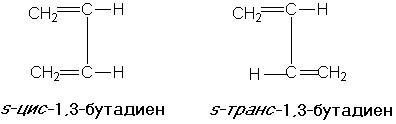какое второе название оптической изомерии
Оптическая изомерия
Опти́ческая изомери́я (энантиомерия) — разновидность пространственной изомерии, являющаяся прямым следствием хиральности молекул, проявляется способностью некоторых веществ поворачивать плоскость поляризованного луча в противоположные стороны. Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии, которые относятся друг к другу как предмет к своему зеркальному отражению.
Энантиомерия (оптическая изомерия)
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идет об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
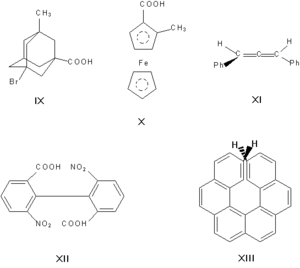
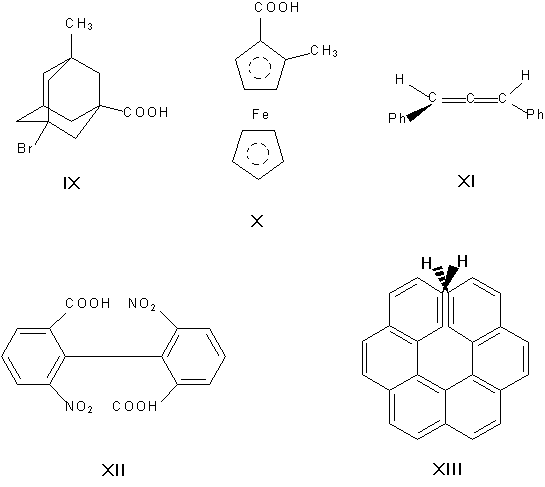
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6′-динитро-2,2′-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Оптические изомеры
Содержание
Исторические сведения
В итоге полемики Ю. Либиха и Ф. Вёлера было установлено (1823), что существуют два резко различных по свойствам вещества состава AgCNO — циановокислое (AgNCO) и гремучее (AgONC) серебро. Ещё одним примером послужили винная и виноградная кислоты, после исследования которых Й. Берцелиус в 1830 ввел термин ИЗОМЕРИЯ и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (т. е. молекуле). Подлинное объяснение изомерия получила лишь во 2-й половине XIX в. на основе теории химического строения А. М. Бутлерова (структурная изомерия) и стереохимического учения Я. Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
Изомерия углеводородной цепи (углеродного скелета)
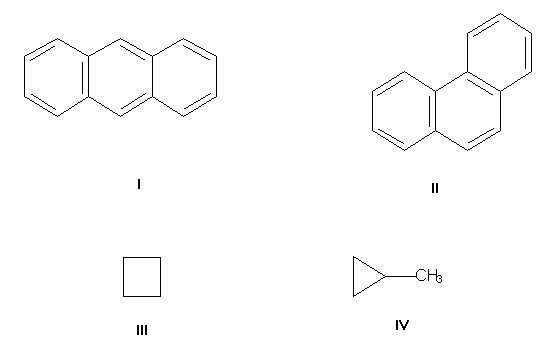
Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3-СН2-СН2-СН3 и изобутан (СН3)3СН. Др. примеры: антрацен и фенантрен (формулы I и II соответственно), циклобутан и метилциклопропан (III и IV).
Валентная изомерия
Валентная изомерия (особый вид структурной изомерии), при которой изомеры можно перевести друг в друга лишь за счет перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен(VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»), бензвален (VIII).
Изомерия функциональной группы
Различается характером функциональной группы. Пример: Этанол (CH3-CH2-OH) и Диметиловый эфир (CH3-O-CH3)
Изомерия положения
Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или двойных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Пространственная изомерия (стереоизомерия)
Энантиомерия (оптическая изомерия)
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Асимметрическими могут быть и др. атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллен (XI), 6,6′-динитро-2,2′-дифеновая кислота (XII). Причина оптическое активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, гексагелицене (XIII).
(R)-, (S)- номенклатура оптических изомеров (правило наименования)
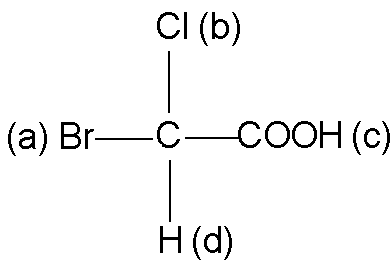
Четырём группам, присоединенным к ассиметрическому атому углерода Cabcd, приписывается различное старшинство, отвечающее последовательности: a>b>c>d. В простейшем случае старшинство устанавливается по порядковому номеру атома, присоединенного к ассиметрическому атому углерода: Br(35), Cl(17), S(16), O(8), N(7), C(6), H(1).
Например, в бромхлоруксусной кислоте:
Старшинство заместителей при ассиметрическом атоме углерода следующее: Br(a), Cl(b), C группы COOH (c), H(d).
У бутанола-2 кислород является старшим заместителем (а), водород — младшим (d):
Требуется решить вопрос о заместителях CH3 и CH2CH3. В этом случае старшинство определяется порядковым номером или номерами других атомов в группе. Первенство остается за этильной группой, так как в ней первый атом С связан с другим атомом С(6) и с другими атомами Н(1), тогда как в метильной группе углерод соединен с тремя атомами Н с порядковым номером 1. В более сложных случаях продлжают сравнивать все атомы, пока не доходят до атомов с различными порядковыми номерами. Если имеются двойная или тройная связи, то находящиеся при них атомы считаются соответственно за два и за три атома. Так, группу —COH рассматривают как С (O, O, H), а группу —COOH — как С(О, О, ОН); карбоксильная группа старше альдегидной, поскольку содержит три атома с порядковым номером 8.
В D-глицериновом альдегиде старшей является группа ОН(а), затем следует CHO(b), CH2OH(c) и Н(d):
Следующий этап заключается в определении, является ли расположение групп правым, R (лат. rectus), или левым, S (лат. sinister). Переходя к соответствующей модели, её ориентируют так, чтобы младшая группа (d) в перспективной формуле оказалась внизу, и затем рассматривают сверху вдоль оси, проходящей через заштрихованную грань тетраэдра и группу (d). В D-глицириновом альдегиде группы
расположены в направлении правого вращения, и следовательно, он имеет R-конфигурацию:
В отличие от D,L номенклатуры обозначения (R)- и (S)- изомеров заключают в скобки.
Диастереомерия
σ—диастереомерия
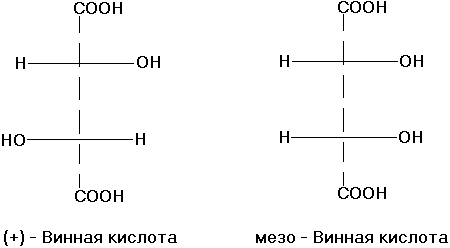
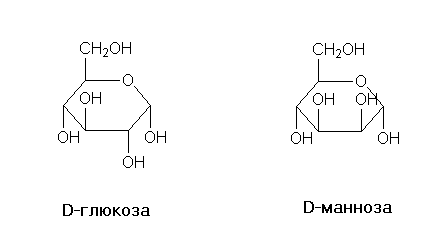
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ и π-диастереомеры. σ-диастериомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастериомеры являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
Для некоторых типов диастереомерия введены специальные обозначения, например трео- и эритро-изомеры — это диастереомерия с двумя асимметрическим атомами углерода и пространств, расположением заместителей у этих атомов, напоминающим соотвующую треозу (родственные заместители находятся по разные стороны в проекционных формулах Фишера) и эритрозу (заместители — по одну сторону):
Эритро-изомеры, которых асимметрические атомы связаны с одинаковыми заместителями, называются мезо-формами. Они, в отличие от остальных σ-диастереомеров, оптически неактивны из-за внутримолекулярной компенсации вкладов во вращение плоскости поляризации света двух одинаковых асимметрических центров противоположной конфигурации. Пары диастереомеров, различающиеся конфигурацией одного из нескольких асимметрических атомов, называются эпимерами, например:
Термин «аномеры» обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклической форме, например аномерны α-D- и β-D-глюкозы.
π—диастереомерия (геометрическая изомерия)
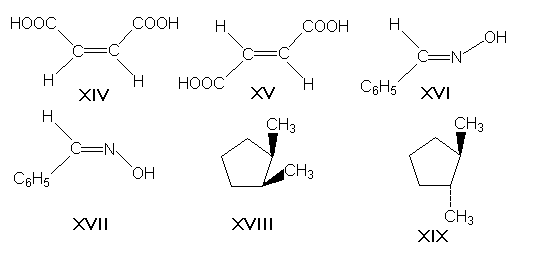
π-диастериомерами, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Конформеры. Таутомеры
Явление неразрывно связано с температурными условиями его наблюдения. Так, например, хлорциклогексан при комнатной температуре существует в виде равновесной смеси двух конформеров — с экваториальной и аксиальной ориентацией атома хлора:
Однако при минус 150 °С можно выделить индивидуальную а-форму, которая ведет себя в этих условиях как устойчивый изомер.
С др. стороны, соединения, в обычных условиях являющиеся изомерами, при повышении температуры могут оказаться находящимися в равновесии таутомерами. Например, 1-бромпропан и 2-бромпропан — структурные изомеры, однако при повышении температуры до 250 °С между ними устанавливается равновесие, характерное для таутомеров.
Изомеры, превращающиеся друг в друга при температуре ниже комнатной, можно рассматривать как нежесткие молекулы.
Существование конформеров иногда обозначают термином «поворотная изомерия». Среди диенов различают s-цис- и s-транс — изомеры, которые, по существу, являются конформерами, возникающими в результате вращения вокруг простой (s-single) связи:
Изомерия также характерна для координационных соединений. Так, изомерны соединения, различающиеся по способу координации лигандов (ионизационная изомерия), например, изомерны:
Здесь, по существу, имеется аналогия со структурной изомерии органических соединений.
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (—)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров — обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов более 500 (известно из них около 70), пространств, изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы. Для обозначения пространств, изомеров разных типов разработана номенклатура стереохимическая, собранная в разделе Е Номенклатурных правил ИЮПАК по химии.
Оптические изомеры
Химикам уже давно известно явление изомерии — когда два вещества имеют одну и ту же брутто-формулу (отражающую только количество разных атомов в веществе), но разные свойства — из-за разного порядка соединения атомов.
Особенно богата изомерами органическая химия. К примеру, этиловый спирт и диметиловый эфир имеют одну и ту же брутто-формулу: C2H6O, но структурная формула спирта — CH3–CH2–OH, а эфира — CH3–O–CH3. Эти вещества имеют разные свойства — как химические, так и физические (температура плавления, вязкость и т. д.).
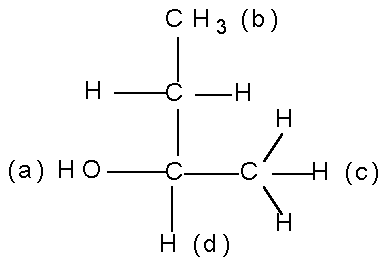
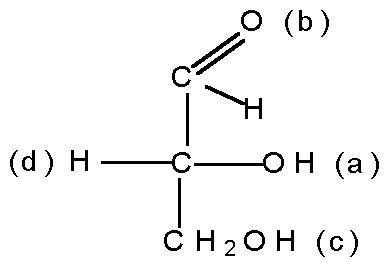
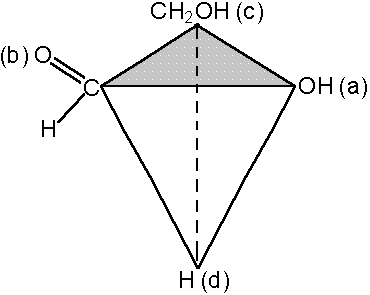
В органической химии известны и так называемые оптические изомеры — молекулы, имеющие одинаковую структурную формулу, но не совместимые со своим зеркальным отражением. Простейший пример такой молекулы — это атом углерода с четырьмя разными заместителями. К примеру, СHClBrF или аланин CH3CHNH2COOH (рис. 1). Наличие у такой молекулы двух разных конфигураций связано с тем, что у атома углерода, образующего четыре одинарные связи, эти связи направлены к вершинам тетраэдра.
Оптические изомеры имеют одинаковый цвет, температуру кипения, плотность. Однако такие вещества обладают интересным физическим свойством — они вращают плоскость поляризации пропущенного через них поляризованного света. Один изомер будет вращать ее влево, другой — вправо.
Атом углерода с четырьмя разными заместителями называется хиральным атомом (от греческого heiros «ладонь» — тот же корень, что и в слове «хиромантия»). Чем больше хиральных атомов в молекуле, тем больше у вещества может быть оптических изомеров.
Интересно, что возможны органические вещества, которые имеют оптические изомеры, хотя в них формально нет ни одного хирального атома — центра изомерии.
Задача
Приведите пример органического вещества, не имеющего хиральных атомов, но при этом имеющего оптические изомеры, с минимальным количеством атомов углерода.
Подсказка 1
Для того чтобы молекула некоторого вещества не совпадала со своим зеркальным отражением, совершенно не обязательно, чтобы у нее был хотя бы один хиральный атом. К примеру, любая молекула в форме спирали будет оптически активной.
Подсказка 2
Кроме того, вспомните, к вершинам какой геометрической фигуры направлены четыре связи в хиральном атоме углерода.
Решение
Начнем с того, что для несовместимости со своим зеркальным отражением молекуле недостаточно быть просто несимметричной. Молекула может быть не равна своему отражению «на бумаге», но совместима с ним. Скажем, молекулу HCl мы можем просто повернуть (или посмотреть на нее с другой стороны). Мы можем также вращать части молекулы вокруг одинарных связей — а вот с двойными и тройными связями так поступать нельзя, они при этом рвутся.
Итак, если структура молекулы имеет такую пространственную асимметрию, что она не совмещается со своим зеркальным отражением, то молекула и ее отражение называются оптическими изомерами. Наша цель — попробовать придумать структуру, которая бы была несовместима со своим зеркальным отражением, имела бы минимальное количество атомов углерода, и при этом сами эти атомы не были бы хиральными центрами молекулы.
На первый взгляд, такой молекулой могли бы быть замещенные этилены, где вместо атомов водорода — четыре разных заместителя:
Однако несмотря на то, что у такого вещества есть изомеры (два произвольно выбранных заместителя у разных атомов углерода могут располагаться по одну сторону двойной связи или по разные), хиральными они не будут, так как молекулы с одной двойной связью — плоские; чтобы совместить их со своим зеркальным отражением, их достаточно просто повернуть на 180° вокруг оси, лежащей в плоскости молекулы и перпендикулярной двойной связи.
Существует вариант с тремя атомами углерода, который формально уже можно назвать решением нашей задачи. Четырехзамещенные аллены RR’C=C=CR»R»’ тоже содержат двойные связи, но их молекулы уже не плоские. Дело в том, что если у одного атома углерода есть две двойные связи, то их плоскости повернуты друг относительно друга на 90 градусов:
Эта молекула уже хиральна, и можно сказать, что задачу мы решили. Однако в ней есть «хиральный центр» — центральный атом углерода. Попробуем решить задачу другим способом.
Три атома углерода можно расположить по-другому — создав из них треугольник. У нас получится вещество циклопропан, С3H6:
Это хорошо известное вещество, которое до сих пор иногда используется в медицине в качестве средства для наркоза. Атомы углерода образуют жесткую плоскость. Каждый из них связан с двумя атомами водорода — один над плоскостью, другой — под ней.
Теперь заменим у двух атомов углерода по одному атому водорода на два других заместителя — к примеру, хлор и бром — так, чтобы они оказались по разные стороны от плоскости атомов углерода. Такое положение заместителей называется транс-изомером 1,2-дизамещенного циклопропана. (Если бы эти заместители располагались по одну сторону от плоскости, у нас получился бы цис-изомер, но он нас сейчас не интересует).
Внимательно посмотрим на получившуюся молекулу и представим себе ее зеркальное отражение:
Обе структуры, как бы мы ни крутили их в пространстве, друг с другом не совмещаются, а атома — хирального центра тут нет.
А теперь попробуем создать полный аналог хирального атома углерода — но без хирального центра. Вернемся к первоначальному атому, с которого мы начали (см. условие задачи). Четыре связи его направлены к вершинам тетраэдра. Давайте попробуем расположить по атому углерода в его вершинах и соединить их связями.
У нас получится углеродный скелет вещества C4H4 — тетраэдрана. Само это вещество еще не получено химиками, но его производные уже существуют в реальности. Если заместить в нём все атомы водорода на разные заместители, то получится вполне себе хиральная молекула, «хиральный центр» которой будет располагаться внутри тетраэдра:
Послесловие
Тема изомерии — одна из самых благодатных тем для игры ума. Даже в школьных олимпиадах по химии очень часто можно встретить задания с просьбой написать все изомеры того или иного вещества (иногда сами составители задач чего-то не рассчитывают, и на решение уходит много времени и очень много бумаги; у автора этой задачи на районной олимпиаде как-то ушло полтора часа и целая тетрадка).
Оптические изомеры — всего один из вариантов изомерии в органической химии, но очень важный.
К примеру, все основные аминокислоты, которые входят в состав наших белков, имеют формулу H2N–CH(R)–COOH — то есть все (кроме глицина, у которого R тоже представляет собой атом водорода) имеют асимметрический атом углерода и имеют оптические изомеры. И в нашем организме встречаются почти исключительно L-изомеры аминокислот (если не вдаваться в тонкости номенклатуры хиральных атомов, которых существует целых три типа, то можно назвать эти молекулы «левыми»). И биохимики до сих пор гадают, почему природа выбрала именно этот изомер — ведь при всех реакциях, когда из более простых веществ получаются вещества с хиральным атомом (без присутствия специфических катализаторов) образуется смесь двух изомеров в равных частях.
Синтетики тоже любят «поиграть» с оптической изомерией и при этом уже создали множество веществ без хирального атома — но с оптической активностью.
Кстати, можно создать хиральную молекулу вообще без заместителей. И она будет достаточно небольшой. Существуют так называемые ароматические углеводороды. Самый простой из них — бензол, C6H6. Его структуру учат в школе — плоский шестигранник. Вещество посложнее — нафталин. Это уже два соединенных по одной стороне бензольных кольца:
Три кольца можно уже соединять в линию — получится антрацен, а можно — под углом, и тогда у нас получится фенантрен:
Так вот, если продолжать соединять кольца под углом и дойти до шести колец, то крайние кольца упрутся друг в друга, им не хватит места, и плоскость молекулы нарушится. Вещество из шести колец называется гексагелицен, и его молекула уже представляет собой спираль. А значит, эта молекула может быть либо левой спиралью, либо правой, и будет иметь оптические изомеры.
Кстати, химики научились получать такие спирали даже из 12 бензольных колец, в них уже есть пара витков.
Более того, и оптическими изомерами весь ассортимент разнообразия химических веществ, как ни странно, не заканчивается.
Стоит сказать о возможности так называемой топологической изомерии. Что это такое? К примеру, существует вещество в форме кольца. Две молекулы этого вещества изомерны одной, в которой одно кольцо продето в другое. И такие молекулы уже есть. Класс веществ, в которых две или более частей молекул удерживаются механически, как звенья цепи, называются катенанами — от латинского catena «цепь» (см. Catenane). Биохимики научились получать катенаны из молекул ДНК, и более короткие структуры тоже складывали в цепочки.
А если представить себе катенан из четырех колец, то возможна изомерия между молекулой, в которой три кольца продеты в четвертое, и молекулой, в которых кольца соединены последовательно.
Виды изомерии в органической химии
Изомерия в химии — что это за явление
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Подробнее явление изучил Й. Берцелиус. Исследовав винную и виноградные кислоты (у обеих формула C 4 H 6 O 6 ) он в 1830 году ввел термин «изомерия». Его предположение заключалось в следующем: вещества с одинаковым составом могут различаться из-за разного распределения атомов в молекуле.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Изомерия — явление, суть которого заключается в существовании химических соединений, которые одинаковы по качественному и количественному составу, но различаются по строению или расположению атомов в пространстве. Вследствие этого они обладают разными физическими и химическими свойствами.
Из данного определения следует определение веществ-изомеров.
Изомеры — это химические соединения с одинаковым составом, но разные по строению или пространственному расположению атомов и свойствам.
Как правило, большое количество изомеров характерно для представителей широко известного класса аминокислот. За счет различных заместителей при α-углеродном атоме им также свойственна и оптическая изомерия, которая будет рассмотрена далее.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
Структурная изомерия
Структурные изомеры — вещества, которые одинаковы по качественному и количественному составу, но различающиеся строением, т. е. порядком расположения атомов. Структурные изомеры имеют одинаковые молекулярные, но разные структурные формулы.
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола ( C 6 H 6 ), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
Рассмотрим подробнее каждый из типов.
1. Оптическая изомерия (энантиомерия).
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
У одного и того же вещества могут быть разные типы изомеров. Так, многим представителем класса алкенов свойственны межклассовая, геометрическая и изомерия углеродного скелета. Среди альдегидов встречается структурная изомерия — углеродного скелета и межклассовая. Для циклоалканов характерна межклассовая изомерия, цис-, транс-изомерия и др.