какое состояние атома называют основным состоянием
Основное и возбужденное состояние атома



Состояние атома, при котором его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными.
При сообщении атому дополнительной энергии электроны могут переходить на обладающие большей энергией орбитали. Эти переходы с подуровня на подуровень возможны только в пределах одного внешнего энергетического уровня. Привозбуждении могут распариваться электроны только внешнего электронного уровня, если на нем есть свободные орбитали.
вОПРОС №6Строение электронных оболочек атомов. Принцип наименьшей энергии, правило Гунда, принцип Паули. Электронная структура атомов и периодическая система Д.И. Менделеева. Формулировка периодического закона Д.И. Менделеева.
4.1. Периодический закон Д.И.Менделеева
«Свойства химических элементов, а также свойства и форма образуемых ими соединений, находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов».
По принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Согласно принципу наименьшей энергии электроны заполняют орбитали в порядке повышения их энергии.
Очередность заполнения орбиталей определяется правилом Клечковского: увеличение энергии и, соответственно, заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равной сумме (n + l) – в порядке возрастания главного квантового числа n.
правило Гунда:
в пределах подуровня электроны размещаются таким образом, чтобы сумма их спиновых квантовых чисел имела бы максимальное значение по абсолютной величине.
Электронная конфигурация атома может быть изображена в виде так называемой электронно-графической формулы. Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с различными значениями спиновых квантовых чисел.
Чтобы составить электронную или электронно-графическую формулу любого элемента следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
число неспаренных (одиночных) электронов определяет валентность элемента, т.е. его способность образовывать химические связи с другими элементами.
Периодическая система, как графическое изображение Периодического закона Д.И. Менделеева, состоит из периодов и групп. Все периоды начинаются с s-элемента и заканчиваются p-элементом первого периода s-элементомПо вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства.
Основное и возбужденное состояние атома
Как известно, атомы могут вступать в химические реакции с другими атомами, с образованием химических связей, путем отдачи/принятия своих/чужих электронов, которые называются валентными (см. Валентность).
В Периодической таблице химических элементов Д. И. Менделеева все атомы отображены в их основном состоянии (состоянии с минимальной энергией). Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице (см. Таблицу электронных конфигураций атомов химических элементов по периодам.
В определенных ситуациях, некоторые атомы, получая энергию извне, переходят в, так называемое, возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние.
Рассмотрим основное и возбужденное состояние атома на конкретных примерах.
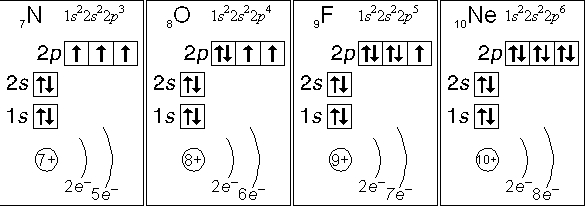
Рис. Электронные конфигурации атомов азота, кислорода, фтора, неона.
Азот, кислород, фтор и неон не могут иметь возбужденного состояния по той простой причине, что они не имеют свободной орбитали с более высокой энергией, на которую могли бы «перескакивать» спаренные электроны с орбиталей с меньшей энергией.
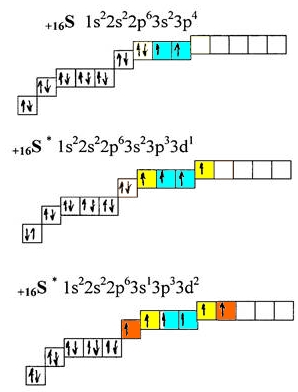
Рис. Возбужденное состояние атома серы.
В основном состоянии атом серы имеет 2 валентных электрона (голубой цвет). Как видно из вышеприведенного рисунка, получая энергию извне, у атома серы могут появляться еще 2 (желтый цвет) или 4 (желтый+оранжевый) дополнительных валентных электрона, при этом общее кол-во валентных электронов увеличивается до 4 или 6 соответственно.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Возбужденные атомы: 1. Кто такие и где встречаются

Три изображения атома: стилизованное, упрощенное и более реалистичное. Упрощенная модель нарисована в соответствии с устаревшей боровской моделью атома, но она удобна для иллюстраций перехода электрона с орбиты на орбиту. Однако не поддавайтесь ложному впечатлению, которое она создает! Реальные электроны в атоме — это вовсе не маленькие шарики, которые летают по четко заданным орбитам; они больше напоминают размазанные в пространстве облака электронной плотности
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Вверху: электронные облака для некоторых возбужденных состояний атома водорода. Внизу: энергетический спектр атома водорода. Изображение с сайта en.wikipedia.org
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Спектральный состав света, исходящего от полярного сияния, позволяет определить, какие именно молекулы испускают это сияние и с какой интенсивностью. Изображение с сайта atoptics.co.uk
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Строение атома
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Одну из первых моделей строения атома — « пудинговую модель » — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома ( массовое число A ) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу:
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
АО
 2
2 2
2

 6
6Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s 2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
1s 2 = [He]
1s 2 2s 2 2p 6 = [Ne]
1s 2 2s 2 2p 6 3s 2 3p 6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s 1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s 2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s 2 2s 1 1s 
У бериллия 2s-подуровень заполнен:
+4Be 1s 2 2s 2 1s 
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s 2 2s 2 2p 1 1s 

+6C 1s 2 2s 2 2p 2 1s 

Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s 2 2s 2 2p 6 1s 

У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s 2 2s 2 2p 6 3s 1 1s 


От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
+19K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 1s




Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s 1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s 2 [Ar] 4s
+21Sc [Ar]3d 1 4s 2 [Ar] 4s 
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия :
+22Ti [Ar]3d 2 4s 2 [Ar] 4s 
+23V [Ar]3d 3 4s 2 [Ar] 4s 
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d 5 4s 1 [Ar] 4s 
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца :
+25Mn [Ar]3d 5 4s 2
+29Cu [Ar]3d 10 4s 1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d 10 4s 2
+31Ga [Ar]3d 10 4s 2 4p 1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d 5 4s 1 ) валентными являются не только электроны внешнего энергетического уровня (4s 1 ), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
+5B 1s 2 2s 2 2p 1 1s 

На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s 2 2s 1 2p 2 1s 

Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
+11Na 1s 2 2s 2 2p 6 3s 1 -1е = +11Na + 1s 2 2s 2 2p 6 3s 0
+17Cl 1s 2 2s 2 2p 6 3s 2 3p 5 +1e = +17Cl — 1s 2 2s 2 2p 6 3s 2 3p 6
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са 2+
19. Ион S 2-
20. Ион Ni 2+
Таким образом, ионы Na + и F — — изоэлектронные. Также они изоэлектронны атому неона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота :
+7N 1s 2 2s 2 2p 3 1s 

6. Электронная формула кислорода :
+8О 1s 2 2s 2 2p 4 1s 

7. Электронная формула фтора :
8. Электронная формула магния :
+12Mg 1s 2 2s 2 2p 6 3s 2 1s 


9. Электронная формула алюминия :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



10. Электронная формула кремния :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2 1s 



11. Электронная формула фосфора :
+15P 1s 2 2s 2 2p 6 3s 2 3p 3 1s 



12. Электронная формула серы :
+16S 1s 2 2s 2 2p 6 3s 2 3p 4 1s 



13. Электронная формула хлора :
14. Электронная формула аргона :
+18Ar 1s 2 2s 2 2p 6 3s 2 3p 6 1s 



15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s 2 2s 1 2p 3 1s 

16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s 2 2s 1 2p 1 1s 

17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са 2+ : +20Ca 2+ 1s 2 2s 2 2p 6 3s 2 3p 6
19. Электронная формула аниона серы S 2- : +16S 2- 1s 2 2s 2 2p 6 3s 2 3p 6





















