какое пространственное строение имеет молекула этилена
Строение молекулы этилена (C2H4), схема и примеры
Общие сведения о строении молекулы этилена
Этилен (этен) – первый представитель гомологического ряда алкенов (непредельные углеводороды с одной двойной связью).
Брутто-формула: C2H4. Молярная масса – 28 г/моль.
Этилен представляет собой газ без цвета, но со слабым запахом. Плотность 1,178 кг/м 3 (легче воздуха). Горючий. Мало растворим в воде, но хорошо в диэтиловом эфире и углеводородах.
Видео
Роль этилена в живом мире
Это первый из открытых газообразных гормонов растений с разнообразными биологическими влияниями. Это и гормон роста, и гормон стресса в одном лице. В сельском хозяйстве его получают в специальных каталитических генераторах из этанола, откуда газ впрыскивают в камеры с плодами. Процесс дозревания зависит от концентрации введенного в камеру этилена и длится от 24 до 48 часов.
Да и самим плодам не слишком будет хорошо в подобных условиях. Если передержать плоды в камере с этиленом, то можно получить обратный эффект: плоды испортятся и не будут годны в пищу, так как этилен стимулирует не только рост и созревание, но и старение, увядание.
В качестве гормона стресса этилен выделяется, когда нарушается целостность растения и его плодов. Это свойство использовали древние египтяне, когда намеренно царапали или мяли финики, фиги и другие плоды с целью скорейшего созревания плодов.
А если еще принять во внимание, что этилен является газообразным веществом, то можно предположить, что с помощью этилена осуществляется обмен информацией между разными органами растений и между растениями в популяции. Данное свойство важно, к примеру, при развитии у растений устойчивости к стрессу.
Итак, мы рассмотрели строение этилена и его биологическую роль. Как оказалось, первое является интересным, а второе – очень важным. В следующей статье мы будем говорить о строении и номенклатуре углеводородов ряда этилена.
Углеводороды
Л е к ц и я 3.
Непредельные углеводороды ряда этилена, общая формула состава. Электронное и пространственное строение, химические свойства этилена
Простейшим алкеном является этилен. Структурная и электронная формулы этилена имеют вид:
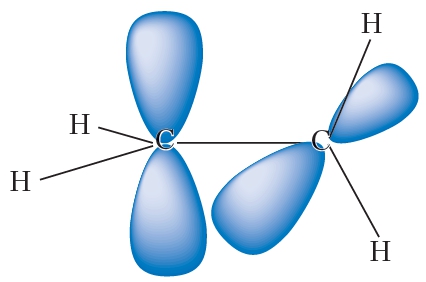
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака 
Этилен – первый член гомологического ряда алкенов.
Но молекула бутена-2 может находиться в виде двух пространственных форм – цис- и транс-:
Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами.
Таким образом, для алкенов возможны два вида структурной изомерии: изомерия углеродной цепи и изомерия положения двойной связи. Возможна также геометрическая изомерия.
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
По химическим свойствам этилен резко отличается от этана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из 


• Способность к реакциям присоединения характерна для всех алкенов.
1. Присоединение водорода (реакция гидрирования):
2. Присоединение галогенов (реакция галогенирования):
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):
Если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
Присоединение галогеноводородов к непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция гидратации):
Этой реакцией пользуются для получения этилового спирта в промышленности.
• Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена (реакция гидроксилирования) перманганатом калия (качественная реакция на двойную связь):
2. Этилен горит светящимся пламенем с образованием оксида углерода(IV) и воды:
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха:
• Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации. Они протекают при повышенной температуре, давлении и в присутствии катализаторов:
Полимеризация – это последовательное соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов характерны реакции присоединения, окисления и полимеризации.
Л е к ц и я 4.
Ацетилен – представитель углеводородов с тройной связью в молекуле.
Химические свойства, получение и применение ацетилена в органическом синтезе
Алкины – это углеводороды с общей формулой CnH2n–2, молекулы которых содержат одну тройную связь.
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов. Молекулярная формула ацетилена C2H2.
Структурная формула ацетилена H–C=C–H.
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s— и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется 



Таким образом, в молекуле ацетилена имеются три 



Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Физические свойства. Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Химические свойства. По химическим свойствам ацетилен во многом аналогичен этилену. Для него характерны реакции присоединения, окисления и полимеризации.
• Реакции присоединения. Алкины присоединяют не одну, а две молекулы реагента. Тройная связь вначале переходит в двойную, а затем – в простую связь (
1. Присоединение водорода (реакция гидрирования) происходит при нагревании в присутствии катализатора. Реакция протекает в две стадии, сначала образуется этилен, а затем – этан:
2. Присоединение галогенов (реакция галогенирования) протекает очень легко (также в две стадии):
Бромная вода при этом обесцвечивается. Обесцвечивание бромной воды служит качественной реакцией на ацетилен, как и на все непредельные углеводороды.
3. Присоединение галогеноводородов (реакция гидрогалогенирования). Важное значение имеет реакция присоединения хлороводорода:
Из винилхлорида получают полимер – поливинилхлорид.
4. Присоединение воды (реакция гидратации) протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида:
Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
• Реакции окисления. Ацетилен очень чувствителен к окислителям.
1. При пропускании через раствор перманганата калия ацетилен легко окисляется, а раствор KMnO4 обесцвечивается:
Обесцвечивание перманганата калия может быть использовано как качественная реакция на тройную связь.
При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
R–C=C–R ‘ + 3[O] + H2O —> R–COOH + R ‘ –COOH.
Ацетилен при полном сгорании образует оксид углерода(IV) и воду:
На воздухе ацетилен горит сильно коптящим пламенем.
• Реакции полимеризации. В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
Получение ацетилена. В лаборатории и в промышленности ацетилен получают взаимодействием карбида кальция с водой (карбидный способ):
Карбид кальция получают в электропечах при нагревании кокса с негашеной известью:
На получение CaC2 затрачивается много электроэнергии, поэтому карбидный метод не может удовлетворить потребности в ацетилене.
В промышленности ацетилен получают в результате высокотемпературного крекинга метана:
Применение ацетилена в органическом синтезе. Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают уксусную кислоту, растворители (1,1,2,2-тетрахлорэтан и 1,1,2-трихлорэтен). При сжигании ацетилена в кислороде температура пламени достигает 3150 °С, поэтому его используют при сварке и резке металлов.
Примеры промышленного использования ацетилена:
Л е к ц и я 5.
Диеновые углеводороды, их строение, свойства, получение и практическое значение
Диеновые углеводороды, или алкадиены, – это углеводороды, содержащие в углеродной цепи две двойные связи. Их состав может быть выражен общей формулой CnH2n–2. Они изомерны ацетиленовым углеводородам.
Большое применение имеют алкадиены, в молекулах которых двойные связи разделены простой связью (сопряженные двойные связи) – это
которые являются исходными веществами для получения каучуков.
Для образования двух двойных связей в одной молекуле необходимо по крайней мере три атома С. Простейшим представителем алкадиенов является пропадиен CH2=C=CH2.
Диеновые углеводороды могут различаться положением двойной связи в углеродной цепи:
Также возможна изомерия углеродной цепи.
Физические свойства. Бутадиен-1,3 при нормальных условиях – газ, который сжижается при t = 4,5 °С; 2-метилбутадиен-1,3 – летучая жидкость, кипящая при t = 34,1 °С.
Химические свойства. Диеновые углеводороды с сопряженными двойными связями обладают высокой химической активностью.
• Они легко вступают в реакции присоединения, реагируя с водородом, галогенами, галогеноводородами и т.д.
Обычно присоединение происходит по концам молекул диенов. Так, при взаимодействии с бромом двойные связи разрываются, к крайним атомам С присоединяются атомы брома, а свободные валентности образуют двойную связь, т.е. в результате присоединения происходит перемещение двойной связи:
При избытке брома может быть присоединена еще одна его молекула по месту оставшейся двойной связи.
У алкадиенов реакции присоединения могут протекать по двум направлениям:
1) по месту разрыва одной двойной связи (1,2-присоединение):
2) с присоединением к концам молекулы и разрывом двух двойных связей (1,4-присоединение):
Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
• Вследствие наличия двойных связей диеновые углеводороды довольно легко полимеризуются. Продуктом полимеризации 2-метилбутадиена-1,3 (изопрена) является полиизопрен – аналог натурального каучука:
Получение. Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем Васильевичем Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола в присутствии катализаторов на основе ZnO и Al2O3:
Но более перспективным методом получения бутадиена является дегидрирование бутана, содержащегося в нефтяных газах. При t = 600 °С происходит ступенчатое дегидрирование бутана при наличии катализатора:
Каталитическим дегидрированием изопентана получается изопрен:
Практическое значение. Диеновые углеводороды в основном применяются для синтеза каучуков:
Строение молекулы этилена
Общие сведения о строении молекулы этилена
Брутто-формула: C2H4. Молярная масса – 28 г/моль.
Этилен представляет собой газ без цвета, но со слабым запахом. Плотность 1,178 кг/м 3 (легче воздуха). Горючий. Мало растворим в воде, но хорошо в диэтиловом эфире и углеводородах.
Электронное строение молекулы этилена
Рис. 1. Строение молекулы этилена.
При образовании π-связи происходит сближение атомов углерода, потому что межъядерное пространство в двойной связи более насыщено электронами, чем в σ-связи. Это стягивает атомные ядра и поэтому длина двойной связи (0,133 нм) меньше одинарной (0,154 нм).
Примеры решения задач
| Задание | В результате присоединения йода к этилену получено 98,7 г иодопроизводного. Рассчитайте массу и количество вещества этилена, взятого для реакции. |
| Решение | Запишем уравнение реакции присоединения йода к этилену: |
В результате реакции образовалось иодопроизводное – дийодэтан. Рассчитаем его количество вещества (молярная масса равна – 282 г/моль):
Согласно уравнению реакции n(C2H4I2) : n(C2H4) = 1:1, т.е. n(C2H4I2) = n(C2H4) = 0,35 моль. Тогда масса этилена будет равна (молярная масса – 28 г/моль):
| Задание | Рассчитайте объем этилена, приведенный к нормальным условиям, который можно получить из технического этилового спирта C2H5OH массой 300 г. Учтите, что технический спирт содержит примеси, массовая доля которых равна 8%. |
| Решение | Запишем уравнение реакции получения этилена из этилового спирта: |
Найдем массу чистого (без примесей) этилового спирта. Для этого сначала рассчитаем его массовую долю:
Определим количество вещества этилового спирта (молярная масса – 46 г/моль):
Согласно уравнению реакции n(C2H5OH) : n(C2H4) = 1:1, т.е. n(C2H5OH) = n(C2H4) = 3,83 моль. Тогда объем этилена будет равен:
Что такое молекула этилена? Какое имеет строение молекула этилена?
Содержание:
Этилен, или этен (Н2С=СН2) – первое соединение из класса алкенов. Он представляет собой бесцветный горючий газ со сладким запахом. У него низкая растворимость в воде, но высокая в органических растворителях.
Строение этилена
Молекула этилена имеет линейное строение. Угол между гибридными орбиталями равен 120 °. Длина связи между углеродными атомами – 0,134 нм.
Химическая формула этена указывает на наличие двух атомов углерода и четырех атомов водорода. Между углеродными атомами присутствует двойная связь, что указывает на sp2-гибридизацию. Для каждого атома углерода характерны три гибридных и одна негибридизованная орбитали.
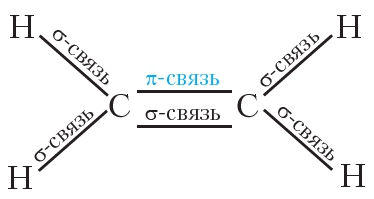
Таким образом, кратная связь формируется из сигма- и пи-связи.
Между атомом углерода и водорода ковалентная слабополярная одинарная сигма-связь. Между углеродными атомами ковалентная неполярная связь.
Для молекулы этилена не характерно пространственное строение, а для дальнейших представителей гомологического ряда алкенов, начиная с пропилена, оно свойственно. Это связано с тем, что у этих соединений есть углеродные атомы в sp3-гибридном состоянии. Метильный фрагмент СН3 выходит за пределы плоскости и образует тетраэдрическое строение.
Химические свойства этилена
В природе этилен играет роль фитогормона, который влияет на рост и развитие проростков, созревание плодов, опадение листьев. Его часто используют в сельском хозяйстве. Этилен получают из этанола в специальных генераторах, откуда газ поступает в камеры с растениями. Плоды в присутствии этена дозревают за 24–48 часов. Но использование газа также может спровоцировать порчу плодов, т. к. этилен ускоряет процессы старения и увядания.
Этилен служит важным сырьем для производства полиэтилена и других полимеров, уксусной кислоты, этилбензола и других органических соединений. При окислении этена в организме человека повышается вероятность образования злокачественных опухолей.
Химия. 10 класс
§ 12. Алкены. Строение молекул
Алкены. Строение молекул
Атомы углерода могут быть связаны между собой не только одинарными, но и двойными связями. Простейшим углеводородом, содержащим двойную связь, является этилен 
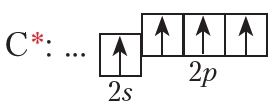
Как и в случае алканов, углерод в молекуле этилена четырёхвалентен. Образование четырёх связей происходит за счёт четырёх атомных орбиталей:
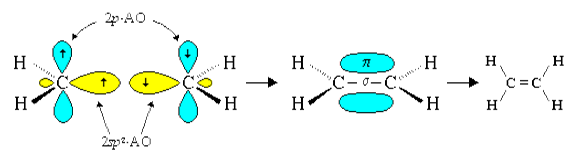
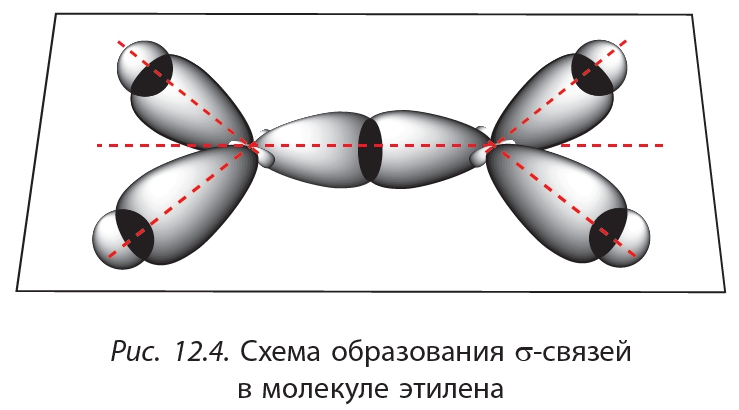
За счёт перекрывания гибридных орбиталей каждый атом углерода образует три связи — одну с соседним атомом углерода и две — с атомами водорода (рис. 12.4).
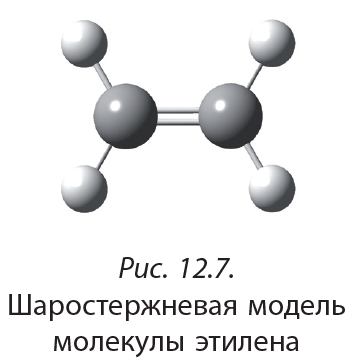
Строение молекулы этилена может быть отображено с помощью шаростержневой модели (рис. 12.7).
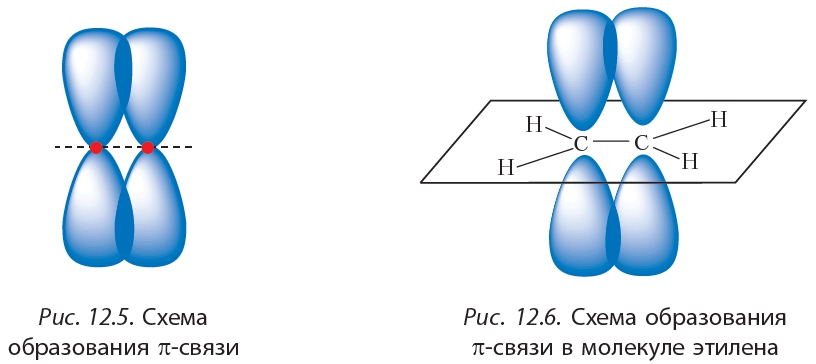
Молекула этилена плоская, валентные углы примерно равны 120°. В плоскости молекулы располагается система σ-связей, а π-связь образуется в результате перекрывания электронных облаков над и под плоскостью молекулы (рис. 12.6).
Как вы уже знаете (§ 7), в молекулах алканов легко происходит вращение вокруг одинарных связей C — C. Вокруг двойной связи 
Этилен является простейшим представителем алкенов — нециклических углеводородов, молекулы которых содержат одну двойную связь.
Ближайший гомолог этилена — пропилен 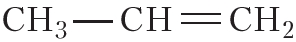
Углеводороды нециклического строения, в молекулах которых имеется одна двойная связь, называются алкенами.
Атомы углерода, образующие двойную связь, находятся в состоянии sp 2 -гибридизации.
Ковалентная связь, образованная за счёт перекрывания электронных облаков вдоль линии, соединяющей ядра атомов, называется σ -связь.
Ковалентная связь, образованная за счёт бокового перекрывания негибридных p -орбиталей, называется π -связь.
Двойная связь включает одну σ — и одну π -связь. π -Связь менее прочная, чем σ -связь.