какое правило должно соблюдаться при разбавлении серной кислоты
Большая Энциклопедия Нефти и Газа
Правило разбавления серной кислоты : следует влипать при перемешивании кислоту в воду, а не наоборот. Сервал кислота очень гигроскопична и поэтому пригодна для осушки многих газов ( но не аммиака. [17]
При разбавлении серной кислоты необходимо приливать кислоту к воде, а не наоборот. Смешивание кислоты с водой сопровождается сильным разогреванием, поэтому при добавлении воды в кислоту происходит разбрызгивание кислоты, что очень опасно. Если кислота попала на кожу или одежду, необходимо смыть ее большим количеством воды, а затем нейтрализовать раствором щелочи. [19]
При разбавлении серной кислоты водой выделяется большое количество тепла. Вода, не успевая смешаться с кислотой, закипает. Образующиеся при этом брызги могут причинить ожоги. Поэтому при разбавлении необходимо постепенно приливать кислоту в воду при непрерывном размешивании. Взаимодействие серной кислоты со многими химическими веществами сопровождается Выделением большого количества тепла и газов, что может привести к разбрызгиванию и даже выбросу реакционной массы. [20]
При разбавлении серной кислоты ее следует медленно приливать в воду. Приливание воды в кислоту категорически запрещается. Эту операцию следует проводить в фарфоровых стаканах, так как она сопровождается сильным разогреванием. [21]
При разбавлении серной кислоты необходимо медленно приливать кислоту в воду. [22]
При разбавлении серной кислоты водой выделяется большое количество тепла. Вода, не успевая смешаться с кислотой, закипает. Образующиеся при этом брызги могут причинять ожоги. Поэтому при разбавлении необходимо постепенно приливать кислоту в воду при непрерывном размешивании. Взаимодействие серной кислоты со многими химическими веществами сопровождается выделением большого количества тепла и газов, что может привести к разбрызгиванию и даже выбросу реакционной массы. [23]
При разбавлении серной кислоты водой следует во избежание вскипания раствора и выброса брызг подливать серную кислоту в воду тонкой струей ( при помешивании), а не добавлять воду в кислоту. [24]
При разбавлении серной кислоты водой концентрация иона NC2 уменьшается, и вместе с этим резко падает скорость нитрования. Однако очень реакциоиноспособные арены нитруются даже в таких условиях, когда обнаружить ион NC2 в растворе какими-либо физическими методами уже невозможно. Имеются доказательства, что даже в отсутствие серной кислоты нитрование осуществляется ионом нитрония. Например, изотопный обмен HNOs с ЩО имеет точно такую же скорость, как и нитрование реакциоиноспособных аренов. [25]
При разбавлении серной кислоты водой необходимо соблюдать большую осторожность и вливать при тщательном перемешивании кислоту тонкой струей в воду, а не наоборот. [26]
При разбавлении серной кислоты необходимо приливать кислоту тонкой струйкой в холодную воду и при этом хорошо размешивать. [27]
При разбавлении серной кислоты всегда следует приливать кислоту к воде тонкой струей, перемешивая при этом жидкость. При обратном порядке сливания происходит сильное местное разогревание жидкости и разбрызгивание кислоты, которая может ожечь лицо и руки, а также испортить одежду. [29]
При разбавлении серной кислоты ее следует медленно приливать в воду. Приливание воды в кислоту категорически запрещается. Эту операцию следует проводить в фарфоровых стаканах, так как она сопровождается сильным разогреванием. [30]
Какое правило должно соблюдаться при разбавлении серной кислоты
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Дайте сравнительную характеристику оксидов серы в степенях окисления +4 и +6. Свой ответ проиллюстрируйте уравнениями химических реакций в молекулярной и ионной формах.
Оксид серы (IV) и оксид серы (V I ) проявляют кислотные свойства.
Оксид серы (IV) и оксид серы (V I ) взаимодействуют с водой с образованием слабой сернистой кислоты и сильной серной кислоты:
SO2 + H2O = H2SO3
SO3 + H2O = H2SO4
Почему свойства разбавленной и концентрированной серной кислоты различаются?
Разбавленная серная кислота является окислителем за счёт атомов водорода в степени окисления +1, а концентрированная серная кислота — за счёт атомов серы в высшей степени окисления +6.
Упражнение 4 Какое правило должно соблюдаться при разбавлении серной кислоты?
При разбавлении серную кислоту приливают в воду, а не наоборот, т.к. при растворении серной кислоты в воде выделяется большое количество теплоты и порция воды, добавленная в кислоту, может закипеть, разбрызгивая едкую жидкость.
Упражнение 5 Массовая доля воды в кристаллогидрате сульфата железа (II), который называют железным купоросом, составляет 45,3 %. Выведите формулу кристаллогидрата.
Дано: соединение FeSO4 • xH2O, ω(xH2O)=45,3%, или 0,453
Найти: формулу-?
Решение
1-й способ
Вычисляем относительную молекулярную массу кристаллогидрата.
Mr(FeSO4•xH2O)=Mr(FeSO4)+х•Mr(H2O)=152+х•18=152+18x, где
Mr(FeSO4)=Ar(Fe)+Ar(S)+4•Ar(O)=56+32+4•16=152,
Mr(H2O)=2•Ar(H)+Ar(O)=2•1+16=18.
Подставив полученные значения в формулу вычисления массовой доли воды в кристаллогидрате:
ω(xH2O)=x • Ar(H2O)/Mr(FeSO4•xH2O)
получим алгебраическое уравнение и решаем его:
18х/(152+18х)=0,453
18х=0,453•(152+18х)
18х=68,856+8,154х
18х-8,154х=68,856
9,846х=68,856
х=68,856:9,846
х=7, формула имеет вид FeSO4 •7 H2O
2-й способ
ω( FeSO4 )=100%-ω(xH2O)=100%-45,3%=54,7%
В 100 г кристаллогадрата масса атомов воды составляет 45,3 г, а масса атомов сульфата железа (II) ― 54,7 г.
Поставим полученные значения в соотношение масс:
m(FeSO4): m(H2O) = Mr(FeSO4): xMr(H2O)
получим алгебраическое уравнение и решим его:
54,7 / 45,3 = 152 / 18х, отсюда по свойству пропорции имеем:
18х•54,7=45,3 • 152
984,6х=6885,6
х=6885,6:984,6
х=7, формула имеет вид FeSO4 •7 H2O
Ответ: FeSO4 •7 H2O
ВЫРАЗИТЕ МНЕНИЕ
Используйте дополнительную информацию и выразите мнение
Разделите лист бумаги пополам вертикальной линией. Напишите уравнения 8 реакций, характеризующих химические свойства серной кислоты, так, чтобы левая часть равенства оказалась на левой половине листа, а правая — на правой. Разрежьте лист по линии, две половинки отдайте двум своим одноклассникам. Их задача — восстановить недостающие половины уравнений реакций. Проверьте их работу, поставьте свою отметку. Допишите уравнения реакций по половинкам листов, полученных от двух других одноклассников.
1) H2SO4 + Mg = MgSO4 + H2↑
2) 2H2SO4 (конц.) + Cu = CuSO4 + SO2↑ + 2H2O
3) H2SO4 + 2NaOH = Na2SO4 + 2H2O
4) H2SO4 + Cu(OH)2↓ = CuSO4 + 2H2O
5) H2SO4 + Na2O = Na2SO4 + H2O
6) H2SO4 + ZnO = ZnSO4 + H2O
7) H2SO4 + BaCl2 = BaSO4 + 2HCl
8) H2SO4 + Na2CO3 =Na2SO4 + CO2 ↑ + H2O
Большая Энциклопедия Нефти и Газа
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться. [1]
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги. [2]
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста. [3]
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты. [4]
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты. [5]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании. [8]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты. [9]
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана. [10]
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая. [11]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании. [12]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты. [13]
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание. [14]
Разбавление и смешивание серной кислоты
В заводских условиях нередко бывает необходимо разбавить концентрированную серную кислоту водой или повысить концентрацию разбавленной кислоты, добавляя к ней концентрированную. Для этого предварительно надо установить или проверить концентрацию ИСХОДНЫХ КИСЛОТ, определив в НИХ содержание H2SO4.
При добавлении воды к концентрированной кислоте (олеуму или моногидрату) можно получить кислоту любой концентрации, однако при смешивании концентрированной. серной кислоты с водой выделяется большое количество тепла. Кислота может нагреться до кипения, произойдет бурное выделение паров и возможен выброс раствора из сосуда. Поэтому кислоты смешивают в специальных аппаратах — смесителях, соблюдая соответствующие меры предосторожности.
Смесители для приготовления кислоты низкой концентрации делают из кислотостойкого материала, для приготовления концентрированной кислоты — из чугуна. В производстве серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри котел, помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В некоторых случаях кислота после смешивания в небольшом резервуаре поступает в трубы, орошаемые снаружи водой, где одновременно охлаждается и дополнительно перемешивается.
При смешивании концентрированной серной кислоты с водой или с более разбавленной серной кислотой необходимо рассчитывать количество смешиваемых кислот. Расчеты проводят по так называемому правилу креста. Ниже приводится несколько примеров такого расчета.
1. Определить количество 100%-ной серной кислоты и воды, которые необходимо смешать для получения 45%-ной II2SO|.
Слева указывают концентрацию более концентрированной кислоты (в данном случае 100%), а справа — более разбавленной (п данном случае 0%—вода). Ннже, между ними, указывают заданную концентрацию (45%). Через цифру, обозначающую эту концентрацию, проводят дне перекрещивающиеся линии, а на их концах указывают соответствующую разность чисел:
Полученные под кислотами исходных концентраций цифры показывают, сколько массовых частей кислоты каждой из указанных концентраций необходимо смешать для получения кислоты заданной концентрации. В нашем примере для приготовления 45%-ной кислоты следует смешать 45 масс. ч. 100%-ной кислоты н 55 масс. ч. воды.
Эту же задачу можно решить исходя из общего баланса II2SO4 (или S03) в серной кислоте:
Числитель левой части уравнения соответствует содержанию H2S04 (в кг) в I кг 100%-ной серной кислоты, знаменатель — общему количеству заданного раствора (в кг). Правая часть уравнения соответствует концентрации серной кислоты в долях единицы. Решая уравнение, получаем х—1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
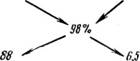
2. Определить количество 20%-ного олеума, которое следует смешать с 10%-нон серной кислотой для получения 98%-ной кислоты.
Задача решается также по правилу креста, однако концентрацию олеума в этом примере нужно выразить в % H2SO4, используя уравнения (9) н (8):
Следовательно, для получения 98%-ной серной кислоты требуется смешать 88 масс. ч. 20%-ного олеума и 6,5 масс. ч. 10%-иой серной кислоты.
Конспект урока химии по теме «Серная кислота
Ищем педагогов в команду «Инфоурок»
Тема урока. Серная кислота. 9 класс.
— активизировать знания учащихся о качественном и количественном составе серной кислоты, ее солей;
— закрепить знания о свойствах серной кислоты, подчеркнув способы её получения;
— углубить знания учащихся об особенностях взаимодействия кислоты с металлами;
— стимулировать познавательную деятельность при решении задач;
— продолжать развивать навыки работы с реактивами;
— сформировать умения обнаружения и определения ионов (сульфат-аниона, катиона водорода);
— способствовать развитию интереса к предмету, уверенности в своих знаниях и умениях.
— развивать навыки работы в паре, группе;
— формировать навыки аккуратного обращения с приборами, реактивами, соблюдения техники безопасности;
— обратить внимание учащихся на практическую сторону знаний, на то, какое значение имеют для нас соли – сульфаты;
— воспитывать умение распоряжаться своим временем, работать в режиме ограничения времени.
1. Формировать способности опознавать, анализировать, сопоставлять явления, факты, наблюдения, работать с текстом.
2. Сформировать знания о физических и химических свойствах серной кислоты.
3. Развивать навыки работы с компьютером, тестами.
4. Формировать умения составлять уравнения реакций, расставлять коэффициенты.
опорный плакат «Серная кислота»,
— презентация «Серная кислота»,
— Периодическая система элементов,
— Компьютер, экран, мультимедиа,
— Инструктивные карточки для учащихся,
— Раздаточный материал по ТБ,
«Серная кислота – хлеб химической промышленности»
План работы на доске:
1. Строение молекулы серной кислоты.
2. Физические свойства кислоты.
3. Химические свойства разбавленной кислоты.
4. Химические свойства концентрированной кислоты.
5. Применение серной кислоты.
— Какой химический элемент мы изучаем?
— К какой группе химических элементов относится сера?
— Возможные степени окисления серы?
— Назовите соединения серы с низшей степенью окисления.
— Соединение серы с высшей степенью окисления? ( H 2 S 04)
1. Что называют кислотой с позиций электролитической диссоциации? (кислота – это электролит, который диссоциирует в растворе на ионы водорода и ионы кислотного остатка).
Образно серную кислоту называют «кровь химии». Нет кислоты, которая бы была нужнее и применялась бы чаще, чем серная. Главным образом ее потребляют две отрасли промышленности: производство синтетических волокон и производство суперфосфата. Также кислота необходима для получения красителей, синтетических моющих средств, медикаментов, ядохимикатов, взрывчатых веществ.
— Какова формула серной кислоты?
— Запишите молекулярную, структурную и электронную формулы кислоты.
— Какой тип связи между атомами в молекуле?
— Определите степень окисления серы в кислоте.
— Какие свойства (окислителя или восстановителя) будет проявлять серная кислота в ОВР? Почему? (схема)
— Дайте характеристику серной кислоты (кислородсодержащая, двухосновная)
Серная кислота является сильным электролитом, но как двухосновная кислота диссоциирует в 2 ступени:
Первая ступень протекает нацело и практически необратима. Вторая — обратима. Тем не менее, диссоциация по второй ступени протекает в значительной степени. (Данные реакции имеет смысл приводить для того, чтобы показать учащимся, что у серной кислоты есть 2 ряда солей). Но в школьном курсе, при составлении ионных уравнений реакций диссоциацию H 2 S 04 пишут в одну ступень, ведь серная кислота сильный электролит:
2. Историческая справка о H 2 S 04
c водой (раствор сильно разогревается).
Следует соблюдать определенные правила при разбавлении серной кислоты: нужно осторожно, тоненькой струйкой, вливать кислоту в воду, непрерывно помешивая: «Сначала вода, потом кислота, иначе случится большая беда».
— Почему именно так разбавляется кислота (т. е. кислота в воду, а не наоборот?)
Напомним, что плотность воды (1 г/мл), а плотность концентрированной серной кислоты (1,8 г/мл), т: е. H 2 S 04( K 0 HU ) почти в 2 раза тяжелее воды. Напомним о большом выделении тепла в результате растворения кислоты в воде.
Если добавляют кислоту в воду, то она идет сразу вниз (т. к. тяжелее) и вся выделяющаяся теплота идет на нагревание раствора. В случае добавления воды в кислоту, вода как более легкая жидкость ко дну не идет, а остается на поверхности. Вода очень быстро закипает, испаряется и брызгами или паром попадает в лицо незадачливого лаборанта.
— датчик температуры (через мультимедийный проектор)
— выпускаем график зависимости температуры от времени при разбавлении кислоты.
При растворении серной кислоты в воде образуются гидраты разного состава, например H 2 S 04 ∙ H 20, H 2 S 04 ∙ 2 H 20.
Воздействие серной кислоты на организм человека (слайд):
— Но если вы всё же получили ожог, то как оказать первую помощь?
При попадании на кожу : промыть большим количеством воды, обработать слабым раствором питьевой соды и снова промыть.
При ожогах глаз : промыть большим количеством воды, наложить светозащитную повязку и обратиться к врачу.
При попадании в ЖКТ : промыть желудок большим количеством воды, дать слабительное и активированный уголь, выпить молоко, вызвать скорую помощь.
Демонстрируем гигроскопические свойства H 2 S 04(К0НЦ), представив ребятам эксикатор с кислотой (Объясним, как им пользоваться (открывать и закрывать, сдвигая крышку).
— Демонстрация стакана с серной кислотой, находящегося между рамами окна.
2. Химические свойства H 2 S 04 (разб)
Какими химическими свойствами обладают кислоты?
— диссоциируют на катионы водорода, взаимодействуют с металлами, находящимися в ряду напряжений до водорода; с основными и амфотерными оксидами, с основаниями – щелочами и нерастворимыми в воде; с растворами солей, если реакция обмена идет до конца.
Давайте проверим, характерны ли эти свойства для раствора серной кислоты. Вы будете работать в группах по 3-4 человека. Проведите опыты согласно инструкции, составьте соответствующие уравнения реакций и сделаете выводы о свойствах разбавленной серной кислоты. Затем один представить от группы расскажет нам о своих наблюдениях и напишет соответствующие уравнения реакций на доске:
1 группа – взаимодействие H 2 S 04 с металлами (цинк, магний, медь),
2 группа – взаимодействие H 2 S 04 с оксидами металлов,
Инструктаж по технике безопасности:
Осторожно работаем с растворами кислот и щелочей.
Используем реактивы в минимальных количествах.
Оставляем рабочее место в порядке.
— Инструкции для лабораторных опытов.
Инструктивная карта «Химические свойства разбавленной серной кислоты»
Опыт 1. Диссоциация серной кислоты на ионы.
Налейте в три пробирки небольшое количество H 2 SO 4 и прилейте в них соответственно растворы индикаторов: лакмуса, метилоранжа и фенолфталеина. Отметьте изменение окраски индикаторов. Составьте уравнения реакций ступенчатой диссоциации серной кислоты.
Сделайте вывод: почему серная кислота изменяет окраску указанных индикаторов?
Опыт 2. Взаимодействие разбавленной серной кислоты с металлами.
Сделайте вывод: с какими металлами взаимодействует разбавленная серная кислота?
Опыт 3. Взаимодействие серной кислоты с оксидом меди ( II ).
Внесите в пробирку небольшое количество оксида меди ( II ) и прилейте серную кислоту. Пробирку нагрейте в пламени спиртовки. Что наблюдаете? Напишите уравнение происходящей реакции в молекулярном и ионно-молекулярном виде.
Сделайте вывод: с какими оксидами взаимодействует серная кислота?
Опыт 4. Взаимодействие серной кислоты с гидроксидом натрия.
В пробирку налейте небольшое количество гидроксида натрия, добавьте фенолфталеин. Что наблюдаете? Почему? Прилейте в пробирку раствор серной кислоты до исчезновения окраски. О чем это свидетельствует? Напишите уравнение происходящей реакции в молекулярном и ионно-молекулярном виде. Как называется эта реакция?
Сделайте вывод: с какими основаниями взаимодействует серная кислота?
Опыт 5. Взаимодействие серной кислоты с гидроксидом меди ( II ).
Получите гидроксид меди ( II ). Для этого к раствору сульфата меди ( II ) прилейте раствор гидроксида натрия. Отметьте признаки реакции. Отлейте небольшое количество осадка в другую пробирку и добавьте в нее серную кислоту. Что наблюдаете? Напишите уравнения происходящих реакций в молекулярном и ионно-молекулярном виде.
Сделайте вывод: с какими основаниями взаимодействует серная кислота?
Опыт 6. Взаимодействие серной кислоты с хлоридом бария.
К раствору хлорида бария прилейте раствор серной кислоты. Что наблюдаете? Напишите уравнение происходящей реакции в молекулярном и ионно-молекулярном виде.
Сделайте вывод: при каких условиях возможны реакции между солями и серной кислотой?
Разбавленная серная кислота проявляет окислительные свойства, в качестве окислителя выступает ион водорода.
Данную реакцию можно рассмотреть с позиций реакций ионного обмена:
Zn ° + 2Н + + S 04 2- = Zn 2+ + S 04 2- + Н2
Zn ° + 2Н + = Zn 2+ + Н2°
Разбавленная серная кислота проявляет все свойства типичных кислот, выступает в качестве электролита в реакциях ионного обмена:
4. Взаимодействие серной кислоты с солями (СаСО 3 )
5. Как двухосновная кислота H 2 S 04 образует 2 ряда солей: кислые (гидросульфаты) и средние (сульфаты). Сульфаты большинства металлов хорошо растворимы в воде. Нерастворимыми являются соли ЩЗМ, Ag и РЬ (данные таблицы растворимости). Демонстрационный эксперимент по получению сульфата бария. Данная реакция является качественной на сульфат-ион.
— Слейте равные объемы серной кислоты и хлорида бария. Отметьте цвет осадка и его нерастворимость в кислотах. Составьте уравнения реакций в молекулярной и ионной форме:
Вывод: реактивом на серную кислоту и ее соли является хлорид бария (или реактивом на сульфат-ион является ион бария.
4. А теперь познакомимся со свойствами концентрированной серной кислоты.
Неактивные металлы (после водорода в ряду активности) восстанавливают серу до ближайшей с.о. +4.
Все возможные электронные переходы концентрированной серной кислоты при взаимодействии с металлами:
S +6 + 2 е → S 4+ ( в виде S0 2 )
S +6 + 8е → S 2- ( H 2 S )
Записываем уравнение реакции:
Таким образом, в качестве продуктов реакции образуются соль, где металл проявляет высшую степень окисления, вода и продукт восстановления серы. Продукт восстановления зависит от активности металла, от концентрации кислоты и температуры.
Li – Mg (щелочные и щелочноземельные металлы)
Al – Pb (металлы средней активности)
Cu, Hg, Ag (благородные)
Рассмотрите несколько примеров реакций взаимодействия металлов с концентрированной серной кислотой, составим к ним электронный баланс.
Напомним правила уравнивания:
1) в начале выставляете коэффициенты перед атомами металла в обеих частях равенства (из электронного баланса);
2) считаете число атомов серы (основной элемент-неметалл) в правой части равенства (4+1 = 5);
3) выставляете полученный коэффициент перед молекулой кислоты (уравняли атомы серы);
5) Проверка правильности составления уравнения: посчитать число атомов кислорода в обеих частях равенства. Они должны быть равны.
Основу всех органических веществ составляет углерод. При действии концентрированной серной кислоты на органические вещества происходит обугливание, так как кислота отнимает от этих веществ водород в виде воды:
Демонстрация: «ромовая баба»: в стакан с сахарной пудрой приливаем немного воды до образования кашицы, наливаем концентрированную серную кислоту и быстро перемешиваем стеклянной палочкой. Масса в стакане чернеет, через 2-3 минуты вспучивается, сильно увеличивается в объеме и выходит за пределы стакана. Серная кислота обугливает массу, и образовавшиеся газы (СО2 и SO 2) выталкивают ее из стакана.
Записываем уравнение реакции:
— Демонстрация обугливания лучинки (результат взаимодействия кислоты с органическим веществом — клетчаткой, вследствие чего углерод выделяется в виде угля. Именно, поэтому, необходимо осторожно обращаться с серной кислотой, иначе могут пострадать кожа и одежда!)
Закрепление изученного материала.
Разбавленная серная кислота реагирует с веществом, формула которого:
2. С помощью какого катиона можно распознать сульфат-ион?
3. При взаимодействии концентрированной серной кислоты с углеводами (сахарами):
а) выделяется оксид углерода ( IV );
б) выделяется водород и кислород;
в) происходит обугливание и образуются SO 2, СО2 и гидраты;
г) ничего не происходит.
4. При растворении концентрированной серной кислоты в воде необходимо:
а) приливать кислоту в воду;
б) приливать воду в кислоту;
в) оба ответа правильные.
5. Свойство, не характерное для концентрированной серной кислоты:
а) гигроскопичность;
б) взаимодействие при обычных условиях с железом;
в) обугливание органических веществ.
1. Разбавленная серная кислота не реагирует с веществом, формула которого:
2. Качественной реакцией на сульфат ион, является его взаимодействие с катионом:
3. При взаимодействии концентрированной серной кислоты с благородными металлами при нагревании будут получены:
а) сульфаты и водород;
б) оксиды и сернистая кислота;
в) оксиды и сероводород;
г) сульфаты, SO 2 и вода.
4. При растворении концентрированной серной кислоты в воде нужно:
а) приливать кислоту в воду;
б) приливать воду в кислоту;
в) оба ответа правильные.
5. При попадании концентрированной серной кислоты на кожу необходимо:
а) промыть кожу водой, протереть спиртом;
б) промыть водой, протереть раствором борной кислоты;
в) промыть водой, нейтрализовать 2%-ым раствором соды, промыть водой.
Итог урока. Рефлексия.
Итак, мы изучили свойства серной кислоты. H 2 S 04 имеет разнообразные области применения: из неё получают красители, минеральные удобрения, лекарства, искусственный шёлк, взрывчатые вещества и т.д. Поэтому справедливыми являются слова академика Ферсмана «Серная кислота – хлеб химической промышленности» (эпиграф урока)
Ответьте на вопросы:
Мне было комфортно на уроке.
Я много узнал нового.
Это мне пригодится в жизни.
Я приняла активное участие в обсуждении темы.
Мне это не интересно.
Домашнее задание : §22, упр. 3, 4.
Творческое задание: сочинить сказку о серной кислоте.
Глава 1. Рождение серной кислоты.
Глава 2. Детство.
Глава 3. На развилке дорог.
Глава 5. Ювелирный магазин.
Глава 6. Кислота-волшебница.