какое обследование покажет инфаркт
Какое обследование покажет инфаркт
Прекардиальная область обычно не изменена. Пальпация верхушечного толчка может быть затруднена. Почти у 25 % больных с передним инфарктом миокарда в течение первых дней болезни в периапикальной области выявляется измененная систолическая пульсация, которая вскоре может исчезнуть. Другие физикальные признаки дисфункции левого желудочка, которые могут встречаться при остром инфаркте миокарда, в порядке убывания по частоте встречаемости располагаются следующим образом: IV (S4) или III (S3) сердечные тоны, приглушенность тонов сердца и, редко, парадоксальное расщепление II тона (гл. 177).
Инфаркт миокарда : Лабораторные исследования
Для подтверждения диагноза инфаркта миокарда служат следующие лабораторные показатели:
1) неспецифнческие показатели тканевого некроза и воспалительной реакции;
2) данные электрокардиограммы;
3) результаты изменения уровня ферментов сыворотки крови.
Проявлением неспецифической реактивности организма в ответ на повреждение миокарда является полиморфно-клеточный лейкоцитоз, который возникает в течение нескольких часов после появления ангинозной боли, сохраняется в течение 3-7 сут и часто достигает значений 12-15o109/л. СОЭ повышается не так быстро, как число лейкоцитов в крови, достигает пика в течение 1-й недели и иногда остается повышенной 1-2 нед.
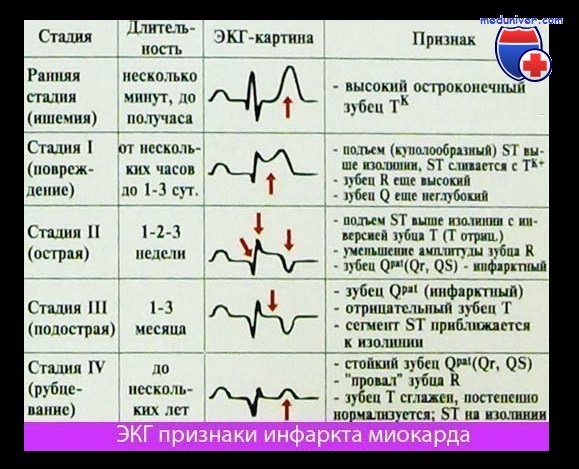
Электрокардиографические проявления острого инфаркта миокарда подробно описаны в разделе по электрокардиографии. Хотя не всегда имеется четкая связь между изменениями на ЭКГ и степенью повреждения миокарда, однако появление патологического зубца Q или исчезновение зубца R обычно позволяет с большой вероятностью диагностировать трансмуральный инфаркт миокарда. О наличии нетрансмурального инфаркта миокарда говорят в тех случаях, когда на ЭКГ выявляются лишь транзиторные изменения сегмента ST и стойкие изменения зубца Т. Однако эти изменения весьма вариабельны и неспецифичны и поэтому не могут служить основой для диагностики острого инфаркта миокарда. В этой связи рациональная номенклатура для диагностики острого инфаркта миокарда должна лишь разграничивать последний на трансмуральный и нетрансмуральный в зависимости от наличия изменений зубца Q или волн ST-Т.
Инфаркт миокарда : Сывороточные ферменты
Некротизированная во время острого инфаркта миокарда сердечная мышца выделяет в кровь большое количество ферментов. Скорость выброса различных специфических ферментов неодинакова. Изменение уровня ферментов в крови во времени имеет большую диагностическую ценность. Динамика концентрации ферментов, наиболее часто используемых для диагностики острого инфаркта миокарда, показана на рис. 190-1. Уровень двух ферментов, сывороточной глутаматоксалоацетаттрансаминазы (СГОТ) и креатинфосфокиназы (КФК) возрастает и снижается очень быстро, в то время как уровень лактатдегидрогеназы (ЛДГ) нарастает медленнее и дольше остается повышенным. Недостаток определения СГОТ заключается в том, что этот фермент содержится также в скелетных мышцах, в клетках печени, эритроцитах и может высвобождаться из этих экстракардиальных источников.
Поэтому в настоящее время определение СГОТ для диагностики острого инфаркта миокарда используют реже, чем раньше, вследствие неспецифичности этого фермента и того, что динамика его концентрации занимает промежуточное положение между динамикой концентрации КФК и динамикой концентрации ЛДГ, в связи с чем информация об уровне СГОТ становится в большинстве случаев излишней. Определение содержания MB изофермента КФК имеет преимущества перед определением концентрации СГОТ, поскольку этот изофермент практически не определяется в экстракардиальной ткани и поэтому более специфичен, чем СГОТ. Поскольку подъем концентрации КФК или СГОТ определяется в течение короткого времени, он может оставаться незамеченным в тех случаях, когда образцы крови берут более чем через 48 ч после развития инфаркта миокарда. Определение MB-КФК имеет практический смысл в тех случаях, когда есть подозрение на повреждение скелетных мышц или ткани мозга, поскольку в них содержатся значительные количества этого фермента, но не его изофермента. Специфичность MB-изофермента для определения повреждения миокарда зависит от используемой методики. Наиболее специфичен радиоиммуноанализ, однако на практике тем не менее чаще используют электрофорез в геле, обладающий меньшей специфичностью и поэтому чаще дающий ложноположительные результаты. При остром инфаркте миокарда уровень ЛДГ повышается в первый же день, между 3-м и 4-м днем он достигает пика и в среднем через 14 дней возвращается к норме. При проведении электрофореза в крахмальном геле можно выделить пять изоферментов ЛДГ. Разные ткани содержат различные количества этих изоферментов. Изофермент, обладающий наибольшей электрофоретической подвижностью, в основном содержится в миокарде, его обозначают как ЛДГ). Изоферменты, обладающие наименьшей электрофоретической подвижностью, содержатся преимущественно в скелетной мускулатуре и в клетках печени. При остром инфаркте миокарда уровень ЛДГ1 повышается еще до того, как повышается уровень общей ЛДГ, т. е. может наблюдаться повышение содержания ЛДГ) при нормальном содержании общей ЛДГ. Следовательно, выявление повышенного уровня ЛДГ| является более чувствительным диагностическим тестом при остром инфаркте миокарда, чем уровень общей ЛДГ, его чувствительность превышает 95 %.
Особую клиническую значимость представляет тот факт, что увеличенный в 2-3 раза уровень общей КФК (но не MB-КФК) может быть следствием внутримышечной инъекции. Возможны случаи парадоксальной диагностики острого инфаркта миокарда у больных, которым была сделана внутримышечная инъекция наркотика в связи с болями в грудной клетке, не связанными с патологией сердца. Кроме того, потенциальными источниками повышенного уровня КФК могут быть: 1) заболевания мышц, в том числе мышечные дистрофии, миопатии, полимиозиты; 2) электроимпульсная терапия (кардиоверсия); 3) катетеризация сердца; 4) гипотиреоидизм; 5) инсульт мозга; 6) хирургические вмешательства; 7) повреждения скелетных мышц при травмах, конвульсиях, длительной иммобилизации. Хирургические вмешательства на сердце и электроимпульсная терапия часто могут приводить к повышению уровня изофермента КФК.
Характерное возрастание концентрации ферментов наблюдается более чем у у 95 % больных с клинически доказанным инфарктом миокарда. При нестабильной стенокардии содержание КФК, ЛДГ, СГОТ обычно не повышается. У многих больных с подозрением на инфаркт миокарда исходный уровень ферментов в крови сохраняется в пределах нормы, при инфаркте миокарда он может повышаться в 3 раза, однако при этом он не превышает верхней границы нормы. Такую ситуацию наблюдают у больных с небольшим инфарктом миокарда. Хотя такое повышение содержания фермента нельзя рассматривать как строгий диагностический критерий острого инфаркта миокарда, оно с высокой вероятностью заставляет подозревать его. Практическую помощь в такой ситуации может оказать определение изоферментов.
В оценке состояния больных острым инфарктом миокарда может оказаться полезной также двухмерная эхокардиография. При этом можно легко выявить нарушения сократимости, в особенности в области перегородки и задненижней стенки. И хотя с помощью эхокардиографии нельзя дифференцировать острый инфаркт миокарда от нарушений сократимости вследствие наличия рубцов или выраженной острой ишемии миокарда, простота и безопасность этого метода позволяют рассматривать его как важный этап обследования больных с острым инфарктом миокарда. Кроме того, эхокардиография может быть весьма информативной для диагностики инфаркта миокарда правого желудочка, аневризмы левого желудочка и тромба в области левого желудочка.
Диагностика инфаркта миокарда
Начало инфаркта миокарда в большинстве случаев трудно перепутать с каким-либо другим заболеванием, кроме стенокардии. Оно сопровождается явными симптомами: длительными приступами боли, удушья, повышенной потливостью, чувством страха смерти. Заболеванию подвержены пациенты, которые наблюдаются у врачей с ИБС или стенокардией. Однако инфаркт миокарда может настигнуть и человека, у которого ранее практически не проявлялись симптомы сердечно-сосудистых заболеваний. При первых признаках приступа важно своевременно вызвать скорую и довериться профессиональным кардиологам.
Методы диагностики
Физикальное обследование
Первичная диагностика инфаркта миокарда, которую проведут прибывшие врачи, заключается, прежде всего, в осмотре пациента и опросе относительно жалоб на состояние здоровья. Данное заболевание можно спутать с приступом стенокардии, особенно если она проявилась впервые. Характер болевых ощущений схож – они распространяются от грудины в левую руку (включая пальцы), плечо, лопатку, шею, челюсть. Отличие инфаркта – в более сильной и острой боли, которая не снимается приемом нитроглицерина.
Болевой синдром при инфаркте миокарда может длиться около суток, сопровождаться слабостью, падением артериального давления, рвотой. Пациент находится в эмоциональном возбуждении, в отличие от приступа стенокардии, когда больные, напротив, стараются двигаться как можно меньше.
Врач измеряет давление (чаще всего оно снижается на 10-15 мм) и пульс, проверяет возможные дисфункции левого желудочка, миокарда, выслушивая тоны сердца.
Лабораторные анализы
На госпитальном этапе диагностика инфаркта заключается в проведении биохимического и общего анализов крови. При данном заболевании в составе крови происходят заметные изменения:
Это показатели некроза, рубцевания тканей сердечной мышцы и наличия воспаления. У больного фиксируется полиморфно-клеточный лейкоцитоз.
Лабораторным способом диагностики инфаркта миокарда проверяется и уровень ферментов сыворотки крови. В ней появляются маркеры, свидетельствующие о некрозе миокарда, – в частности сократительный белок тропонин, который не обнаруживается у здорового человека. К маркерам также относятся КФК, миоглобин, появляющиеся в сыворотке крови в первые часы после начала заболевания.
Ряд биохимических реакций в крови не являются специфическими для инфаркта, поэтому чрезвычайно важно доверить диагностику высококвалифицированным врачам и клинике с широкими техническими возможностями.
Электрокардиография
ЭКГ при инфаркте миокарда – один из наиболее действенных, объективных и информативных способов диагностики. При возможности обратитесь за неотложной помощью к врачам кардиологической бригады – в оснащении их автомобиля обязательно находится портативный электрокардиограф, который позволит в кратчайшие сроки диагностировать заболевание.
ЭКГ-оборудование улавливает электрические импульсы, которые генерируются сердечной мышцей, и регистрирует их на бумаге. На основании анализа кардиограммы квалифицированный врач может определить:
локализацию некроза (задняя, передняя или боковая стенка, перегородка, базальная стенка и др.);
величину и глубину поражения;
Врач обращает внимание на характер зубцов электрокардиограммы, анализирует повышение уровня отдельных сегментов. В частности, крупноочаговый трансмуральный инфаркт миокарда характеризуется появлением патологического зубца Q.
Исследование занимает около 10 минут и не вызывает неприятных ощущений. При инфаркте ЭКГ может проводиться каждые полчаса для постоянного обновления данных.
Эхокардиография
Более распространенное среди пациентов название эхокардиографии – УЗИ сердца. Это чрезвычайно эффективный инструмент диагностики острого инфаркта миокарда и других видов этой патологии.
Исследование не связано с болезненными ощущениями и занимает 20-25 мин. Врач смазывает грудную клетку больного специальным гелем и водит по ней ультразвуковым датчиком. Эхокардиограф считывает полученные данные о состоянии миокарда, перикарда, крупных сосудов, клапанов, а врач сразу анализирует их. Преимуществом метода является возможность за кратчайший срок визуально оценить функциональность работы органа и диагностировать нарушения регионарной сократимости.
Режим допплера, в котором работают современные УЗИ-аппараты, позволяет оценить качество кровотока в сердце, определить наличие в них тромбов. Также анализируются звуковые сигналы сердца, измеряется давление в полостях органа, изучаются осложнения.
Рентгенография
Для объективного прогноза развития осложнений при инфаркте миокарда в рамках диагностики проводится рентгенография грудной клетки.
Среди опасных осложнений чаще всего этим методом диагностируется отек легких, который является одним из явных признаков острой левожелудочковой недостаточности. На снимке фиксируется нарушение кровотока в верхних отделах легких, легочной артерии, расплывчатый рисунок сосудов и др. Также при инфаркте вероятно расслоение аорты, другие изменения в грудной ее части. Рентгенография позволяет диагностировать нарушения кровоснабжения органов, располагающихся в непосредственной близости от сердца.
Среди рентгенологических методов, применяемых в кардиологии для определения инфаркта, также распространены коронароангиография и мультиспиральная компьютерная томография сердца. С их помощью определяется место и характер сужения коронарной артерии.
Диагностика инфаркта миокарда в CBCP
Инфаркт проще предотвратить, чем лечить его последствия, которые зачастую бывают чересчур обширными. Поэтому при появлении первых болей в сердце не оттягивайте обращение к врачу.
Центр патологии органов кровообращения располагает диагностическим оборудованием последнего поколения и специалистами высокой квалификации. Мы обезопасим вас от тяжелого недуга и не допустим развития сердечно-сосудистых патологий.
Какое обследование покажет инфаркт
Инфаркт миокарда – это заболевание, сопровождающееся некрозом одного или нескольких участков сердечной мышцы в результате острого нарушения кровотока в коронарных артериях, питающих миокард. Острый инфаркт миокарда без подъема сегмента ST и инфаркт миокарда с подъемом сегмента ST являются разновидностями острого коронарного синдрома, который включает также нестабильную стенокардию.
Инфаркт миокарда – ведущая причина смертности в большинстве стран, в том числе в России. Своевременная госпитализация во многих случаях позволяет предотвратить необратимые повреждения сердечной мышцы, однако часто пациенты неправильно оценивают возникающие симптомы и пытаются справиться с ними самостоятельно, что приводит к позднему обращению к врачу. Поэтому при острой боли в груди или других тревожных симптомах необходимо как можно раньше проконсультироваться со специалистом.
Риск инфаркта миокарда повышается с возрастом – чаще заболевают люди старше 60 лет. Однако в последнее время увеличилось количество ранних инфарктов миокарда – у людей моложе 40 лет. Среди пациентов младше 70 лет преобладают мужчины, однако после 70 количество мужчин и женщин с инфарктом миокарда становится одинаковым. Это может быть связано с защищающим действием эстрогенов (женских половых гормонов), которые снижают вероятность атеросклероза – главного фактора риска развития сердечного приступа.
Прогноз инфаркта миокарда зависит от обширности поражения сердечной мышцы, наличия сопутствующих заболеваний, времени обращения за медицинской помощью и возраста пациента. Смертность при остром инфаркте миокарда достигает 30 %.
Сердечный приступ, ИМ.
Синонимы английские
Heart attack, acute myocardial infarction, MI, myocardial infarction.
Основным симптомом острого инфаркта миокарда является резкая боль в груди, которая чаще всего ощущается как резкое сдавливание. Она продолжается обычно дольше 15 минут и не купируется приемом нитроглицерина. Боль может распространяться на левое плечо, лопатку, шею, нижнюю челюсть, может сопровождаться холодным потом, тошнотой и рвотой, потерей сознания. В некоторых случаях боль имеет нетипичную локализацию – в животе, в позвоночнике, левой или даже правой руке.
Иногда инфаркту предшествуют неспецифические симптомы: в течение нескольких дней до сердечного приступа человек может ощущать слабость, недомогание, дискомфорт в области груди.
Инфаркт может не сопровождаться характерным болевым синдромом и проявляться лишь такими признаками, как одышка, учащенное сердцебиение, слабость, тошнота. Неявная симптоматика инфаркта миокарда особенно характерна для женщин.
Таким образом, основными симптомами острого инфаркта миокарда являются:
Общая информация о заболевании
Инфаркт миокарда развивается в результате нарушения кровоснабжения сердечной мышцы, что приводит к недостатку кислорода и питательных веществ и некрозу (омертвению) участка миокарда. Основной причиной нарушения кровотока в сосудах, питающих миокард, является атеросклероз коронарных артерий – отложение атеросклеротических бляшек, состоящих в основном из холестерина, на внутренней поверхности сосудов. Затем происходит разрастание соединительной ткани (склероз) стенки сосуда и формирование отложений кальция (кальциноз) с дальнейшей деформацией и сужением просвета сосуда вплоть до полной закупорки. Впоследствии в атеросклеротической бляшке может развиваться так называемое асептическое воспаление, которое при воздействии провоцирующих факторов (физической нагрузке, повышении артериального давления и др.) способно приводить к надрыву бляшки. В области повреждения скапливаются тромбоциты, выделяются биологически активные вещества, которые еще больше усиливают адгезию (слипание) форменных элементов крови, и в итоге образуется тромб, закупоривающий просвет коронарной артерии. Возникновению тромба также способствует повышенная свертываемость крови. В случае, если кровоток в сосудах не восстанавливается в ближайшие шесть часов, происходят необратимые изменения в тканях миокарда.
Редко инфаркт миокарда случается при резком спазме или тромбоэмболии патологически неизмененных коронарных артерий, однако это наблюдается лишь в 5 % случаев.
При нарушении кровоснабжения миокарда гибель клеток начинается, прежде всего, в области эндокарда, а затем зона повреждения распространяется по направлению к перикарду. Обширность поражения зависит от степени закупорки артерии, ее длительности, системы коллатерального кровообращения.
Некроз в тканях сердечной мышцы вызывает острую боль. Обширное повреждение миокарда может приводить к нарушению сократительной функции сердца, что проявляется острой левожелудочковой недостаточностью с развитием отека легких и кардиогенного шока. Кардиогенный шок, в свою очередь, усугубляет течение инфаркта миокарда за счет ухудшения коронарного кровообращения. В результате возникают тяжелые нарушения ритма сердца, в том числе фибрилляция предсердий.
Трансмуральный инфаркт в некоторых случаях может приводить к разрыву стенки сердца или к аневризме – локальному истончению и выпячиванию участка миокарда.
Кто в группе риска?
Основной причиной развития инфаркта миокарда (до 90 % всех случаев) является атеросклероз. Поэтому факторы риска развития атеросклероза увеличивают и вероятность развития сердечного приступа. В группу риска входят:
Острый инфаркт миокарда во многих случаях протекает малосимптомно или атипично, что затрудняет его диагностику. Существует ряд заболеваний, проявления которых зачастую могут быть схожи с проявлениями сердечного приступа: аневризма аорты, стенокардия, заболевания печени и желчевыводящих путей, депрессия, эзофагит и другие. Поэтому при подозрении на инфаркт миокарда необходимо провести ряд лабораторных и инструментальных исследований, позволяющих отличить инфаркт миокарда от другой патологии и выявить обширность и локализацию повреждения, продолжительность ишемии, постинфарктные осложнения. Кроме того, важно распознать признаки сопутствующих заболеваний: патологии почек и дыхательной системы, сахарного диабета, анемии. Все это определяет дальнейшую схему лечения и прогноз заболевания.
Другие методы исследования
Терапия назначается индивидуально в зависимости от возраста пациента, тяжести состояния и обширности поражения сердечной мышцы. Огромное значение имеет восстановление кровоснабжения миокарда в течение первых 12 часов после появления первых признаков инфаркта миокарда. Это может предотвратить или уменьшить степень некроза тканей. Основными направлениями терапии при остром инфаркте миокарда являются купирование болевого синдрома, тромболитическая и антикоагулянтная терапия, снижение нагрузки на миокард, предупреждение и лечение возникших осложнений.
Здоровое питание с низким содержанием насыщенных жиров и большим количеством овощей и фруктов.
Достаточная физическая активность.
Отказ от алкоголя и курения.
Своевременное прохождение профилактических медицинских осмотров для выявления заболеваний, повышающих риск развития инфаркта миокарда.
Рекомендуемые анализы
Диагностика и лечение инфаркта миокарда на догоспитальном этапе
Как проводится купирование болевого приступа? В каких случаях показана тромболитическая терапия, а в каких — антикоагулянтная? Как проводится тромболитическая терапия? Что важно уточнить перед проведением тромболитической терапии? Инфаркт миокарда —
Как проводится купирование болевого приступа?
В каких случаях показана тромболитическая терапия, а в каких — антикоагулянтная?
Как проводится тромболитическая терапия? Что важно уточнить перед проведением тромболитической терапии?
Инфаркт миокарда — неотложное клиническое состояние, обусловленное некрозом участка сердечной мышцы, развившимся в результате нарушения ее кровоснабжения. Поскольку в первые часы (а иногда и сутки) от начала заболевания бывает сложно дифференцировать острый инфаркт миокарда и нестабильную стенокардию, для обозначения периода обострения ишемической болезни сердца (ИБС) в последнее время пользуются термином «острый коронарный синдром», под которым понимают любую группу клинических признаков, позволяющих заподозрить инфаркт миокарда или нестабильную стенокардию. Острый коронарный синдром может рассматриваться как первичный диагноз; он диагностируется на основании болевого синдрома (затяжной ангинозный приступ, впервые возникшая, прогрессирующая стенокардия) и изменений ЭКГ. Различают острый коронарный синдром с подъемом сегмента ST или остро возникшей полной блокадой левой ножки пучка Гиса (состояние, требующее проведения тромболизиса, а при наличии технических возможностей — ангиопластики) и без подъема сегмента ST — с его депрессией сегмента ST, инверсией, сглаженностью псевдонормализацией зубца Т, или вообще без изменений на ЭКГ (тромболитическая терапия не показана). Таким образом, диагноз «острый коронарный синдром» позволяет оперативно оценить объем необходимой неотложной помощи и выбрать адекватную тактику ведения пациентов.
С точки зрения определения объема необходимой лекарственной терапии и оценки прогноза представляют интерес три классификации. По глубине поражения (на основе данных электрокардиографического исследования) различают трансмуральный и крупноочаговый («Q-инфаркт» с подъемом сегмента ST в первые часы заболевания и формированием зубца Q в последующем) и мелкоочаговый («не Q-инфаркт», не сопровождающийся формированием зубца Q, а проявляющийся отрицательными зубцами Т); по клиническому течению — неосложненный и осложненный инфаркт миокарда; по локализации — инфаркт левого желудочка (передний, задний или нижний, перегородочный) и инфаркт правого желудочка.
Диагностика инфаркта миокарда на догоспитальном этапе
Наиболее типичным проявлением инфаркта миокарда является приступ боли в грудной клетке. Диагностически значимы такие параметры, как интенсивность болевого синдрома (если аналогичные боли возникали ранее, то при инфаркте они бывают необычно интенсивными), его продолжительность (необычно длительный приступ, продолжающийся более 15-20 мин), неэффективность сублингвального приема нитратов. При анализе клинической картины необходимо получить ответы на следующие вопросы:
По симптоматике острейшей фазы инфаркта миокарда, помимо болевого, выделяют и другие клинические варианты инфаркта миокарда (см. таблицу).
Данные физикального обследования (гипергидроз, резкая общая слабость, бледность кожных покровов, признаки острой сердечной недостаточности) при любом клиническом варианте инфаркта миокарда имеют только вспомогательное диагностическое значение.
Электрокардиографическими критериями инфаркта миокарда являются изменения, служащие признаками:
При инфаркте передней стенки подобные изменения выявляются в I и II стандартных отведениях, усиленном отведении от левой руки (aVL) и соответствующих грудных отведениях (V1, 2, 3, 4, 5, 6). При высоком боковом инфаркте миокарда изменения могут регистрироваться только в отведении aVL, и для подтверждения диагноза необходимо снять высокие грудные отведения. При инфаркте задней стенки (нижнем, диафрагмальном) эти изменения обнаруживаются во II, III стандартном и усиленном отведении от правой ноги (aVF). При инфаркте миокарда высоких отделов задней стенки левого желудочка (заднебазальном) изменения в стандартных отведениях не регистрируются, диагноз ставится на основании реципрокных изменений — высоких зубцов R и Т в отведениях V1-V2.
Кроме того, косвенным признаком инфаркта миокарда, не позволяющим определить фазу и глубину процесса, является остро возникшая блокада ножек пучка Гиса (при наличии соответствующей клиники).
Наибольшей достоверностью обладают электрокардиографические данные в динамике, поэтому электрокардиограммы по возможности должны сравниваться с предыдущими.
Таким образом, на догоспитальном этапе оказания медицинской помощи диагноз острого инфаркта миокарда ставится на основании клинической картины и изменений электрокардиограммы. В дальнейшем диагноз уточняется в стационаре после определения уровня маркеров некроза миокарда в крови и на основании динамики ЭКГ. В большинстве случаев острого коронарного синдрома с подъемом сегмента ST формируется инфаркт миокарда с зубцом Q; при остром коронарном синдроме без подъема сегмента ST при повышении уровня маркеров некроза диагностируется инфаркт миокарда без зубца Q, а при нормальном их уровне — нестабильная стенокардия.
Ведение больных на догоспитальном этапе
Для купирования тошноты и рвоты рекомендуют в/в введение 10-20 мг метоклопрамида (церукала, реглана). При выраженной брадикардии показано использование атропина в дозе 0,5 мг (0,5 мл 0,1%-ного раствора) в/в; терапия артериальной гипотензии проводится по общим принципам коррекции гипотензии при инфаркте миокарда.
Недостаточная эффективность обезболивания наркотическими анальгетиками служит показанием к в/в инфузии нитратов (см. ниже). При низкой эффективности нитратов в сочетании с тахикардией дополнительный обезболивающий эффект может быть получен благодаря введению бета-адреноблокаторов (см. ниже). Боль может быть купирована в результате эффективного тромболизиса (см. ниже).
Продолжающиеся интенсивные ангинозные боли служат показанием к применению масочного наркоза закисью азота (обладающей седативным и анальгезирующим действием) в смеси с кислородом. Начинают с ингаляции кислорода в течение 1-3 мин, затем используют закись азота (20 %) с кислородом (80 %) с постепенным повышением концентрации закиси азота до 80 %; после засыпания больного переходят на поддерживающую концентрацию газов — 50:50. Закись азота не снижает выброса левого желудочка. Возникновение побочных эффектов (тошноты, рвоты, возбуждения или спутанности сознания) является показанием для уменьшения концентрации закиси азота или отмены ингаляции. При выходе из наркоза ингалируют чистый кислород в течение 10 мин для предупреждения артериальной гипоксемии.
А. Показаниями к проведению тромболизиса служит подъем сегмента ST более чем на 0,1 мВ по крайней мере в двух стандартных отведениях ЭКГ и более чем на 0,2 мВ в двух смежных грудных отведениях или остро возникшая полная блокада левой ножки пучка Гиса в период от 30 мин до 12 ч от начала заболевания. Применение тромболитических средств возможно и позднее, если сохраняется подъем ST на ЭКГ, продолжается болевой приступ и/или наблюдается нестабильная гемодинамика.
В отличие от внутрикоронарного системный тромболизис (осуществляется внутривенным введением тромболитических средств) не требует каких-либо сложных манипуляций и специального оборудования. При этом он достаточно эффективен, если проводится в первые часы развития инфаркта миокарда (оптимально — на догоспитальном этапе), поскольку сокращение летальности напрямую зависит от сроков достижения реперфузии.
При отсутствии противопоказаний решение вопроса о проведении тромболизиса принимается на основании анализа фактора времени: при транспортировке более 30 мин или при отсрочке внутрибольничного проведения тромболизиса более чем на 60 мин введение тромболитических средств должно осуществляться на догоспитальном этапе. Во всех остальных случаях оно должно быть отложено до стационара.
Наиболее часто для проведения тромболизиса используется стрептокиназа внутривенно только через периферические вены, попытки катетеризации центральных вен недопустимы; перед инфузией возможно внутривенное введение 5-6 мл 25%-ного магния сульфата либо 10 мл кормагнезина-200 в/в струйно, медленно (за 5 мин); «нагрузочная» доза аспирина (250-300 мг разжевать) дается всегда, за исключением случаев, когда аспирин противопоказан (аллергические и псевдоаллергические реакции); 1 500 000 Ед стрептокиназы разводятся в 100 мл изотонического раствора хлорида натрия и вводятся внутривенно за 30 мин.
Одновременного назначения гепарина при использовании стрептокиназы не требуется — предполагают, что стрептокиназа сама обладает антикоагуляционными и антиагрегационными свойствами. Показано, что внутривенное введение гепарина не снижает летальности и частоты рецидивов инфаркта миокарда, а эффективность подкожного введения препарата сомнительна. Если гепарин по каким-либо причинам был введен ранее, это не является препятствием к проведению тромболизиса. Рекомендуется назначение гепарина через 12 ч после прекращения инфузии стрептокиназы. Практиковавшееся ранее использование гидрокортизона для профилактики анафилаксии признано не только малоэффективным, но и небезопасным в острейшей стадии инфаркта миокарда (глюкокортикоиды увеличивают риск разрыва миокарда).
Основные осложнения тромболизиса:
Клинические признаки восстановления коронарного кровотока: прекращение ангинозных приступов через 30-60 мин после введения тромболитика, стабилизация гемодинамики, исчезновение признаков левожелудочковой недостаточности, быстрая (в течение 2-3 ч) динамика ЭКГ с приближением сегмента ST к изолинии на 50% от исходного уровня подъема и ранним формированием патологического зубца Q и/или отрицательного зубца Т, появление реперфузионных аритмий (ускоренного идиовентрикулярного ритма, желудочковой экстрасистолии и др.), быстрая динамика МВ-КФК.
Для решения вопроса о возможности использования тромболитических средств следует уточнить ряд моментов:
Следует также обратить внимание на другие состояния, чреватые развитием геморрагических осложнений и служащие относительными противопоказаниями к проведению системного тромболизиса: тяжелые заболевания печени и почек; подозрение на хроническую аневризму сердца, перикардит, инфекционный миокардит, тромб в сердечных полостях; тромбофлебит и флеботромбоз; варикозное расширение вен пищевода; язвенная болезнь в стадии обострения; беременность.
В сомнительных случаях проведение тромболитической терапии должно быть отложено до поступления больного в стационар (при атипичном развитии заболевания, неспецифических изменениях ЭКГ, давно существующей блокаде ножки пучка Гиса или ЭКГ-признаках несомненного предшествующего инфаркта миокарда, маскирующих типичные изменения).
Б. При отсутствии показаний к тромболитической терапии (поздние сроки, так называемый мелкоочаговый или «не-Q-инфаркт») проводится антикоагулянтная терапия. Ее цель заключается в предупреждении или ограничении тромбоза венечных артерий, а также в профилактике тромбоэмболических осложнений (особенно часто развивающихся у больных передним инфарктом миокарда, при низком сердечном выбросе, мерцательной аритмии). Для этого на догоспитальном этапе внутривенно болюсно вводится гепарин в дозе до 5000 МЕ. Если в условиях стационара не проводится тромболитическая терапия, то начинается длительная внутривенная инфузия гепарина со скоростью 800-1000 МЕ/ч под контролем активированного частичного тромбопластинового времени. Альтернативой может, по-видимому, служить подкожное введение низкомолекулярного гепарина в «лечебной» дозе. Введение гепарина на догоспитальном этапе не препятствует проведению тромболизиса в стационаре.
В. С первых минут от начала развития инфаркта миокарда всем больным при отсутствии противопоказаний следует назначать малые дозы ацетилсалициловой кислоты (аспирина). Антитромбоцитарный эффект препарата максимально проявляется уже через 30 мин, а своевременное начало применения аспирина позволяет существенно снизить летальность. Назначение ацетилсалициловой кислоты перед проведением тромболизиса дает наибольший клинический эффект. Доза для первого приема на догоспитальном этапе составляет 160-325 мг (разжевать). На стационарном этапе препарат назначается 1 раз в сутки по 100-125 мг.
А. Внутривенное введение нитратов при остром инфаркте миокарда способствует купированию болевого синдрома, гемодинамической разгрузке левого желудочка, снижает АД. Растворы нитратов для внутривенного введения готовят ex tempore: каждые 10 мг нитроглицерина (например, 10 мл 0,1%-ного раствора в виде препарата перлинганит) или изосорбида динитрата (например, 10 мл 0,1%-ного раствора в виде препарата изокет) разводят в 100 мл физиологического раствора (20 мг препарата — в 200 мл физиологического раствора и т. д.); таким образом, 1 мл приготовленного раствора содержит 100 мкг препарата. Нитраты вводят капельно под постоянным контролем АД и ЧСС с начальной скоростью 5-10 мкг/мин и последующим увеличением скорости на 20 мкг/мин каждые 5 мин до достижения желаемого эффекта или максимальной скорости введения — 400 мкг/мин. Обычно эффект достигается при скорости инфузии 50-100 мкг/мин. При отсутствии дозатора приготовленный раствор, содержащий в 1 мл 100 мкг нитрата, вводят при тщательном контроле (см. выше) с начальной скоростью 2-4 капли в минуту, при условии стабильной гемодинамики и сохранения болевого синдрома скорость может постепенно увеличиваться вплоть до максимальной — 30 капель в минуту. Введение нитратов начинают как линейные, так и специализированные бригады СиНМП и продолжают в стационаре. Продолжительность внутривенного введения нитратов — 24 ч и более; за 2-3 ч до окончания инфузии назначается первая доза нитратов внутрь. Передозировка нитратов, вызывающая падение сердечного выброса и снижение САД ниже 80 мм рт. ст., может привести к ухудшению коронарной перфузии и к увеличению размеров инфаркта миокарда.
Б. Внутривенное введение бета-адреноблокаторов, так же как и применение нитратов, способствует купированию болевого синдрома. Ослабляя симпатические влияния на сердце (усиливающиеся в первые 48 ч от начала развития инфаркта миокарда как вследствие самого заболевания, так и в качестве реакции на боль) и снижая потребность миокарда в кислороде, они способствуют уменьшению размеров инфаркта миокарда, подавляют желудочковые аритмии, уменьшают риск разрыва миокарда и повышают таким образом выживаемость пациентов. Очень важно, что, согласно экспериментальным данным, бета-адреноблокаторы позволяют отсрочить гибель ишемизированных кардиомиоцитов (они увеличивают время, в течение которого эффективна реперфузионная терапия).
При отсутствии противопоказаний бета-адреноблокаторы назначаются всем больным острым инфарктом миокарда. На догоспитальном этапе показаниями к их внутривенному введению для линейной бригады служат соответствующие нарушения ритма, а для специализированной — упорный болевой синдром, тахикардия, артериальная гипертензия. В первые часы заболевания показано дробное внутривенное введение пропранолола (обзидана) по 1 мг в минуту каждые 3-5 мин под контролем АД и ЭКГ до достижения ЧСС 55-60 в минуту или до достижения общей дозы 0,1 мг на кг массы тела пациента. При брадикардии, признаках сердечной недостаточности, AV-блокаде и снижении САД менее 100 мм рт. ст. пропранолол не назначается, а при развитии указанных изменений на фоне его применения введение препарата прекращается.
Отсутствие осложнений терапии бета-адреноблокаторами на догоспитальном этапе служит показанием для обязательного ее продолжения в условиях стационара с переходом на прием пропранолола внутрь в суточной дозе 40-320 мг в 4 приема (первый прием — спустя 1 ч после внутривенного введения).
В. Внутривенная инфузия магния сульфата проводится у больных с доказанной или вероятной гипомагнезиемией или при синдроме удлиненного QT, а также в случае осложнения инфаркта миокарда некоторыми вариантами аритмий. При отсутствии противопоказаний магния сульфат может служить определенной альтернативой применению нитратов и бета-адреноблокаторов, если их введение по какой-то причине невозможно (из-за противопоказаний или отсутствия препаратов). Согласно результатам ряда исследований, он снижает летальность при остром инфаркте миокарда, а также предотвращает развитие аритмий (в том числе реперфузионных при проведении системного тромболизиса) и постинфарктной сердечной недостаточности.
Этой же цели служит оксигенотерапия, показанная при остром инфаркте миокарда всем больным в связи с частым развитием гипоксемии даже при неосложненном течении заболевания. Ингаляция увлажненным кислородом проводится (если это не причиняет чрезмерных неудобств) с помощью маски или через носовой катетер со скоростью 3-5 л/мин и целесообразна в течение первых 24-48 ч от начала заболевания (начинается на догоспитальном этапе и продолжается в стационаре).
Тактика ведения больного с различными вариантами инфаркта миокарда на догоспитальном этапе представлена на рис. 1 и рис. 2.
Острый инфаркт миокарда является прямым показанием к госпитализации в отделение (блок) интенсивной терапии или кардиореанимации. Транспортировка больного осуществляется на носилках.
А. Л. Верткин, доктор медицинских наук, профессор
В. В. Городецкий, кандидат медицинских наук
О. Б. Талибов, кандидат медицинских наук