какое количество апудоцитов известно на сегодняшний день
Апудоциты
Впервые апудоциты были описаны Н.К. Кульчицким в конце XIX в. в эпителии кишечника, в конце 30-х гг. XX в. подобные клетки были обнаружены в эпителии бронхов и альвеол.
Считается, что первичные клетки APUD-системы происходят из нервного гребешка (нейро-эндокринно-программированного эпибласта), т.е имеют нервное происхождение. В ходе развития организма они распределяются между клетками различных органов. Апудоциты в органах и тканях могут располагаться диффузно или группами среди других клеток. Биологически активные соединения, образующиеся в клетках данной системы, выполняют эндокринную, нейрокринную, нейроэндокринную, а также паракринную функции. Целый ряд свойственных им соединений (вазоактивный интестинальный пептид, нейротензин и другие) высвобождаются не только из клеток APUD-системы, но также и из нервных окончаний. Поэтому трудно сказать совершенно определённо, куда именно следует относить APUD-систему: к нервной или к эндокринной системе.
Содержание
Морфология (строение) апудоцитов
При обычной гистологической окраске апудоциты лёгких имеют несколько бо́льшие размеры, чем собственные клетки органа, округлую или треугольную форму, их цитоплазма эозинофильна, ядро сдвинуто в апикальную часть клетки. В базальной части располагаются секреторные гранулы, которые дают положительную реакцию с серебром и окрашиваются диазониевым методом. Эти гранулы являются основным ультраструктурным признаком апудоцитов и местом накопления биогенных аминов и пептидных гормонов, а их характерное строение обычно позволяет установить тип продуцируемого гормона.
Свойства апудоцитов
2. Способность к поглощению предшественников биогенных аминов — определённых аминокислот (тирозин, гистидин и др.).
3. Декарбоксилирование поглощённых аминокислот (удаление у них карбоксильной группы и превращение таким способом аминокислот в амины).
4. Значительное содержание специальных ферментов — глицерофосфатдегидрогеназы, неспецифических эстераз, холинэстеразы.
5. Аргирофилия (прокрашиваются солями серебра).
6. Специфическая иммунофлюоресценция (связывание с тканеспецифическими флуоресцентными белками-маркёрами).
7. Присутствие особого фермента — нейронспецифической гамма-енолазы.
8. В клетках АPUD-системы генетически детерминирована высокая метаболическая и функциональная активность, которая выражается в высокой ктивности ферментов цикла Кребса, гликолиза, пентозофосфатного шунта и обмена аминов.
Функции апудоцитов
Апудоциты секретируют свои продукты путём экзоцитоза:
С помощью биологически активных веществ апудоцитов диффузная нейроэндокринная система управляет развитием и жизнедеятельностью организма: участвует в формировании условных рефлексов, болевых и эмоциональных ощущений, а также в процессах памяти и сна. В дыхательной системе апудоциты появляются на разных стадиях эмбриогенеза и принимают участие в процессах цито-, гисто- и органогенеза, регулируют пролиферацию и дифференцировку клеток различных органов, изменяют многие звенья патогенеза заболеваний в эмбриональном и постэмбриональном периодах.
Особое значение апудоциты приобретают при изменение состояния организма под действием чрезвычайных ситуаций, приводящих к стрессу. Они играют важную роль в поддержании гомеостаза в таких ситуациях. Так, например, под влиянием гипербарической оксигенации в лёгких повышается количество апудоцитов, усиливается выработка ими гормонов и изменяется их функционирование.
Практически все гормоны апудоцитов являются пролиферотропными веществами, влияющими на деление клеток. При этом часть из них функционирует как активаторы, а другая часть — как ингибиторы клеточной пролиферации. В зависимости от условий одни и те же гормоны могут быть одновременно как активаторами, так и ингибиторами деления. При нормальной синхронной работе всех клеток АPUD-системы в организме постоянно поддерживается оптимальный уровень концентрации гормонов, который обеспечивает процесс пролиферации и апоптоза в каждом конкретном органе согласно его морфологического и функционального статуса. Нарушение выработки определенных гормонов диффузной эндокринной системой при опухолевом росте может привести к расстройствам в гормональном статусе человека.
Какое количество апудоцитов известно на сегодняшний день
APUD-система (АПУД-система, диффузная нейроэндокринная система) — система клеток, имеющих предполагаемого общего эмбрионального предшественника и обладающих способностью ситезировать, накапливать и секретировать биогенные амины и/или пептидные гормоны. Аббревиатура APUD образована из первых букв английских слов:
— А — amines — амины;
— р — precursor — предшественник;
— U — uptake — усвоение, поглощение;
— D — decarboxylation — декарбоксилирование.
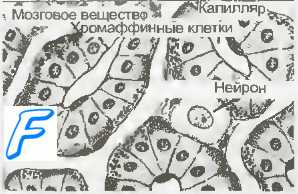
В настоящее время идентифицировано около 60 типов клеток APUD-системы (апудоциты), которые встречаются в:
— центральной нервной системе — гипоталамусе, мозжечке;
— симпатических ганглиях;
— железах внутренней секреции — аденогипофизе, шишковидном теле, щитовидной железе, островках поджелудочной железы, надпочечниках, яичниках;
— желудочно-кишечном тракте;
— эпителии дыхательных путей и легких;
— почках;
— коже;
— тимусе;
— мочевых путях;
— плаценте и т.д.
В результате проведенных эмбриологических исследований сделано предположение, что первичные клетки APUD-системы происходят из нервного гребешка (нейро-эндокринно-программированного эпибласта). В ходе развития организма они распраделяются между клетками различных органов. Апудоциты могут в органах и тканях могут располагаться диффузно или группами среди других клеток.
В клетках APUD-системы синтезируются, наряду с биогенными аминами, пептиды. Установлено, что биологически активные соединения, образующиеся в клетками данной системы, выполняют эндокринную, нейрокринную и нейроэндокринную, а также паракринную функции. Следует подчеркнуть, что ряд соединений (вазоактивный интестинальный пептид, нейротензин и др.) высвобождаются не только из клеток APUD-системы, но и из нервных окончаний.
Этот факт и широкое представительство в отделах головного мозга, а также дифференцировка клеток данной системы из нервного гребешка и их расположение в тканях эндокринных желез, связанных с головным мозгом (гипофиз, шишковидная железа и т.д.) позволяет сделать вывод о том, что эта система является особым звеном, ответственным за поддержание гомеостаза организма.
Ряд авторов считают, что APUD-система является отделом нервной системы, помимо центральной, периферической и автономной систем.
Однако на основании анализа данных многочисленных исследований последних лет можно заключить, что в основе механизма регуляции всех органов и систем организма лежит координированное функциональное взаимодействие между эндокринной (в том числе APUD-сиетемой) и нервной системами.
В результате обобщения результатов изучения «получения» и «переноса» информации на субклеточном, клеточном и тканевом уровнях о состоянии организма в целом и его отдельных частей, что подтверждается фактом идентичности физиологически активных соединений как в нервной системе (нейротрансмиттеры) так и в качестве гормонов APUD-системы. Это позволяет объединить эти две системы, ранее рассматриваемые в отдельности, в универсальную нейроэндокринную систему.
APUD-система
Определение
APUD-система ( « АПУД-система», « Эй-Пи-Ю-Ди-система» ) — это система разбросанных по организму эндокринных секретирующих клеток (апудоцитов), имеющих обще е нервное происхождение и обладающих способностью си н тезировать, накапливать и секретировать биогенные амины и/или пептидные гормоны.
Ключевые признаки APUD-системы
1. Диффузное (разбросанное) расположение её клеток в отличие от секретирующих клеток эндокринных желёз.
2. Поглощение аминокислот-предшественниц.
3. Декарбоксилирование аминокислот-предшественниц.
4. Секреция биогенных аминов и/или пептидных гормонов.
Синонимы APUD-системы: «диффузная эндокринная система», «диффузная нейроэндокринная система», «паракринная система», «ПОДАП-система», «система светлых клеток», «хромафинная система», «гастроэнтеропанкреатическая система» и др.
Расшифровка названия «APUD»
Название «APUD» образован о из первых букв английских слов:
— А — amines — амины;
— P — precursor — предшественник;
— U — uptake — усвоение, поглощение;
— D — decarboxylation — декарбоксилирование.
Считается, что первичные клетки APUD-системы происходят из нервного гребешка (нейро-эндокринно-программированного эпибласта), т.е. имеют нервное происхождение. В ходе развития организма они распределяются между клетками различных органов. Апудоциты в органах и тканях могут располагаться диффузно или группами среди других клеток. Биологически активные соединения, образующиеся в клетками данной системы, выполняют эндокринную, нейрокринную, нейроэндокринную, а также паракринную функции. Целый ряд свойственных им соединений (вазоактивный интестинальный пептид, нейротензин и другие) высвобождаются не только из клеток APUD-системы, но также и из нервных окончаний. Поэтому трудно сказать совершенно определённо, куда именно следует относить APUD-систему: к нервной или к эндокринной системе.
Тем не менее, определённо можно сказать следующее:
APUD-система относится к нейроэндокринной системе регуляции и отвечает за поддержание гомеостаза в организме наряду с нервной и эндокринной системами.
Свойства апудоцитов
Все клетки системы АПУД способны накапливать аминокислоты гистидин, триптофан и тирозин и путём декарбоксилирования превращать их в биологически активные вещества (медиаторы): гистамин, серотонин и дофамин. Кроме этого, практически любая клетка системы АПУД потенциально способна синтезировать пептидные гормоны. Как правило, каждая АПУД-клетка синтезирует только один тип гормона или медиатора.
Апудоциты открытого типа являются хеморецепторами для содержимого полых органов: желудка, кишки или бронхов. Они сообщаются с внешней средой. Апудоциты закрытого типа получают информационные сигналы из внутренней среды организма. Они отвечают на эти сигналы продуцированием гландулярных пептидных гормонов (соматостатин, ВИП, бомбезин, нейротензин, субстанция Р, эндорфины и т.д.) и биогенных аминов. Все активные вещества, которые они выделяют, также имеют возможность резервного синтеза и в клетках других органов.
endkletki.jpg
Рисунок 1. Эндокринные клетки АПУД-системы желудочно-кишечного тракта.
Гастроэнторопанкреатическая эндокринная система
Наиболее изучена АПУД-система желудочно-кишечного тракта и поджелудочной железы, объединяемая в гастроэнтеропанкреатическую эндокринную систему, на долю которой приходится около половины всех апудоцитов организма. Она является самым большим производителем гормонов в теле человека.
Несколько разных типов апудоцитов этой системы регулируют секрецию соляной кислоты в желудке.
В кислотопродуцирующей зоне желудка (в теле желудка, области дна и интермедиальной зоне) ECL- и D-клетки зарытого типа располагаются рядом с секретирующими соляную кислоту париетальными клетками желудка и обеспечивают паракринную регуляцию их гистамином и соматостатином. В антральной части желудка (в самой нижней его части, которая переходит в двенадцатиперстную кишку) располагаются G-клетки открытого типа. Они имеют мембранные рецепторы, открытые в просвет желудочно-кишечного тракта (их содержится 220—490 клеток на 1 мм²), от которых к кислотопродуцирующим париетальным клеткам желудка гиперсекреторный гастрин транспортируется кровью по воротным сосудам и по общему системному кровотоку. При этом рядом с G-клетками находятся D-клетки открытого типа, и, таким образом, последние имеют возможность паракринно ингибировать секрецию гастрина G-клетками.
EC-клетки, наиболее многочисленная популяция энтероэндокринных клеток эпителиальной выстилки желудочно-кишечного тракта. Их популяция протянулась от нижнего пищеводного сфинктера до ануса. Они производят и запасают серотонин (около 90% всего синтезируемого в теле человека серотонина), который стимулирует секрецию пищеварительных ферментов, выделение слизи и двигательную активность пищеварительной системы. Также они выделяют субста́нцию Р, обладающую широким спектром биологической активности, которая оказывает сосудорасширяющее действие, влияя на артериальное давление крови, увеличивает капиллярную проницаемость, способствует дегрануляции тучных клеток, является хемоаттрактантом для лейкоцитов, активирует синтез и высвобождение медиаторов воспаления, вызывает сокращение гладкой мускулатуры, оказывает секретогенное действие, стимулирует высвобождение пролактина и пищеварительных гормонов.
D1-клетки, содержатся в желудке, тонкой и толстой кишке и выделяют вазоакти́вный интестина́льный пепти́д (ВИП), являющийся нейромедиатором и ингибитором, угнетающим секрецию соляной кислоты париетальными клетками и одновременно стимулирующим панкреатическую секрецию, выделение пепсиногена главными клетками слизистой оболочки желудка и независимое от желчных кислот желчеотделение, обладает сильным стимулирующим действием на кровоток в стенке кишки, а также на гладкую мускулатуру желудочно-кишечного тракта.
РР-клетки содержатся в слизистой оболочке пилорического отдела желудка, тонкой и толстой кишках и выделяют панкреатический полипептид, являющийся антагонистом холецистокинина. Они подавляют секрецию поджелудочной железы и секрецию желудочного сока.
Какие же вещества способна производить АПУД-система?
Какое количество апудоцитов известно на сегодняшний день
Общими свойствами апудоцитов, определяемыми как эндокриноподобные, являются:
— высокая концентрация биогенных аминов — катехоламины, 5-гидрокситриптамин (серотонин);
— способность к поглощению предшественников биогенных аминов — аминокислот (тирозин, гистидин и др.) и их декарбоксилирование;
— значительное содержание ферментов — глицерофосфатдегидрогеназы, неспецифических эстераз, холинэстеразы;
— аргирофилия;
— специфическая иммунофлюоресценция;
— присутствие фермента — нейронспецифической енолазы.
Биогенные амины и гормоны, синтезируемые в апудоцитах, обладают многообразными эффектами не только в отношении органов желудочно-кишечного тракта. В таблице, представлена краткая характеристика наиболее изученных гормонов APUD-сиетемы.
Классификация апудоцитов желудочно-кишечного тракта
В марте 1973 года на Международном симпозиуме по гастродуоденальнои патофизиологии в Болонье была принята первая классификация эндокриноподобных клеток. Согласно этой классификации в желудке выделяют шесть типов эндокринных клеток:
— ЕС-клетки (энтерохромаффинные) — синтезируются субстанция Р, серотонин, мотилин (ЕС2) и др.;
— G-клетки — вырабатывают гастрин (и незначительное количество АКТГ),
— ECL-клетки (энтерохромаффиноподобные) — синтезируются серотонин, гистамин и, вероятно, дофамин;
— а-подобные клетки (схожи по ряду признаков с а-клетками поджелудочной железы, вырабатывающие глюкагон) — образуется глюкагон, к этой грппе относятся и D-клетки (D и D1), в которых синтезируется соматостатин;
— ЕС- и S-клетки (в тонкой кишке) — вырабатывается секретин;
— EG-клетки — синтезируется энтероглюкагон.
В наибольшей степени в настоящее время изучена APUD-система, представленная в органах желудочно-кишечного тракта и поджелудочной железе, которую объединяют в отдельную гастроэнтеропанкреатическую эндокринную систему. Соединения, синтезируемые в апудоцитах, представлены в этих органах, называются гастроинтестинальный гормонами. Считается, что от общего количества апудоцитов в организме на долю этой части APUD-системы приходится примерно половина всех клеток этой системы.
Гастроинтестинальные гормоны имеют ряд особенностей по сравнению с классическим определением гормонов:
— клетки, секретирующие гастроинтестинальные гормоны, расположены диффузно, а не объединены в железистые структуры (железы внутренней секреции);
— аналогичные соединения выявлены в нейронах центральной, периферической и автономной (желудочно-кишечного тракта) нервной системы, в органах мочеполовой системы, легких и т.д.;
— синтез и секреция гастроинтестинальных гормонов регулируются непосредственно объемом, значениями рН, химическим составом и температурой содержимого желудочно-кишечного тракта.
Характерными признаками большинства эндокриноподобных клеток слизистой оболочки пилорическои части желудка и тонкого кишечника являются:
— четкая морфологическая полярность — наличие рецепторного полюса, в котором расположен супрануклеарный пластинчатый комплекс Гольджи и базальные секреторные гранулы диаметром 100—300 нм;
— непосредственный контакт рецепторного полюса с внутренним просветом органов.
Химус, поступивший в пилорическую часть желудка и тонкий кишечник, для апудоцитов является источником информации о количестве, природе, состоянии пищи и продуктов ее переваривания. В слизистой оболочке дна желудка эндокриноподобные клетки расположены в железах и не могут взаимодействовать непосредственно с его содержимым и, как следствие, не отвечают на типичные стимуляторы апудоцитов пилорического отдела.
Секреция содержимого гранул происходит либо на базальной поверхности апудоцита, либо вдоль нижней части его боковой поверхности. Биологически активные соединения (активные пептиды и биогенные амины) оказывают свое действие, как правило, паракринным путем, т.е. на клетки-мишени, расположенные в непосредственной близости. Выделяемые эндокриноподобными клетками соединения могут, не поступая в кровь (не осуществляя истинно эндокринного влияния), взаимодействовать с рецепторами, расположенными на нервных окончаниях, гладкомышечных клетках стенки сосудов, осуществляя местную (паракринную) регуляцию.
АПУД-СИСТЕМА
АПУД-СИСТЕМА, APUD-система (APUD — аббревиатура, образованная из первых букв английских слов amine амины, precursor предшественники аминов, uptane накопление, decarboxylation декарбоксилирование) — нейроэндокринно-запрограммированная клеточная организация, обладающая высокой функциональной активностью. Благодаря синтезу, накоплению и секреции пептидов и аминов, характеризующихся гормональным действием, она участвует в проведении нервного возбуждения, процессах обмена и обеспечении гомеостаза. В клинике АПУД-система изучается в связи с развитием морфофункциональной патологии образующих ее клеток, проявляющейся в виде апудопатий и апудом (специфических гормонально-активных опухолей).
Учение об АПУД-системе является новым, проблема эта еще мало изучена; наряду с достижениями в этой области многие вопросы остаются пока не вполне ясными, а трактовка их спорной.
Концепция АПУД-системы предложена Пирсом (A. G. Е. Pearse) в 1966—1968 годы. Ей предшествовало учение, сформулированное Фейртером (F. Feyrter; 1938, 1953, 1966) о периферической эндокринной системе клеток.
Зрелые дифференцированные клетки АПУД-системы называются апудоцитами, их предшественники — апудобластами, а процесс развития апудоцитов — апудвгенезом.
Известны около 40 типов апудоцитов, из них 18 определенно являются производными нейральной или специализированной эктодермы, источники остальных типов клеток остаются неизвестными.
Клетки АПУД-системы локализуются в различных органах, как обладающих, так и не обладающих гормональной функцией: гипофизе, эпифизе, щитовидной и околощитовидной железах, желудочно-кишечном тракте, поджелудочной железе, печени, надпочечниках, пищеводе, трахее, бронхах, почках, каротидном теле, вкусовых сосочках языка и др. Локализация таких клеток и продуцируемые ими вещества представлены в таблица 1, предложенной И. М. Кветным в 1981 году. Приведенный перечень апудоцитов не следует считать исчерпывающим, он может служить лишь основой для дальнейших исследований в целях подтверждения и поиска новых элементов АПУД-системы.
Важную роль в распознавании клеток АПУД-системы играют методы электронной микроскопии, иммуноцитохимии, радиоиммунологический метод, биологическое определение гормонов.
В 1977 годы была разработана Лозаннская классификация клеток АПУД-системы, локализующихся в органах пищеварения (представлена в таблица 2).
Клетки, локализующиеся в органах желудочно-кишечного тракта, продуцируют многочисленные гормоны и так называемые «кандидаты в гормоны», классификацию которых в 1974 году разработал Гроссман (S. P. Grossman) (таблица 3).
Ряд пептидов (см.), обладающих гормональной активностью, родственных друг другу по структуре и по происхождению из клеток АПУД-системы, обнаружены как в гастроэнтеропанкреатической системе, так и в мозговой ткани. Такие пептиды (гормоны) были систематизированы Пирсом в 1977 г.
Эволюция пептидных гормонов и расщепляющих их высокоспецифических пептидаз происходит параллельно с эволюцией специфических рецепторов.
Нарушения структуры и функции апудоцитов, выражающиеся клиническими синдромами, называют апудопатиями.
И. М. Кветной и H. Т. Райхлин (1978) предложили клинико-морфологическую классификацию апудопатий, разделив их на первичные и вторичные и определив принадлежность к этим категориям конкретных форм.
I. Первичные апудопатии.
1. Апудопатии, характеризующиеся гиперплазией (гиперфункцией) отдельных апудоцитов (синдром гиперфункции эпифиза — эпифизарное ожирение Марбурга, гиперпаратиреоз — гиперпаратиреоидная фиброзная остеодистрофия, акромегалия, острая язва желудка и двенадцатиперстной кишки и т. д.).
2. Апудопатии, вызванные гипоплазией (гипофункцией) отдельных апудоцитов (гипофункциональный эпифизарный синдром — болезнь Пеллицци, синдром гипопаратиреоиднои тетании; хронический гастрит с секреторной недостаточностью, сахарный диабет и т. д.).
3. Апудопатии, проявляющиеся опухолями, исходящими из клеток АПУД-системы (апудомы) (см. ниже).
4. Апудопатии, при которых имеет место дисфункция многих апудоцитов — так наз. множественные эндокринные неоплазии (см. ниже).
II. Вторичные апудопатии (следствие реакции клеток АПУД-системы на патологию, первично развившуюся вне этой системы).
1. Апудопатии при инфекционных болезнях (сосудистые поражения; изменения АД, чаще гипотонического характера; нарушения углеводного обмена и т. д.).
2. Апудопатии при опухолевом росте, именуемые паранеопластичес-кими синдромами (неспецифическое усиление обмена веществ, лихорадка, изменения крови, гиперкортицизма полиневриты, невропатии и психические нарушения).
3. Апудопатии при заболеваниях сердечно-сосудистой системы (проявляются острыми эрозиями и язвой желудка с кровотечениями).
4. Апудопатии при заболеваниях нервной системы (при болезни Паркинсона и амиотрофическом боковом склерозе).
5. Апудопатии при врожденных обменных нарушениях.
6. Апудопатии при коллагенозах.
Важной является проблема а пудом — опухолей эндокринных клеток АПУД-системы, обладающих гормональным действием, секретирующих пептиды и амины. При этом наблюдаются поражения клеток типа гиперплазии или неоплазии.
Ультраструктура апудом характеризуется наличием «эндокринных» или «нейроэндокринных» аккумулирующих гранул, содержащих пептидные компоненты. С ними связаны важные цитохимические признаки апудом, в частности их неспецифическая эстеразная и (или) холинэсте-разная активность. Имеются данные в пользу того, что первичным исходным продуктом отдельных апудом является мультипотенциальный белок, так называемый «общий предшественник». Когда на этот белок действуют фракции микросомальных ферментов, секретируемых дифференцированными клетками, образуются гормонально «корригированные» вещества этих клеток (например, инсулин с микросомами инсулом, гастрин с микросомами гастрином и т. п.).
Большая часть известных апудом является эндокринными опухолями пищеварительного тракта, продуцирующими гормоны. К ним относятся гастриномы, инсуломы, карциноиды, а также нек-рые еще сравнительно мало изученные опухоли — глюкагонома, VIP-ома, РР-ома и соматостатинома. Известны и эктопические опухоли, образующие такие вещества, как АКТГ.
Гистологические исследования Блума и Полака (S. R. Bloom, J.M. Polak, 1980) позволили установить, что многие из этих опухолей состоят из нескольких типов клеток АПУД-системы, секретирующих несколько (два и более) гормонов. Обычно доминирует клиническая картина, связанная с тем гормоном, который секретируется в максимальном количестве.
Апудомы делят на три группы:
1. Ортоэндокринные апудомы, такие как инсулома, глюкагонома, га-стринома, феохромоцитома, опухоли передней доли гипофиза, кальцитонинома и карциноиды; они продуцируют соответствующие гормоны теми же клетками, что и в нормальных условиях, но в избыточных количествах.
2. Параэндокринные апудомы, исходящие из желез внутренней секреции либо из тканей, которые обычно не рассматриваются как эндокринные (например, ткань бронхов, почек), секретируют один или несколько гормонов, типичных для других клеток АПУД-системы. Так, АКТГ, помимо гипофиза, может секретироваться медуллярным раком щитовидной железы, феохромоцитомой, опухолью островков Лангерганса поджелудочной железы. Нек-рые параэндокринные апудомы, например, карциноиды бронхов, секретируют антидиуретический гормон (АДГ), а почечная карцинома — энтероглюкагон.
3. Множественные эндокринные неоплазии (МЭН) — аденомы, гиперплазии, или множественный эндокринный аденоматоз (МЭА) представляют собой наследственно детерминированные поражения, характеризующиеся образованием множественных опухолей эндокринных желез у одного и того же больного, происходящих, как правило, из клеток АПУД-системы. Среди них выделяют три основных синдрома МЭН (МЭА): МЭН-I, или синдром Вермера — Андердейла; МЭН-II, или синдром Сиппла; МЭН-III, или синдром Горлина. Характеристика этих синдромов приводится ниже.
Наиболее подробно изучены следующие апудомы: гастрин ома, или синдром Золлингера — Эллисона (см. Золлингера — Эллисона синдром), инсулома (см.), глюкагонома (см.), карциноид (см.). Кроме того, описаны более редкие апудомы — випома, РР-ома, соматостатинома [Гласс (G. В. Glass), 1980; О. С. Радбиль, 1981] и др.
Випома — содержит вазоактивный интестинальный полипептид VIP (выделен из тонкой кишки свиней), состоящий из 28 аминокислотных остатков, сходный по структуре с секретином, глюкагоном и обладающий широким спектром биологических эффектов, как-то: вазодилатация и гипотензия (вплоть до сосудистого коллапса), стимуляция кишечной секреции, торможение секреции желудком HCl, стимуляция гликогенолиза и липолиза, гиперкальциемия, расслабление гладкой мускулатуры (кроме мышц сосудистой стенки), стимуляция панкреатической секреции бикарбонатов и отделения желчи. Избыточная секреция VIP сопровождается тяжелыми водянистыми поносами, низкой секрецией HCl, гипокалиемией. Уровень VIP в плазме крови при випомах очень высок.
Действием VIP хорошо объясняется симптоматика при синдроме Вернера — Моррисона — неклеточной аденомы островковых клеток поджелудочной железы (его синонимами являются: панкреатическая холера, синдром WDHA — водная диарея, гипокалиемия, ахлоргидрия). Клинической картине свойственна тяжелая водянистая диарея (10— 15 л в сутки), ахлоргидрия или гипохлоргидрия, гипокалиемия, дегидратация, нарушение толерантности к глюкозе по типу сахарного диабета, гиперкальциемия, гипотензия, приливы, гипотония и растяжение желчного пузыря.
О причинной роли VIP в патогенезе синдрома Вернера — Моррисона свидетельствует также наличие высоких концентраций этого полипептида в плазме, опухолевой ткани, падение его уровня в циркулирующей крови, а также исчезновение или уменьшение клинических проявлений этого синдрома после удаления випомы или химиотерапии; следует иметь в виду, что водянистую диарею могут вызвать также панкреатический полипептид (РР), простагландины.
Примерно в 2/3 случаев випомы являются относительно доброкачественными опухолями. Они могут быть удалены хирургическим путем, однако после операции возможны рецидивы. При злокачественных випомах удается добиться длительной ремиссии при помощи стрептозотоцина (короткие курсы по 2—4 г через день, всего не более 8 дней с месячным перерывом). Для подавления диареи больному перед операцией вводят соматостатин или большие дозы кортикостероидов.
PP-ома характеризуется наличием выделенного Киммелом (J. R. Kimmel) с соавторами, в 1968 году при очистке инсулина цыпленка большого пептида, который был обозначен термином «панкреатический полипептид» (РР). Он содержит 36 аминокислотных остатков, локализуется в секреторных гранулах клеток, рассеянных как в островковой ткани поджелудочной железы, так и в экзокринной ее ткани, оказывает разнообразное воздействие на функции желудочно-кишечного тракта. Вслед за тем P P был обнаружен в поджелудочной железе различных видов животных. Были также обнаружены высокие его концентрации в циркулирующей крови после приема пищи. У человека РР, по-видимому, образуется только в поджелудочной железе; в плазме крови после тотальной панкреатэктомии он не определяется. Фармакологическими исследованиями установлено, что РР в небольшой степени тормозит сокращение желчного пузыря и его секрецию, а также секрецию панкреатических ферментов, но не влияет сколько-нибудь существенно на секрецию HCl, моторно-эвакуаторную функцию желудка, концентрацию глюкозы, инсулина и глюкагона в крови. Для концентрации РР в плазме крови характерны значительные индивидуальные колебания.
РР часто обнаруживают в эндокринных опухолях поджелудочной железы, примерно в 50% случаев они секретируют РР дополнительно к инсулину глюкагону.
Ларссон (L. I. Larsson) с соавторами (1976) и Боди (С. Bordi) с соавторами (1977) описали 2 случая «чистых» РР-клеточных опухолей. В одном из них имел место классический синдром Вернера — Моррисона; при этом панкреатическая эндокринная опухоль с печеночными метастазами состояла на 90% из РР-клеток, a VIP-иммунореактивные клетки составляли менее 1%, концентрация РР в плазме была повышена в 1000 раз. У другого больного во время операции по поводу язвенной болезни случайно обнаружили 2 небольшие опухоли в поджелудочной железе, в одной из которых преобладали РР-клетки. Ларссон в 1977 г. описал различные типы гиперплазии РР-клеток, в том числе у ряда больных ювенильным диабетом и хроническим панкреатитом (возможно, речь идет о неспецифической реакции на повреждение панкреатической ткани). Примерно у 50% больных с глюкагономами зарегистрирована высокая концентрация P P в плазме крови.
Обнаружение у ряда больных с синдромом типичной водной диареи РР-клеточной опухоли и тысячекратное увеличение в их плазме количества P P при нормальном содержании VIP дало основание предполагать, что P P является дополнительным причинным фактором и при этом синдроме.
Известно также, что препарат РР запатентован как ветеринарное слабительное средство. Однако высокие дозы P P воздействуют на кишечник скорее как стимулятор дефекации, чем как средство, вызывающее поносы. Поэтому данные о том, что РР является причинным фактором синдрома водной диареи требуют дополнительного подтверждения.
РР-омы клинически обычно протекают латентно, так что установить наличие их затруднительно. Лечение хирургическое.
Соматостатинома — опухоль, состоящая преимущественно из содержащих соматостатин D-клеток, обнаружена в мозге, желудочно-кишечном тракте и поджелудочной железе различных видов животных и человека.
Соматостатин (см.) — полипептид, содержащий 14 аминокислотных остатков, обладает различным фармакологическим действием, оказывает тормозящее влияние на эндокринные и секреторные функции, в частности на секрецию HCl, эндогенного гастрина, внешнесекреторную функцию поджелудочной железы (ферменты и бикарбонаты), на секрецию инсулина, РР и глюкагона (Блум, 1978), гормона роста и высвобождение TSH, секрецию всех других гастроинтестинальных гормонов и гормональных пептидов. С тех пор как было обнаружено, что соматостатин тормозит секреторную функцию гипофизарных, желудочно-кишечных и панкреатических клеток, было высказано предположение, что он может оказывать физиологическое действие как нейральным, так и паракринным путем. Его происхождение, природа и биологическое значение полностью пока не ясны.
До сего времени в литературе было сообщено о трех соматостатиномах — доброкачественной и 2 злокачественных (в поджелудочной железе). Уровень соматостатина в плазме был повышен у этих больных в 40 раз. Диагноз подтверждался гистологическим и ультраструктурным сходством клеток метастазов и панкреатических D-клеток. Наблюдалось поражение желчного пузыря, связанное, по-видимому, с тем, что соматостатин угнетает сокращение желчного пузыря, способствуя развитию холелитиаза. При избытке соматостатина тормозится секреция РР и нарушаются процессы всасывания в желудочно-кишечном тракте.
Диагноз соматостатиномы ставится при избыточном высвобождении из ее клеток соматостатина под воздействием толбутамида. Лечение соматостатином требует дальнейшей разработки. Установлено, что диазоксид снижает уровень соматостатина в плазме. При лечении соматостатиномы предложено применять стрептозотоцин, уровень соматостатина в плазме при этом снижается в 3—4 раза.
Все большее значение приобретает изучение множественных эндокринных неопластических синдромов — МЭН [Бейлин (S. В. Baylin, 1978), О. С. Радбиль, 1980, и др.].
МЭH-I (синдром Вермера — Андердейла) — аутосомно-доминант-ное заболевание с высокой пенетрантностью гена, при к-ром пролиферативный процесс (опухоль или гиперплазия) поражает не менее двух эндокринных желез. Наиболее часто процесс развивается в паращитовидных железах, поджелудочной железе, гипофизе, в коре надпочечников, щитовидной железе, реже в энтеро-хромаффинной ткани и половых железах. Известны два клинических варианта, связанных с поражением поджелудочной железы — когда на первый план выступает клиническая картина синдрома Золлингера — Эллисона и когда преобладают нарушения регуляции обмена углеводов (спонтанные гипогликемии, диабет, повышенное выделение глюкагона опухолью поджелудочной железы). Наблюдаются также карциноидный синдром и не-р-клеточные островковые опухоли, которые могут вызывать синдром водной диареи, что, по-видимому, связано с избыточным образованием VIP. Лечение МЭН-1: при соответствующих показаниях паратиреоидэктомия; удаление инсуломы; при синдроме Золлингера — Эллисона — удаление опухоли, нередко в сочетании с тотальной резекцией желудка, или курсовое альтернативное лечение циметидином (тагамет) либо ранитидином.
МЭH-II (синдром Сиппла) — аутосомно-доминантное поражение с высокой степенью пенетрантности; патология — семейная, связанная с поражением нейроэктодермальной ткани, характеризуется наличием гиперпаратиреоидизма, двусторонними феохромоцитомой и медуллярной карциномой щитовидной железы. Лечение МЭН-II зависит от уровня секреторной активности опухолей и характера их развития. Медуллярные карциномы щитовидной железы и феохромоцитомы подлежат удалению.
МЭH-III (синдром Горлина) — аутосомно-доминантное поражение, при котором развиваются рак щитовидной железы, двусторонняя феохромоцитома, нейромы слизистых оболочек (языка, губ, век), утолщение нижней губы, реже — периферические или висцеральные нейромы или нейрофибромы. При этом наблюдается марфаноподобное строение тела (см. Марфана синдром). Лечение мэн-III начинают с удаления феохромоцитомы и затем пораженной щитовидной железы (тотальная тиреоэктомия и тщательное исследование лимфатических узлов, удаление регионарных метастазов).
Описаны также синдромы МЭН смешанного типа, при которых наблюдаются поражения, свойственные двум или трем множественным неопластическим синдромам.
В таблице 4 приведена характеристика трех главных синдромов МЭН по Бейлину (1978).
Концепция АПУД-системы является основой для дальнейшего изучения взаимоотношений между центрально или периферически действующими пептидами — передатчиками нервного возбуждения и эндокринными пептидами гастроэнтеропанкреатического комплекса, гипофиза и плаценты. Развитие учения об АПУД-системе объединенными усилиями эмбриологов, гистологов, нейрофизиологов, клиницистов и представителей других специальностей позволит, по-видимому, уточнить на основе мультидисциплинарных исследований патогенетические закономерности возникновения и развития многих заболеваний, их клиническую картину, улучшить их диагностику и разработать более рациональные и специфические методы лечения.
Таблицы
Таблица 1. АПУДОЦИТЫ И ПРОДУЦИРУЕМЫЕ ИМИ ВЕЩЕСТВА