какое количество альфа частиц образуется при превращении ra 226 в po 214
Какое количество альфа частиц образуется при превращении ra 226 в po 214
Рассмотрим распад радия-226 подробнее. У 226 Ra период полураспада 1600 лет. Следовательно, только через 1600 лет его активность, т.е. количество распадов уменьшится в два раза. Можно смело считать, что его активность за годы и даже столетие заметно не измениться, т.е. он будет распадаться практически с постоянной скоростью. Соответственно радон-222 тоже будет образовываться с постоянной скоростью, но образовавшись он будет и распадаться. Его активность со временем t будет меняться по закону
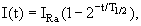
где IRa – активность радия, T1/2 – период полураспада радона-222 (
3.8 дня). Через время равное периоду полураспада радона, его активность будет равно половине активности радия, через два периода полураспада 3/4 и т.д. На рис. 2 показана зависимость активности радона от времени.
Видно, что приблизительно через месяц активность радона станет практически такой же, как и активность радия. Периоды полураспадов всех последующих изотопов вплоть до свинца-210 заметно меньше, чем у радона-222 и их активности будут меняться практически так же, как и активность радона. Через месяц активности 222 Rn, 218 Po (полоний), 214 Pb, 214 Bi (висмут), 214 Po будут одинаковыми и такими же как у 226 Ra. Их активности дальше будут меняться очень медленно, так же как у 226 Ra.
Что касается 210 Pb, то через месяц он будет образовываться с постоянной скоростью, но количество его и, соответственно, активность будет расти по такому же закону (1), только период полураспада в (1) в этом случае будет «свинцовый», т.е. 22.3 года. На рис. 3. показана зависимость активности свинца-210 от времени. Видно, что активность свинца-210 набирается гораздо медленнее, чем у его «предшественников».
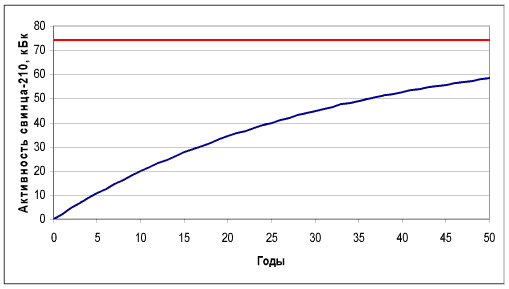
Рис. 3. Зависимость активности свинца-210 от времени.
У висмута-210 и полония-210 периоды полураспада заметно меньше, чем у свинца-210, и их активности будут меняться со временем также как у свинца-210. В конце концов образуется стабильный свинец-206.
Радиоизотопные источники альфа-излучения
Основными радиоизотопными источниками α-излучения являются тяжёлые радиоактивные элементы: радий-226 и дочерние продукты его деления, полоний-210, плутоний-238, плутоний-239, актиний-227, америций-241, самарий-242.
Радий-226 исторически был самым первым обнаруженным радиоактивным элементом, но и сейчас он используется достаточно широко. Радий-226 в процессе α-распада последовательно проходит целый ряд превращений:
226 Ra→ 222 Rn→ 218 Po→ 214 Po→ 210 Po→ 206 Pb в конечном итоге превращаясь в нерадиоактивный свинец 206 Pb. На каждом этапе этих превращений излучается одна α-частица, но каждой реакции соответствует своя энергия α-частиц и свой период полураспада. Характеристики α-распада 226 Ra и его дочерних продуктов представлены в таблице 2.5 [5].
Основные характеристики α-распада 226 Ra и его дочерних продуктов
| Исходный изотоп | Реакция α-распада | Энергия α-частиц, МэВ | Период полураспада |
| 226 Ra | 226 Ra→ 222 Rn+α | 4,777 | 1622 года |
| 222 Rn | 222 Rn→ 218 Po+α | 5,486 | 3,825 суток |
| 218 Po | 218 Po→ 21 4 Po+α+2e | 5,998 | 3,05 мин |
| 21 4 Po | 21 4 Po→ 21 0 Po+α+2e | 7,680 | 164 мкс |
| 21 0 Po | 21 0 Po→ 2 06 Pb+α | 5,298 | 138,4 суток |
| 2 06 Pb | Устойчивый | — | — |
Примечание: Полная схема распада 226 Ra кроме реакций α-распада включает и реакции β-распада со своими дочерними продуктами.
Наличие нескольких дочерних продуктов α-распада, также подверженных α-распаду с резко отличными периодами полураспада, приводит к нестабильности величины активности радиевых источников во времени и нестабильности его энергетического спектра, поскольку каждый из дочерних продуктов испускает α-частицы с энергией, существенно отличной как от энергии α-частиц 226 Ra, так и от энергии α-частиц, испускаемых другими дочерними продуктами. Поэтому радиевые источники не используют в качестве образцовых источников α-излучения. В качестве таковых преимущественно используют плутониевые и другие источники.
Плутоний получают путём облучения нейтронами 238 U в ядерном реакторе. 239 Pu имеет период полураспада 24360 лет, что обеспечивает долговременную стабильность его активности: за 20 лет его активность уменьшается всего на 0,14 %. Однако, такая высокая стабильность обеспечивается лишь в случае высокой изотопной однородности источника. Дело в том, что при облучении урана-238 нейтронами, помимо изотопа 239 Pu в небольших количествах образуются изотопы 241 Pu, 240 Pu и 238 Pu. Но если небольшие примеси 240 Pu и 238 Pu не приводят к заметным изменениям активности источника, поскольку период полураспада этих изотопов весьма велик (6580 лет у 240 Pu и 86,4 года у 238 Pu), то примеси изотопа 241 Pu могут приводить к существенно большей нестабильности источника за счёт накопления изотопа 241 Am. Этот изотоп образуется в результате β-распада 241 Pu (период полураспада 12,9 года), и сам является активным α-источником с периодом полураспада 458 лет. Постепенное накопление в источнике 241 Am приводит к небольшому росту активности источника. Энергия α-частиц, излучаемых при распаде 239 Pu, составляет примерно 5,1 МэВ. Энергия α-частиц, излучаемых при распаде 241 Am, составляет 5,47 МэВ. При распаде 238 Pu большая часть испускаемых α-частиц (71%) имеет энергию 5,5 МэВ, а остальные 28 % – энергию 5,46 МэВ.
Более детальные сведения о нуклидах, являющихся источниками α-излучения, приведены в таблице 2.6 [8].
В настоящее время в качестве образцовых источников α-излучения преимущественно используют плутониевые источники из изотопов 239 Pu и 240 Pu. Они излучают α-частицы примерно одинаковой энергии
5,1 МэВ, обладают близкими периодами полураспада, что позволяет использовать любые смеси этих изотопов для создания источников α-излучения.
Нуклиды, используемые как источники α-излучения
| Нуклид | Период полураспада | Энергия интенсивных α-групп, МэВ | Относительная интенсивность, % |
| 146 Sm 150 Gd 148 Gd 232 Th 238 U 235 U | 7∙10 7 лет 2,1∙10 6 лет 84 года 1,41∙10 10 лет 4,5∙10 9 лет 7,1∙10 8 лет | 2,46±0,02 2,73±0,01 3,18±0,01 4,011±0,005 4,200±0,005 4,214±0,003 4,394±0,002 4,438±0,003 4,550±0,003 | 5,5 |
| 236 U 230 Th | 2,39∙10 7 лет 8,0∙10 4 лет | 4,493±0,003 4,6175±0,0015 4,6840±0,0015 | |
| 234 U 237 Np | 2,4∙10 5 лет 2,14∙10 6 лет | 4,7736±0,002 4,787±0,002 | |
| 233 U | 1,62∙10 5 лет | 4,7829±0,0012 4,8236±0,0012 | |
| 241 Pu | 5,6∙10 5 лет | 4,853±0,0015 4,896±0,0015 | |
| 242 Pu | 3,73∙10 5 лет | 4,856±0,002 4,900±0,002 | |
| 231 Pa | 3,25∙10 4 лет | 4,950±0,001 5,013±0,001 5,057±0,001 | |
| 239 Pu | 2,44∙10 4 лет | 5,1055±0,0008 5,1433±0,0008 5,1556±0,0008 | |
| 240 Pu | 6,58∙10 3 лет | 5,1233±0,0007 5,1677±0,0007 | |
| 243 Am | 7,95∙10 3 лет | 5,233±0,001 5,275±0,001 | |
| 241 Am | 458 лет | 5,442±0,001 5,484±0,001 | |
| 250 Cf | 13,2 года | 5,9891±0,0006 6,0308±0,0006 | |
| 252 Cf | 2,646 года | 6,0757±0,0005 6,1183±0,0005 | |
| 249 Cf | 360 лет | 5,760±0,001 5,813±0,001 6,194±0,0007 |
Для создания миниатюрных источников α-излучения с высокой активностью используются калифорниевые источники с преобладанием изотопа 252 Cf. При этом примеси других изотопов калифорния несущественно расширяют энергетический спектр испускаемых α-частиц.
Радий-226
230 Th (α)
Принадлежит к радиоактивному семейству урана-238 (так называемый ряд урана-радия).
Содержание
Образование и распад
Радий-226 непосредственно образуется в результате α-распада нуклида 230 Th (период полураспада составляет 75 380(30) [2] лет):
С крайне низкой вероятностью (2,6(6)·10 −9 % [2] ) радий-226 испытывает кластерный распад с образованием нуклида 14 C:
Получение
Применение
См. также
Примечания
Полезное
Смотреть что такое «Радий-226» в других словарях:
Радий-228 — Таблица нуклидов Общие сведения Название, символ Радий 228, 228Ra Альтернативные названия мезоторий I, MsTh I, MsTh1 Нейтронов 140 Протонов 88 Свойства нуклида Атомн … Википедия
Радий — У этого термина существуют и другие значения, см. Радий (значения). 88 Франций ← Радий → Актиний … Википедия
Радий — (Ra) радиоактивный хим. элемент II гр. периодической системы, порядковый номер 88, массовое число 226. Открыт в 1898 г. Пьером и Марией Кюри (при исследовании радиоактивных свойств урана). В настоящее время известны 14 изотопов Ra, как природных … Геологическая энциклопедия
РАДИЙ — (символ Ra), химический элемент, белый радиоактивный металл из группы ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. Впервые обнаружен в ураните в 1898 г. Пьером и Марией КЮРИ. Этот металл, присутствующий в урановых рудах был выделен Марией КЮРИ в 1911 г. Радий… … Научно-технический энциклопедический словарь
Радий — (Radium), Ra, радиоактивный химический элемент II группы периодической системы, атомный номер 88, атомная масса 226,0254; относится к щелочноземельным металлам. Радий открыт французскими физиками П. Кюри и М. Склодовской Кюри в 1898. Открытие… … Иллюстрированный энциклопедический словарь
РАДИЙ — радиоактивный хим. элемент, символ Ra (лат. Radium), ат. н. 88, ат. м. самого долгоживущего изотопа 226,02 (период полураспада 1600 лет). Как продукт распада урана радий может накапливаться в довольно больших количествах. На примере Р. было… … Большая политехническая энциклопедия
РАДИЙ — (лат. Radium) Ra, химический элемент II группы периодической системы, атомный номер 88, атомная масса 226,0254, относится к щелочно земельным металлам. Радиоактивен; наиболее устойчивый изотоп 226Ra (период полураспада 1600 лет). Название от лат … Большой Энциклопедический словарь
Радий — Rа радиоактивный химический элемент II группы периодической системы, атомный номер 88, атомная масса 226,03; сыграл основополагающую роль в исследовании строения атомного ядра и явления радиоактивности; применяется как гамма источник в… … Термины атомной энергетики
радий — я; м. [лат. Radium от radius луч] Химический элемент (Ra), радиоактивный серебристо белый металл (применяется в медицине и технике как источник нейтронов). ◁ Радиевый, ая, ое. Р ая руда. * * * радий (лат. Radium), Ra, химический элемент II группы … Энциклопедический словарь
Радий — I Радий (Radium, Ra) радиоактивный химический элемент II группы периодической системы элементов Д.И. Менделеева; атомный номер 88, атомная масса 226,05. Серебристо белый металл, крайне редкий: в 1 т урановой руды содержится не более 0,34 г радия … Медицинская энциклопедия
Радий
| Радий | |
|---|---|
| Серебристo-белый металл | |
 | |
| Название, символ, номер | Радий / Radium (Ra), 88 |
| Атомная масса (молярная масса) | 226,0254 а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 7s 2 |
| Радиус иона | (+2e) 143 пм |
| Электроотрицательность | 0,9 (шкала Полинга) |
| Электродный потенциал | Ra←Ra 2+ −2,916 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 1-й 509,3 (5,2785) кДж/моль (эВ) 2-й 979,0 (10,147) кДж/моль (эВ) |
| Плотность (при н. у.) | (при к.т.) 5,5 г/см³ |
| Температура плавления | 1233 K |
| Температура кипения | 2010 K |
| Уд. теплота плавления | 8,5 кДж/моль |
| Уд. теплота испарения | 113 кДж/моль |
| Молярная теплоёмкость | 29,3 Дж/(K·моль) |
| Молярный объём | 45,0 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,148 |
| Теплопроводность | (300 K) (18,6) Вт/(м·К) |
| Номер CAS | 7440-14-4 |
Радий — элемент 2-й группы (по устаревшей классификации — главной подгруппы второй группы), седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium ). Простое вещество радий — блестящий металл серебристо-белого цвета, быстро тускнеющий на воздухе. Относится к щёлочноземельным металлам, обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226 Ra (период полураспада около 1600 лет ).
Содержание
История
Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран. Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий. Первое сообщение об открытии радия (в виде смеси с барием) Кюри сделали 26 декабря 1898 года во Французской академии наук. В 1910 году Мария Кюри и Андре Дебьерн выделили чистый радий путём электролиза хлорида радия на ртутном катоде и последующей дистилляции в водороде. Выделенный элемент представлял собой, как сейчас известно, изотоп радий-226, продукт распада урана-238. За открытие радия и полония супруги Кюри получили Нобелевскую премию. Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде.
В России радий впервые был получен в экспериментах известного советского радиохимика В. Г. Хлопина. В 1918 году на базе Государственного рентгеновского института было организовано Радиевое отделение, которое в 1922 году получило статус отдельного научного института. Одной из задач Радиевого института были исследования радиоактивных элементов, в первую очередь — радия. Директором нового института стал В. И. Вернадский, его заместителем — В. Г. Хлопин, физический отдел института возглавил Л. В. Мысовский.
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т. д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
| Изотоп | |
| Эманация радия | 222 Rn |
| Радий A | 218 Po |
| Радий B | 214 Pb |
| Радий C | 214 Bi |
| Радий C1 | 214 Po |
| Радий C2 | 210 Tl |
| Радий D | 210 Pb |
| Радий E | 210 Bi |
| Радий F | 210 Po |
Происхождение названия
Название «радий» связано с излучением ядер атомов Ra (лат. radius — луч).
Нахождение в природе
Все природные изотопы радия сведены в таблицу:
| Изотоп | Историческое название | Семейство | Период полураспада | Тип распада | Дочерний изотоп (историческое название) |
|---|---|---|---|---|---|
| Радий-223 | актиний Х (AcX) | ряд урана-235 | 11,435 дня | α | радон-219 (актинон, An) |
| Радий-224 | торий Х (ThX) | ряд тория-232 | 3,66 дня | α | радон-220 (торон, Tn) |
| Радий-226 | радий (Ra) | ряд урана-238 | 1602 года | α | радон-222 (радон, Rn) |
| Радий-228 | мезоторий I (MsTh1) | ряд тория-232 | 5,75 года | β | актиний-228 (мезоторий II, MsTh2) |
Геохимия радия во многом определяется особенностями миграции и концентрации урана, а также химическими свойствами самого радия — активного щёлочноземельного металла. Среди процессов, способствующих концентрированию радия, следует указать в первую очередь на формирование на небольших глубинах геохимических барьеров, в которых концентрируется радий. Такими барьерами могут быть, например, сульфатные барьеры в зоне окисления. Поднимающиеся снизу хлоридные сероводородные радийсодержащие воды в зоне окисления становятся сульфатными, сульфат радия соосаждается с BaSO4 и CaSO4, где он становится практически нерастворимым постоянным источником радона. Из-за высокой миграционной способности урана и способности его к концентрированию формируются многие типы урановых рудообразований в гидротермах, углях, битумах, углистых сланцах, песчаниках, торфяниках, фосфоритах, бурых железняках, глинах с костными остатками рыб (литофациями). При сжигании углей зола и шлаки обогащаются 226 Ra. Также содержание радия повышено в фосфатных породах.
В результате распада урана и тория и выщелачивания из вмещающих пород в нефти постоянно образуются радионуклиды радия. В статическом состоянии нефть находится в природных ловушках, обмена радием между нефтью и подпирающими её водами нет (кроме зоны контакта вода—нефть) и в результате имеется избыток радия в нефти. При разработке месторождения пластовые и закачиваемые воды интенсивно поступают в нефтяные пласты, поверхность раздела вода—нефть резко увеличивается, и в результате радий уходит в поток фильтрующихся вод. При повышенном содержании сульфат-ионов растворенные в воде радий и барий осаждаются в виде радиобарита Ba(Ra)SO4, который выпадает на поверхности труб, арматуры, резервуаров. Типичная объёмная активность поступающей на поверхность водонефтяной смеси по 226 Rа и 228 Rа может быть порядка 10 Бк/л (соответствует жидким радиоактивным отходам).
Получение
Получить чистый радий в начале XX века стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало XX века в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Обычно радий добывается из урановых руд. В рудах, достаточно старых для установления векового радиоактивного равновесия в ряду урана-238, на тонну урана приходится 333 миллиграмма радия-226.
Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — +2. Гидроксид радия Ra(OH)2 — сильное, коррозионное основание.
Ввиду сильной радиоактивности все соединения радия светятся голубоватым светом (радиохемилюминесценция), что хорошо заметно в темноте, а в водных растворах его солей происходит радиолиз.
Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны:
9 Be + 2 4 α → 12 C + 1 n
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60 Co ( T1/2 = 5,3 года ), 137 Cs ( T1/2 = 30,2 года ), 182 Ta ( T1/2 = 115 сут ), 192 Ir ( T1/2 = 74 сут ), 198 Au ( T1/2 = 2,7 сут ) и т. д.
До 1970-х годов радий часто использовался для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных и морских приборов, специальных часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием ( T1/2 = 12,3 года ) или 147 Pm ( T1/2 = 2,6 года ). Иногда часы с радиевым светосоставом выпускались и в гражданском исполнении, в том числе наручные. Также радиевую светомассу в быту можно встретить в некоторых старых ёлочных игрушках, тумблерах с подсветкой кончика рычажка, на шкалах некоторых старых радиоприёмников и прочее. Характерный признак светосостава постоянного действия советского производства — краска горчично-жёлтого цвета, хотя иногда цвет бывает и другим (белым, зеленоватым, тёмно-оранжевым и прочее). Опасность таких приборов состоит в том, что они не содержали предупреждающей маркировки, выявить их можно только дозиметрами. Также люминофор с годами деградирует и краска к нашему времени зачастую перестаёт светиться, что, разумеется, не делает её менее опасной, так как радий никуда не девается. Ещё одна опасная особенность радиевой светомассы в том, что со временем краска деградирует и может начать осыпаться, и пылинка такой краски, попавшая внутрь организма с едой или при вдохе, способна причинить большой вред за счёт альфа-излучения.
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
В начале XX века радий даже считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средства для повышения тонуса и потенции.
Изотопы
Известны 35 изотопов радия в диапазоне массовых чисел от 201 до 235. Изотопы 223 Ra, 224 Ra, 226 Ra, 228 Ra встречаются в природе, являясь членами радиоактивных рядов урана-238, урана-235 и тория-232. Остальные изотопы могут быть получены искусственным путём. Большинство известных изотопов радия претерпевают альфа-распад в изотопы радона с массовым числом, на 4 меньшим, чем у материнского ядра. Нейтронодефицитные изотопы радия имеют также дополнительный канал бета-распада с эмиссией позитрона или захватом орбитального электрона; при этом образуется изотоп франция с тем же массовым числом, что и у материнского ядра. У нейтронно-избыточных изотопов радия (диапазон массовых чисел от 227 до 235) обнаружен только бета-минус-распад; он происходит с образованием ядер актиния с тем же массовым числом, что и у материнского ядра. Некоторые изотопы радия ( 221 Ra, 222 Ra, 223 Ra, 224 Ra, 226 Ra) вблизи линии бета-стабильности обнаруживают, помимо альфа-распада, кластерную активность с испусканием ядра углерода-14 и образованием ядра свинца с массовым числом, на 14 меньшим, чем у материнского ядра (например, 222 Ra → 208 Pb+ 14 C), хотя вероятность этого процесса составляет лишь 10 −8 …10 −10 % относительно альфа-распада. Радиоактивные свойства некоторых изотопов радия:
Репродукции продуктов, содержащих радий, выпускавшихся в начале XX века, на витрине в Музее Марии Кюри, Париж.





