Финастерид или омник что лучше
Так ли безопасны препараты для лечения доброкачественной гиперплазии предстательной железы?
В декабре 2015 года в Journal of Urology были опубликованы результаты нового исследования, в котором изучалась безопасность новых препаратов для лечения доброкачественной гиперплазии предстательной железы (ДГПЖ): доксазозина, финастерида и их комбинации. Шестью самыми частными побочными эффектами при их применении являлись: головокружение, ортостатическая гипотензия, слабость, импотенция, снижение либидо и нарушение эякуляции.
В исследование были рандомизированы 3047 мужчин с ДГПЖ в возрасте 50 лет и старше, которые получали плацебо, доксазозин (4-8 мг), финастерид (5 мг) или комбинацию доксазозин + финастерид. Период наблюдения за пациентами составил в среднем 4,5 лет. Сравнение частоты развития побочных эффектов проводилось с плацебо.
Анализ первого года терапии показал, что риск развития головокружения был значительно выше на фоне применения доксазозина (в 2,2 раза; p
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
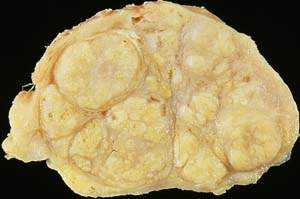 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Комбинированная терапия доброкачественной гиперплазии предстательной железы: преимущества и недостатки
Раньше пациенты, не отвечающие на андрогендепривационную терапию (АДТ), считались безнадежными: до 2004 г. онкологи не могли предложить ничего, кроме паллиативной помощи митоксантроном. Сейчас, манипулируя гормонами, можно отсрочить использование цитостатиков даже в отношении мужчин с метастатическим раком предстательной железы (РПЖ), который уже не отвечает на гормо нальную терапию и даже доцетаксел… Противоречие? Нет! Просто изменилось представление о гормональной независимости опухоли, и появились препараты, подавляющие синтез тестостерона даже в клетках самой опухоли.


