Фиброз мочевого пузыря у женщин что это
Болезнь Ормонда – это вариант мезинхимопатии, неспецифический фибросклеротический процесс, развивающийся в соединительной ткани забрюшинного пространства. Проявления обусловлены сдавлением мочеточников, сосудов и почек. Основные симптомы – поясничные и абдоминальные боли, дискомфорт в паховой области. В запущенных случаях присоединяется ХПН, наблюдаются отеки, тошнота, снижение диуреза. Диагноз подтверждают данные КТ, МРТ, ПЭТ и морфологического исследования, определения уровня IgG4. Лечение консервативное (гормонотерапия), при нарушении уродинамики – оперативное.
МКБ-10
Общие сведения
Забрюшинный фиброз впервые описал французский исследователь И. Альбарран в начале XX века, более объемную работу по изучению патологии провел американский уролог Д.К. Ормонд в 1948 году. Специалисты в сфере современной урологии рассматривают большинство случаев болезни как иммунозависимую системную патологию, ассоциированную с иммунными комплексами IgG4-СЗ, характеризующуюся тотальной или частичной воспалительной инфильтрацией органов и тканей плазматическими клетками. Именно они вырабатывают IgG4, что инициирует облитерирующий флебит и фибросклероз. Болезнь Ормонда – частный случай мезинхимопатии, аналогичные изменения регистрируются в других органах и системах. Патологию чаще диагностируют у мужчин старше 50 лет.
Причины
Причины забрюшинного фиброза до настоящего времени остаются дискутабельными. Считается, что этиологические факторы провоцируют иммунный ответ, что способствует воспалительному поражению брюшины, исходом которого становится фиброз. Агрессивность патологии различается, причины вариативности неизвестны. Основным патогенетическим триггером называют повышенную экспрессию комплекса IgG4 плазматическими клетками. Болезнь Ормонда может быть вторичной, специалисты выделяют ряд состояний, которые потенциально приводят к ретроперитонеальному фиброзу:
К предрасполагающим факторам относят курение, воздействие асбеста. Наличие нескольких больных в пределах одной семьи указывает на возможную роль генетических факторов. У некоторых пациентов, страдающих фибросклерозом Ормонда, выявляют человеческий лейкоцитарный антиген HLA–B27 (иммуногенетический маркер), носительство которого свидетельствует о предрасположенности к аутоиммунным заболеваниям, включая забрюшинный фиброз. Существуют и другие генетические ассоциации, повышающие вероятность патологии.
Патогенез
По последним данным, в 50-75% болезнь Ормонда связана с присутствием плазматических клеток, продуцирующих IgG4. Патология чаще проявляется системно, аналогичные изменения тканей почти всегда выявляют в поджелудочной железе, лимфатических узлах, гипофизе. Наблюдается опухолевидный отек вовлеченных органов, лимфоплазматическая инфильтрация и фиброзно-склеротический процесс различной степени выраженности. Измененная клетчатка сдавливает мочеточник, крупные магистральные сосуды, лимфатические пути, реже – почки.
Забрюшинный фиброз как следствие злокачественных новообразований, составляет 8-10% от общего числа случаев болезни. Активному синтезу коллагена способствует десмоплазия (образование волокнистой соединительной ткани как ответ на присутствие раковых клеток в забрюшинном пространстве) либо первичная опухоль, например, лимфома, саркома или метастатические поражения из других органов: желудка, простаты, почек.
Инфильтрат состоит из многочисленных лимфоцитов, плазматических клеток, макрофагов, иногда нейтрофилов. Воспалительные клетки вкраплены в коллагеновые пучки, организованы узловыми скоплениями вокруг мелких сосудов. Патология классифицируется как связанная с IgG4 при наличии сториформного фиброза, инфильтрации эозинофилов, облитерирующего флебита. Тучные клетки находятся в дегранулированном состоянии, что согласуется с их активным участием в фиброзно-воспалительной реакции.
Классификация
Забрюшинный фиброз может быть изолированным, связанным с аутоиммунными болезнями, или возникшим на фоне многоочагового фиброзно-воспалительного заболевания, ассоциированного с IgG4. Поражение чаще затрагивает оба мочеточника. Стандартизированные критерии для классификации ретроперитонеального фиброза отсутствуют, патология рассматривается в одном ряду с хроническим периаортитом, перианевризматическим фиброзом и воспалительными аневризмами брюшной аорты, которые имеют общие гистологические и клинические признаки. Формы ретроперитонеального фиброза:
Симптомы болезни Ормонда
Вначале в 60-90% случаев наблюдаются системные симптомы: слабость, анорексия, потеря веса. Клинические проявления развернутой формы многообразны, включают дискомфорт в поясничной области, животе и над лоном (70-90%). Боль обычно тупая, не изменяется в зависимости от положения тела, временно реагирует на нестероидные противовоспалительные средства. При поражении мочеточника имитирует почечно-мочеточниковую колику, для которой типичны резкая болезненность, положительный симптом поколачивания, рвота.
Компрессия сосудов проявляется гидроцеле и варикоцеле (30%). Характерны жалобы на дискомфорт в промежности, чувство распирания мошонки. Сдавление нижней полой вены и лимфатических путей вызывает отеки нижних конечностей и хромоту у каждого десятого больного. При вовлечении почечных артерий возникает рено-сосудистая гипертензия. Повышение давления носит устойчивый характер. При существовавшей ранее гипертонии ее течение ухудшается. Высокое давление при постановке диагноза выявляют у трети пациентов.
Осложнения
Осложнения заболевания весьма серьезны, связаны с высокой летальностью (10-20%). Сужение просвета мочеточников и их гипотония приводят к рецидивирующему пиелонефриту, гидронефротической трансформации почек (55-100%), хронической почечной недостаточности (40-90%). У 32% больных диагностируют атрофию почки, связано ли это с обструкцией мочеточника, стенозом почечной артерии или другими причинами – остается неясным. Часто после поражения одного мочеточника другой вовлекается в процесс в период от нескольких недель до нескольких лет.
Тромбоз глубоких вен и легочная эмболия – грозные осложнения венозной компрессии при синдроме Ормонда – встречаются редко, что обусловлено компенсаторными возможностями организма (формированием коллатеральных путей для оттока крови). При забрюшинном фибросклерозе могут поражаться брыжеечные и чревные артерии с развитием стеноза и ишемических осложнений, напоминающих брыжеечный васкулит. У 30% больных ретроперитонеальным фиброзом изменена грудная аорта, что может привести к ее аневризме.
Диагностика
Аутоиммунное склерозирующее заболевание сложно заподозрить из-за многообразия жалоб. Изменения в анализах неспецифичны, встречаются при других патологиях. Нередко недообследованные пациенты получают неполноценное лечение у уролога или гастроэнтеролога, что ухудшает прогноз. Доказано, что на начальной стадии можно добиться ремиссии болезни с помощью исключительно консервативной терапии, поэтому специалисты считают приоритетным раннее выявление патологического процесса. Алгоритм обследования при забрюшинном фиброзе Ормонда включает:
Дифференциальную диагностику проводят с опухолями забрюшинного пространства, обструктивной уропатией другого генеза (при нефролитиазе, лучевых повреждениях, неспецифическом уретерите). Схожая картина наблюдается при воспалительных процессах клетчатки, посттравматических состояниях и новообразованиях мочеточника. Дифференциальный диагноз между идиопатическим, связанным с IgG4, и вторичным фибросклерозом имеет решающее значение, поскольку тактика ведения может кардинально различаться.
Лечение болезни Ормонда
Лечебные мероприятия направлены на сохранение функциональной способности органов мочевыделения, предотвращение распространения патологического процесса на соседние структуры, облегчение или купирование неблагоприятных симптомов. Тактика лечения (консервативное или хирургическое с приемом лекарств) зависит от стадии ретроперитонеального фиброза. При отсутствии уропатии и выраженного сдавления сосудов возможна медикаментозная терапия с обязательным наблюдением (КТ, МРТ и УЗИ органов брюшной полости и почек, оценка СОЭ, уровня С-реактивного белка).
Консервативная терапия
Консервативное лечение позволяет добиться положительной динамики у 80-83% пациентов. Эффект кортикостероидов обусловлен их противовоспалительным действием, способностью замедлять созревание соединительной ткани. Тамоксифен назначают при наличии противопоказаний к кортикостероидам или одновременно с гормональными средствами. Комбинация глюкокортикоидов с азатиоприном наиболее полезна при воспалении. Азатиоприн также применяют в качестве иммуносупрессивного препарата при неэффективности глюкокортикоидной терапии. Иммунодепрессант микофенолат угнетает синтез пурина и пролиферацию лимфоцитов.
Оперативные вмешательства
Обструктивная уропатия с нарушениями уродинамики и тенденцией к гидронефрозу почек подразумевает решение вопроса об отведении мочи. Первичное лечение забрюшинного фиброза включает уретеролиз, латеральную или внутрибрюшинную транспозицию мочеточников, их изоляцию. Далее обязательно проводят курс противорецидивной терапии, позволяющий снизить вероятность рецидивирования с 50 до 10%.
Экспериментальные способы
В последнее время начали применять эффективные экстракорпоральные методы терапии, основанные на выведении из крови болезнетворных и токсичных субстанций. Существует несколько вариантов: плазмаферез, лимфоцитаферез (отдельное извлечение лимфоцитарных клеток), каскадная фильтрация плазмы. Хорошие результаты получают при перфузии жидкой части крови через носитель, отсекающий соответствующие антитела.
Из новых лекарственных препаратов, обеспечивающих улучшение при идиопатических и IgG4-связанных патологиях, выделяют ритуксимаб (моноклональные антитела, полученные методом генной инженерии). Его назначают в качестве монотерапии или в комбинации с кортикостероидами. Ритуксимаб используют в профилактических целях по достижении ремиссии. Крупные рандомизированные исследования не проводилось, подходы к терапии во многом находятся на стадии разработки.
Прогноз и профилактика
Если болезнь диагностирована на ранней стадии с условием адекватной терапии, прогноз благоприятный. Гидронефроз и хроническая болезнь почек ухудшают исход. Улучшение функции почек происходит за 14-18 дней, далее пациенты подлежат тщательному наблюдению: сначала каждые три месяца, если нет отрицательной динамики – 1 раз в полгода. Забрюшинный фиброз, инициированный опухолевыми заболеваниями, имеет неблагоприятный прогноз с летальностью в течение полугода.
Профилактические мероприятия для предотвращения идиопатических форм заболевания не разработаны. Для предупреждения вторичного забрюшинного фиброза следует отказаться от курения, придерживаться здорового образа жизни. Недопустим прием лекарственных препаратов с превышением рекомендованных дозировок и длительности терапии, самолечение. Ранее обращение к специалисту при появлении неприятных симптомов, прохождение полной диагностики значительно увеличивает шансы на благоприятный исход – лечению лучше поддаются острые формы фиброза или существующие не более 6 месяцев.
Склероз шейки мочевого пузыря
Что такое?
Склероз шейки мочевого пузыря (стеноз или фиброз) – это процесс замещения функционально активной ткани уретро-везикального перехода на соединительную ткань. Другими словами, в месте перехода мочевого пузыря в мочеиспускательный канал образуется рубец. Фиброзное перерождение тканей полых органов сопровождается огрубением и уплотнением их стенок, нарушением перистальтики, а также снижением эластичности. Замещение эпителия на коллагеновые волокна имеет тенденцию к генерализации процесса, поэтому в месте склерозирования зачастую возникают деформации, разрастание рубцов с возможным перекрытием просвета полого органа.
Образование рубцовой ткани в шейке запускают воспалительные процессы, микроциркуляторные нарушения и травмы. Гибель клеток и вялотекущее воспаление сопровождается активизацией специальных клеток – фибробластов, которые активизируют синтез коллагеновых волокон. В норме лишние волокна рассасываются после купирования воспалительного процесса. Однако в условиях недостатка кислорода и нарушений метаболических процессов в клетках коллагенолизис значительно замедляется. Соединительная ткань образуется в избытке, изменяет структуру изначально поврежденной стенки. В результате развивается стеноз (сужение или стриктура) верхнего отдела мочеиспускательного канала или его облитерация (полное перекрытие).
Склероз шейки мочевого пузыря чаще обнаруживается у мужчин, что обусловлено анатомическими особенностями расположения уретрального канала. В большинстве случаев разрастание фиброзной ткани начинается после хирургических вмешательств по поводу опухолей простаты (аденомэктомии или простатэктомии).
Заболевание проявляется нарушениями мочеиспускания. В тяжелых случаях провоцирует задержки мочи, расширение мочеточников, почечную недостаточность. При своевременной диагностике и правильном лечении прогноз для пациента благоприятный.
Виды склероза шейки мочевого пузыря
В зависимости от степени нарушений и интенсивности проявлений заболевания выделяют 3 степени стеноза мочевого пузыря:
Симптомы склероза шейки мочевого пузыря
На начальных этапах развития патологии наблюдается сужение шейки пузыря, что проявляется слабыми признаками дизурии. В начале микции пациенту приходится тужиться, струя мочи становится слабой. Компенсированная стадия длится до 3 лет.
На субкомпенсированной стадии стеноз шейки становится более выраженным, что сопровождается застоем урины. Позывы в туалет возникают чаще, мочеиспускание затрудненное, после микции у пациента остается ощущение неполноценного опорожнения. Застойные явления создают благоприятные условия для развития инфекционных осложнений (цистита, уретрита).
На поздних этапах прогрессии заболевания зачастую присоединяется бактериальная инфекция. У пациента поднимается температура, возникают болезненные позывы, мочеиспускание сопровождается резями, иногда наблюдаются боли в надлобковой области. Возможно неконтролируемое выделение мочи.
При сильном фиброзе шейки ее просвет перекрывается, возникает острый застой мочи, когда самостоятельное опорожнение пузыря становится невозможным. При этом урина вытекает небольшими порциями самопроизвольно, однако попытки помочиться контролируемо оказываются безрезультатными.
Причины склероза шейки мочевого пузыря
Для разрастания рубцовой ткани в области перехода пузыря в уретру есть анатомические предпосылки. Здесь более плотная соединительнотканная выстилка под эпителием, из-за чего шейка лишена складок и менее эластична, что плохо сказывается на компенсации склеротических изменений. Формирование рубцов быстро приводит к выраженному сужению просвета. Причин, которые могут спровоцировать фиброзное перерождение тканей, несколько:
Склонность к стенозу пузырной шейки есть у пациентов, которые проходили лучевую терапию по поводу опухолей пузыря или простаты, а также у людей с системными заболеваниями соединительной ткани и патологиями иммунитета.
Получить консультацию
Почему «СМ-Клиника»?
Диагностика склероза шейки мочевого пузыря
Подозрения на стеноз шейки мочевого пузыря возникают у уролога еще на этапе сбора жалоб и анамнеза. В пользу данного диагноза говорит факт о перенесенных вмешательствах на органах мочеполовой системы, инвазивных диагностических процедурах, хронических воспалительных заболеваниях. Для врача важно объективно выявить склероз шейки и исключить другие патологии, которые могут привести к застою мочи. С этой целью назначают инструментальные методы диагностики:
Лабораторную диагностику применяют с целью выявления осложнений, а также на этапе подготовки пациента к операции. Проводят анализы мочи, общий и биохимический анализ крови. При подозрениях на онкопатологии назначают тесты на специфические онкомаркеры.
Мнение эксперта
Иногда мужчины годами лечат простатит, полагая, что нарушения мочеиспускания являются следствием именно этого заболевания. Естественно, противовоспалительные препараты, свечи и растительные средства не дают никакого эффекта.
Практика показывает, что пациенты приходят к врачу уже в запущенных случаях, когда имеет место острая задержка мочи и серьезные проблемы с почками. Промедление с обращением за помощью ведет не только к пиелонефриту. Следствием хронического застоя урины может стать формирование дивертикулов пузыря, расширение мочеточников, гидронефроз и даже почечная недостаточность. Постоянные проблемы с мочеиспусканием провоцируют у больного тревожность, неврозоподобные состояния и даже депрессию. На самом деле всего этого можно избежать – стеноз мочепузырной шейки поддается лечению и большинство осложнений можно предотвратить, если вовремя провести операцию.
Мингболатов Аятулла Шахболатович,
врач уролог-андролог высшей категории, к.м.н.
Методы лечения склероза шейки мочевого пузыря
Фиброзное перерождение тканей шейки мочевого пузыря невозможно устранить консервативными способами. Чтобы восстановить нормальный пассаж мочи, необходимо избавиться от рубцовой деформации. С этой целью проводят хирургическое вмешательство.
Консервативное лечение
Медикаменты назначают на этапе подготовки к операции, а также в послеоперационном периоде для профилактики инфекционных осложнений. В составе комплексного лечения применяют антибиотики, обезболивающие и противовоспалительные препараты.
Хирургическое лечение склероза шейки мочевого пузыря
Предпочтительно проведение малотравматичных вмешательств по удалению склерозированых тканей шейки. В современной урологии чаще используется трансуретральная резекция (ТУР), однако методику применяют на ранних этапах развития заболевания при небольшом объеме фиброзной ткани. Рубцы иссекают с помощью специального оборудования (резектоскопа), который вводят через уретральный канал.
Инцизия пузырной шейки подразумевает рассечение рубцовой ткани для формирования просвета. Применяется при значительных рубцовых изменениях и острой задержке мочи. В отверстие вводят временный катетер, который удаляют через некоторое время после операции.
Профилактика
Чтобы предотвратить формирование рубца на шейке мочевого пузыря, необходимо своевременно лечить инфекционно-воспалительные патологии урогенитального тракта. Важно вовремя обращаться за помощью при нарушениях уродинамики и первых признаках заболеваний простаты.
Предупредить постоперационный стеноз шейки мочевого пузыря помогают современные методы оперирования, которые активно практикуются в специализированных центрах, в т.ч. в «СМ-Клиника». Манипуляции по иссечению тканей проводят с помощью гольмиевого лазера и биполярного плазменно-кинетического оборудования. Практика показывает, что после их применения риск развития склероза шейки сводится к минимуму.
Реабилитация
После трансуретрального рассечения рубцов на шейке пузыря пациент находится в стационаре около 3 дней. На протяжении месяца нельзя заниматься сексом, поднимать тяжести, подвергать себя тяжелым физическим нагрузкам, запрещается купание в открытых водоемах, посещение сауны и бани.
Синдром болезненного мочевого пузыря /интерстициальный цистит: факторы прогноза клинического течения заболевания
А.В. Зайцев, М.Н. Шаров, О.А. Арефьева, Д.Ю. Пушкарь
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» МЗ РФ; Москва, Россия
Введение
Природа синдрома болезненного мочевого пузыря/интерстициального цистита (СБМП/ ИЦ) остается до конца неизвестной. Среди этиологических факторов рассматриваются аутоиммунные, аллергические, инфекционные, неврологические, сосудистые заболевания, а также инфильтрация стенки мочевого пузыря повышенным количеством тучных клеток, повреждение защитного слоя муцина и воздействие на стенку мочевого пузыря токсических субстанций, содержащихся в моче. Многообразие симптомов и различия в восприимчивости пациентов к лечению указывают на полиэтиологичность заболевания [1]. Название «интерстициальный цистит» нередко фокусирует внимание исследователей лишь на мочевом пузыре, в то время он может быть лишь местом сосредоточения действия различных этиологических факторов. Интерстициальный цистит, первоначально считавшийся заболеванием мочевого пузыря, в настоящее время подразумевает хронический болевой синдром. Понимание этого и привело в настоящей попытке пересмотреть название заболевания. В данном контексте термин синдром болезненного мочевого пузыря (СБМП) был признан более удачным новым названием для интерстициального цистита, поскольку это название находится в одном ряду с названиями других тазовых болевых синдромов и не противоречит клиническим проявлениям данного синдрома и знаниям его патофизиологии.
СБМП (BPS ⁄ IC) хроническое заболевание, при котором в биоптатах мочевого пузыря выявляется различная степень выраженности воспаления, фиброза детрузора и мастоцитоза. Клеточные механизмы воспаления при СБМП и процессы, приводящие к повреждению ткани и фиброзу, пока еще не совсем ясны [2, 3]. Вместе с тем результаты проведенных исследований показали, что фиброз и мастоцитоз детрузора связаны с необходимостью проведения различных видов лечения и предполагают неудачу стандартной терапии [4].
Выбор лечебной тактики должен основываться, насколько это возможно, на плацебо-контролируемых исследованиях; лечение начинают с менее инвазивных методов; планировать лечение на основании индивидуальных особенностей пациента; рассматривать применение более инвазивных методик только при отсутствии эффекта от преоральной фармакотерапии и внутрипузырного лечения; непроверенные методы лечения должны применяться в рамках клинических исследований; инвазивные оперативные методы должны применяться в последнюю очередь, за редким исключением.
Согласно рекомендациям Американской урологической ассоциации (AUA, 2011) лечение СБМП/ИЦ следует начинать с наиболее консервативных методик, а в случае их неэффективности переходить к менее консервативным методам. Вид лечения зависит от тяжести симптомов заболевания и предпочтений самого пациента. По истечению клинически значимого периода применение неэффективных методик прекращают. В интересах пациента следует проводить многоплановую, симультанную терапию. Это, прежде всего, относится к лечению тазовой боли, когда нередко необходим мультидисциплинарный подход. При неэффективности различных методов лечения следует провести пересмотр лечебной тактики и, возможно, клинического диагноза [5].
Пациентов, страдающих СБМП/ИЦ необходимо информировать о нормальной функции мочевого пузыря, характере заболевания, существующих методах лечения их риске, поведенческой терапии, средствах борьбы со стрессом, приводящим к усилению симптоматики. Вторым направлением в лечении СБМП/ ИЦ является применение мануальной терапии (воздействие на тазовые, абдоминальные и бедренные мышечные триггерные точки, протяженные мышечные контрактуры и рубцы). Вместе с тем, назначение упражнений, направленных на укрепление мышц тазового дна (например, гимнастика по Кегелю), является противопоказанным. Пероральная фармакотерапия заключается в назначении трициклических антидепрессантов (амитриптилин), антигистаминных препаратов (гидроксизина гидрохлорид) и блокаторов Н-2 рецепторов (циметидин), а также пентозанполисульфата (Elmiron®). Для внутрипузырной фармакотерапии рекомендованы диметилсульфоксид (ДМСО), гепарин и лидокаин в сочетании с кортикостероидами. В отличие от США, в Канаде и странах Европы для инстилляций в мочевой пузырь в настоящее время нередко применяют препараты, восстанавливающие защитный гликозаминогликановый слой: хондроитинсульфат (Gepan®), гиалуронат натрия (Cystistat®, Урогиал) или их комбинацию (Ialuril®).
Третьим направлением (уровнем) в лечении СБМП/ИЦ является цистоскопия под общей анестезией с гидробужированием мочевого пузыря. При выявлении участков Гуннеровского поражения выполняют их коагуляцию (гольмиевый лазер, электрокоагуляция) и/или введение в подслизистый слой триамцинолона.
К четвертому направлению лечения относятся различные методики нейростимуляции, включая имплантацию постоянного нейростимулятора. В урологической клинике МГМСУ, а также в ряде медицинских центров Европы на протяжении длительного времени применяют метод эндовезикального ионофореза (эндовезикального введения лекарственных препаратов под действием электрического постоянного тока).
Назначение циклоспорина А и внутридетрузорное введение ботулинического токсина типа А (botulinum toxin A, BTX-A) рассматриваются как пятое направление лечения СБМП/ИЦ.
Следует отметить, что в связи с отсутствием роста микрофлоры при бактериологическом исследовании у большинства больных СБМП/ИЦ и недоказанностью инфекционной теории его возникновения, длительное применение антибиотиков является неоправданным. Вместе с тем при выполнении эндовезикальных процедур и цистоскопии проводится антимикробная профилактика развития мочевой инфекции, при этом предпочтение отдается препаратам, обладающих доказанной эффективностью при однократном применении (например, фосфомицина трометамол).
По мере накопления клинического опыта необходима критическая оценка эффективности и безопасности существовавших ранее и появляющихся новых методов лечения СБМП/ИЦ. Медикаментозное лечение, безусловно, имеет ряд преимуществ, однако эффективность медикаментозной терапии всецело зависит от совершенствования наших знаний об этиологии и патогенезе данного заболевания.
Материалы и методы
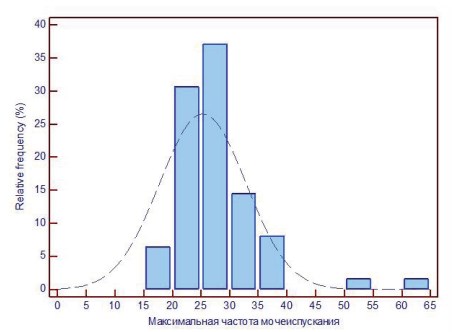
В университетской урологической клинике МГМСУ им. А.И. Семашко МЗ РФ с 2010 по 2014 гг. были обследованы 110 пациенток с СБМП. Хроническая тазовая боль и учащенное, болезненное мочеиспускание являются ведущими симптомами СБМП. Согласно заполнявшемуся дневнику мочеиспусканий максимальное количество мочеиспусканий в сутки у обследуемых пациенток составило 65, а минимальное – 14 (в ср. 25,32±7,5), при этом их беспокоили мочеиспускания, как в дневное, так и в ночное время суток практически в равном количестве (в среднем каждый час) (рис. 1).
Рисунок 1. Гистограмма. Распределение пациенток по количеству мочеиспусканий в сутки
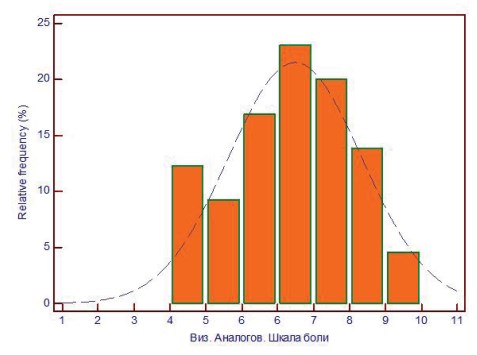
Выраженность болевого синдрома у пациенток оценивали по 10-бальной визуальной аналоговой шкале боли (ВАШ) (рис. 2). Среднее значение уровня боли по ВАШ составляло 6,9 ± 1,7 баллов, при этом 4% и 13% пациенток отметили максимально возможный балл (9 и 10 соответственно).
Рисунок 2. Гистограмма.Распределение пациенток по степени выраженности болевого синдрома
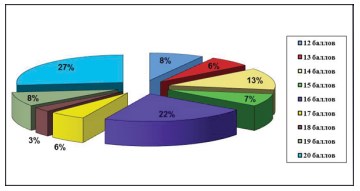
Рисунок 3. Диаграмма. Распределение пациенток согласно данным опросника «Индекс симптомов интерстициального цистита и качества жизни» (Interstitial Cystitis Symptom and Problem Indexes)
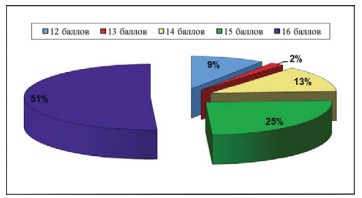
Качество жизни пациенток было проанализировано с помощью индекса качества жизни больных с интерстициальным циститом (ICPI). Все пациентки набрали более 10 баллов, что характерно для пациентов СБМП. Медиана по шкале ICPI составила 14 баллов, минимум – 10, максимум – 16. Как видно из рисунка 4, 51% пациенток набрали максимальное количество баллов, у них клинические проявления заболевания приводят к резкому затруднению социальной адаптации.
Рисунок 4. Диаграмма. Распределение пациенток согласно данным шкалы «Индекс качества жизни больных интерстициальным циститом (ICPI)»
Шкала симптомов тазовой боли, безотлагательности и частоты мочеиспусканий (PUF score) помимо симптомов дизурии дополнительно касается качества жизни больных и их сексуальной активности на фоне заболевания. Согласно указанному опроснику, средний балл составил 22, минимальный – 15, максимальный – 38 (рис. 5).
Рисунок 5. Диаграмма. Распределение пациенток согласно данным шкалы «Симптомы тазовой боли, безотлагательности и частоты мочеиспусканий (PUF)»
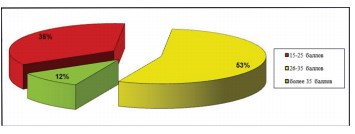
Важный аспект качества жизни пациенток, страдающих заболеваниями мочеполовых органов и/или нарушениями функции тазового дна, – сексуальная функция. Для оценки сексуальный функции пациенток был использован индекс женской сексуальной дисфункции (FSFI). Согласно этому опроснику 38% пациенток СБМП были сексуально неактивны, из них 60% обследованных избегали половых контактов вследствие выраженности симптомов СБМП, главным образом по причине наличия диспареунии. Среди 62% сексуально активных больных 53% имели различной степени выраженности сексуальную дисфункцию
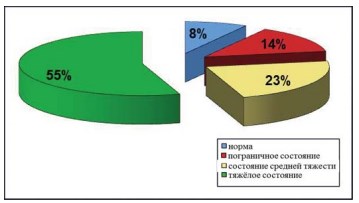
При проведении оценки состояния пациенток, страдающих СБМП, необходимо уделять пристальное внимание изучению их психологического статуса. Для оценки этого статуса использовалась госпитальная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale), распределение пациенток по этому показателю представлено на рисунке 6. У 55% пациенток с СБМП помимо симптомов основного заболевания отмечаются тяжёлые депрессивные и тревожные расстройства.
Рисунок 6. Диаграмма. Распределение пациенток согласно данным «Госпитальной шкалы тревоги и депрессии (HADS)».
Средний балл по шкале HADS составил 17,09 (ДИ 16.15-18.03) балла, медиана – 19,0 баллов, минимум – 4,0, максимум – 21,0 баллов.
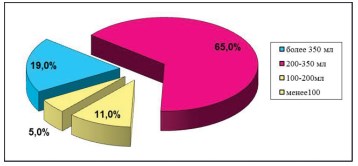
Рисунок 7. Диаграмма. Распределение пациенток в зависимости от величины анатомической ёмкости мочевого пузыря
Результаты
Ранее нами были опубликованы результаты патоморфологических исследований биоптатов мочевого пузыря у больных СБМП [6,7]. Патоморфологические изменения у больных СБМП/ИЦ имеют прямую зависимость от степени выраженности изменений слизистой мочевого пузыря, выявленных при цистоскопии. Выявлена прямая корреляция показателей характера альтеративных изменений уротелия, степени выраженности воспалительной инфильтрации и выраженности боли, симптомов дизурии, в частности, частоты мочеиспусканий и императивных позывов, качества жизни и состояния психического здоровья. Степень выраженности фиброза, наличие пери неврита и мастоцитоза имеют прямую зависимость от продолжительности заболевания.
Пока этиология СБМП остается до конца неизвестной, лечение его является во многом эмпирическим. В лечении СБМП решающим фактором успеха является разработка и проведение многоплановой терапии. С учетом результатов патоморфологических исследований, свидетельствующих о преобладании явлений фиброзно-склеротического процесса в стенке мочевого пузыря у пациенток с СБМП, особенно в случаях наличия Гуннеровских поражений, необходимость включения в комплексную терапию препаратов с против склеротическим, антифиброзным действием не вызывает сомнений. Для лечения склеротического процесса в мочевом пузыре необходимо комплексное воздействие, как на сформировавшуюся соединительную ткань, так и на иммуно-воспалительный процесс, вызывающий ее формирование.
Клиника урологии МГМСУ располагает опытом применения с этой целью отечественного комплексного лекарственного препарата Лонгидаза (ООО «НПО Петровакс Фарм), представляющий собой коньюгат гиалуронидазы с высокомолекулярным носителем Поли-н-оксидом (активированным производным N – окиси полиэтиленпиперазина), аналогом иммуномодулятора Полиоксидония. Лонгидаза – комплексное лекарственное средство, обладающее ферментативной (гиалуронидазной) активностью пролонгированного действия. Лонгидаза обладает всем спектром фармакологических свойств, присущих лекарственным средствам с гиалуронидазной активностью, но терапевтический эффект Лонгидазы, как ферментного препарата, значительно выше благодаря пролонгированному действию, стабилизации фермента, повышению устойчивости к действию ингибиторов, наличию других фармакологических свойств, привнесенных в препарат носителем: хелатирующих, антирадикальных, иммуномодулирующих, противовоспалительных [8,9]. Всемирная организация здравоохранения (ВОЗ) в 2015 году присвоила препарату Лонгидаза международное непатентованное наименование (МНН), Лонгидаза зарегистрирована ВОЗ под МНН бовгиалуронидаза азоксимер (bovhyaluronidase azoximer) [10]. В проведенное ранее исследование нами были включены 60 больных в возрасте от 18 до 50 лет с СБМП/ ИЦ, которые были разделены случайным образом на две группы, сопоставимые по основным прогностическим признакам: опытная (30 человек) и контрольная (30 человек). Оценка эффективности лечения определяется в соответствии с положительной динамикой основных диагностических критериев (клинических и лабораторных), параметров иммунного статуса больных, а также эндоскопической картины и емкости мочевого пузыря. При этом отличия в исходах расценивались как влияние лонгидазы. Лечение препаратом лонгидаза 3000 МЕ в основной группе больных продолжалось в течение 50 дней (одна инъекция внутримышечно в 2 мл 0,5 % раствора новокаина через 5 дней, № 10) на фоне базисной терапии. Пациенты контрольной группы получали только базисную терапию.
На фоне проведения комплексной терапии с использованием препарата лонгидаза у 11 (36,7%) больных исчезли боли, интервал между мочеиспусканиями и его эффективный объем увеличился у 21 (70%) пациентки, при этом в 8 (26,7%) случаях прекратилась ноктурия. Терапевтический эффект оказался стойким и сохранился на протяжении 6 месяцев у 25 (83,3%) больных. Показатель максимального цистометрического объема (V цист. макс) в основной группе больных увеличился на 54,2+005 мл. Показатель детрузорного давления (Р дет.) уменьшился до 14,41+0,03 см Н2О. Величина показателя эластичности детрузора увеличилась сразу после курса лечения (+4.71+0,007 мл/см Н2О), а через 6 месяцев составила 49,83+0,08 мл/см Н2О, что выше исходного на 5,42+0,08 мл/см Н2О. При применении препарата лонгидаза не отмечено местных и общих побочных, а также аллергических реакций.
Результаты проведенного сравнительного исследования показали положительное влияние Лонгидазы за счет регресса иммуно-воспалительного процесса и увеличения эластичности детрузора, а также на такие показатели как уровень боли, интервал между мочеиспусканиями и эффективный объем мочевого пузыря. Наличие двух лекарственных форм этого препарата (для в/м введения и в виде ректальных свечей) дает широкие возможности для его применения в комплексном лечении пациентов этой группы [12].
Обсуждение
В данном исследовании мы стремились уточнить взаимосвязь между анатомической емкостью мочевого пузыря у пациентов с СБМП/ИЦ и клиническими проявлениями заболевания. Известно, что СБМП/ИЦ является гетерогенным синдромом, включающим в себя различные фенотипические подгруппы пациентов с соответствующими патогенетическими путями развития болезни. Некоторые факторы, приводящие к дисрегуляции и хронической тазовой боли не связаны со снижением емкости мочевого пузыря. Результаты показали, что психосоциальные факторы риска и диссоциативная патология позитивно коррелируют с анатомической емкостью мочевого пузыря.
Частота развития СБМП/ИЦ увеличивается с возрастом и пациентки с более тяжелым фенотипом заболевания (например, с Гуннеровскими поражениями мочевого пузыря) старше и имеют сниженную емкость мочевого пузыря. Возраст, продолжительность заболевания могут быть связанными со структурными изменениями в мочевом пузыре и воспалением. Помимо возраста, малая емкость мочевого пузыря существенно коррелировала с высокими показателями шкал оценки боли, ургентности и частоты мочеиспусканий. Следует согласиться с рядом исследователей, считающих СБМП/ИЦ со снижением емкости и Гуннеровскими поражениями отдельным клиническим подтипом заболевания.
Результаты пилотного исследования Colaco M. с соавт. (2014), показали, что у пациентов со сниженной анатомической емкостью мочевого пузыря (≤ 400 мл) профиль экспрессии генов в образцах слизистой оболочки мочевого пузыря отличается от показателей пациентов с емкостью >400 мл и людей в контрольной группе [11]. Профиль экспрессии генов в образцах из мочевого пузыря пациентов со сниженной емкостью был повышенным при воспалении и иммунном ответе, а снижение профиля экспрессии ключевых генов наблюдается в процессе поддержания барьерной функции уротелия. Таким образом, сниженная емкость мочевого пузыря может представлять отличительный признак, важный как в диагностике, так и в лечении данной подгруппы пациентов с СБМП/ИЦ.
Среди изученных неурологических симптомов и синдромов выявлена существенная положительная корреляция между увеличенной емкостью мочевого пузыря и диагнозом депрессия (p = 0.0059). Депрессия является общепризнанным коморбидным фактором при СБМП/ИЦ. В последующем анализе групп пациентов показана ассоциация именно боли с симптомами депрессии, а не с симптомами расстройств мочеиспускания. В клинических и научных исследованиях боль и расстройства мочеиспускания необходимо изучать и оценивать раздельно [12]. При обследовании 16185 пациентов с IC/BPS (ср. возраст 46 лет) и 32370 людей в контрольной группе частота депрессии, тревоги и инсомнии выявлялась значительно чаще в основной группе [13]. В другом исследовании, проведенном в рамках проекта Multidisciplinary Approach to Pelvic Pain (MAPP), также сообщалось, что среди неурологических синдромов, ассоциированных с СБМП/ИЦ, превалируют депрессия и тревога [14].
Продолжаются исследования, направленные на поиск биомаркеров СБМП. Представляют интерес полученные данные о значении гликопротерина YKL-40. Гликопротеин YKL-40 играет роль в процессах воспаления, усиливает трансформацию экстрацеллюлярного матрикса и фиброгенез в тканях человеческого организма. YKL-40 экспрессируется в различных типах клеток (например, тучных клетках, макрофагах, нейтрофилах, хондроцитах и гладкомышечных клетках сосудов) [15, 16]. Чрезмерная продукция YKL-40 может быть причиной накопления матрикса, приводящего к фиброзу ткани. Обнаружено увеличение концентрации YKL-40 в сыворотке крови и моче пациентов с СБМП. В частности, уровень данного гликопротеина был выше у пациентов с фиброзом детрузора по сравнению с теми, у которых он не выявлялся. Степень фиброза детрузора ассоциирована с количеством YKL40-позитивных клеток, тучных клеток и концентрации в моче YKL-40. Емкость мочевого пузыря обратно пропорционально коррелирует с количеством YKL40-позитивных и тучных клеток. YKL-40 обнаружен в гранулах тучных клеток при иммуноэлектронной микроскопии детрузора мочевого пузыря. Согласно этим данным тучные клетки экспрессируют и, вероятно, секретируют YKL-40 при СБМП. Тучные клетки содержат в гранулах различные медиаторы (например, цитокины, лейкотриены, гистамин, гепарин) и могут синтезировать YKL-40. Поскольку тучные клетки экспрессируют YKL-40 и существенно связаны с фиброзом детрузора, предполагалось, что YKL-40 может рассматриваться как воспалительный медиатор при BPS ⁄ IC, секретируемый этими клетками. Вовлечение YKL-40 в воспалительный процесс в мочевом пузыре усиливает перестройку экстрацеллюлярного матрикса, приводящее к фиброгенезу [17]. Существенное увеличение концентрации в сыворотке крови и моче YKL-40 у пациентов с BPS ⁄ IC, особенно с фиброзом детрузора по сравнению со здоровыми людьми подтверждает эту теорию. По мнению авторов исследования, YKL-40 может использоваться в качестве не инвазивного биомаркера фиброза детрузора. До настоящего времени наличие фиброза детрузора можно подтвердить лишь результатами патоморфологического исследования биоптатов мочевого пузыря [18].
Снижение анатомической емкости мочевого пузыря