Фибринолитики что это за препараты
ФИБРИНОЛИТИЧЕСКИЕ СРЕДСТВА
Фибринолитические средства (фибрин + греческий lysis растворение, разрушение) — лекарственные средства, растворяющие или способствующие растворению нитей фибрина и вызывающие в результате этого рассасывание свежих и еще не подвергшихся организации тромбов. Фибринолитические средства применяют для профилактики и лечения тромбоэмболических осложнений.
Фибринолитические средства условно разделяют на препараты прямого и непрямого действия. К фибринолитическим средствам прямого действия относят вещества, влияющие непосредственно на фибринолитическую систему крови in vitro и in vivo. Фибринолитическим средствам непрямого действия вызывают при резорбтивном действии освобождение эндогенных веществ, активирующих фибринолитическую систему. К фибринолитическим средствам прямого действия относят такие активаторы фибринолиза (см.), как стрентокиназа, стафилокиназа, урокиназа, стрептолиаза (стрептаза), фибринолитический фермент фибринолизин (см.), протеолитические ферменты: трипсин (см.), химотрипсин (см.), тромболитин (комплекс трипсина и гепарина), а также препараты протеаз из грибков (аспергиллин, трихолизин и др.).
Фибринолитические средства ферментной природы применяют не только в виде индивидуальных веществ, но и в виде так называемых иммобилизованных ферментов. Последние обладают пролонгированным эффектом и способны обеспечивать регулируемое депонирование лекарственного вещества в соответствующем органе и ткани без повышения его концентрации в общем кровотоке. К числу иммобилизованных водорастворимых фибринолитических средств относится отечественный препарат стрептодеказа, содержащий стрептокиназу.
К группе фибринолитических средств непрямого действия относят вещества синтетического и природного происхождения, активирующие фибринолиз путем высвобождения активаторов профибринолизина (плазминогена) из стенки сосудов или лейкоцитов. Непрямое фибринолитическое действие могут оказывать некоторые сосудорасширяющие вещества, напр, никотиновая кислота (см.), ее производные. Непрямым путем активируют фибринолиз также адреналин (см.), ацетилхолин (см.), вещества, способствующие выделению гистамина (см.), пирогенные бактериальные липополиеахариды, например, пирогенал (см.).
Из большого числа веществ, обладающих свойствами фибринолитических средств, в медицинской практике для лечения тромбозов используется ограниченное число препаратов. Одним из наиболее активных среди них является препарат естественного фермента плазмы крови человека фибринолизин, расщепляющий фибрин и фибриноген. Он расщепляет такие пептидные связи, гидролиз которых ведет к быстрому разделению молекулы фибрина на растворимые в воде фрагменты (фибринопептиды). Кроме того, он может разрушать в организме пептидные связи глюкагона, бета-лактоглобулина, гормона роста, факторов свертывания крови V, VII, X и XII, некоторых компонентов сывороточного комплемента и др. Однако эти свойства проявляются при больших концентрациях фибринолизина. Фибринолизин также оказывает угнетающее действие на агрегацию тромбоцитов, индуцированную тромбином. Фибринолизин влияет на кининовую систему, что сопровождается образованием активных кининов (см.).
Механизмы действия различных активаторов фибринолиза неодинаковы. Так, активирующее действие стрептокиназы осуществляется тремя различными путями: путем образования комплекса с плазминогеном, образования комплекса с особым проактиватором, а также в результате прямого действия стрептокиназы на молекулу плазминогена. Урокиназа вызывает расщепление в молекуле плазминогена внутренней аргинил-валиновой пептидной связи и образование при этом молекулы плазмина. Стафилокиназа активирует плазминоген посредством конформационных изменений молекулы профермента, освобождающих активный центр фермента. Трипсин активирует плазминоген посредством протеолитического расщепления пептидных связей и сам активно расщепляет нити фибрина.
Стрептокиназа и урокиназа способны проникать внутрь тромба и активировать там профибринолизин, адсорбированный на фибрине. Лизис тромба под влиянием стрептокиназы и урокиназы является процессом, в к-ром важную роль играет как экзогенный, так и эндогенный лизис нитей фибрина. В отличие от этого тромболитическое действие фибринолизина развивается в основном по краям тромба. Центральные участки тромба стойки к фибринолизину. Возможно, что это в определенной степени обусловлено различиями молекулярного веса (массы) веществ и их способности проникать внутрь тромба.
В действии стрептокиназы и урокиназы на организм имеются и существенные различия. Стрептокиназа является чужеродным для организма белком, поэтому при повторном введении она может вызывать аллергические реакции. Как правило, через 1—2 недели после первой инфузии стрептокиназы происходит значительное повышение титра антистрептокиназы, достигающее максимума через 3—4 недели. Через 4—6 месяцев их содержание снижается до исходного уровня. В связи с этим повторное применение данного препарата можно проводить не ранее чем через 3 месяца после первого введения в соответствующих дозах и с добавлением кортикостероидов. Для выявления повышенной чувствительности организма к стрептокиназе можно использовать определение титра анти-стрептокиназных антител.
Урокиназа является веществом, родственным по происхождению эндогенным веществам организма человека, в связи с чем она не вызывает аллергических реакций, характерных для стрептокиназы.
Препараты протеолитических ферментов (трипсин и др.) обладают сильным тромболитическим действием. Однако при парентеральном введении они вызывают серьезные осложнения, в том числе разрушение различных факторов свертывания крови, геморрагические явления, что ограничивает возможность использования таких препаратов для резорбтивного действия.
Одним из методов повышения терапевтической эффективности и снижения токсичности фибринолитических средств является региональное внутрисосудистое введение их в зону расположения тромба. Этим достигается высокая концентрация фибринолитических средств в области тромба, а низкая концентрация в общем кровотоке позволяет избежать нежелательных осложнений. Работами Е. И. Чазова и сотрудниками (1981) показана возможность введения тромболитических веществ с помощью специального катетера даже в устья коронарных артерий.
Другим методом повышения тромболитической активности и безопасности протеолитических препаратов, получаемых из грибков, является дополнительное фракционирование белков из образуемых грибками протеаз. При этом имеется возможность получения более специфичных для фибринолиза и менее токсичных протеаз. Этой же цели могут служить исследования генетической изменчивости и отбора мутантов микроорганизмов, являющихся продуцентами более специфичных фибринолитических веществ.
Основными показаниями к применению фибринолитических средств являются тромбоэмболии периферических сосудов, особенно глубоких вен конечностей, легочных артерий, сосудов глаз, острый инфаркт миокарда, острый тромбофлебит, обострение хронического тромбофлебита. Применение фибринолитических средств при тромбозах сосудов головного мозга осложняется трудностями диагностики. Лечение проводят только в тех случаях, когда не возникает никаких сомнений в наличии у больного тромботического инсульта. При лечении тромбоэмболий целесообразно сочетать введение фибринолитических средств с антикоагулянтами и ингибиторами агрегации тромбоцитов. Эффективность лечения тромбозов с применением фибринолитических средств в значительной степени зависит от времени, прошедшего с момента возникновения тромба, размеров и локализации тромба, степени его ретракции, концентрации фибриногена в крови, состояния сердечно-сосудистой системы и др. Установлено, что венозные тромбы подвергаются лизису под влиянием фибринолитических средств в течение более длительного срока, чем артериальные тромбы. При инфаркте миокарда применение фибринолитических средств нередко сопровождается анальгетическим эффектом. Механизм ослабления боли связывают со спазмолитическим действием фибринолитических средств, увеличением объемной скорости коронарного кровотока, разрушением вторичных тромбов, улучшением микроциркуляции и уменьшением в связи с этим зоны ишемии вокруг очага некроза.
При передозировке фибринолитическими средства или повышенной реакции организма на их введение в качестве антагонистов используют ингибиторы фибринолиза из числа ингибиторов протеаз природного происхождения, например, пантрипин (см.), контрикал, ингитрил, трасилол (см.) и др., а также некоторые синтетические препараты, напр, аминокапроновую кислоту (см.), нарааминометилбензойную кислоту (амбен), парааминометилциклогексанкарбоновую кислоту и др. При необходимости применяют также фибриноген (см.).
Противопоказаниями к применению фибринолитических средств являются геморрагические диатезы, кровотечения, открытые раны, язвенная болезнь желудка и двенадцатиперстной кишки, нефрит, гепатит, фибриногенопения, туберкулез легких в острой форме, лучевая болезнь. Относительными противопоказаниями являются поражения сосудов мозга на фоне высокого АД, тяжелые атеросклероз и декомпенсация сердечно-сосудистой системы, сахарный диабет. Не рекомендуется назначение фибринолитических средств в частности стрептокиназы, беременным женщинам (в первые 18 недель беременности), поскольку может нарушиться фибринный слой трофобласта, что вызывает преждевременную отслойку плаценты.
Библиогр.: Актуальные проблемы гемостазпологии, под ред. Б. В. Петровского и др., М., 1981;
Маликовский П. и Козлов В. А. Антикоагулянтная и тромболитическяа терапия в хирургии, М., 1976; Чазов E. и Лакин К. М. Анти-коагулянты и фибринолитические средства, М., 1977.
Фибринолитики что это за препараты
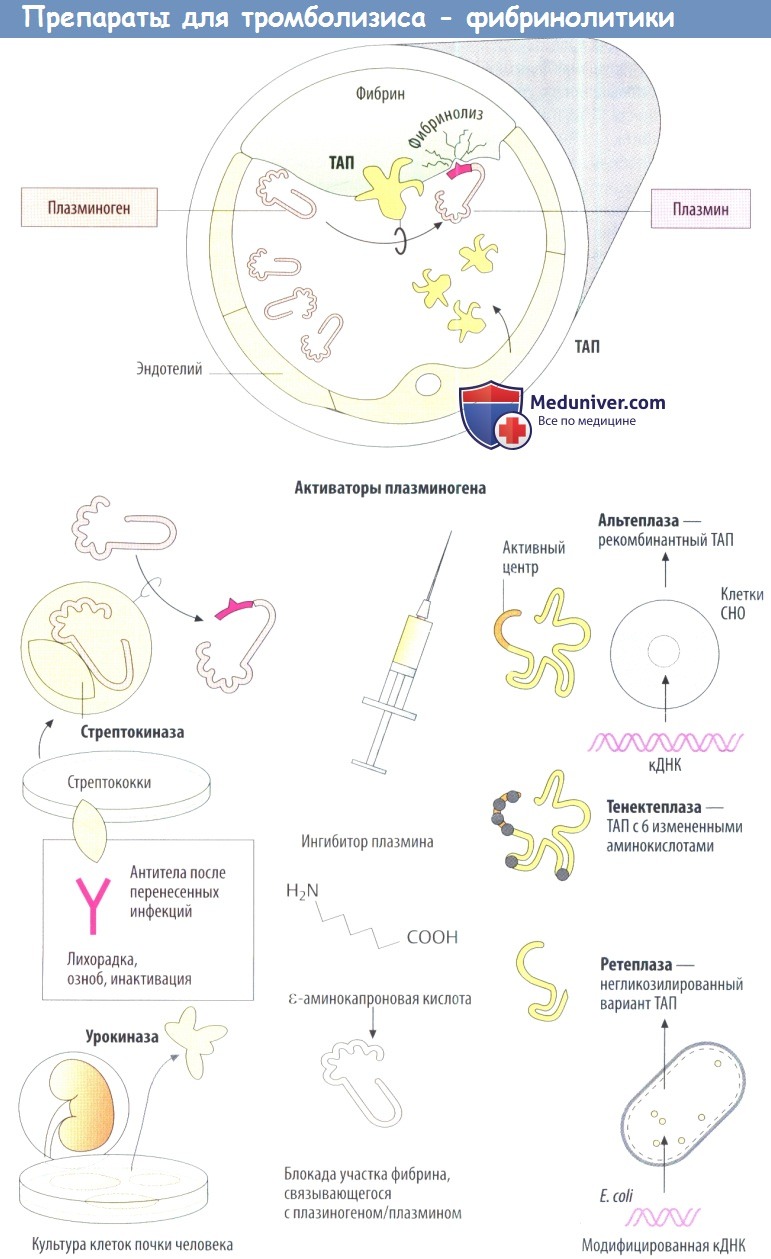
Сетчатую структуру фибрина в тромбах способен гидролизовать плазмин. Как протеаза плазмин способен расщеплять не только фибрин, но и фибриноген и другие белки. Плазмин образуется из неактивного предшественника плазминогена, присутствующего в крови.В физиологическихусловияхспецифичность действия по отношению к фибрину обусловлена тем, что активация плазмина происходит на фибриновом сгустке.
Тканевый активатор плазминогена (ТАП) выделяется из эндотелиальных клеток при застое крови. Наряду со своим каталитическим центром эта протеаза обладает и другими функциональными доменами, включая участки для связывания с фибрином. При контакте с фибрином интенсивность превращения плазминогена в плазмин в несколько раз выше, чем в токе крови. У плазминогена также есть область для связывания с фибрином.
Доступные для использования в терапевтических целях активаторы плазминогена называются фибринолитиками; их вводят в/в при инфаркте миокарда, инсульте, тромбозе глубоких вен нижних конечностей, тромбоэмболии легочной артерии и других тромботических окклюзиях сосудов. Чем раньше после образования тромба будет начата терапия, тем больше шансов на успешное восстановление проходимости закупоренного сосуда.
Достижение желаемого результата таит в себе риск кровотечения (наиболее серьезный побочный эффект), т. к. помимо внутрисосудистого сгустка фибрина, формирующего тромб, также растворяется фибрин, закрывающий дефект в стенке сосуда при его повреждении. Кроме того, использование фибринолитиков несете собой опасность расщепления фибриногена и других факторов свертывания, циркулирующих в крови (системный фибринолиз).
Первым фибринолитиком была стрептокиназа. Сама по себе она не обладает ферментативной активностью, и только после связывания с молекулой плазминогена образуется комплекс, активирующий плазминоген. Стрептокиназу продуцируют стрептококки. В результате перенесенных ранее стрептококковых инфекций в крови могут присутствовать антитела к стрептокиназе, что вызывает реакции несовместимости.
Анизострептаза представляет собой искусственный плазминоген-стрептокиназный комплекс, который характеризуется более длительным действием
Урокиназа — эндогенный активатор плазминогена, который встречается в различных органах. Урокиназу, используемую в терапевтических целях, получают из культур клеток почки человека. В ответ на ее применение появление циркулирующих антител не предполагается. Это вещество стоит дороже стрептокиназы. Его действие не зависит от фибрина.
Альтеплаза — рекомбинантный ТАП. Поскольку этот активатор плазминогена продуцируется эукариотическими клетками яичника китайского хомячка (СНО), в нем присутствуют углеводные остатки, как в нативном веществе. При использовании в терапевтических дозах альтеплаза теряет свою «фибриновую зависимость» и тем самым также активирует циркулирующий плазминоген. При свежем инфаркте миокарде альтеплаза эффективнее стрептокиназы.
Тенектеплаза представляет собой разновидность альтеплазы, ген которой изменен шестью точечными мутациями, в результате чего произошло значительное увеличение периода ее полувыведения (t1/2 тенектеплазы 20 мин, t1/2 альтеплазы 3-4 мин) Дозировку тенектеплазы подбирают в соответствии с массой тела и вводят в/в струйно.
Ретеплаза — вариант ТАП, в котором вследствие делеции отсутствуют и фибринсвязывающие участки, и олигосахаридные боковые цепи (продуцируется прокариотами Е. coli). Она выводится медленнее, чем альтеплаза. В то время как альтеплазу вводят инфузионно, ретеплазу можно вводить в виде двух в/в струйных инъекций с интервалом 30 мин.
Ингибиторы плазмина. ε-аминокапроновая, а также транексамовая и парааминометилбензойная кислоты ингибируют плазмин и могут быть полезны при геморрагических осложнениях. Они занимают участки плазминогена или плазмина, предназначенные для связывания с фибрином, что обусловливает их ингибирующее действие.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ферменты, применяемые при тромбозах и тромбоэмболиях
В организме человека важную роль в поддержании гемостаза играет активация физиологических ингибиторов свертывания крови.
Преферанская Нина Германовна
Доцент кафедры фармакологии образовательного департамента Института фармации и трансляционной медицины Первого МГМУ им. И.М. Сеченова, к.фарм.н.
При повреждении кровеносного сосуда инициируется каскад реакций с образованием сгустка крови, так называемого тромба, предотвращающего кровотечение. В первую очередь к месту повреждения прикрепляются тромбоциты, образуя рыхлую непрочную тромбоцитарную пробку (белый тромб), который может закупорить только небольшой сосуд. Белый тромб формируется только в местах повреждения сосуда в условиях высокой скорости кровотока. Свертывание крови включает эффективно регулируемую серию превращений неактивных зимогенов в активные ферменты. Активный протеолитический фермент свертывающей системы тромбин катализирует превращение фибриногена в мономер — фибрин. Растворимый белок плазмы крови фибриноген превращается в нерастворимый белок фибрин, который откладывается между тромбоцитами. В нормальных физиологических условиях фермента крови тромбина нет. Он образуется из своего активного зимогена — белка плазмы протромбина в присутствии ионов Са 2+ под влиянием фермента — тромбокиназы, который освобождается при разрушении кровяных пластинок. В области замедленного кровотока разрушенные эритроциты с фибрином формируют красные тромбы, образуется нерастворимый полимерный фибриновый сгусток — гель фибрина, с формированием прочного фибринового тромба.
Под влиянием противосвертывающей (фибринолитической) системы кровь поддерживается в жидком состоянии. Система фибринолиза является протеолитической системой плазмы крови, ответственной за лизис фибринового сгустка. Основным физиологическим пусковым механизмом является процесс активации факторов контактной фазы фибринолиза. Для каждого фактора свертывания крови существуют различные специфические ингибиторы, такие как α2–антиплазмин, α2–макроглобулин, α1–антитрипсин, антитромбин–III, интер–α–ингибитор трипсина, антиконвертин, антиакселерин. Большинство ингибиторов находятся в избытке и способны образовывать обратимые комплексы с плазмином. Сохранение крови в жидком состоянии позволяет восстановить нормальный кровоток в сосуде. Такие ингибиторы ферментов свертывания крови, как α2-макроглобулин, α1-антитрипсин и комплекс антитромбин Ш–гепарин, обладают небольшой фибринолитической активностью.
Центральным ферментом системы фибринолиза является плазмин, на регуляцию активации которого направлены все реакции системы фибринолиза. В процессе фибринолиза под действием специфических активаторов неактивный плазминоген (профибринолизин) превращается в активный плазмин (фибринолизин). Тканевой активатор плазминогенасодержится в эндотелии сосудов всех тканей. Плазмин гидролизует фибрин с образованием растворимых пептидов. Растворимые пептиды поступают в кровоток и там фагоцитируются. Плазмин быстро инактивируется α2-антиплазмином и др. ингибиторами сериновых протеаз, улавливается печенью и не оказывает системного действия. Снижение активности этой системы способствует образованию тромбов, тогда как повышение ее активности может приводить к развитию геморрагий. Снижение фибринолитической ативности крови и повышенная склонность к тромбообразованию сопровождаются различными тромбозами и тромбоэмболиями. Противосвертывающая система обеспечивает лизис фибрина, разрушает тромб и препятствует распространению тромба за пределы поврежденного участка.
Фибринолитические (тромболитические) средства применяют для растворения образовавшихся тромбов при тромбозе коронарной артерии (остром инфаркте миокарда), тромбозах глубоких вен, тромбоэмболии периферических сосудов, острой тромбоэмболии ветвей легочной артерии, тромбозе артериовенозного, аортокоронарного (вспомогательного) шунтов и для восстановления проходимости тромбированных катетеров. В качестве фибринолитических применяют лекарственные средства: стрептокиназы, тканевого активатора плазминогена и урокиназы.
Все тромболитические препараты — это белковые соединения с коротким периодом полувыведения: стрептокиназы – Т½ = 10–23 мин., урокиназы — Т½ = 10–20 мин., проурокиназы — Т½ = 7 мин., алтеплазы — Т½ = 5–8 мин., тенектоплазы — Т½ = 90 мин. Препараты подвергаются метаболизму в основном в печени. Вводят внутривенно (в/в), реже внутрикоронарно (в/к) и как можно раньше — после появления первых симптомов тромбоза (желательно в первые 2–6 час.).
При применении фибринолитических средств наиболее часто возникают побочные эффекты: у 10–15% больных отмечается резистентность к препаратам; кровотечения во внутренние органы и в подкожные ткани, кровотечения из ран, десен, желудочно–кишечные кровотечения, внутричерепное кровоизлияние; аллергические реакции гиперчувствительности (кожные проявления, бронхоспазм, крапивница, редко анафилаксия); аритмии, внезапная артериальная гипотония, отек легких, одышка. Однако современные схемы лечения фибринолитическими средствами и усовершенствование методов их получения позволили значительно снизить частоту нежелательных реакций и осложнений при их применении.
ВАЖНО! Противопоказаниями к применению фибринолитических средств служат: геморрагический синдром, в т.ч. геморрагии в глазу, острые внутренние кровотечения, нарушения мозгового кровообращения, внутричерепная аневризма, острый перикардит, расслаивающая аневризма аорты, тяжелая почечная недостаточность, беременность, период лактации, детский возраст до 18 лет.
Одним из наиболее дешевых фибринолитических (тромболитических) препаратов с доказанной эффективностью является стрептокиназа (целиаза) — золотой стандарт. Выпускается рекомбинантная стрептокиназа под ТН «Эберкиназа» и «Тромбофлюкс». Стрептокиназу выделяют из культуры b–гемолитического стрептококка группы С, который образует комплекс с плазминогеном. Препарат обладает фибринолитической активностью, что обусловлено способностью взаимодействовать с плазминогеном крови. Комплекс стрептокиназы с плазминогеном обладает протеолитической активностью и катализирует превращение плазминогена в плазмин. Последний способен вызывать лизис фибрина в сгустках крови, инактивировать фибриноген, влиять на факторы V и VII свертывания крови.
Активность стрептокиназы определяют по способности препарата лизировать в определенных условиях сгусток фибрина, образованный смесью растворов фибриногена и тромбина, и выражают в интернациональных (международных) единицах (ИЕ/МЕ). Выпускается в виде лиофилизированного порошка для приготовления раствора для в/в и в/а введений 100 000 МЕ, 250 000 МЕ, 750 000 МЕ и 1 500 000 МЕ во флаконах. Читать внимательно инструкцию по применению.
Другим фибринолитическим препаратом является тканевой активатор плазминогена, который продуцируется эндотелиальными клетками и вызывает частичный протеолиз плазминогена, превращаясь в плазмин. Обладает высоким сродством к фибрину и ускоряет в сотни раз его действие на плазминоген, причем активирует только те молекулы плазминогена, которые адсорбированы на нитях фибрина. Его действие ограничивается фибрином тромба. Попадая в кровоток, он связывается со специфическим ингибитором и поэтому мало действует на циркулирующий в крови плазминоген и в меньшей степени снижает уровень фибриногена. Для клинического использования был получен по рекомбинантной ДНК технологии синтетический препарат тканевого активатора плазминогена — Алтеплаза (Актилизе), выпускаемый в виде лиофилизированного порошка для приготовления раствора для инфузий. Препарат активируется при соединении с фибрином и стимулирует превращение плазминогена в плазмин, способствуя растворению сгустка фибрина.
Вводят в/в при остром инфаркте миокарда, вызванного тромбозом коронарных сосудов и при острой массивной тромбоэмболии легочной артерии. Препарат эффективен в первые 6–12 час. после введения. Метаболизируется в печени. Снижает риск смертности в первые 30 дней после начала инфаркта миокарда — чем раньше начато лечение, тем больше вероятность благоприятного исхода. При его применении часто возникают геморрагические осложнения. Риск кровотечений повышается при одновременном использовании производных кумарина, антиагрегантов, гепарина и других ЛС, угнетающих свертывание крови. Одновременно с введением препарата рекомендуют назначение антиагреганта — ацетилсалициловой кислоты и антикоагулянта (низкомолекулярные гепарины).
ВАЖНО! При возникновении кровотечения следует прекратить введение препарата.
Тенектеплаза (Метализе) — рекомбинантный фибрино–специфический активатор плазминогена, является производным естественного тканевого активатора плазминогена, модифицированного в трех участках. Тенектеплаза связывается с фибриновым компонентом тромба и избирательно катализирует превращение связанного с тромбом плазминогена в плазмин, который разрушает фибриновую основу тромба.
Выпускается в виде лиофилизата для приготовления раствора для в/в: по 6000 ЕД во флаконе (30 мг); 8000 ЕД — фл. (40 мг); 10 000 ЕД — фл. (50 мг). В комплект входят: шприц пластмассовый с растворителем (6 мл, 8 мл, 10 мл), игла (одноразовая) и адаптер. В 1 мл разведенного раствора содержится 1000 ЕД (5 мг) тенектеплазы. Необходимая доза препарата вводится путем быстрой однократной в/в инъекции в течение 5–10 сек.
В сравнении с естественным тканевым активатором плазминогена, тенектеплаза обладает более высоким сродством к фибрину и устойчивостью к инактивирующему действию эндогенного ингибитора активатора плазминогена I. Применяется в качестве тромболитической терапии острого инфаркта миокарда. Применение тенектеплазы в течение 30 дней снижает уровень смертности от инфаркта миокарда на 6,2%. Выводится с желчью, поэтому при нарушениях функции почек не отмечается изменений фармакокинетики; снижает смертность в первые 30 дней после начала инфаркта.
Рекомбинантный человеческий тканевой активатор плазминогена
В клетках почечных канальцев синтезируется протеолитический активатор плазминогена урокиназа, с аминокислотой серином в качестве активного центра, который превращает плазминоген в плазмин и способствует освобождению почечных клубочков от фибриновых волокон. Активность урокиназы приводит к дозозависимому снижению уровней плазминогена и фибрина, увеличивает продукты разложения фибрина и фибриногена, оказывая антикоагулирующий эффект. При одновременном применении с антикоагулянтами прямого действия фармакологический эффект усиливается.
Урокиназа (Урокиназа медак) — прямой активатор фибринолитической системы, подобен стрептокиназе, но более специфичен в отношении действия на тромб, — активирует глу– и лиз–плазминогены, превращая их в плазмин, вызывающий ферментативное разрушение фибрина. Распад фибриновых нитей приводит к дезинтеграции составных элементов тромба и он расщепляется на мелкие фрагменты, которые уносятся током крови или растворяются на месте плазмином. Применение препарата вызывает лизис тромба снаружи и изнутри, а образовавшиеся продукты деградации фибриногена способствуют гипокоагуляции, блокируют агрегацию эритроцитов и тромбоцитов и снижают вязкость крови. Урокиназа в отличие от стрептокиназы не имеет антигенных свойств, т.к. не образует антител, циркулирующих в крови, и это дает препарату важное преимущество. Получают препарат путем экстракции урокиназы из культуры почечных клеток человеческого плода; метод позволяет получить препарат с одинаковой молекулярной массой (м.м.) 35 000 Да.
Выпускают лиофилизированный порошок для приготовления раствора для инфузий 10 000 МЕ; 50 000 МЕ; 100 000 МЕ и 500 000 МЕ во флаконах. Урокиназа водорастворима и сохраняет свою активность длительное время, ее гипокоагуляционные свойства сохраняются после парентерального введения в течение 3–6 час.
Проурокиназа — одноцепочечный активатор плазминогена урокиназного типа. В присутствии фибрина превращается в урокиназу. Проурокиназа рекомбинантная (Гемаза, Пуролаза) выпускаются в виде лиофилизированного порошка для приготовления раствора для в/в введения. Проурокиназа состоит из 2 полипептидных цепей с м.м. 20 тыс. Дa и 34 тыс. Дa, соединенных дисульфидным мостиком.
Препарат специфически стимулирует превращение (посредством гидролиза аргинин–валиновой связи) профибринолизина (плазминогена) в фибринолизин (плазмин), который способен лизировать фибриновые сгустки. Препарат способствует растворению тромба, в отличие от действия антикоагулянтов, которые лишь ингибируют его образование.
Выпускают лиофилизированный порошок для приготовления раствора для инфузий: 2 000 000 МЕ — во флаконах (50 мл) и 5000 МЕ — в ампулах (1, 2 мл).
Препарат вводится только в/в, 100 мг (20 мг болюсно и 80 мг инфузионно в течение 60 мин.) в 0,9% растворе NaCl. Раствор готовится непосредственно перед применением и не подлежит хранению.
РЕЗЮМЕ. Антикоагулянты и антиагреганты применяются исключительно с профилактической целью для предупреждения образования тромба, тогда как тромболитические (фибринолитические) средства в течение первых суток способны растворить уже образовавшийся фибриновый тромб. Применение этих препаратов восстанавливает нормальный кровоток в зоне ишемии пораженного органа и нормализует его функционирование.