Фетальный что это значит
Фетальный
Смотреть что такое «Фетальный» в других словарях:
фетальный — эмбриональный Словарь русских синонимов. фетальный прил., кол во синонимов: 2 • плодный (6) • … Словарь синонимов
фетальный — Плодный, относящийся к соответствующему периоду утробного развития. [http://www.lexikon.ru/sexology.html] Тематики сексология … Справочник технического переводчика
фетальный — (fetalis; лат. fetus порождение, потомство) относящийся к плоду, характерный для плода … Большой медицинский словарь
Фетальный — прил. Находящийся в начальной стадии своего развития; эмбриональный 4.. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
Фетальный — Плод в утробе матери Плод (лат. foetus) развивающийся в материнской утробе человеческий организм с 8 й недели развития и до момента рождения. Некоторые источники считают плодом зародыши, которые достигли возраста в 9 или 10 недель. Используется… … Википедия
фетальный — фет альный … Русский орфографический словарь
фетальный — … Орфографический словарь русского языка
Фетальный — (лат. fetus – зародыш, отпрыск) – 1. свойственный фетальному периоду эмбрионального развития, ребёнку на этой стадии внутриутробного развития; 2. связанный с периодом развития плода (с 91 дня беременности до родов), например, вызванный… … Энциклопедический словарь по психологии и педагогике
ФЕТАЛЬНЫЙ — [от лат. fetus отпрыск, зародыш] то же, что эмбриональный … Психомоторика: cловарь-справочник
Фетальный алкогольный синдром
Фетальный алкогольный синдром
Содержание:
О том, что употребление алкоголя во время беременности вредит плоду, знают все, однако далеко не все женщины воздерживаются от спиртного в период вынашивания ребенка. Такое отношение чревато последствиями. Одно из них — ФАС (фетальный алкогольный синдром) — рождение ребенка с врожденными физическими и умственными недостатками.
ФАС: что это такое

В то время как эксперты постоянно твердят, что даже самое небольшое количество этилового спирта опасно для плода, в обществе сохраняются вредные мифы. Слишком много людей до сих пор думают, что бокал вина время от времени или небольшая кружка пива не представляют угрозы. Что еще хуже, некоторые считают, что небольшое количество спиртного может даже оказать положительное влияние и на мать и на её ребенка.
По статистике, ФАС встречается примерно у 4 детей из 1000. Даже рюмка водки может стать фатальной для здоровья и привести к фетальному алкогольному синдрому и многочисленным врожденным дефектам новорожденного.
Влияние этанола на беременность
Наибольший риск развития расстройств у ребенка связан с умеренным употреблением спиртосодержащих напитков на протяжении всей беременности и с эпизодическим пьянством.
Как проявляется фетальный алкогольный синдром
При диагностике полноценного ФАС берутся во внимание 4 диагностических критерия:
Выраженность патологий, связанных с ФАС, зависит от количества потребляемого спиртного. Чем чаще женщина пьет, тем больше вероятность серьезных расстройств.
В более зрелом возрасте из-за повреждения нервной системы у детей могут появиться другие симптомы: проблемы с равновесием и с управлением собственным телом, трудности с распознаванием сенсорных впечатлений. Они не могут концентрироваться на чем-то одном, плохо усваивают знания, имеют нарушения внимания.
У людей, рожденных с фетальным алкогольным синдромом, диагностируют:
Кроме того, малыши и подростки склонны к зависимости и депрессии, тревожности и неврозам. Они очень часто испытывают трудности:
Люди в более зрелом возрасте не могут устанавливать отношения и поддерживать более длительные социальные контакты. Они не излечиваются полностью, не могут сохранить постоянную работу и с большей вероятностью остаются зависимыми.
Согласно исследованиям, ФАС, проявляющийся всеми вышеперечисленными симптомами, встречается примерно у 10% больных детей. В остальных случаях возможны разновидности этого заболевания. 
Другой вариант — «эффект алкоголя на плод», называемый FAE. Во время его протекания отсутствуют физические симптомы, типичные ФАС. Ещё одна из разновидностей — ARND, характеризующаяся повреждением нервной системы.
Диагностика
В диагностике заболеваний должны участвовать педиатр, детский невролог, психолог или психиатр и невролог. Диагноз ставится по совокупности признаков (нарушений в работе нервной системы, отклонений в лице и физическом развитии) и на основании подтверждения того, что мать пила во время беременности.

Лечение ФАС
ФАС неизлечим, но правильный диагноз чрезвычайно важен. Благодаря ему с первых дней жизни можно обеспечить ребенку надлежащий уход и принять меры для минимизации характерных нарушений, облегчить его дальнейшее обучение, например, посредством индивидуальных занятий. Такое поведение позволяет создать соответствующие условия для развития и предотвратить последующие стрессы, связанные с трудностями в обучении и установлением контактов.
Подход к каждому маленькому пациенту нужно подбирать индивидуально, в зависимости от выраженности симптомов. Детям с ФАС обычно требуется постоянная физическая реабилитация, психологическая помощь и регулярные занятия с неврологом. 
Быстрая диагностика и начало лечения дают детям лучшие возможности для развития и надежду на самостоятельную жизнь во взрослом возрасте.
Фетальный что это значит
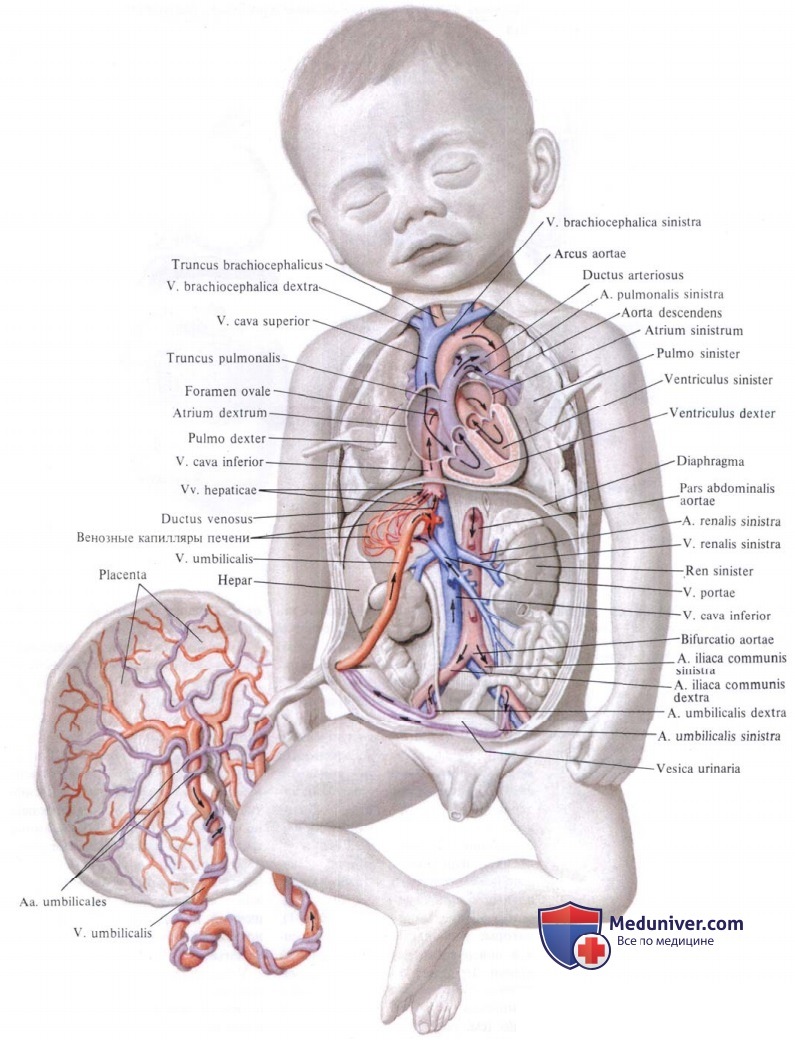
Фетальное кровообращение у новорожденных детей частично функционирует в течение 10—15 ч внеутробной жизни. В это время сохраняется небольшой кровоток через овальное окно и артериальный проток. Возможен и двухсторонний шунт с током крови справа-налево и слева-направо. Установлено, что в первые 4 ч после рождения у большинства детей двухстороннее шунтирование крови через артериальный проток имеет несколько вариантов:
1) право-левый шунт в систолу и лево-правый шунт в диастолу;
2) право-левый шунт в систолу и двухсторонний шунт в диастолу;
3) непрерывный двухсторонний шунт в систолу и диастолу.
Право-левый ток крови обычно регистрируется в раннюю систолу, лево-правый ток крови, наблюдающийся в диастолу, продолжается длительно в течение всей диастолы. Двухсторонний турбулентный кровоток через артериальный проток имеет высокую скорость и продолжительность. С возрастанием скорости кровотока по артериальному протоку в диастолу двухсторонний шунт сменяется на лево-правый. Скорость лево-правого шунта в диастолу возрастает в первые 12 ч после рождения ребенка.
Частично циркулирующие фетальные коммуникации у новорожденного ребенка играют регуляторную роль, снижая гемодинамическую нагрузку на миокард ПЖ во время послеродовой сердечно-легочной адаптации.
После рождения ребенка происходят изменения и в системе общего кровообращения. Плацентарный артериальный кровоток прекращается в течение 45—60 с после рождения. Скорость плацентарного венозного кровотока составляет 75 мл/кг-мин, замедляется через 2 мин после рождения, почти полностью прекращается на 3-й и заканчивается на 5-й минуте жизни.
Перестройка кровообращения приводит к возрастанию выброса ЛЖ примерно на 25%. В первые 2 ч после рождения резистентность периферических регуляторных сосудов низкая, в последующее время она повышается, обеспечивая таким образом необходимый уровень АД крови. В первые сутки после рождения у здоровых доношенных новорожденных наблюдается гиперкинетический тип сокращения межжелудочковой перегородки, который регистрируется до конца первой недели жизни. Такой тип сокращения межжелудочковой перегородки с высоким давлением крови в легочной артерии при транзиторной легочной гипертензии служит для облегчения работы миокарда ЛЖ. После закрытия артериального протока ударный объем ЛЖ в среднем равняется 4,0 мл, а скорость кровотока в общей системе циркуляции составляет 2,3—3,1 л/мин*м2.
Перестройка общего кровообращения сопровождается улучшением оксигенации крови и выделения углекислого газа из организма ребенка. Так, парциальное напряжение кислорода в крови в первые 10 мин жизни равняется 30 мм рт. ст., в последующие 15 мин возрастает до 60 мм рт. ст., в течение 1-го часа — до 80 мм рт. ст. и к концу первых суток жизни устанавливается на уровне 90 мм рт. ст. Парциальное напряжение углекислого газа в крови при рождении высокое (60 мм рт. ст.) и достигает уровня взрослого в течение 2-го часа жизни.
С первых по пятые сутки жизни отмечается нарастание минутного объема кровообращения, с максимальным подъемом на 3-й день после рождения. Увеличение минутного объема кровообращения происходит в значительной мере за счет возрастания ударного объема ЛЖ. Возрастание минутного объема кровообращения вместе с нормализацией общего периферического сопротивления сосудов в конечном итоге приводит к улучшению периферической циркуляции крови, увеличению кровенаполнения периферических сосудов, улучшению оттока крови из тканей и возрастанию скорости кровотока по сосудам.
После рождения постепенно повышается АД крови, особенно максимальное. Системное АД после рождения составляет в среднем 72/47 мм рт. ст., со 2—3-го дня жизни возрастает в среднем до 94/72 мм рт. ст. с наиболее значительным подъемом на 4—5-й день жизни. Возрастание системного АД связано с увеличением не только сердечного выброса, но и общего сосудистого периферического сопротивления, что обусловлено увеличением относительной массы мышечной стенки сосудистого ложа и повышением тонуса сфинктеров периферических регуляторных сосудов.
После рождения имеется устойчивая тенденция к снижению гематокрита, что также влияет на состояние общего кровотока: с уменьшением гематокрита снижается вязкость крови и возрастает скорость кровотока в общем сосудистом русле.
Метаболизм миокарда новорожденных постепенно переходит от утилизации глюкозы как основного источника энергии к потреблению жирных кислот.
Функциональное закрытие венозного протока происходит в течение первых нескольких минут жизни, а полное анатомическое закрытие — на 2—3-й неделе после рождения.
На качестве переходного кровообращения сказывается такой фактор, как время перевязки пуповины. При поздней перевязке пуповины (наложение скобок более чем через 3 мин после рождения плода) происходит возрастание объема циркулирующей крови до 60%. Этот дополнительный объем крови обеспечивает увеличение объема крови в правом и левом предсердиях («плюс-объем»), обусловливая более высокий уровень среднего АД. Среднее давление крови в предсердиях достигает исходного уровня только спустя 2—3 ч. В этом случае на сердце новорожденного ребенка падает дополнительная работа по перекачиванию большего объема крови. Кроме того, при позднем наложении скобок на пуповину происходит увеличение массы эритроцитов на 40—50%, что способствует повышению вязкости крови и, соответственно, гемодинамической нагрузки на сердце ребенка.
Переходная циркуляция сопровождается такими клиническими проявлениями, как акроцианоз, периоральный цианоз, усиливающийся при беспокойстве или крике ребенка, сердечные шумы. В первые несколько часов жизни шумы переходного кровообращения над областью сердца выслушиваются у 85% новорожденных детей. Чаще всего они обусловлены временным функционированием артериального протока с лево-правым шунтированием крови или турбулентным движением потока крови на изгибах крупных кровеносных сосудов. Отдельные сердечные шумы выслушиваются в раннюю или позднюю систолу. В первые полчаса-час после рождения на ЭКГ могут регистрироваться удлинение интервалов P-R, QRS, инверсия зубца Т в отведении VI, который в это время становится положительным за счет систолической перегрузки ПЖ.
Пренатальное консультирование детским урологом и тактика принятия решений при диагностике синдрома «мегацистис» в первом триместре гестации
Проведен анализ перинатальных исходов течения беременностей и разработан алгоритм тактических решений при выявлении синдрома «мегацистис» плода в первом триместре гестации.
Analysis of perinatal outcomes of pregnancy course was done, and the algorithm of tactic decisions in revealing megacystis syndrome of the fetus in the first term of gestation was developed.
Одним из актуальных аспектов современной детской урологии является диагностика пороков мочевыделительной системы на антенатальном этапе, их доля среди всех антенатально диагностируемых пороков составляет 26–28% [1]. Высокая распространенность и многообразие пороков органов мочевыделения, тяжесть осложнений и нередко их фатальная предопределенность заставляют рассматривать проблему их существования с точки зрения их профилактики [2]. Качественно проведенная антенатальная диагностика позволяет существенно повысить достоверность прогноза, спланировать сроки, объем лечебных мероприятий, проводимых на этапе доклинических проявлений, что в своем комплексе предопределяет исход диагностируемого патологического состояния, предотвращает развитие опасных для жизни осложнений, снижает вероятность рождения детей с тяжелыми инкурабельными пороками [3].
Обращаясь к детским урологам и хирургам, педиатрам, врачам акушерам, генетикам и специалистам ультразвуковой диагностики в качестве основной аудитории для дискуссии по проблеме пренатальной диагностики (ПД) врожденных пороков развития (ВПР) мочевыделительной системы (МВС), мы предлагаем сместить акцент при выявлении данной патологии на максимально ранние гестационные сроки, то есть на первый триместр гестации и обсудить прогностическую значимость такой позиции.
С одной стороны, на сегодняшний день приоритеты для решения проблем первого триместра гестации до сих пор полностью возложены на врачей ультразвуковой диагностики (УЗ), акушеров и генетиков. С другой стороны, в настоящее время в соответствии с имеющимся законодательством детский уролог должен принимать участие в пренатальном консультировании, а именно пренатальном прогнозировании диагностированной патологии плода, нести ответственность за принятые решения. В конце концов, именно детский уролог и является тем доктором, который в последующем и занимается лечением данных пациентов [4].
В Европейской пренатальной диагностике настоящего времени заложена идеология раннего пренатального скрининга, сформулированная основателем Фонда медицины плода (Fetal Medicine Foundation, FMF, Лондон) Кипросом Николаидисом. Если ранее считалось, что все осложнения развития плода и течения беременности возникают либо реализуются во второй половине беременности, и это предопределяло увеличение частоты контролирующих диагностических процедур с целью выявления патологии, то исследования последнего времени доказали, что формирование осложнений развития плода происходят в сроки до 12 недель и срок первого скрининга 11–14 недель беременности оптимален для диагностики большинства летальных и инвалидизирующих ВПР и хромосомных аномалий (ХА). Данный тезис декларирован в виде основного бренда Фонда медицины плода: «перевернуть «диагностическую пирамиду», заложив в ее основание качественный ранний пренатальный скрининг первого триместра гестации» [5].
ПД врожденных и наследственных заболеваний (ВНЗ) ставит своей задачей выявление ВПР, ХА, моногенных заболеваний. По данным Европейского регистра ВПР у новорожденных частота ВПР регистрируется в пределах 2,5–3,0%, ХА, в основном трисомии, составляют суммарно 2–3 случая на 1000 рождений, а моногенные заболевания регистрируются у 0,5–1,4% родившихся детей. По данным Всемирной организации здравоохранения, частота ВНЗ среди живо- и мертворожденных детей не превышает 4–6% [6–8].
Существующая в России с декабря 1993 г. трехуровневая система пренатальной диагностики, включающая УЗИ, биохимический скрининг второго триместра, инвазивные методы (амниоцентез, кордоцентез), не оправдала себя, и подведенные итоги были неутешительными. Реформирование системы массового пренатального обследования беременных женщин было основано на положительном международном опыте Фонда медицины плода и включено в национальный проект «Здоровье» с 2010 года с переводом на экспертный уровень всех субъектов Российской Федерации [6].
В качестве приоритетной основы ПД был выбран алгоритм программы Астрайя, базирующийся на рекомендациях Фонда медицины плода (FetalMedicine Foundation, FMF): 1) декретированные сроки проведения исследований — 11–14 недель; 2) комплекс сертифицированных неинвазивных диагностических методов: ультразвуковой и биохимический скрининг (определение молекулярных сывороточных маркеров: свободной бета-единицы хорионического гонадотропина человеческого (ХГЧ) и ассоциированного с беременностью протеина плазмы А (ПАПП-А)); 3) комбинированный расчет индивидуального риска хромосомных аномалий с отнесением в группу риска беременных, чей риск составил 1:100 и выше [6].
Наряду с этим за последние годы констатированы значительные успехи в развитии фундаментальных вопросов антенатальной урологии. Разработан диагностический алгоритм пренатальной ультразвуковой идентификации вариантов пороков мочевыделительной системы, что приблизило нас к постановке пренатального диагноза. Определены прогностические критерии перспективной функции почек и объективные уродинамические критерии «фатальных пороков» и т. д [3, 9, 10]. Однако важно отметить, что все это касается второго и в большей степени третьего триместра гестации, когда анатомические структуры плода, а вместе с тем и ультразвуковые маркеры патологии МВС становятся наиболее выраженными и доступными для визуализации. Однако в случаях диагностики прогностически неблагоприятных пороков развития упущены сроки для прерывания беременности. Именно эти обстоятельства заставили нас поддержать основной тезис Фонда медицины плода и обратиться к обсуждению вопроса антенатальной диагностики патологии МВС, сместив акцент на первый триместр гестации.
Для первого триместра гестации манифестным УЗ-маркером пороков МВС является синдром «мегацистис», который в литературной дискуссии имеет неоднозначную трактовку, а соответственно, противоречивые тактические рекомендации [11–14].
Частота выявления синдрома «мегацистис» первого триместра беременности составляет 0,02–0,19% [13, 14]. Синдром фетального увеличения мочевого пузыря большинство авторов трактует как результат низкой обструкции мочевых путей, причинами которой могут явиться патология уретры в виде атрезии или фибростеноза, дисгенезии клоаки с атрезией прямой кишки и уретры, встречающиеся у плодов обоего пола. Но наиболее часто диагностируется синдром клапанов задней уретры, характерный для плодов мужского пола [15].
Помимо этого, увеличение мочевого пузыря может сопровождать пороки МВС, патогенез которых не связан с наличием анатомической обструкции нижних мочевых путей, и обструкция в таких случаях носит функциональный характер. В настоящее время известно два синдрома: синдром мегацистис-мегауретер-микроколон-кишечной гипоперистальтики и prune-belle синдром. Причина функциональной обструкции детрузора обусловлена резким снижением, а вернее, отсутствием его сократительной способности, что морфологически проявляется дегенерацией и разреженностью гладких мышц, разрастанием фиброзной ткани, наличием массивных гиалиновых отложений. Летальность при данных синдромах составляет от 20% до 50% вследствие легочной недостаточности в неонатальном периоде или почечной недостаточности в ранней детском возрасте [15–18].
Диагноз «синдром «мегацистис» плода» большинство авторов трактует как прогностически неблагоприятный признак, угрожаемый по перинатальным потерям вследствие декомпенсированных пороков мочевыделительной системы, ассоциированных с дисплазией почечной паренхимы. Наиболее неблагоприятным вариантом является формирование кистозной дисплазии почечной паренхимы (преимущественно IV типа по Поттеру) [7, 8, 11, 14, 20].
С другой стороны, N. Sebire и S. Sahid сообщают о самостоятельной спонтанной регрессии синдрома «мегацистис» плода и рождении здоровых детей [21]. Это, по-видимому, происходит из-за того, что формирование гладкомышечной мускулатуры и иннервации мочевого пузыря не заканчивается к 13-й неделе гестации и продолжается в последующие дни, что дает основание для саморазрешения проблемы в последующие недели внутриутробного развития плода [22].
Учитывая, что синдром «мегацистис» в 25–40% сочетается с хромосомной патологией [23], существенную роль для принятия решения о пролонгировании или прерывании беременности играют результаты генетических исследований, кариотипирования плодного материала. Большинство авторов сходятся во мнении, что клапаны задней уретры, а также prune-belle синдром не являются генетически наследуемой патологией, однако это не исключает возможность хромосомных поломок. A. W. Liao констатирует в 25% случаев наличие трисомии по 13-й и 18-й хромосоме при увеличении размеров мочевого пузыря от 7 до 15 мм у плодов 10–14 недель гестации [23].
Разнообразие литературных данных и неоднозначность тактических рекомендаций заставляет нас подробно и целенаправленно обсуждать данную проблему в кругу детских урологов и врачей антенатальной диагностики, осознавая сложность и ответственность при принятии решения как в случаях пролонгирования течения беременности, так и при ее прерывании.
Целью настоящей публикации является проведение анализа перинатальных исходов течения беременностей и разработка алгоритма тактических решений при выявлении синдрома «мегацистис» плода в первом триместре гестации.
Материалы и методы исследования
Нами проведен анализ течения 11 беременностей первого триместра с антенатально выявленным диагнозом: «синдром «мегацистис» плода», которые входили в группу перинатального наблюдения генетика Областного перинатального центра и детского уролога.
Продольный размер мочевого пузыря превышал условный норматив 7 мм и варьировал в пределах 8–31 мм (рис. 1).
Обращает на себя внимание, что в 85% случаев возраст женщин колебался от 31 до 41 года. Из 11 наблюдаемых беременных только 6 женщин прошли ранний пренатальный скрининг по программе Астрайя, 5 женщин обследованы не были. По результатам биохимического скрининга уровень ХГЧ был нормальным во всех случаях, уровень ПАПП-А отклонялся от нормальных значений у 2 из 6. Ультразвуковые маркеры ВПР и ХА были выявлены в виде: увеличения воротникового пространства до 26 и 30 мм у 2 плодов, наличие сочетанного порока развития — омфалоцеле — у 1 плода, в 1 случае диагностированы кисты пуповины. Ни у кого из обследованных плодов расчетный индивидуальный риск хромосомной патологии не превышал допустимых значений (то есть во всех случаях был более 1:100) (табл.).
На момент диагностики данного состояния только в 2 случаях была выявлена одно- и двусторонняя пиелоэктазия (рис. 2). При динамическом наблюдении в течение 2 недель на фоне нарастания размеров мочевого пузыря двусторонняя пиелоэктазия выявлена в 5 случаях (рис. 3).
Результатом исследования явился анализ исходов течения беременностей.
Тактика принятия решений была мотивирована степенью поражения мочевыделительной системы, то есть степенью дилатации мочевого пузыря, наличием ретенции верхних мочевых путей.
Учитывая высокий процент сопутствующей генетической патологии при наличии синдрома «мегацистис» у плодов, в 5 случаях выполнено кариотипирование плодного материала (ворсин хориона). При этом в 1 случае выявлена трисомия по 18 паре хромосом с кариотипом 46ХХ + 47, 18 и беременность была прервана, в других случаях патологии кариотипа не выявлено.
В 5 наблюдениях после первичной визуализации увеличенного мочевого пузыря 14–30 мм продолжено динамическое наблюдение в течение 2 недель, что позволило констатировать нарастание увеличения мочевого пузыря и появление расширений верхних мочевых путей у 4 плодов, что обосновало прерывание беременностей.
В 4 наблюдениях исходное значительное увеличение пузыря до 29–30 мм позволило связать это с выраженной обструкцией уретры и прервать беременности без проведения дополнительных исследований.
В 1 случае отмечена замершая беременность. В целом в 10 из 11 случаев беременности были прерваны.
Только в 1 случае при исходном увеличении размеров пузыря до 8 мм динамическое наблюдение позволило наблюдать положительную динамику и нормализацию размеров пузыря, а как следствие — пролонгирование течения беременности. Однако исход ее оценить пока не представляется возможным, так как роды еще не произошли.
Проведенный анализ диагностических мероприятий и исходов течения беременностей позволил разработать диагностический алгоритм, который предполагает обязательное кариотипирование плодного материала при наличии размеров пузыря в пределах 7–15 мм. При подтверждении нарушения кариотипа целесообразно прерывание беременности, в противном случае — динамическое наблюдение до появления убедительных маркеров прогноза диагностируемого состояния.
Значительное исходное увеличение пузыря ≥ 20–30 мм однозначно свидетельствует о выраженной обструкции нижних мочевых путей и не требует динамического наблюдения, целесообразно прерывание беременности.
Наличие расширения верхних мочевых путей не всегда дополняет синдром «мегацистис» в ранние сроки гестации (11–13 недель) и наиболее отчетливо определяется во втором и третьем триместрах гестации. Однако во всех случаях его наличие является фактором, отягощающим прогноз.
Таким образом, подводя итоги анализа литературных данных и результатов собственных наблюдений, очевидны несколько выводов:
Литература
* ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
** ГУЗ Саратовский областной ПЦ, Саратов
*** НИИ фундаментальной и клинической уронефрологии, Саратов

_575.jpg)