Фарестон или тамоксифен что эффективнее? Фарестон таблетки инструкция. Тамоксифен таблетки инструкция.
Фарестон или тамоксифен что эффективнее
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Материалы конгрессов и конференций
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ЭНДОКРИНОТЕРАПИЯ ДИССЕМИНИРОВАННОГО
РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В МЕНОПАУЗЕ:
ОБСУЖДЕНИЕ I-II ЛИНИИ
В.Ф. Семиглазов
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Прогресс в эндокринотерапии за последние 100 лет почти не расширил рамки эффективности в 30% (при пересчете на всех леченных больных). Открытие рецепторов эстрогенов (РЭ) и прогестерона (РП) позволило надежнее определять кандидатов для эндокринотерапии. Известно, что при высокой концентрации РЭ и РП (выше 20 фмоль/мг белка) до 70% больных раком молочной железы (РМЖ) «отвечают» на гормонотерапию. Однако во всей популяции больных РМЖ, включая и пациентов с отсутствием рецепторов в опухоли, оказывается, что только 30% пациентов положительно реагируют на гормонотерапию (1-3).
И все же нельзя сказать, что бурный прогресс фармакоиндустрии, предлагающей все новые и новые гормональные препараты, не сказался на улучшении результатов лечения РМЖ. Во-первых, появление четверть века назад первого антиэстрогена тамоксифена, ставшего «золотым» стандартом у больных РМЖ с РЭ+/РП+ опухолями, заметно увеличило продолжительность жизни больных. Применение агониста ЛГ-рилизинг-гормона (золадекса) в комбинации с тамоксифеном у менструирующих больных РМЖ вместо хирургической овариэктомии также увеличило продолжительность и качество жизни больных. Назначение ингибиторов ароматазы нового поколения (Аримидекса, Фемары, Аромазина) при наступлении рецидива заболевания на фоне ранее проводившейся адъювантной терапии тамоксифеном приводит к объективной ремиссии еще у 25% больных, потерявших чувствительность к антиэстрогенам. Такая же схема последовательного применения сначала антиэстрогенов (тамоксифена) в течение 2-3 лет с последующим приемом ингибиторов ароматазы (Фемара, Аримидекс, Аромазин) проходит сейчас проверку в клинических испытаниях адъювантной гормонотерапии (4-11).
После разработки иммуногистохимической методики информация о содержании рецепторов может быть получена из архивных парафиновых блоков, содержащих первичную опухоль. Доказано, что опухоли, содержащие более 10% окрашенных на рецепторы эстрогенов или прогестерона клеток, оказываются чувствительными к гормонотерапии. Больные с РЭ-/РП- опухолями характеризуются лишь 5-10% вероятностью ответа на эндокринотерапию. Эти пациенты лучше лечатся с помощью цитотоксической или иной терапии.
При гормонозависимых метастатических РМЖ, безотносительно возраста больных, чаще всего применяется тамоксифен как первая линия терапии. Лечение тамоксифеном позволяет контролировать заболевание в течение 9-12 мес. У больных ранними стадиями РМЖ (I-II) и РЭ+ опухолями адъювантная терапия тамоксифеном сокращает риск рецидива на 45-50%. Недавно показано, что применение тамоксифена в течение 5 лет у здоровых женщин высокого риска уменьшает риск возникновения РМЖ также на 50%.
Несмотря на значительный благоприятный эффект тамоксифена в отношении изменения «естественной истории РМЖ», более чем у половины больных развивается рецидив заболевания после терапии тамоксифеном. Естественно возникает вопрос, как лечить этих пациентов.
Важно установить морфологический диагноз рецидива, степень и характер распространения процесса и вновь оценить рецепторный статус рецидивной опухоли. Больные со значительной органной дисфункцией из-за вовлеченности в опухолевый процесс (например, метастатический лимфангит в легких, множественные или массивные метастазы в печени) даже и при высоком уровне рецепторов к стероидным гормонам лучше поддаются паллиативному лечению с помощью цитотоксической терапии. Пациенты, у которых рецидив заболевания наступил после прекращения терапии тамоксифеном свыше 1 года назад, сохраняют шанс ответа на повторное лечение тамоксифеном. Пациенты, у которых развился рецидив заболевания во время лечения тамоксифеном или менее чем через 1 год после его прекращения имеют антиэстроген-резистентные опухоли, и они должны лечиться с помощью каких-то других альтернативных подходов (Piccart M.J., 2003). Для больных с РЭ-/РП- эндокринотерапия не показана, целесообразно назначение химиотерапии. У больных же с рецептор-положительными опухолями вторая и последующие линии гормонотерапии зависят также и от менопаузального статуса.
Новое поколение ингибиторов ароматазы стремительно становится терапией первой линии у постменопаузальных женщин, страдающих распространенным РМЖ, прогрессирующим на фоне терапии тамоксифеном.
До недавнего времени у постменопаузальных больных РМЖ в качестве вторичной эндокринотерапии выполнялась адреналэктомия или гипофизэктомия; чуть позже в качестве второй линии обычно использовали прогестины. Применение ингибиторов ароматазы при распространенном РМЖ у женщин в постменопаузе началось в 1980 г. с внедрения аминоглютетимида. Многочисленные исследования подтвердили эффективность этого препарата в первой и второй линии терапии. Аминоглютетимид, изученный в клинических испытаниях как препарат второй линии, показал схожую эффективность с хирургической адреналэктомией. Однако аминоглютетимид не является специфичным для фермента ароматазы, ингибируя одновременно синтез как глюкокортикоидов, так и минералокортикоидов. Поэтому при применении препарата требуется одновременное назначение гидрокортизона. Изучение ингибиторов ароматазы нового поколения (анастрозола, летрозола) показало их большую эффективность и меньшую токсичность по сравнению с прогестинами и аминоглютетимидом.
Два ингибитора ароматазы чаще всего использовались в качестве терапии второй линии: анастрозол (Аримидекс) (1 мг/сут. ежедневно) и летрозол (Фемара) (2,5 мг/сут. ежедневно). Эти новые ингибиторы ароматазы являются селективными (т.е. не взаимодействуют с другими энзимами цитохрома Р450), поэтому пациенты не нуждаются в дополнительной заместительной терапии даже в случаях острых инфекционных процессов или хирургического вмешательства. Уровень безопасности анастрозола (Аримидекса), летрозола (Фемары) и экземестана (Аромазина) выше всех предшествующих гормональных препаратов, поэтому именно эти препараты являются предпочтительными для первой линии гормонотерапии.
Опубликованы результаты двух клинических исследований, в которых сравнивали анастрозол и тамоксифен (12, 13). Североамериканское исследование, проведенное в США и Канаде, продемонстрировало превосходство анастрозола над тамоксифеном по такому показателю, как время до прогрессирования заболевания, но не выявило превосходства по частоте общего объективных ответов (9). Следует отметить, что в более крупном клиническом исследовании TARGET (Tamoxifen or Anastrozole Randomized Group Efficacy and Tolerability), которое было проведено в Европе, Австралии, Новой Зеландии, Южной Америке и ЮАР, не было обнаружено увеличения времени до прогрессирования у пациенток, леченных анастрозолом, по сравнению с пациентками, получавшими тамоксифен (медиана 8,2 против 8,3 мес.) (13). Дизайн этих двух исследований был спланирован таким образом, чтобы можно было провести анализ объединенных данных, который недавно опубликован (14). Между группами тамоксифена и анастрозола не было выявлено значимых различий ни по одному из основных параметров эффективности (оценивались время до прогрессирования, общая эффективность, частота клинического улучшения, время до прекращения терапии). Эти ретроспективные анализы показали, что анастрозол превзошел тамоксифен в подгруппе пациенток с рецептор-позитивными опухолями.
Летрозол превзошел тамоксифен по таким показателям как время до прогрессирования заболевания (медиана 9,4 мес. против 6,0 мес. соответственно; р
Фарестон или тамоксифен что эффективнее
Адъювантная гормональная терапия существенно изменила прогноз больных раком молочной железы с наличием рецепторов эстрогенов и прогестерона в опухоли. При назначении тамоксифена отмечается снижение на 50% частоты рецидива на фоне приема препарата и на 30% в следующие 5 лет после прекращения его приема. Это сопровождается снижением смертности на 30% в течение 15 лет с начала приема тамоксифена. Ингибиторы ароматазы в течение 5 лет обладают еще большим эффектом в сравнении с тамоксифеном, уменьшая риск прогрессирования на 30% за период приема и на 15% риск смерти в первые 10 лет. Однако накопленный опыт показывает, что после прекращения 5-летнего приема тамоксифена или ингибиторов ароматазы у больных сохраняется риск отсроченного прогрессирования. Это послужило основанием для проведения исследований по увеличению сроков адъювантной гормонотерапии.
Увеличение продолжительности приема тамоксифена было изучено в двух опубликованных на сегодняшний день исследованиях (таблица 1). В исследовании NSABP-14 увеличение продолжительности приема до 10 лет не привело к улучшению отдаленных результатов. В это исследование включались больные с N0, а значит с низким риском прогрессирования, что не позволило выявить потенциально возможную пользу длительного приема тамоксифена. В исследовании ATLAS увеличение продолжительности приема тамоксифена с 5 до 10 лет привело к достоверному снижению риска прогрессирования и смерти. При этом польза от длительного приема тамоксифена становится достоверной отсроченно, только после прекращения 10-летнего приема препарата. Причиной улучшения результатов лечения является уменьшение частоты локальных рецидивов заболевания, возникновения контрлатерального рака молочной железы (профилактический эффект) и незначительное снижение частоты отдаленных метастазов. В обоих исследованиях отмечено снижение частоты и выраженности ишемической болезни сердца, отсутствие увеличения частоты инсультов и тромбоэмболий и увеличение в 2 раза (с 2-3% до 4-5%) частоты возникновения рака эндометрия.
Таблица 1. Результаты рандомизированных исследований
по сравнению продленной и стандартной адъювантной гормонотерапии.
| Исследование | Число больных | Лечение | Срок наблюдения после рандомизации | БРВ | OВ |
|---|---|---|---|---|---|
| NSABP B-14 [1] | 1172 | Тамоксифен 5 лет Плацебо 5 лет | 7 лет | 78% 82% | 91% 94% |
| ATLAS [2] | 6846 | Тамоксифен 5 лет Плацебо 5 лет | 10 лет | 78,6%* 74,9% | 87,8%* 85% |
| MA.17 [3] | 1918 | Летрозол 5 лет Плацебо 5 лет | 5 лет | 95%* 91% | 93% 94% |
| NSABP B-42 [4] | 3966 | Летрозол 5 лет Плацебо 5 лет | 7 лет | 84,7% 81,3% | Н.Д. |
| IDEAL [5] | 1824 | Летрозол 5 лет Летрозол 2,5 года | 6,6 года | 82% 85,4% | Н.Д. |
| ABCSG-16 [6] | 3482 | Анастрозол 5 лет Анастрозол 2 года | 5 лет | 78% 78% | Н.Д. |
* – статистически достоверная разница; Н.Д. – нет данных.
Ингибиторы ароматазы продемонстрировали большую эффективность в сравнении с тамоксифеном при проведении адъювантной гормонотерапии больным раком молочной железы с наличием рецепторов стероидных гормонов в опухоли. В связи с этим стало актуальным изучить клиническую эффективность увеличения продолжительности приема ингибиторов ароматазы по сравнению со стандартным 5-летним приемом. В таблице 1 приведены результаты исследования по изучению продленной терапии ингибиторами ароматазы. Следует отметить, что только одно исследование MA.17 опубликовано в полном виде, для всех остальных исследований известна только безрецидивная выживаемость и токсичность терапии. В исследовании MA.17 прием летрозола в течение 5 лет после окончания 5-летней терапии тамоксифеном (79% больных) или ингибиторами ароматазы (21%) привел к достоверному снижению безрецидивной выживаемости, не оказав влияния на общую. Отмечено, что основной причиной снижения безрецидивной выживаемости стало уменьшение частоты контрлатерального рака. В исследования NSABP B-42 10-летний прием летрозола не повлиял на частоту прогрессирования заболевания по сравнению с 5-летним приемом тамоксифена или ингибиторов ароматазы. Анализ токсичности демонстрирует увеличение риска развития сердечно-сосудистых заболеваний и костных переломов на фоне длительного приема препаратов. Риск развития переломов повышается после 7 лет приема ингибиторов ароматазы.
Два исследования посвящены определению оптимальной продолжительности проведения адъювантной гормонотерапии. Дополнительные 5 лет приема были выбраны эмпирически, и остается актуальным сокращение сроков проведения адъювантной терапии для удобства пациентов и уменьшения риска развития побочных эффектов. В исследовании IDEAL сравнивается дополнительное назначение летрозола в течение 2,5 и 5 лет после ранее проведенной стандартной 5-летней адъювантной терапии. При медиане наблюдения 6,6 года после рандомизации не отмечено разницы в показателях безрецидивной и общей выживаемости. Длительный прием летрозола сочетался со снижением частоты контрлатерального рака.
В исследовании ABCSG-16 больным раком молочной железы с наличием рецепторов стероидных гормонов в опухоли и отсутствием амплификации HER2, получавшим адъювантную терапию тамоксифеном или ингибиторами ароматазы в течение 5 лет, назначали дополнительный прием анастрозола в течение 2 или 5 лет. В исследование были включены 3484 больные без признаков болезни на момент рандомизации после 5 лет адъювантной терапии. Стратификация проводилась в зависимости от проводимой гормонотерапии в первые 5 лет (тамоксифен или ингибиторы ароматазы). Предварительные результаты, доложенные на прошедшем симпозиуме по раку молочной железы в Сан-Антонио (США) в декабре 2017 года, свидетельствуют, что частота развития прогрессирования заболевания была одинаковой в обеих группах, безрецидивная выживаемость составила 78% и не зависела от вида гормонотерапии в первые 5 лет. Не отмечено разницы в развитии контрлатерального рака молочной железы. В группе длительного приема анастрозола отмечается повышение частоты костных переломов после 3-го года приема. Авторы делают вывод, что увеличение продолжительности адъювантной терапии на 2 года (всего 7 лет) эффективно предотвращает прогрессирование рака молочной железы и предохраняет от развития побочных эффектов, обусловленных длительным приемом ингибиторов ароматазы. Добавление ингибиторов ароматазы в течение 5 лет не дает выигрыша в улучшении отдаленных результатов и сопровождается увеличением побочных эффектов.
Приведенные исследования показывают, что назначение тамоксифена или ингибиторов ароматазы в течение 7-10 лет может приводить к выигрышу в безрецидивной и общей выживаемости по сравнению с 5-летним их назначением. Очевидно, что выигрыш этот отмечается лишь у меньшинства пациенток, в то время как большинство напрасно получают потенциально токсичную терапию со снижением качества жизни. Поэтому важно при обсуждении увеличения продолжительности гормонотерапии оценивать риск дальнейшего прогрессирования после 5 лет адъювантной гормонотерапии у каждой конкретной больной. Этому было посвящено исследование Оксфордской группы EBCTCG (Early Breast Cancer Trialists Collaborative Group) [7].
Были обобщены 88 исследований по 5-летнему назначению адъювантной гормонотерапии и оценен риск прогрессирования и смерти в течение 15 (5-20) лет после прекращения приема в зависимости от различных прогностических факторов.
Результаты наблюдения за больными в последующие 15 лет после 5-летнего прекращения гормонотерапии демонстрируют увеличение кумулятивного риска прогрессирования и смерти от рака молочной железы. Риск прогрессирования и последующей смерти от рака молочной железы напрямую связан с наличием метастазов и их числом в подмышечных лимфоузлах (см. таблицу 2). В первые 5 лет приема гормональных препаратов наблюдается существенное отставание риска смерти от частоты развития прогрессирования заболевания. Однако при наблюдении в течение 20 лет частота смерти от рака молочной железы догоняет частоту рецидивирования и составляет в зависимости от метастатического поражения подмышечных лимфоузлов 15%, 28% и 49%.
Таблица 2. Риск прогрессирования и смерти при проведении гормонотерапии в течение 5 лет.
| Частота рецидивов | Частота смерти | |||
|---|---|---|---|---|
| 5-летняя | 20-летняя | 5-летняя | 20-летняя | |
| N0 | 6% | 22% | 3% | 15% |
| N1-3 | 10% | 31% | 5% | 28% |
| N4-9 | 22% | 52% | 12% | 49% |
Авторы изучили, какие клинические факторы в наибольшей степени определяют риск прогрессирования после прекращения приема гормонов за период 5-20 лет. Оказалось, что, несмотря на то, что на период 5 лет все больные не имели признаков прогрессирования заболевания, размер первичной опухоли и состояние подмышечных лимфоузлов в момент постановки диагноза в наибольшей степени предсказывали риск прогрессирования в последующие после прекращения приема гормональных препаратов годы. Минимальный ежегодный риск прогрессирования менее 1% и кумулятивный в 13% на период 20 лет отмечается у больных с T1N0. С увеличением размера первичной опухоли и числа метастазов в подмышечные лимфоузлы растет как ежегодный, так и кумулятивный риск прогрессирования, достигая максимальных значений 2,8% и 41% при T2N4-9. У больных с T1N0 на частоту прогрессирования оказывала влияние степень дифференцировки, увеличивая его с 10% при высокой степени до 17% при низкой.
Таким образом, проведенное исследование подтвердило, что после прекращения приема гормональных препаратов в течение 5 лет в последующие годы происходит увеличение риска прогрессирования, степень которого зависит от размера первичной опухоли, наличия и числа метастазов в подмышечных лимфоузлах. Все это оправдывает и объясняет целесообразность увеличения продолжительности приема тамоксифена или ингибиторов ароматазы у больных с высоким риском прогрессирования. При обсуждении необходимости продолжения гормонотерапии после 5 лет приема исследование EBCTCG помогает оценить риск прогрессирования и принять правильное решение.
Можно ли с большей точностью определить популяцию больных, которым показано проведение продленной адъювантной гормонотерапии? Возможно, использование генетических тестов (например, Oncotype DX или MammaPrint) с лучшей точностью в сравнении со стадией болезни позволит выявить пациентов с высоким риском прогрессирования после 5 лет адъювантной терапии. Но пока отсутствуют результаты таких исследований, практический интерес представляет исследование по изучению циркулирующих опухолевых клеток у больных после 5 лет адъювантной гормонотерапии [8]. В исследование, которое было представлено на конференции по раку молочной железы в Сан-Антонио в 2017 году, включались больные раком молочной железы II-III стадий с отсутствием экспрессии HER2, которым проводилась адъювантная химиотерапия с добавлением и без бевацизумаба (исследование E5103). Затем больным с наличием рецепторов стероидных гормонов назначали адъювантную гормонотерапию. У 546 больных без признаков прогрессирования выполняли определение наличия циркулирующих опухолевых клеток в крови методом CELLSEARCH CTC assay в период 4,5-7 лет с момента постановки диагноза.
Оказалось, что циркулирующие опухолевые клетки определяются у 4,8% больных: у больных с наличием рецепторов стероидных гормонов – 5,1%, при отрицательных рецепторах – 4,3%. При медиане наблюдения 1,6 года после выполнения теста наличие циркулирующих опухолевых клеток увеличивает риск прогрессирования в 20 раз у больных с положительными рецепторами и не влияет на частоту прогрессирования при отрицательных рецепторах. Было показано, что риск прогрессирования в ближайшие 2 года у больных с положительными рецепторами и наличием циркулирующих опухолевых клеток и без них составляет 35% и 2% соответственно. Авторы посчитали полученные результаты неожиданными. Первой неожиданностью было обнаружение циркулирующих опухолевых клеток у больных без признаков болезни после 5 лет интенсивной адъювантной химиогормонотерапии. Второй неожиданностью была высокая предсказывающая способность прогрессирования заболевания в случае обнаружения циркулирующих опухолевых клеток только у больных с наличием рецепторов стероидных гормонов в опухоли. И третья неожиданность – это быстрое прогрессирование болезни в этой группе больных после окончания адъювантной гормонотерапии.
Авторы делают вывод, что обнаружение циркулирующих опухолевых клеток у больных с наличием рецепторов стероидных гормонов в момент окончания 5-летнего приема адъювантной гормонотерапии является четким биомаркером быстрого прогрессирования заболевания в ближайшие годы после ее окончания. Можно предположить, что определение опухолевой ДНК в плазме крови больных после 5-летнего приема гормональной адъювантной терапии также может служить индикатором присутствия микрометастазов и высокого риска прогрессирования. Возможно, именно эти больные выигрывают от увеличения продолжительности адъювантной гормонотерапии, а тест на определение циркулирующих опухолевых клеток или опухолевой ДНК будет обязательным для определения оптимальной продолжительности гормонотерапии. Можно думать, что в группе больных с высоким риском прогрессирования будут найдены более эффективные методы лечения в сравнении с увеличением только продолжительности приема гормональных препаратов. Добавление ингибиторов циклинзависимых киназ приведет не только к повышению эффективности адъювантной гормонотерапии, но и к возможному сокращению сроков ее проведения. Интересным представляется назначение ингибиторов контрольных точек иммунного ответа у больных с микрометастазами рака молочной железы после проведения начального этапа гормонотерапии.
Исходя из полученных данных, можно сделать следующие выводы:
Ключевые слова: рак молочной железы, адъювантная гормонотерапия.
Узнать больше о лечении рака молочной железы можно на
Большой конференции RUSSCO «Рак молочной железы»
(25-26 января 2018, Лотте Отель Москва)
Торемифен – эффективная и безопасная альтернатива тамоксифену в адъювантной эндокринной терапии рака молочной железы
В отличие от тамоксифена, эффективность и побочные эффекты торемифена в адъювантной терапии рака молочной железы (РМЖ) не были изучены в полной мере. С целью более точной оценки эффективности и вероятности возникновения серьезных побочных эффектов торемифена в сравнении с тамоксифеном был проведен метаанализ, объединивший результаты четырех рандомизированных исследований. Было показано, что торемифен является убедительной и безопасной альтернативой тамоксифену в адъювантной эндокринной терапии.
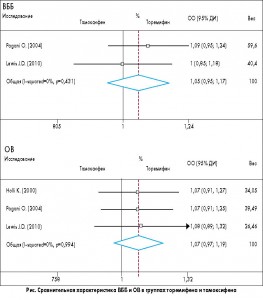
В метаанализ были включены в общей сложности данные 1890 пациенток с РМЖ, получавших терапию торемифеном, и 1857 пациенток, принимавших тамоксифен. По сравнению с пациентками, принимающими тамоксифен, в группе торемифена не было статистически значимой разницы в общей выживаемости – ОВ (относительный риск – ОР – 1,07; 95% доверительный интервал – ДИ – 0,97-1,19; р=0,994) или выживаемости без болезни – ВББ (ОР 1,05; 95% ДИ 0,95-1,17; р=0,431). Показатели количества тромбоэмболических событий в группе торемифена, включающих тромбоз глубоких вен (ОР 0,68; 95% ДИ 0,40-1,17; р=0,926), нарушения мозгового кровообращения (ОР 0,59; 95% ДИ 0,32-1,09; р=0,438) и эмболию легочной артерии (ОР 0,91; 95% ДИ 0,42-2,01; р=0,618), незначительно отличались от таковых в группе тамоксифена. Количество осложнений в виде полипов и рака эндометрия в двух группах было почти одинаковым. Результаты данного метаанализа позволили авторам утверждать, что торемифен столь же эффективен в адъювантной терапии пери- и постменопаузального РМЖ, как тамоксифен, и имеет аналогичный профиль серьезных осложнений.
Тамоксифен, антиэстрогенный препарат, который используется в адъювантной эндокринной терапии РМЖ, может значительно улучшить показатели ВББ и ОВ (C.K. Osborne, 1998; EBCTCG, 2005). Торемифен, другой нестероидный селективный модулятор рецептора эстрогена, показал равноценные эстроген-рецептор-связывающий и противоопухолевый эффекты в доклинических исследованиях (S. Kallio et al., 1986). Торемифен оказывает эстрогенные или антиэстрогенные эффекты в зависимости от органа-мишени, дозы препарата и длительности лечения. Этот препарат в основном используется у больных с прогрессирующим РМЖ. По данным предшествующего метаанализа, торемифен и тамоксифен в равной степени эффективны и хорошо переносятся при лечении прогрессирующего РМЖ у женщин в постменопаузе. Однако эффективность торемифена в адъювантной эндокринной терапии не была достаточно изучена. До сих пор лишь немногие рандомизированные клинические исследования (K. Holli et al., 2000; O. Pagani et al., 2004; J.D. Lewis et al., 2010) сообщали об эффективности торемифена в адъювантной терапии по сравнению с тамоксифеном. В то же время тамоксифен способен вызывать серьезные побочные эффекты, такие как тромбоэмболические события, гинекологические осложнения и осложнения со стороны органов зрения, которые могут представлять угрозу жизни пациенток. Важно отметить, что торемифен, хлорированное производное тамоксифена, может иметь другую фармакокинетику и более благоприятный профиль переносимости (J.D. Lewis et al., 2010; P. Hirsimaki et al., 2002). Данные о побочных эффектах, представленные в предыдущих исследованиях, были противоречивыми. По результатам исследований Международной группы по изучению рака молочной железы (IBCSG), большее количество нарушений мозгового кровообращения и гинекологических осложнений были зарегистрированы у пациенток, получавших терапию торемифеном, но в двух других исследованиях продемонстрированы прямо противоположные результаты.
Данный метаанализ был проведен с целью более точного определения эффективности торемифена в качестве адъювантной терапии по сравнению с тамоксифеном. Более серьезные побочные эффекты от приема торемифена по сравнению с тамоксифеном также были оценены в данном исследовании. Установлено, что торемифен был эффективной и безопасной альтернативой тамоксифену в адъювантной гормонотерапии РМЖ.
В метаанализ были включены результаты четырех рандомизированных мультицентровых исследований, описанные в трех публикациях (K. Holli et al., 2000; O. Pagani et al., 2004; J.D. Lewis et al., 2010). Это исследования, проведенные Финской исследовательской группой по изучению РМЖ, Международной группой по изучению РМЖ, а также Североамериканское исследование сравнительной эффективности тамоксифена и торемифена (North American Fareston versus Tamoxifen Adjuvant – NAFTA) соответственно. Для оценки эффективности препаратов в метаанализ были включены 1890 случаев использования торемифена и 1857 случаев лечения тамоксифеном. Кроме того, были оценены побочные эффекты путем сопоставления 1864 случаев в группе торемифена и 1845 случаев в группе тамоксифена.
По сравнению с группой тамоксифена, у пациенток в группе торемифена не было существенной разницы в ОВ за период наблюдения (ОР 1,07; 95% ДИ 0,97-1,19; р=0,994 для гетерогенности) (рис.). Данные о ВББ были приведены только в двух исследованиях. По аналогии, показатели ВББ существенно не отличались в обеих группах (ОР 1,05; 95% ДИ 0,95-1,17; р=0,431 для гетерогенности) (рис.).
Торемифен и тамоксифен могут вызывать такие побочные явления, как потливость, приливы, слабость, а также тромбоэмболические и гинекологические осложнения. Тяжелые неблагоприятные осложнения, в том числе тромбоэмболии, полипы и рак эндометрия, оказывают серьезное влияние на качество жизни пациенток. Показатели уровня тромбоза глубоких вен в группе торемифена существенно не отличались от таковых в группе тамоксифена (ОР 0,68; 95% ДИ 0,40-1,17; р=0,926). Также не было значительных отличий между показателями возникновения острых нарушений мозгового кровообращения в группе торемифена по сравнению с группой тамоксифена (ОР 0,59; 95% ДИ 0,32-1,09; р=0,438 для гетерогенности). Кроме того, показатели эмболии легочной артерии в обеих группах не отличались (ОР 0,91; 95% ДИ 0,42-2,01; р=0,618 для гетерогенности). В целом у пациенток, получавших торемифен, не было зафиксировано существенной разницы в количестве тромбоэмболических событий по сравнению с группой тамоксифена (ОР 0,81; 95% ДИ 0,66-1,01; р=0,799 для гетерогенности). Показатели возникновения полипов эндометрия в двух группах были почти такими же (ОР 1,03; 95% ДИ 0,61-1,73; р=0,831 для гетерогенности). Кроме того, не было значительной разницы в заболеваемости раком эндометрия (ОР 0,99; 95% ДИ 0,36-2,73; р=0,297 для гетерогенности). Стоит отметить, что осложнения со стороны органов зрения были освещены только в исследовании NAFTA.
Проведенный метаанализ, который объединил результаты четырех рандомизированных исследований, позволяет дать более точную оценку эффективности и серьезных побочных эффектов торемифена в качестве адъювантной терапии по сравнению с тамоксифеном. Доказано, что пациентки в группе приема торемифена имели сходные показатели ОВ и ВББ с таковыми в группе приема тамоксифена. Кроме того, не было продемонстрировано значительной разницы в количестве тромбоэмболических событий у пациенток групп торемифена и тамоксифена. Гинекологические осложнения возникали почти в равной степени в обеих группах. Результаты исследования позволяют предположить, что торемифен является эффективной и безопасной альтернативой тамоксифену в адъювантной эндокринной терапии РМЖ у пациенток в пери- и постменопаузе. И торемифен и тамоксифен, связываясь с рецептором эстрогена, оказывают эстрогенные или антиэстрогенные эффекты (S. Kallio et al., 1986). Данные препараты достаточно эффективны в эндокринной терапии РМЖ, но в то же время имеют множество побочных эффектов (S. Pyrhonen et аl., 1999). Данный метаанализ показал, что торемифен является таким же эффективным антиэстрогенным препаратом, как и тамоксифен. Несмотря на то что существенных различий в выживаемости выявлено не было, в обеих группах зафиксированы различные показатели ОВ и ВББ. Необходимы дальнейшие широкие клинические испытания, чтобы подтвердить этот предварительный вывод.
Тамоксифен до настоящего времени используется в качестве адъювантной эндокринной терапии, особенно у пациенток в пременопаузе и пожилых пациенток с низким риском рецидива (J.D. Lewis et al., 2010). К сожалению, не у всех пациенток с гормон-рецептор-положительными опухолями отмечается позитивный эффект после терапии тамоксифеном. В некоторых исследованиях (M.P. Goetz et. al., 2007; M. Ingelman-Sundberg, 2005; R. Carpenter, 2008) сообщается, что полиморфизм гена CYP2D6 цитохрома Р450 оказывает влияние на метаболизм тамоксифена, что может ухудшить результаты. Хотя метаболизм торемифена не изучен в достаточной степени, торемифен может потенциально быть альтернативой тамоксифену в этой ситуации.
Тромбоэмболические и гинекологические осложнения серьезно влияют на качество жизни больных. Обнаружено, что частота тромбоэмболических осложнений у пациенток, получавших торемифен, не отличалась от таковой у пациенток, получавших тамоксифен. В соответствии с данными предыдущего метаанализа (S. Pyrhonen, 1999), частота тромбоэмболических событий была одинаковой в двух группах. Тем не менее по-прежнему является необходимым проведение больших клинических испытаний с фокусом на тромбоэмболических событиях, вызванных применением торемифена и тамоксифена. Два гинекологических осложнения, рассмотренных в метаанализе, возникали почти в равной степени в обеих группах. Предыдущие исследования (O. Pagani et al., 2004; J.D. Lewis et al., 2010; T. Saarto et al., 1996) показали, что серьезная окулотоксичность возникала очень редко в обеих группах. Более низкая генотоксичность (S. Shibutani et al., 2001) может быть потенциальным преимуществом для торемифена по сравнению с тамоксифеном (S. Shibutani et al., 2000). Следовательно, торемифен является достойной заменой тамоксифену. Некоторые исследования сообщают о более низком эстрогенно-антиэстрогенном соотношении у торемифена, чем у тамоксифена, что могло бы объяснить различия в количестве тромбоэмболических событий, вызванных двумя препаратами. В случае возникновения тяжелых побочных эффектов при использовании тамоксифена в качестве альтернативного варианта может быть рассмотрен торемифен. Однако проведение дальнейших клинических исследований с целью систематизации побочных эффектов этих двух препаратов является крайне необходимым.
С другой стороны, данный метаанализ имеет некоторые недочеты. Во-первых, доза торемифена 40 мг/сут, которую принимали пациентки в течение 3 лет в Финской исследовательской группе (K. Holli et al., 2000), отличалась от таковой в остальных трех рандомизированных исследованиях. Во-вторых, многие пациентки не завершили лечение или проверку исполнения в исследовании NAFTA. В-третьих, в то время когда было начато исследование NAFTA, химиотерапия не входила в стандарты лечения больных с гормон-рецептор-положительными опухолями молочной железы, и, следовательно, часть пациенток не получали лечения цитостатиками. В-четвертых, результаты исследования были основаны на нескорректированных статистических показателях, и более точная оценка может быть дана с учетом таких факторов, как во зраст пациенток, индекс массы тела и менопаузальный статус.
Результаты представленного метаанализа подтверждают, что торемифен столь же эффективен, как и тамоксифен, в адъювантной терапии пациенток в пери- или в постменопаузе и характеризуется сходным уровнем побочных эффектов. Таким образом, торемифен представляет собой действенную и безопасную альтернативу тамоксифену в адъювантной эндокринной терапии РМЖ. Дальнейшие рандомизированные клинические исследования с большим размером выборки крайне необходимы для более точной оценки эффективности и побочных эффектов торемифена по сравнению с тамоксифеном.
Статья печатается в сокращении.
Zhou W.-B., Ding Q., Chen L., Liu X.-A., Wang S. Toremifene is an effective and safe alternative to tamoxifen in adjuvant endocrine therapy for breast cancer: results of four randomized trials. Breast Cancer Res Treat (2011), 128: 625-631.
Перевела с англ. Мария Стафейчук
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Роль вірусу папіломи людини (ВПЛ) у розвитку раку шийки матки (РШМ) та інших захворювань аногенітальної ділянки доведена та загальновідома. Незважаючи на це, щорічно відзначається зростання показників захворюваності на РШМ. Специфічні методи противірусного лікування ВПЛ не розроблені, єдиним дієвим способом попередження розвитку РШМ та інших асоційованих із ним захворювань є вакцинація. Глобальна пандемія коронавірусної хвороби загрожує зірвати вакцинацію проти ВПЛ у країнах із низьким та середнім рівнем доходу, що негативно впливає на стратегію зупинення поширення захворюваності на РШМ.
Із розвитком імуноцитологічних, імуногістохімічних та інших методів молекулярної діагностики значно розширилися терапевтичні можливості лікування онкологічної та онкогематологічної патології, у тому числі хронічної лімфоцитарної лейкемії (ХЛЛ). Визначення деяких факторів ризику дозволяє оптимізувати терапію та обрати ту терапевтичну опцію, яка матиме найбільшу користь для конкретного пацієнта.
Уже вдруге щорічний конгрес Європейського товариства медичної онкології (ESMO) відбувається у віртуальному просторі (формальним його господарем 21-25 вересня був Париж). Звичайно ж, через такий формат ці дуже важливі зустрічі онкологів багато втрачають, але всупереч складним умовам на конгресі ESMO-2021 оприлюднено результати низки важливих досліджень, які невдовзі змінять стандарти лікування. Традиційно про найголовніші досягнення повідомляється на президентських симпозіумах (їх було кілька). Особливо виділимо три повідомлення: про роль імунотерапії при занедбаному раку шийки матки, а також при ранній стадії меланоми і недрібноклітинного раку легені (НДРЛ).

Warning: Use of undefined constant expert_review_likes - assumed 'expert_review_likes' (this will throw an Error in a future version of PHP) in /var/www/www-ars1963/data/www/ck62.ru/wp-content/themes/colormag/comments.php on line 93