12 дней на ивл что дальше
Прекращение длительной ИВЛ
Прекращение длительной ИВЛ, извлечение интубационной трубки из просвета гортани и трахеи и переход к самостоятельному дыханию – ответственные шаги после осуществления продолжительной искусственной вентиляции легких. Любой ошибочный шаг на этой стадии лечения способен нивелировать достигнутые терапевтические результаты.
Начало постепенного прекращения вспомогательной вентиляции является таким же важным моментом, как и начало. Специалисты считают, что продолжительное использование данного метода провоцирует развитие зависимости от аппарата у неврологических пациентов. Человек попросту привыкает к аппарату, у него может наблюдаться ослабление мышечного аппарата.
Условия прекращения респираторной поддержки
Ключевым требованием к прекращению ИВЛ является пресечение недостаточности дыхания и восстановление газообмена в легких при самостоятельной дыхательной активности. При самостоятельном дыхании РаО2 должно достигнуть 80 мм.рт.ст, сердечный ритм, дыхательные движения, показатели давления должны пребывать в пределах нормы.
Во время перехода на самостоятельную дыхательную активность и при извлечении интубационной трубки из гортани и трахеи пациент должен самостоятельно делать вдох с показателями разрежения не менее 20 см. вод.ст.
После прекращения продолжительной искусственной вентиляции легких извлечение интубационной трубки должно осуществляться спустя несколько часов после возвращения самостоятельной дыхательной активности у человека. За этот промежуток времени не должно наблюдаться таких признаков:
Временной промежуток, в котором происходит адаптация пациента, зависит от различных факторов – от продолжительности дыхания с помощью аппарата, от характера заболевания. Длительность восстановления колеблется от нескольких часов до нескольких суток, кроме того, могут потребоваться специальные дыхательные упражнения, чтобы восстановить мышечный аппарат и укрепить его. Чтобы провести постепенную адаптацию с самостоятельному дыханию и плавно тренировать дыхательные мышцы, часто прибегают к помощью специального т-образного коннектора. Он подсоединяется к интубационной трубке, аппарат отключается. Через вход этого коннектора человек вдыхает воздух, обогащенный кислородом.
Определение подготовленности пациента к переводу
Ключевыми показателями для извлечения интубационной трубки являются:
Перед изъятием трубки проводится тщательный туалет дыхательных путей. Они должны быть полностью проходимыми. Если на протяжении нескольких суток у пациента не отмечается динамика к самостоятельному дыханию, ИВЛ заменяют интубацией через трахеостому. Важно вовремя обнаружить ошибки при прекращении вентиляции. Иногда, чтобы сохранить функцию диафрагмы, прибегают к электрической стимуляции нервов в ней.
Методики «отлучения» от респиратора
Чтобы прекращение искусственной вентиляции легких было успешным, прибегают к помощи таких средств:
Если у пациента отмечается наличие сопутствующей обструкции дыхательных путей и другие нарушения (левожелудочковая недостаточность, ишемия миокарда), при высоких дыхательных нагрузках среднее внутриплевральное давление может существенно снижаться. Так происходит увеличение постнагрузки, появляется ишемия или застойные явления в сосудах легких. В этих случаях уменьшают потребность в вентиляции теми методами, которые способствуют улучшению механики внешнего дыхания и уменьшают минутную вентиляцию.
Положительный результат приносит применение самостоятельных вдохов и выдохов с постоянно положительным давлением. Либо же применяется неинвазивная респираторная поддержка. Чтобы улучшить функционирование сердца и уменьшить признаки ишемии, используют терапию медикаментозными средствами.
Месяц на ИВЛ. Как восстанавливаются пациенты после победы над коронавирусом?
Каждый тяжелый случай заболевания COVID-19 для врачей – серьезный вызов и отдельная история спасения. В основном медикам приходится рассчитывать на свои силы. Конечно, не без надежды и на самого пациента. Но в случае, когда болезнь протекает тяжело, полностью восстановиться – дело не одного дня. Здесь нужен комплексный подход. О таких пациентах не перестают заботиться, даже когда те покидают стены больниц. Им дорога – на долечивание и реабилитацию. Чтобы, как говорится, от болезни не осталось и следа.
Почти месяц – на волоске. 27 дней за жизнь Бориса Федоровича боролись врачи Жодинской городской больницы. Реанимация, искусственная кома, аппарат ИВЛ – и все это с диагнозом «коронавирусная инфекция». И при таком раскладе дел вернуться буквально с того света – чудо… Сотворенное в большей степени руками врачей.
Месяц, как один день, пролетел еще у одного пациента жодинской больницы. 28 дней за мужчину дышал аппарат ИВЛ. Но хорошо то, что хорошо кончается: 1:0 в пользу врачей и … жизни. Рассказать о своих ощущениях пациенту пока еще тяжело – мешает трубка в горле (это временная мера).
Через терапевтический корпус Жодинской больницы, который с середины апреля перепрофилирован под пациентов с COVID-19, прошли больше 340 человек с коронавирусной инфекцией. Везли сюда и взрослых, и детей из всех регионов Минской области. Сейчас, в основном, в отделении – жители Жодино и Смолевичского района, у которых пневмония средней степени тяжести.
Владимир Циолта, главный врач Жодинской центральной городской больницы: «О чень многие прошли через отделение реанимации, часть прошла через аппараты ИВЛ, часть – без респираторной поддержки. Мы можем гордиться пациентами, потому что, в любом случае, когда человек находится на ИВЛ больше месяца, это уже достижение, с какой бы патологией он не был».
Елена Бондрева, главный врач Минского областного центра медицинской реабилитации «Загорье»: «К нам поступают пациенты разного плана – это и пациенты, снятые с ИВЛ, и пациенты более легкие, которым не требуется кислородная поддержка. Мы стараемся сразу включить в их лечение, кроме медикаментов, различные другие методы и способы медицинской реабилитации. Это психологическая реабилитация, физическая в виде лечебной физкультуры, дыхательной гимнастики и физиотерапии».
Восстановиться после болезни пациентов отправляют также в Республиканскую больницу спелеолечения и санаторий «Березина». Кому-то назначают процедуры в поликлиниках по месту жительства. В Минской области для реабилитации госпитализируют примерно каждого десятого, у кого болезнь протекала в тяжелой форме.
Наталья Боярская, начальник главного управления по здравоохранению Миноблисполкома: « И сейчас мы отмечаем положительную тенденцию по снижению заболеваемости. Наши первые районы, которые вступили в эпидситуацию, это Копыль. Столбцы, Червень. В них выздоровевших значительно больше, чем заболевших. По всей области уже более трех тысяч полностью выздоровевших. Это 41% от заболевших».
На долечивание и восстановление уходит в среднем две-три недели. В областном центре медицинской реабилитации с середины апреля поставили на ноги больше пятисот человек. Одномоментно здесь готовы принять до 180 пациентов. Сейчас загружено учреждение на две трети, но в скором времени центр рассчитывает открыть двери и для остальных пациентов. А пока, конечно, задача – как можно дальше увести пациента от коронавируса, чтобы от болезни не осталось и следа.
Искусственная вентиляция легких (ИВЛ): инвазивная и неинвазивная респираторная поддержка
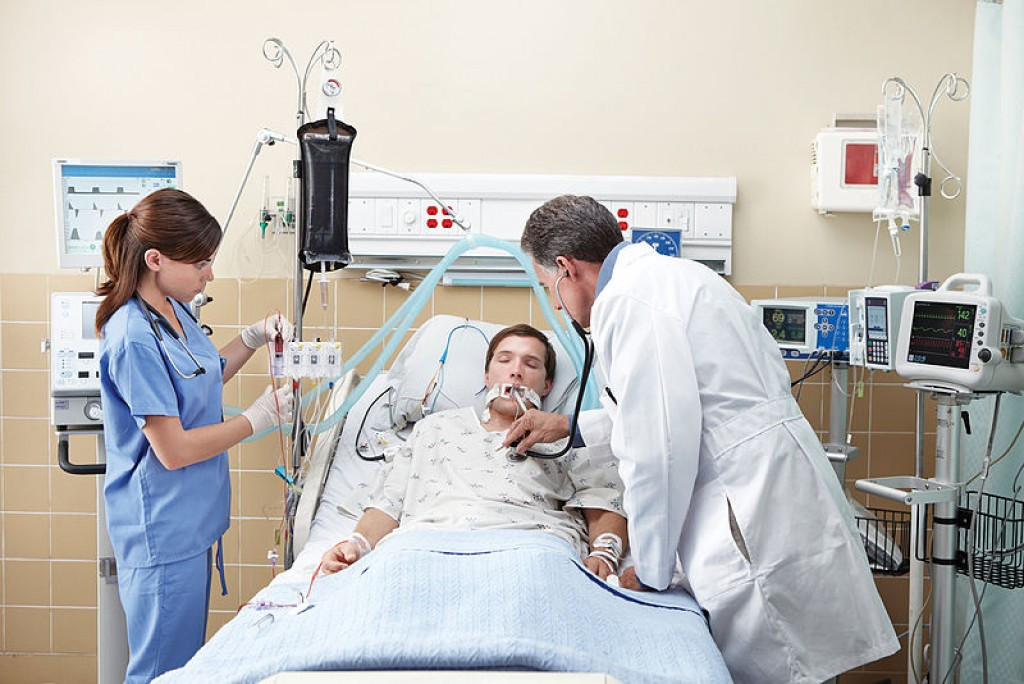
К искусственной вентиляции легких (ИВЛ) прибегают для оказания помощи пациентам с острой или хронической дыхательной недостаточностью, когда больной не может самостоятельно вдыхать необходимый для полноценного функционирования организма объем кислорода и выдыхать углекислый газ. Необходимость в ИВЛ возникает при отсутствии естественного дыхания или при его серьезных нарушениях, а также во время хирургических операций под общим наркозом.
Что такое ИВЛ?
Искусственная вентиляция в общем виде представляет собой вдувание газовой смеси в легкие пациента. Процедуру можно проводить вручную, обеспечивая пассивный вдох и выдох путем ритмичных сжиманий и разжиманий легких или с помощью реанимационного мешка типа Амбу. Более распространенной формой респираторной поддержки является аппаратная ИВЛ, при которой доставка кислорода в легкие осуществляется с помощью специального медицинского оборудования.
Показания к искусственной вентиляции легких
Искусственная вентиляция легких проводится при острой или хронической дыхательной недостаточности, вызванной следующими заболеваниями или состояниями:
Инвазивная вентиляция легких
Эндотрахеальная трубка вводится в трахею через рот или через нос и подсоединяется к аппарату ИВЛ
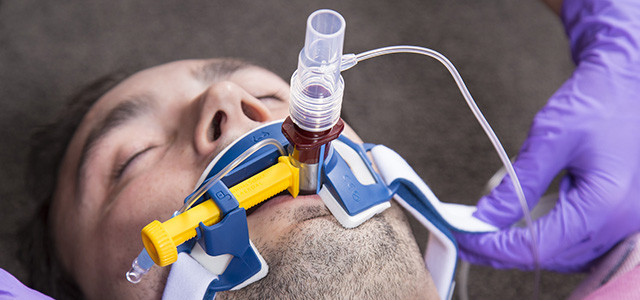
При инвазивной респираторной поддержке аппарат ИВЛ обеспечивает принудительную прокачку легких кислородом и полностью берет на себя функцию дыхания. Газовая смесь подается через эндотрахеальную трубку, помещенную в трахею через рот или нос. В особо критических случаях проводится трахеостомия – хирургическая операция по рассечению передней стенки трахеи для введения трахеостомической трубки непосредственно в ее просвет.
Инвазивная вентиляция обладает высокой эффективностью, но применяется лишь случае невозможности помочь больному более щадящим способом, т.е. без инвазивного вмешательства.
Кому и когда необходима инвазивная ИВЛ?
Подключенный к аппарату ИВЛ человек не может ни говорить, ни принимать пищу. Интубация доставляет не только неудобства, но и болезненные ощущения. Ввиду этого пациента, как правило, вводят в медикаментозную кому. Процедура проводится только в условиях стационара под наблюдением специалистов.
Инвазивная вентиляция легких отличается высокой эффективностью, однако интубация предполагает введение пациента в медикаментозную кому. Кроме того, процедура сопряжена с рисками.
Традиционно инвазивную респираторную поддержку применяют в следующих случаях:
Как работает аппарат инвазивной ИВЛ?
Принцип работы приборов для инвазивной ИВЛ можно описать следующим образом.
Особенности оборудования для инвазивной вентиляции
Оборудование для инвазивной вентиляции легких имеет ряд характерных особенностей.
Неинвазивная вентиляция легких
За последние два десятилетия заметно возросло использование оборудования неинвазивной искусственной вентиляции легких. НИВЛ стала общепризнанным и широко распространенным инструментом терапии острой и хронической дыхательной недостаточности как в лечебном учреждении, так и в домашних условиях.
Одним из ведущих производителей медицинских респираторных устройств является австралийская компания ResMed
НИВЛ — что это?
Неинвазивная вентиляция легких относится к искусственной респираторной поддержке без инвазивного доступа (т.е. без эндотрахеальной или трахеостомической трубки) с использованием различных известных вспомогательных режимов вентиляции.
Оборудование подает воздух в интерфейс пациента через дыхательный контур. Для обеспечения НИВЛ используются различные интерфейсы – носовая или рото-носовая маска, шлем, мундштук. В отличие от инвазивного метода, человек продолжает дышать самостоятельно, но получает аппаратную поддержку на вдохе.
Когда применяется неинвазивная вентиляция легких?
Ключом к успешному использованию неинвазивной вентиляции легких является признание ее возможностей и ограничений, а также тщательный отбор пациентов (уточнение диагноза и оценка состояния больного). Показаниями для НИВЛ являются следующие критерии:
12 дней на ивл что дальше
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.
Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии
Изучение летальности и факторов риска смерти больных с COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии (ОРИТ) лечебных учреждений Российской Федерации.
Материалы и методы
Ретроспективное исследование было выполнено в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых пациентов с COVID-19 на базе Первого МГМУ им. И.М. Сеченова. В исследование включали всех пациентов с известными исходами (смерть от любых причин или выздоровление) SARS-CoV-2 пневмонии, осложнившейся острым респираторным дистресс синдромом (ОРДС), которые были проконсультированы с 16 марта по 3 мая 2020 г. Факторы риска смерти анализировали с помощью многофакторной регрессионной модели Кокса.
В исследование были включены 1522 пациента, 864 (56,8%) мужчины и 658 (43,2%) женщин. Медиана возраста – 62 года. 922 (60,6%) больных находились в ОРИТ стационаров Москвы и Московской области, 600 (39,4%) – лечебных учреждений в 70 регионах Российской Федерации. У 995 (65,4%) больных диагноз SARS-CoV-2 инфекции был подтвержден с помощью ПЦР. Умерли 995 (65,4%) пациентов, выжили 527 (34,6%). Основными причинами смерти были ОРДС (93,2%), серКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (3) дечно-сосудистые осложнения (3,7%) и тромбоэмболия легочной артерии (1,0%). Летальность была низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно повышалась у больных, которых приходилось переводить на неинвазивную (36,8%) или инвазивную (76,5%) вентиляцию легких. Риск смерти увеличивался с возрастом и в возрастных группах старше 50 лет у мужчин был достоверно выше, чем у женщин. В однофакторных моделях заболеваниями, ассоциировавшимися с развитием летального исхода, были артериальная гипертония, ИБС, инсульт, фибрилляция предсердий, сахарный диабет 2 типа, ожирение и солидные опухоли, однако в многофакторной модели, построенной по всем признакам с коррекцией по полу и возрасту, статистическое значение сохранили только ИБС (отношение рисков [ОР] 1,257, 95% доверительный интервал [ДИ] 1,064-1,485, p=0,007), сахарный диабет 2 типа (ОР 1,300, 95% ДИ 1,131-1,494, p Заключение
Основными факторами риска смерти больных с COVID-19, переведенных в ОРИТ для респираторной поддержки, были тяжесть ОРДС, прежде всего необходимость в ИВЛ, пожилой возраст, мужской пол, а также ИБС, ожирение и сахарный диабет 2 типа.
Вдекабре 2019 г. в Китае началась вспышка инфекции, вызванной SARS-CoV-2 (severe acute respiratory syndrome coronavirus-2) и получившей название COVID-19 (Coronavirus disease 2019) [1]. В течение последующих 6 мес общее число подтвержденных случаев новой коронавирусной инфекции в мире превысило 18 млн и продолжает быстро увеличиваться, особенно в США, странах Южной Америки и Индии. Только в июле 2020 г. в мире было зарегистрировано более 7 млн новых случаев SARS-CoV-2 инфекции. Хотя санитарно-эпидемиологические меры, которые в том или ином объеме предпринимаются во всех странах, охваченных пандемией COVID-19, позволяют ограничить распространение инфекции, их неизбежное ослабление сопровождается новым ростом заболеваемости (“второй волной»). В связи с этим основные надежды в борьбе с пандемией связывают с вакцинацией. В настоящее время в различных странах, включая Россию, разрабатываются почти 200 вакцин-кандидатов против SARS-CoV-2 [2]. Недавно были опубликованы обнадеживающие результаты клинических исследований 1-2 фазы вакцин, разработанных в России, Великобри тании, США или Китае 6. В рандомизированном контролируемом исследовании у 1077 здоровых добровольцев в возрасте 18-55 лет однократное введение рекомбинантной векторной вакцины ChAdOx1, содержащей ген белка S( spike) SARS-CoV-2 (университет Оксфорда, Великобритания), вызывало образование нейтрализующих антител в достаточном титре в 91% случаев и Т-клеточный ответ в 100% [4]. Достигнутый эффект сохранялся через 56 дней. Вакцинация часто вызывала развитие местных и общих нежелательных реакций, однако они не были тяжелыми и обычно контролировались парацетамолом. В августе 2020 г. в Российской Федерации была зарегистрирована первая отечественная вакцина против SARS-CoV-2, которая состоит из двух рекомбинантных аденовирусных векторов, несущих ген белка S вируса SARS-CoV-2. В двух открытых неконтролируемых исследованиях 1/2 фазы у 76 здоровых добровольцев введение вакцины вызывало мощный гуморальный и клеточный ответ и хорошо переносилось [6]. Основными нежелательными явлениями были боль в месте инъекции (58%), повышение температуры тела (50%), головная боль (42%), астения (28%) и боль в мышцах и суставах (24%). Серьезных нежелательных явлений не зарегистрировали.
У большинства больных COVID-19 характеризуется легким или бессимптомным течением, однако у части пациентов наблюдается развитие вирусной пневмонии, которая может осложниться острым респираторным дистресс синдромом (ОРДС) и полиорганной недостаточностью [7]. В Китае доля пациентов, которым потребовался перевод в отделение реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки, среди госпитализированных больных с COVID19 варьировалась от 5% до 32% [8,9], в Ломбардии (Италия) в ОРИТ были госпитализированы 9% из 17713 пациентов с подтвержденной SARS-CoV-2 инфекцией [10], а в Чикаго (США) – 6,1% из 8673 больных [11] По данным исследований, проводившихся в Китае и других странах, риск более тяжелого течения COVID-19 выше у людей старшего возраста, страдающих различными сопутствующими заболеваниями, прежде всего сердечно-сосудистыми, сахарным диабетом и ожирением 12. Сходные результаты были получены в нашем ретроспективном исследовании, в которое были включены более 1000 пациентов с тяжелой и крайней тяжелой SARS-CoV-2 пневмонией, госпитализированных в ОРИТ лечебных учреждений Российской Федерации для респираторной поддержки [17]. Около половины из них были в возрасте старше 60 лет, а более чем у 2/3 пациентов имелись различные сопутствующие заболевания, в том числе артериальная гипертония и другие сердечно-сосудистые болезни, сахарный диабет, ожирение и др. У каждого пятого больного с тяжелым течением COVID-19 наблюдалось раннее развитие септического шока, факторами риска которого были возраст старше 50 лет и наличие трех сопутствующих заболеваний [18]. Мы не анализировали летальность больных в российских ОРИТ, так как исследование проводилось вскоре после начала вспышки SARS-CoV2 инфекции в Российской Федерации, а исходы заболевания у большинства пациентов еще не были известны вследствие непродолжительного срока наблюдения. Необходимо отметить, что в регулярно публикуемые статистические показатели включают данные о летальности больных только с подтвержденной SARS-CoV-2 инфекцией, в то время как у значительной части госпитализированных пациентов со средне-тяжелым или тяжелым течением COVID-19 результаты полимеразной цепной реакции (ПЦР) оказываются отрицательными, а диагноз устанавливают на основании клинической картины, эпидемиологического анамнеза и данных компьютерной томографии (КТ) органов грудной клетки. В нашей когорте доля таких пациентов составила около 40% [17]. Соответственно, исследования, которые проводятся в обычной клинической практике, позволяют получить более точное представление об исходах COVID-19.
Целью настоящего ретроспективного исследования было изучение летальности и факторов риска смерти больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ лечебных учреждений Российской Федерации.
Материал и методы
Ретроспективное исследование было выполнено в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых на базе Первого МГМУ им. И.М. Сеченова. Анализировали заявки на консультацию больных с тяжелым течением COVID-19, поступавшие в центр по интернет из ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В исследование включали всех пациентов с COVID-19, которым потребовалась респираторная поддержка, независимо от результата ПЦР. Если результаты вирусологического исследования были отрицательными, сомнительными или отсутствовали, то диагноз устанавливали на основании клинических признаков острой респираторной инфекции, осложнившейся острой дыхательной недостаточностью, в сочетании с характерными данными компьютерной томографии (КТ) органов грудной клетки при отсутствии других этиологических факторов [19].
На основании полученных заявок оценивали демографические показатели, сопутствующие заболевания (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция), данные КТ легких, уровень респираторной поддержки (оксигенотерапия, неинвазивная вентиляция легких [НИВЛ], искусственная вентиляция легких [ИВЛ] без признаков септического шока, ИВЛ в сочетании с септическим шоком [полиорганная недостаточность и необходимость в вазопрессорной поддержке]). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аорто-коронарное шунтирование) в анамнезе. Хроническую сердечную недостаточность не учитывали в связи с высокой вероятностью гипердиагностики этого состояния. Ожирение диагностировали на основании индекса массы тела: 2 – нормальная масса тела, 25,0-29,9 кг/м 2 – избыточная масса тела, 30,0-34,9 кг/м 2 – ожирение 1 степени, 35,039,9 кг/м 2 – 2 степени и ≥40,0 кг/м 2 – 3 степени. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты. Степень выраженности изменений на КТ легких оценивали с учетом распространенности и характера поражения [17].
Исходы (смерть или выздоровление) определяли с помощью базы данных COVID-19, которая создана в Российской Федерации по решению Министерства здравоохранения. В эту базу данных включается информация о всех пациентах, у которых установлен диагноз COVID-19, в том числе вероятный. Если исход заболевания в базе данных не был зафиксирован, то запрашивали соответствующее лечебное учреждение. Пациентов, у которых продолжалась респираторная поддержка на момент анализа, в исследование не включали.
Статистический анализ. Описательный статистический анализ проводился с использованием программы IBM SPSS Statistics 22 (IBM Corporation, США). Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Данные для количественных показателей представлены в виде среднего арифметического и стандартного отклонения (при нормальном распределении) или в виде медианы и межквартильного размаха (при отклонении распределения от нормального). Данные для качественных переменных представлены в виде абсолютных значений и доли в процентах. Медианы количественных показателей сравнивали с помощью U-критерия Манна-Уитни (при сравнении двух групп). Сравнение групп по качественным признакам проводилось с помощью критерия χ2-Пирсона (при количестве наблюдений в группе ≥10) и точного критерия Фишера (при количестве наблюдений в группе
Результаты
Демографические показатели. Федеральный дистанционный консультативный центр анестезиологии и реаниматологии для взрослых на базе Первого МГМУ им. И.М. Сеченова был создан по приказу Минздрава РФ 16 марта 2020 г. С этого времени в центр ежедневно поступает по 100-180 заявок на консультацию больных с диагнозом COVID-19, госпитализированных в ОРИТ. В целом на 16 августа 2020 г. в центре проконсультированы 11829 больных, в том числе 3100 из Москвы, 909 из Московской области и 7820 из других регионов Рос сийской Федерации. Из этой когорты были отобраны первые 1522 пациента с известными исходами, которые были проконсультированы до 3 мая 2020 г. Наблюдение за пациентами с момента госпитализации в инфекционный стационар до развития конечной точки (летальный исход или выписка из стационара) проводили до 7 июля 2020 г. Медиана длительности наблюдения составила 16 (9; 27) дней.
Доля мужчин среди обследованных больных несколько превышала долю женщин (табл. 1). Женщины были достоверно старше мужчин (средний возраст 64,4±13,4 и 59,1±13,8 лет, соответственно; р ТАБЛИЦА 1. Демографические и клинические показатели 1522 больных с тяжелым и крайне тяжелым течением COVID-19, госпитализированных в ОРИТ
Клиническая характеристика пациентов. У всех больных наблюдалась картина ОРДС в виде двусторонней полисегментарной пневмонии 3-4 стадии и острой дыхательной недостаточности, требовавшей респираторной поддержки. Примерно 80% больных были переведены на ИВЛ в связи с нарастающей острой дыхательной недостаточностью, которую не удавалось контролировать оксигенотерапией или НИВЛ. Почти у каждого пятого пациента отмечено развитие септического шока, характеризовавшегося полиорганной недостаточностью и необходимостью в вазопрессорной поддержке. Доля пациентов, находившихся на ИВЛ, в Москве и Московской области была выше (86,5% и 88,5%), чем в других регионах Российской Федерации (66,3%), а доля больных, которым потребовалась только оксигенотерапии, в московском регионе была, наоборот, в несколько раз ниже (4,9%, 8,2% и 24,7%, соответственно).
У большинства больных имелись различные сопутствующие заболевания. Чаще всего встречались артериальная гипертония (59,5%), сахарный диабет 2 типа (26,7%) и ожирение (26,0%), несколько реже – ИБС (15,4%), инсульт в анамнезе (7,4%), фибрилляция предсердий (10,6%) и ХОБЛ (5,1%). Частота других заболеваний, в том числе бронхиальной астмы, злокачественных новообразований, ревматических аутоиммунных заболеваний и ВИЧ-инфекций была низкой и не превышала 5%.
У 363 (23,9%) пациентов не были выявлены сопутствующие заболевания, у 395 (26,0%) – имелось по крайней мере одно заболевание, у 383 (25,3%) – два, у 379 (24,9%) – три и более.
Выживаемость пациентов. За период наблюдения умерли 995 (65,4%) пациентов, выжили 527 (34,6%). Медиана выживаемости пациентов, рассчитанная методом Каплана-Майера, составила 17 (15,7; 18,2) дней (рис. 1). С момента госпитализации в стационар 14- и 28-дневная выживаемость пациентов равнялась 56,0% и 36,4%, соответственно. В Москве за период наблюдения умерли 551 (74,5%) из 740 человек, в Московской области – 143 (78,6%) из 182, в других регионах – 301 (50,2%) из 600.

Причины летального исхода включали в себя ОРДС (93,2%), сердечно-сосудистые осложнения (3,7%), тромбоэмболию легочной артерии (1,0%), осложнения онкологических заболеваний (0,9%), “септические» осложнения (0,7%), осложнения цирроза печени (0,3%), осложнения ВИЧ-инфекции (0,1%) и туберкулез (0,1%).
Летальность пациентов, находившихся на оксигенотерапии, составила 10,1% (20/199), НИВЛ – 36,8% (35/95), ИВЛ – 76,5% (940/1228). Самой высокой летальность была среди пациентов, у которых имелись признаки септического шока – 86,6% (246/284). Медиана длительности ИВЛ у умерших пациентов равнялась 6 (3; 12) дней, а медиана длительности ИВЛ до экстубации у выживших пациентов – 13 (7; 21) дней. Среди пациентов, у которых диагноз SARS-CoV-2 инфекции, был подтвержден и не был подтвержден с помощью ПЦР, летальность не отличалась – 63,5% и 68,9%, соответственно.

Факторы риска смерти. Пациенты, у которых наступил летальный исход, были старше выживших больных (табл. 2). В регрессионной модели Кокса риск смерти у пациентов старше 50 лет был достоверно выше, чем у больных более молодого возраста, и достигал максимума у пациентов старше 70 лет (рис. 2). Выживаемость в значительной степени зависела как от возраста, так и от пола. Среди пациентов старше 50 лет выживаемость у мужчин была достоверно ниже, чем у женщин, однако среди пациентов в возрасте ≤50 лет выживаемость не различалась у мужчин и женщин (рис. 3).

| Параметры | Выжившие (n=527) | Умершие (n=995) | p | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Возраст, лет; Me (IQR) | 56 (48; 64) | 65 (56; 74) | ТАБЛИЦА 3. Отношение рисков смерти, рассчитанное в регрессионной модели Кокса для сопутствующих заболеваний| Фактор | Исходная модель | Модель 1 | Модель 2 | ОР; 95% ДИ | p | ОР; 95% ДИ | p | ОР; 95% ДИ | p | Примечание: Исходная модель: однофакторный анализ; *анализ двух признаков совместно – пол и возраст; Модель 1: многофакторный анализ каждого признака по отдельности с коррекцией по полу и возрасту; Модель 2: многофакторный анализ по всем признакам с коррекцией по полу и возрасту | | |||||||||
| Пол (мужской) | 1,167; 1,029-1,324 | 0,016 | 1,358*; 1,194-1,545 |  Рис. 4. Отношение рисков смерти пациентов в зависимости от числа сопутствующих заболеваний Рис. 4. Отношение рисков смерти пациентов в зависимости от числа сопутствующих заболеваний | |||||||||||||||||||
Лабораторные показатели. У умерших пациентов количество лейкоцитов, нейтрофилов и содержание глюкозы в крови были выше, чем у выживших больных, а количество тромбоцитов и сывороточное содержание альбумина оказалось ниже (табл. 4). В то же время концентрации С-реактивного белка (СРБ), фибриногена и D-димера достоверно не отличались между двумя группами. Частота острого повреждения почек (ОПП) была достоверно выше в группе умерших пациентов (26,7% и 8,5%, соответственно; p 
| Параметры | Все пациенты | Выжившие | Умершие | p | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Гемоглобин, г/л | 126 (110; 136), n=449 | 132 (119; 145), n=158 | 125 (110; 135), n=219 | 0,859 | ||||||||||||
| Лейкоциты, ×10 9 /л | 8,1 (5,6; 11,8), n=595 | 7,2 (5,0; 9,9), n=227 | 9,0 (6,3; 12,6), n=368 | 9 /л | 0,9 (0,6; 1,3), n=519 | 1,0 (0,6; 1,3), n=190 | 0,9 (0,6; 1,3), n=329 | 0,167 | ||||||||
| Нейтрофилы, ×10 9 /л | 6,2 (3,9; 8,8), n=351 | 5,3 (3,6; 7,6), n=139 | 6,9 (4,3; 9,3), n=212 | 0,001 | ||||||||||||
| Тромбоциты, ×10 9 /л | 235 (170; 293), n=371 | 191 (144; 268), n=198 | 180 (132; 244), n=304 | 0,050 | ||||||||||||
| Альбумин, г/л | 32,0 (27,9; 36,9), n=278 | 33,1 (28,8; 37,1), n=97 | 31,0 (27,0; 35,7), n=181 | 0,010 | ||||||||||||
| Глюкоза, ммоль/л | 7,3 (5,8; 9,9), n=436 | 6,9 (5,6; 8,5), n=164 | 7,7 (5,9; 10,8), n=272 | 0,001 | ||||||||||||
| СРБ max, мг/л | 131,0 (72,8; 209,0), n=218 | 117,5 (42,0; 207,0), n=86 | 133,5 (96,0; 212,0), n=132 | 0,231 | ||||||||||||
| Фибриноген, г/л | 5,1 (3,9; 7,2), n=234 | 5,1 (4,0; 7,3), n=100 | 5,3 (3,9; 7,1), n=134 | 0,866 | ||||||||||||
| Д-димер, нг/мл | 820 (384; 2348), n=95 | 727 (381; 1957), n=36 | 930 (426; 2682), n=59 | 0,485 | ||||||||||||
| Поражение почек, n (%) | 335/587 (57,1) | 83/210 (39,5) | 252/377 (66,8) | 2 | 64,6 (43,7; 84,0), n=531 | 76,7 (61,0; 92,4), n=197 | 57,0 (36,5; 77,4), n=334 | 2 | 59,0 (36,0; 80,8), n=510 | 75,3 (56,0; 89,4), n=193 | 46,9 (27,5; 72,2), n=317 | Поражение печени, n (%) | 283/1201 (23,6) | 85/433 (19,6) | 198/768 (25,8) | 0,090 |
| АЛТ max, ед/л | 41,1 (28,1; 73,0), n=515 | 43,0 (29,2; 76,0), n=194 | 40,0 (27,3; 69,0), n=321 | 0,320 | ||||||||||||
| АСТ max, ед/л | 56,0 (39,0; 93,0), n=500 | 53 (36,0; 83,5), n=189 | 58,0 (40,0; 101,7), n=311 | 0,040 | ||||||||||||
| Общий билирубин, мкмоль/л | 13 (9; 20), n=88 | 12 (8; 15), n=33 | 14 (9; 27), n=55 | 0,072 | ||||||||||||
| ЛДГ max, ед/л | 619 (418; 875), n=179 | 511,6 (375; 694), n=56 | 675 (495;994), n=123 | 0,003 |
Обсуждение
В нашем исследовании летальность у 1522 больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ лечебных учреждений Российской Федерации, составила 65,4%. В течение первых 14 дней после госпитализации в инфек ционный стационар умерли 44,0% больных, а в течение 28 дней – 63,6%. В качестве причины смерти у 93% больных был указан ОРДС. Летальность была низкой (10,1%) у пациентов, находившихся на оксигенотерапии, однако она значительно увеличивалась при прогрессирующем течении заболевании и достигала 76,8% у больных, которых приходилось переводить на ИВЛ. Самой высокой летальность (86,6%) была у пациентов с септическим шоком, характеризовавшися полиорганной недостаточностью и необходимостью в вазопрессорной поддержке. Следует отметить, что у больных с тяжелым течением COVID-19 именно вирус, а не вторичные бактериальные инфекции является ведущей причиной развития сепсиса и септического шока [20]. В пользу этого свидетельствуют раннее развитие септического шока у значительной части пациентов [18] и отрицательные результаты бактериологического исследования крови и выделений из нижних дыхательных путей более чем у 75% больных сепсисом, развившимся на фоне COVID-19 [21].
В исследованной когорте летальность больных, госпитализированных в ОРИТ, была практически одинаковой в Москве и Московской области (74,5% и 78,6%, соответственно) и существенно ниже (50,2%) в других регионах России. Вероятно, это объяснялось тем, что в Московском регионе, где было зарегистрировано максимальное число случаев SARS-CoV-2 инфекции, в ОРИТ переводили пациентов с наиболее тяжелым течением пневмонии, прежде всего нуждавшихся в ИВЛ. Так, частота ИВЛ у больных, поступивших в ОРИТ лечебных учреждений Москвы и Московской области, превышала 85%, в то время как в других регионах России только около 66% больных, переведенных в ОРИТ, нуждались в ИВЛ, а примерно 25% пациентов получали оксигенотерапию.
Для достоверного диагноза SARS-CoV-2 инфекции необходим положительный результат ПЦР, однако в исследованной когорте примерно у трети пациентов диагноз не удалось подтвердить с помощью вирусологического исследования. Тем не менее, во всех этих случаях наличие COVID-19 не вызывало сомнения и подтверждалось как клиническими данными (острая респираторная инфекция, осложнившаяся острой дыхательной недостаточностью, при отсутствии других возможных этиологических факторов), так и типичными результатами КТ органов грудной клетки (двусторонние зоны “матового стекла» ± зоны консолидации и ретикулярные изменения легких). Высокие чувствитель
ность и специфичность КТ органов грудной клетки в диагностике SARS-CoV-2 инфекции подтверждаются результатами исследований, проводившихся в других странах 22. Летальность больных с подтвержденным и неподтвержденным диагнозом SARS-CoV-2 инфекции в нашем исследовании была практически одинаковой.
Хотя пандемия COVID-19 продолжается уже более полугода, данные о летальности больных, которым потребовалась госпитализация в ОРИТ, остаются ограниченными. P. Quah и соавт. провели мета-анализ 15 исследований, в которых оценивали летальность у 3798 больных с COVID-19, поступивших в ОРИТ [25]. Эти исследования проводились в разных странах, в том числе в Китае, США, Италии, Испании, Германии, Дании и Великобритании. Большинство из них были небольшими и включали в себя не более 100 пациентов. В целом летальность составила всего 25,7%, однако более половины больных оставались в ОРИТ на момент публикации, поэтому очевидно, что приведенный показатель является заниженным и его не следует сравнивать с таковым в нашем исследовании, в которое включали только пациентов с известными исходами SARS-CoV-2 пневмонии. Например, в самом крупном итальянском исследовании, в которое были включены более 1500 больных с COVID-19, госпитализированных в ОРИТ, на момент анализа летальность равнялась 26%, однако 58% больных продолжали лечение в ОРИТ, и только 16% пациентов были выписаны [10]. В исследованной нами когорте летальность увеличилась с 44% через 14 дней до 63% через 28 дней. Необходимо также учитывать и различную частоту ИВЛ, которая варьировалась от 35,4% в китайских исследованиях до 89,3% в исследованиях, проведенных в США. В целом частота ИВЛ в исследованиях, включенных в мета-анализ, была ниже (70%), чем в российской когорте (около 80%). В другом мета-анализе были обобщены результаты 24 наблюдательных исследований в целом у 10150 пациентов с COVID-19, госпитализированных в ОРИТ в лечебных учреждениях Азии, Европы и Северной Америки [26]. Летальность варьировалась от 0 до 84,6% и в среднем составила 41,6%. Следует отметить, что только в 7 исследованиях исходы были известны у всех больных, причем только в одно из них было включено достаточно количество больных (n=371), в то время как в остальных оно варьировалось от 1 до 50 (в целом 80). В более крупном исследовании, проводившемся в НьюЙорке, летальность в ОРИТ достигла 78% [27]. Кроме того, авторы мета-анализа не оценивали тяжесть пациентов, поступивших в ОРИТ, в частности частоту ИВЛ.
В опубликованных ранее исследованиях также была выявлена ассоциация между сахарным диабетом и более тяжелым течением COVID-19. Например, в крупном американском исследовании (n=7162) частота сахарного диабета у пациентов, поступивших в ОРИТ, была в несколько раз выше, чем у больных, которым не потребовалась госпитализация [42]. Сходные данные были получены в другом американском исследовании [15]. В итальянском исследовании у 373 госпитализированных больных с COVID-19 сахарный диабет ассоциировался с достоверным увеличением риска летального исхода (относительный риск 1,56; 95% ДИ 1,05-2,02) [43].
ХОБЛ и бронхиальная астма в исследованной нами когорте больных с тяжелым течением COVID-19 встречались реже (5,1% и 2,3%, соответственно), чем в общей российской популяции [44]. Результаты метаанализа 6 исследований у 1558 больных COVID-19 показали, что ХОБЛ является независимым фактором риска прогрессирования SARS-CoV-2 инфекции [45]. В нашем исследовании частота ХОБЛ у умерших пациентов примерно в два раза превышала таковую у выживших. Тем не менее, роль этого заболевания как фактора риска смерти у пациентов, госпитализированных в ОРИТ, не была подтверждена при многофакторном анализе.
Низкая частота бронхиальной астмой у пациентов с COVID-19 была отмечена и в других исследованиях [46]. S. Lovinsky-Desir и соавт. показали, что наличие бронхиальной астмы у больных с COVID-19 не сопровождалось ухудшением прогноза независимо от возраста, наличия ожирения или других сопутствующих заболеваний [47]. В нашем исследовании частота бронхиальной астмы у умерших и выживших пациентов была одинаковой. Высказано предположение, что особенности иммунного ответа у пациентов с бронхиальной астмой или терапия ингаляционными глю ко кор ти костероидами могут препятствовать более тяжелому течению SARS-CoV-2 пневмонии [46,48], хотя благоприятный эффект последних вызывает сомнение. Бронхиальная астма часто асоциируется с увеличением количества эозинофилов, которые обладают как провоспалительными эффектами, так и иммунорегулирующей противовирусной активностью. Однако в настоящее время нет данных о том, что эозинофилы оказывают защитное действие или, наоборот, способствуют поражению легких при SARS-CoV-2 инфекции, хотя эозинопения позволяет предсказать более тяжелое течение заболевания [49]. В нашей когорте абсолютное число эозинофилов в крови было ниже 0,02 × 109/л у большинства больных, госпитализированных в ОРИТ, а случаев эозинофилии крови мы не зарегистрировали [50].
Частота других сопутствующих заболеваний, которые теоретически могут повысить риск смерти больных с тяжелым течением COVID-19, в том числе злокачественных опухолей, гемобластозов, ревматических аутоиммунных заболеваний (таких как ревматоидный артрит, системная красная волчанка и др.) и ВИЧинфекции, в исследованной когорте была низкой. У умерших пациентов частота солидных опухолей, диагностированных в течение последних 5 лет, в несколько раз превышала таковую у выживших больных (5,3% и 1,9%, соответственно), однако роль злокачественных новообразований как фактора риска смерти не была подтверждена при многофакторном регрессионном анализе Кокса. Частота аутоиммунных заболеваний, гемобластозов и ВИЧ-инфекции соответствовала таковой в общей популяции и была практически одинаковой у умерших и выживших пациентов.
Мы не анализировали прогностическое значение лабораторных показателей, так как подробные результаты анализов крови и мочи имелись далеко не во всех случаях. Следует отметить, что концентрации СРБ и Dдимера достоверно не отличались между группами выживших и умерших пациентов. Как и следовало ожидать, частота ОПП, которое служит одним из проявлений сепсиса и септического шока, была достоверно выше у умерших больных. В то же время разница частоты повреждения печени между двумя группами не достигла статистической значимости.
Заключение
В российских ОРИТ летальность больных SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержки, составила в среднем 65,4%. Летальность в значительной степени зависела от тяжести ОРДС и показаний к госпитализации в ОРИТ. Так, она была значительно выше у пациентов, которых переводили на ИВЛ, особенно при наличии признаков септического шока, и оказалась ниже в регионах Российской Федерации, где, в отличие от Москвы и Московской области, около четверти больных, поступивших в ОРИТ, не нуждались в НИВЛ или ИВЛ. Летальность у пациентов старше 50 лет, особенно мужчин, была выше, чем у больных более молодого возраста. По данным многофакторного анализа Кокса, факторами, ассоциировавшимися с более высоким риском смерти больных тяжелой SARS-CoV-2 пневмонией, осложнившейся ОРДС, были ИБС (инфаркт миокарда и/или вмешательства на коронарных артериях в анамнезе), ожирение (ИМТ≥35 кг/м 2 ) и сахарный диабет 2 типа.