Увеличение активности амилазы в крови более чем 10 раз характерно для
Увеличение активности амилазы в крови более чем 10 раз характерно для
Амилаза панкреатическая – одна из разновидностей амилазы, которая вырабатывается поджелудочной железой.
P-изофермент амилазы, альфа-амилаза панкреатическая, P-амилаза, P-тип амилазы.
Синонимы английские
Pancreatic alpha-amylase, pancreatic AML, P-type amylase, P-type alpha-amylase, amylase isoenzymes, amylase isoforms.
Энзиматический колориметрический метод.
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Амилаза – пищеварительный фермент, который способен расщеплять углеводы.
Наибольшее количество амилазы содержится в слюнных и поджелудочной железах.
Амилаза, которая вырабатывается в поджелудочной железе, – панкреатическая амилаза (P-тип) – входит в состав панкреатического сока. Из поджелудочной железы панкреатический сок, содержащий липазу, через панкреатический проток попадает в двенадцатиперстную кишку, где помогает переварить пищу.
Амилаза слюнных желез – слюнная амилаза (S-тип) – осуществляет переваривание крахмала пищи в ротовой полости.
В норме в крови циркулирует небольшое количество амилазы. При этом около 60 % составляет слюнная амилаза (S-тип), а остальные 40 % – панкреатическая амилаза.
Когда происходит повреждение поджелудочной железы, как при панкреатите, или если панкреатический проток блокируется камнем или опухолью, панкреатическая амилаза (P-тип) начинает в больших количествах попадать в кровоток. Повышения активности слюнной амилазы при этом не происходит.
Небольшие количества амилазы образуются также в яичниках, кишечнике и скелетной мускулатуре.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Возраст
Референсные значения
Причины повышения активности панкреатической амилазы
Причины понижения активности панкреатической амилазы
Что может влиять на результат?
Кто назначает исследование?
Врач общей практики, терапевт, гастроэнтеролог, хирург.
Амилаза общая в сыворотке
Амилаза – один из ферментов пищеварительного сока, который выделяется слюнными железами и поджелудочной железой.
Диастаза, сывороточная амилаза, альфа-амилаза, амилаза сыворотки.
Amy, alpha-amylase, AML, diastase, 1,4-?-D-glucanohydralase, serum amylase, blood amylase.
Кинетический колориметрический метод.
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Амилаза – один из нескольких ферментов, которые вырабатываются в поджелудочной железе и входят в состав панкреатического сока. Липаза расщепляет жиры, протеаза – белки, а амилаза расщепляет углеводы. Из поджелудочной железы панкреатический сок, содержащий амилазу, через панкреатический проток попадает в двенадцатиперстную кишку, где помогает переварить пищу.
В норме только небольшое количество амилазы циркулирует в кровяном русле (из-за обновления клеток поджелудочной железы и слюнных желез) и попадает в мочу. Если происходит повреждение поджелудочной железы, как при панкреатите, или если панкреатический проток блокируется камнем либо опухолью, амилаза начинает в больших количествах попадать в кровоток, а затем в мочу.
Небольшие количества амилазы образуются в яичниках, кишечнике, бронхах и скелетной мускулатуре.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения: 28 — 100 Ед/л.
Причины повышения активности общей амилазы в сыворотке
Причины понижения активности общей амилазы в сыворотке
Что может влиять на результат?
Кто назначает исследование?
Врач общей практики, терапевт, гастроэнтеролог, хирург.
Увеличение активности амилазы в крови более чем 10 раз характерно для
К.А. Никольская (1), Д.С. Бордин (1, 2), Л.В. Винокурова (1), М.В. Малых (1), Е.А. Дубцова (1)
1) Московский клинический научный центр им. А.С. Логинова ДЗМ, Москва, Россия; 2) Тверской государственный медицинский университет, Тверь, Россия
Дифференциальная диагностика заболеваний, приводящих к гиперамилаземии, обширна и разнообразна, и первое заболевание, которое необходимо исключить, – это панкреатит. Чаще всего острый панкреатит и/или обострение хронического панкреатита приводят к гиперамилаземии, которая сопровождается гиперамилазурией (повышением уровня диастазы мочи) и целым симптомокомплексом, главенствующую роль в котором играет боль. Именно поэтому многие врачи при сочетании болей в животе и гиперамилаземии чаще всего ставят диагноз «панкреатит». Всегда ли этот диагноз правомерен? Представленный клинический случай гиперамилаземии у больной целиакией демонстрирует вариабельность заболеваний, сопровождающихся гиперамилаземией, и показывает, насколько важно вовремя и точно установить ее причину.
Для цитирования: Никольская К.А., Бордин Д.С., Винокурова Л.В., Малых М.В., Дубцова Е.А. Гиперамилаземия – всегда ли это панкреатит? Фарматека. 2019;26(2):130–35. DOI: https://dx.doi.org/10.18565/pharmateca.2019.2.130-135
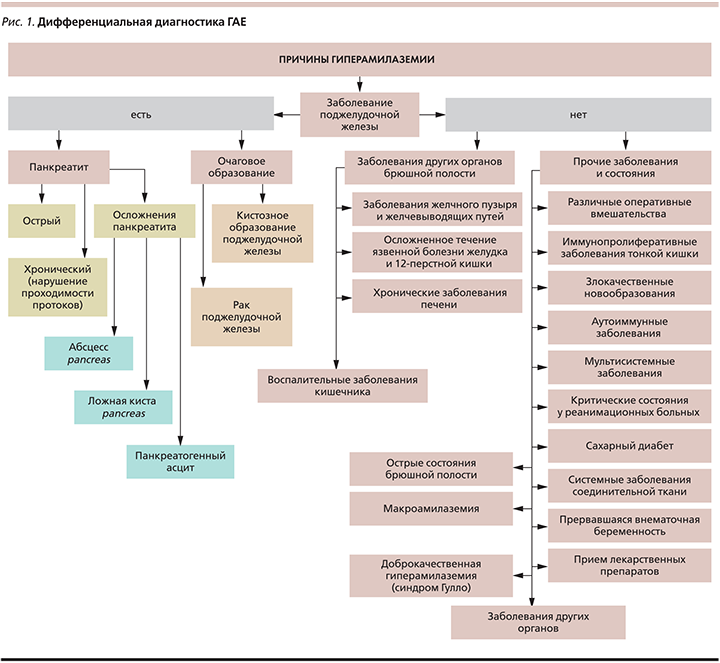
Чаще всего гиперамилаземия (ГАЕ) служит маркером заболеваний поджелудочной железы (ПЖ) – острого панкреатита (ОП), хронического панкреатита (ХП), рака ПЖ. Однако в 8% случаев ГАЕ сочетается с нормальным содержанием амилазы в моче и не сопровождается другими симптомами [1].
Нередко появление ГАЕ врачи расценивают как проявление панкреатита, не обращая внимания на отсутствие каких-либо других проявлений этого заболевания. В настоящее время исследование уровня амилазы в крови входит в рутинный скрининг биохимических анализов, в связи с чем бессимптомная ГАЕ выявляется все чаще, причем стандартные диагностические методы (сбор анамнеза, физикальное обследование, трансабдоминальное ультразвуковое исследование (УЗИ) органов брюшной полости) не всегда выявляют какую-либо патологию, объясняющую лабораторные отклонения. Общепринятого алгоритма диагностического поиска в таких случаях на сегодняшний день не существует [2].
Чтобы не ошибиться в диагнозе при наличии гиперамилаземии, важно помнить, что не всегда ее причиной служат заболевания ПЖ [3–5]. Если при проведении банального УЗИ органов брюшной полости есть изменения, характерные для панкреатита, то необходимо провести более тщательное обследование пациента с применением таких инструментальных исследований, как мультиспиральная компьютерная томография с внутривенным контрастированием, магнитно-резонансная томография и как уточняющий метод – эндоскопическая ультрасонография. Кроме ОП и обострения ХП к ГАЕ могут приводить новообразования ПЖ [6] и ее травмы, а также различные осложнения панкреатита, такие как псевдокисты ПЖ.
В 1964 г. P. Wilding, et al. [7] описали пациента с длительной ГАЕ без клинических проявлений панкреатита. Наличие повышения уровня фермента было объяснено его связыванием с сывороточным глобулином. Через 3 года Р. Berk, et al. [8] описали еще троих пациентов с подобными проявлениями, также без панкреатита, и предложили термин «макроамилаземия» (МАЕ) для обозначения отдельной формы ГАЕ.
По мнению данных авторов, МАЕ возникает вследствие образования и циркуляции в крови комплексов нормальной сывороточной амилазы с белками или углеводами [9]. Данные комплексы имеют большую молекулярную массу, вследствие чего плохо фильтруются почками. Вес молекулы макроамилазы может составлять от 150 тыс. до 2 млн Д, тогда как молекулярный вес обычной молекулы амилазы человека составляет 50–55 тыс. Д [10]. Крупные молекулы задерживаются в кровотоке, что подтверждается высоким уровнем амилазы в крови и низким уровнем амилазы в моче [11, 12]. МАЕ встречается у 0,1% всей популяции [13] и описана у 2,9% госпитализированных пациентов [14–16]. Таким образом, МАЕ может быть причиной ГАЕ неуточненной этиологии [17]. По данным многоцентровых исследований, у 6–9,6% пациентов с ГАЕ, выявленной при рутинном обследовании, диагностируется МАЕ [18, 19].
При таких ситуациях клинические проявления могут отсутствовать, а пациенты длительно безрезультативно обследуются с проведением высокотехнологичных, нередко инвазивных методик. При сочетании МАЕ с болями в животе пациентам могут выполнять диагностические оперативные вмешательства [20].
В исследовании Н.Б. Губергриц и соавт. (2007) [12] показано, что МАЕ встречается у 11% больных ХП. У 3–5% пациентов с повышенным уровнем сывороточной амилазы имела место МАЕ. Сочетание ГАЕ и соотношения клиренсов амилазы и креатинина 2 SD выше контрольного). Средние уровни общей амилазы и макроамилазы были значительно повышены в обеих группах больных целиакией. Уровни неосажденной амилазы (фракция амилазы ПЖ и слюны) не отличались от таковых в контрольной группе. У 3 (3,4%) здоровых лиц, 21 (16,8%) пациента с нелеченой целиакией и 7 (7%) пациентов на АГД была значительно повышена активность макроамилазы [31].
В исследовании 2006 г., проведенном в Италии (Палермо) с участием 90 взрослых пациентов и 112 детей с целиакией, были оценены показатели изоамилазы ПЖ и липазы в сыворотке крови до начала АГД и спустя 12 месяцев на фоне ее соблюдения. В подгруппе взрослых были проанализированы уровни эластазы сыворотки и трипсина. Кроме того, выполнено УЗИ поджелудочной железы. Установлено, что на момент постановки диагноза целиакии у 26 (29%) взрослых и 29 (26%) детей выявлено повышение уровня амилазы и/или липазы; уровень трипсина был повышен в 69% случаев, эластазы – в 19%. Частота повышения уровней ферментов ПЖ была сходной для пациентов с «типичными» и «атипичными» симптомами целиакии, а также в случаях ее бессимптомного течения. В основном выявлялось повышение уровня ферментов до двух нормальных значений. Данные изменения не были связаны с употреблением алкоголя, наркотических препаратов, а также с наличием болевого синдрома и сахарного диабета. УЗИ органов брюшной полости показало отсутствие патологических изменений со стороны ПЖ во всех случаях. Через 12 месяцев соблюдения АГД повышение уровня амилазы ПЖ выявлено в 3 случаях, а липазы – в 2; следует отметить, что эти пациенты не в полной мере придерживались АГД [32].
Таким образом, ГАЕ может сопровождаться не только ОП и ХП, но и ряд других состояний (рис. 1).
Клинический случай
Больная С. 55 лет в августе 2018 г. была госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова с диагнозом ХП.
При поступлении пациентка предъявляла жалобы на периодически возникающий дискомфорт в правом подреберье, сухость во рту, вздутие и урчание в животе, склонность к задержке стула.
Анамнез заболевания
Из анамнеза известно, что в 1981 г. больной был поставлен диагноз «первичное бесплодие». Однако в 1990 г. она родила в срок здорового ребенка. Беременность протекала с анемией (гемоглобин – 90 г/л на фоне приема препаратов железа). В 2016 г. пациентка отметила появление дискомфорта в животе и обратилась в поликлинику по месту жительства, где при обследовании выявлена ГАЕ до 3–4 норм. При УЗИ – умеренные диффузные изменения ПЖ, при эзофагогастродуоденоскопии (ЭГДС) – хронический гастрит. На основании полученных данных был установлен диагноз «хронический панкреатит, обострение». Пациентке предложено стационарное лечение, от которого она отказалась. В течение последующих 2 лет проводилась терапия полиферментными препаратами в минимикросферах в суточной дозе 125 тыс. ЕД липазы, спазмолитиками, 1 раз в 3–4 месяца проводился контроль уровня амилазы крови, увеличение которого 3–4 раза выше нормального сохранялось. Кроме того, за последние полтора года вес пациентки снизился на 8 кг.
Данные физикального обследования
Общее состояние удовлетворительное. Кожные покровы и видимые слизистые оболочки обычной окраски и влажности, тургор кожи снижен, пониженного питания (индекс массы тела 18,3 кг/м2). В легких дыхание везикулярное, хрипов нет, частота дыханий 16 в минуту. Частота сердечных сокращений 68 в минуту. Артериальное давление – 130/90 мм рт. ст. Живот не вздут, при пальпации мягкий, безболезненный. Печень у края реберной дуги. Селезенка не пальпируется.
Диагностика
По данным лабораторных исследований, отмечено повышение уровня амилазы крови до 411 ЕД/л (норма до 100 ЕД/л) с сохранением нормального уровня амилазы мочи, незначительно выраженный цитолиз и снижение уровня сывороточного железа до 4,7 мкмоль/л (табл. 1).
Остальные показатели клинического и биохимического анализов крови в пределах референсных значений.
УЗИ. Размеры печени не увеличены – косой внутренний размер правой доли 133 мм (норма до 150 мм), толщина левой доли 58 мм (норма до 60 мм), контур ровный. Эхоструктура паренхимы печени неоднородная, эхогенность незначительно повышена, сосудистый рисунок не изменен.
Воротная вена не расширена – 11 мм, просвет однороден. Объемных образований не выявлено. Внутрипеченочные желчные протоки не расширены. Общий желчный проток 4 мм в диаметре, на доступном осмотру участке его просвет однороден. Желчный пузырь с перетяжками в теле и дне, в размерах не увеличен – 98×18 мм, стенки не утолщены. Содержимое пузыря однородное, конкременты не определяюттся. Паравезикальная область не изменена.
ПЖ обычной формы, контуры четкие, ровные. Размеры: головка 27 мм (норма до 30 мм), тело 14 мм (норма до 20 мм), хвост 23 мм (норма до 35 мм). Эхоструктура ткани ПЖ неоднородная, эхогенность незначительно повышена. Главный панкреатический проток не расширен.
Селезенка не увеличена – 83×32 мм, контур ровный, ткань однородная. Селезеночная вена не расширена.
В желудке неоднородное жидкостное содержимое. Свободной жидкости в брюшной полости не выявлено.
Заключение: ультразвуковые признаки незначительных диффузных изменений печени, ПЖы, деформации желчного пузыря.
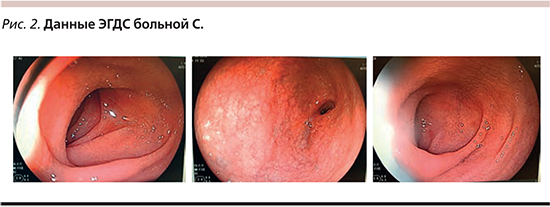
ЭГДС. Слизистая оболочка бульбодуоденального перехода отечная, имеет «мозаичный» рисунок, далее в вертикальной части 12-перстной кишки слизистая оболочка истончена, складки не визуализируются, в нисходящей части 12-перстной кишки слизистая оболочка отечная, складки местами сглажены, перистальтика активная (рис. 2).
Заключение: дуоденит – эндоскопическая картина наиболее соответствует целиакии.
Пациентке была выполнена биопсия залуковичного отдела 12-перстной кишки. В биоптате фрагменты слизистой оболочки тонкой кишки. Кишечные ворсины сглажены. Поверхность слизистой оболочки, сохранившаяся на небольшом протяжении, выстлана клетками эпителия кубической формы. Количество бокаловидных клеток снижено. Число межэпителиальных лимфоцитов увеличено (до 35 на 100 эпителиоцитов). Глубина крипт увеличена. Соотношение ворсина/крипта не превышает 1:1, часть – разрушены и деэпителизированы с поверхностными эрозиями. Строма сильно инфильтрирована лимфоцитами, плазмоцитами с примесью нейтрофилов и эозинофилов. Собственная пластинка отечна и умеренно инфильтрирована лимфоцитами и плазмоцитами. Умеренная гиперплазия бруннеровых желез.
Заключение: морфологическая картина более соответствует глютеновой энтеропатии, MARSH IIIа. Хронический активный эрозивный дуоденит.
Также было выполнено иммунологическое исследование, которое обнаружило повышение титра антител к тканевой трансглутаминазе IgA в 10 раз, к деамидированным пептидам глиадина IgG – более чем в 6 раз, к деамидированным пептидам глиадина IgA – в 8 раз (табл. 2).
Заключительный диагноз
На основании вышепредставленных данных пациентке был выставлен заключительный клинический диагноз «целиакия, латентная форма» и назначена АГД.
Через 3 месяца уровень амилазы крови у пациентки нормализовался, прибавка в весе составила 8 кг.
Заключение
Особенностью представленного клинического случая явилась гипердиагностика ХП. Диагноз был установлен только на основании повышения уровня амилазы крови без каких-либо клинических проявлений и инструментального подтверждения. В течение двух лет больная безуспешно лечилась полиферментными препаратами: ГАЕ сохранялась и продолжалось снижение массы тела. После установления диагноза «целиакия, латентная форма» и назначения АГТ уровень амилазы крови нормализовался и восстановилась масса тела.
Подобные наблюдения представили А. Carroccio, et al. [32], также отметившие нормализацию уровня амилазы крови на фоне соблюдения АГД у больных целиакией.
Литература
1. Тихонова Т.А. Гиперамилаземия – угрожающий симптом или безопасная находка? Бюллетень медицинских интернет-конференций. 2016;6(6).
2. Красновский А.Л., Григорьев С.П., Золкина И.В. и др. Бессимптомная панкреатическая гиперферментемия. Российский медицинский журнал. 2014;5:52–56.
3. Logie J.J., Cox M., Sharkey J. A multidisciplinary approach to an unusual cause of hyperamylasaemia. BMJ CaseRep. 2015;6:2015209780. Doi: 10.1136/bcr-2015-209780.
4. Shah K.S., Shelat V.G., Jogai S., Trompetas V. Primary gallbladder lymphoma presenting with perforated cholecystitis and hyperamylasaemia. Ann R CollSurg Engl. 2016;98(2):13–5. Doi: 10.1308/rcsann.2016.0001.
5. Sinha S., Khan H., Timms P.M., Olagbaiye O.A. Pancreatic-type hyperamylasemia and hyperlipasemia secondary to ruptured ovarian cyst: a case report and review of the literature. J Emerg Med. 2010;38(4):463–66. Doi: 10.1016/j.jemermed.2008.04.042.
6. Matsuura H., et al. Four cases of macroamylasemia malignant tumor. Bull Hygo Cancer Hosp. 1981;12:59.
7. Wilding P., Cooke W.T., Nicholson G.I. Globulin-bound amylase. Ann. Intern. Med. 1964;64:1053–56.
8. Berk J.E., Kizu H., Wilding P., Searcy R.L. Macroamylasemia: a newly recognized cause for elevated serum amylase activity. N Engl J Med. 1967;277:941–46.
9. Губергриц Н.Б., Лукашевич Г.М., Загоренко Ю.А.Макроамилаземия – безобидное заблуждение или опасное незнание? Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2007;5:64–70.
10. Levitt M.D. Study of macroamylase complexes. J Lab Clin Med. 1972;80:414–22.
11. Haubrich W.S., Schaffner F., Berk J.E. Macroamylasemia. Bockus gastroenterology.5th ed. Philadelphia: WB Saunders, 1995.P. 2851–60.
12. Губергиц Н.Б., Голубова О.А. Макроамилаземия у больных с хроническим панкреатитом. Вопросы реконструктивной и пластической хирургии. 2014;1(48):75–80.
13. Imrie C.W., King J., Henderson A.R. Macroamylasemiae survey of prevalence in a mixed population. N Engl J Med. 1972;287–931.
14. Barrows D., Berk J.E., Fridhandler L. Macroamylasemiae survey of prevalence in a mixed population. N Engl J Med. 1972;286:1352.
15. Berk J.E., Fridhandler L. The prevalence of macroamylasemia. Further study. Am J Gastroenterol 1974;62:54–8.
16. Boyle C.E.L., Fraser C.G. Macroamylasaemia: how common is it? Br Med J. 1985;291;1389.
17. Gubergrits N., Golubova O., Lukashevich G., Fomenko P. Elevated serum amylase in patients with chronic pancreatitis: Acute attack or macroamylasemia? Pancreatology. 2014;14:114–16. Doi: 10.1016/j.pan.2013.12.004.
19. Warshaw A.L., Hawboldt M.M. Puzzling persistent hyperamylasemia, probably neither pancreatic nor pathologic. Am J Surg. 1988;155:453–56.
20. Губергриц Н.Б., Лукашевич Г.М., Загоренко Ю.А.Макроамилаземия – безобидное заблуждение или опасное незнание? Сучасна гастроентерологія. 2006;6(32):93.
21. Mifflin T.E., Benjamin D.C., Bruns D.E. Rapid quantitative, specific measurement of pancreatic amylase in serum with use of a monoclonal antibody. Clin Chem. 1985;31(8):1283–88.
22. Mifflin T.E., Forsman R.W., Bruns D.E. Interaction of immobilized anti-salivary amylase antibody with human macroamylases: implications for use in a pancreatic amylase assay to distinguish macroamylasemia from acute pancreatitis. Clin Chem. 1989;35:1651–54.
23. LottJ A., Ellison E.C. Amylase assay and diagnosis of pancreatic disease
24. Anunann R.W., Berk J.E., Fridhandler L., et al. Hyperamylasemia with carcinoma of the lung. Ann Intern Med. 1973;78:521–25.
25. Warshaw A.L., Lee K.H. Characteristic alterations of serum isoenzymesofamylase in diseasesofliver, pancreas,salivarygland,lung, and genitals. J Surg Res. 1977;22:362–69.
26. Gao T., Eto K., Nakayama J., et al. Abnormalamylasein a patient with malignant tumor. Med Biol (Tokyo). 1971;82:53–6.
27. Ishizuka T., Yasuda K., Kajita K., et al. Macroamylasemiaassociated with thyroid cancer, elevated serum thyroxine-binding globulin(TBG),chronic pancreatitis, and gastrointestinal polyposis. Gastroenterol Jpn. 1986;21:385–90.
28. Blumstein M., Bank S., Greenberg R.E., et al. Immunoproliferative small intestinal disease in an American patient with lymphoma and macroamylasemia. Gastroenterology. 1992;103(3):1071–74.
29. Katsanos K.Н., Kolios G., Tsianos G.V., Tsianos E.V.Hyperamylasemia in inflammatory bowel disease: report of a case with literature review. Ann Gastroenterol. 2004;17(3):306–12.
30. Katz S., Bank S., Greenberg R.E., et al. Hyperamy lasemia in inflammatory bowel disease. J Clin Gastroenterol. 1988;10(6):627–30.
31. Rabsztyn A., Green P.H.R., Berti I., et al. Macroamylasemia in patients with coeliac disease. Am J Gastroenterol. 2001;96:1096–100.
32. Carroccio A., Di Prima L., Scalici C., et al. Unexplained elevated serum pancreatic enzymes: a reason to suspect celiac disease. Clin Gastroenterol Hepatol. 2006;4(4):455–59.
Анализ крови на амилазу – это исследование венозной крови для определения концентрации в ней этого фермента. Количество амилазы служит индикатором состояния и работы поджелудочной. В комплексе с результатами других исследований помогает оценить углеводный обмен. Кровь на анализ сдается натощак после 10-12-ти часов голодания. Полчаса непосредственно перед сдачей необходимо отказаться от курения, исключить физическое перенапряжение стресс.
Общие сведения
Фермент является составляющей частью панкреатического сока, отвечает за расщепление углеводов. В крови в норме концентрация фермента небольшая. Панкреатический сок поступает в двенадцатиперстную кишку и участвует в процессе переваривания пищи. Наличие фермента в крови в норме объясняется обновлением клеток, в которых он содержится. Поступление амилазы в кровь в большом количестве чаще всего вызвано блокированием панкреатического протока (например, новообразованием или камнями) либо значительным повреждением поджелудочной.
Данный тест имеет высокое значение в диагностике панкреатита и ряда других заболеваний, при которых поджелудочная вовлекается в патологический процесс. Часто назначается совместно с анализом крови на липазу (фермент, который отвечает за расщепление жиров). Также результаты теста используются для мониторинга состояния больных с онкологией, которая затрагивает поджелудочную; оценки результатов хирургического вмешательства.
Показания к исследованию
Данный тест назначается в следующих случаях:
Расшифровка результатов
Норма общей амилазы составляет 28-100 Ед/л. Концентрация панкреатического фермента интерпретируется с учетом общего количества амилазы. Наиболее распространенной причиной завышенных показателей является панкреатит. При остром заболевании показатели могут превышать норму в 6-10 и более раз. Она сохраняется высокой в течение 3-5-ти дней. Если показатели в несколько раз выше нормы, скорее всего боль вызвана повреждением поджелудочной. Необходимо учитывать, что у некоторых пациентов с острым панкреатитом активность фермента остается в пределах нормы или повышается незначительно. По результатам данного теста нельзя судить о тяжести заболевания. Например, если гибнет большая часть клеток, вырабатывающих фермент, его активность остается в пределах нормы. При хроническом заболевании показатели сначала повышаются, а в дальнейшем постепенно снижаются. Чаще всего хроническое заболевание развивается у алкоголиков. Увеличения количества фермента может объясняться и другими причинами (например, злокачественным новообразованием поджелудочной, перитонитом, беременностью).
Снижение количества фермента наблюдается у пациентов с высоким холестерином, тяжелым гепатитом, снижением функциональных возможностей поджелудочной, муковисцидозом.
Для получения интерпретации результатов и дальнейших рекомендаций необходимо обращаться к врачу. Во многих случаях при нарушении показателей пациенту требуется немедленная медицинская помощь. Самолечение недопустимо, так как может стать причиной необратимых патологических изменений в организме.