Усиление кардиотонического эффекта это что
Кардиотонические средства. Средства, стимулирующие сердце
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Глава 18. Кардиотонические средства
Кардиотонические средства повышают сократимость миокарда (силу сокращений сердца); применяются при сердечной недостаточности.
Сердечная недостаточность характеризуется нарушением сократительной функции миокарда и снижением сердечного выброса, что приводит к ухудшению кровоснабжения органов и тканей. При сердечной недостаточности сердце неспособно перекачивать кровь в таком количестве, чтобы обеспечить потребность тканей в кислороде, в результате нарушаются условия для их нормального функционирования.
К развитию сердечной недостаточности приводят:
По скорости развития заболевания различают острую и хроническую сердечную недостаточность. Острая сердечная недостаточность — это тяжелое нарушение кровообращения, которое может осложняться отеком легких, развивается быстро (иногда в течение нескольких минут). При этом требуется быстрое медикаментозное вмешательство. Хроническая сердечная недостаточность развивается медленно (месяцы, годы), при этом временами возможны проявления острой сердечной недостаточности.
В зависимости от локализации различают недостаточность левых или правых отделов сердца (предсердий, желудочков).
При левожелудочковой сердечной недостаточности сердце неспособно перекачивать всю кровь из венозной системы в артериальную, повышается венозное давление, возникает застой крови в большом и малом круге кровообращения, снижается сердечный выброс и ухудшается кровоток в органах и тканях. Снижение почечного кровотока стимулирует высвобождение ренина и как следствие образование ангиотензина II и альдостерона, который вызывает задержку в организме натрия и воды. В результате развиваются отеки подкожной клетчатки и внутренних органов. Недостаточное кровоснабжение тканей приводит к их гипоксии, проявляющейся одышкой, цианозом кожных покровов и слизистых оболочек и постепенным развитием дистрофии органов. Вследствие повышения венозного давления и снижения сердечного выброса возникает рефлекторная тахикардия.
Кардиотонические средства, повышая силу сокращений миокарда, увеличивают сердечный выброс и улучшают кровоснабжение органов и тканей, нормализуют почечный кровоток и уменьшают задержку жидкости в организме, снижают венозное давление, ликвидируют застой крови в венозной системе. В результате исчезают отеки, одышка, восстанавливается функция внутренних органов. Кардиотонические средства, которые в настоящее время используются в клинической практике, повышают сократимость миокарда вследствие увеличения концентрации ионизированного кальция (Са 2+ ) в цитоплазме кардиомиоцитов. Ионы Са 2+ связываются с тропонином С тропонин-тропомиозинового комплекса кардиомиоцитов и, изменяя конформацию этого комплекса, устраняют его тормозное
влияние на взаимодействие актина и миозина. В результате происходит образование большего числа актинмиозиновых комплексов, что приводит к усилению мышечного сокращения.
Кардиотонические средства подразделяют на:
18.1. СЕРДЕЧНЫЕ ГЛИКОЗИДЫ
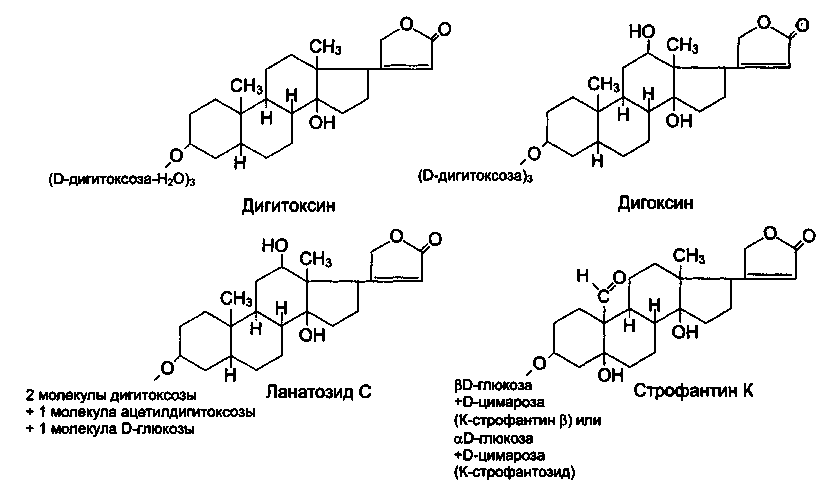
Дигитоксин, дигоксин (Ланоксин, Ланикор, Диланацин), ланатозид С (Целанид, Изоланид), уабаин (Строфантин К), коргликон.
Сердечные гликозиды относятся к соединениям стероидной структуры, выделенным из растительного сырья. Настои наперстянки, содержащие сердечные гликозиды, издавна использовались в народной медицине для устранения отеков и чувства перебоев в работе сердца. В клинической медицине эти средства впервые были успешно использованы в конце XVIII века У. Уитерингом у больных с сердечной недостаточностью. Открытие кардиотонического и мочегонного свойств препаратов наперстянки по значимости до сих пор считается одним из важнейших в медицине.
Сердечные гликозиды получают из растительного лекарственного сырья, в частности, из различных видов наперстянки (пурпуровой, ржавой и шерстисто»), из строфанта (гладкого, Комбе), ландыша, морского лука и др.
Сердечные гликозиды состоят из несахаристой части (агликона или генина) и Сахаров (гликона). Агликон имеет стероидную структуру (циклопентанпер-гидрофенантрена) и у большинства гликозидов связан с ненасыщенным лактановым кольцом. Структура агликона определяет фармакодинамические свойства сердечных гликозидов, в том числе их главное действие – кардиотоническое. Растворимость в воде, липидах и, как следствие, способность всасываться в кишечнике, биодоступность, способность к кумуляции, экскреция определяются сахаристой частью, которая оказывает также влияние на активность и токсичность сердечных гликозидов.
Сердечные гликозиды, действуя на миокард, вызывают следующие основные эффекты.
Положительный инотропный эффект (от греч. inos — волокно, мускул; tropos — направление) – увеличение силы сердечных сокращений (усиление и укорочение систолы). Этот эффект связан с прямым действием сердечных гликозидов на кардиомиоциты.
Отрицательный хронотропный эффект (от греч. chronos – время) – урежение сокращений сердца и удлинение диастолы, связанное с усилением парасимпатических влияний на сердце (повышением тонуса вагуса). Отрицательное хронотропное действие сердечных гликозидов устраняется атропином. Вследствие урежения сердечных сокращений и удлинения диастолы создаются условия, благоприятствующие восстановлению энергетических ресурсов миокарда во время диастолы. Устанавливается более экономный режим работы сердца (без увеличения потребления миокардом кислорода).
Отрицательный дромотропный эффект (от греч. dromos — дорога). Сердечные гликозиды оказывают как прямое, так и связанное с повышением тонуса вагуса угнетающее влияние на проводящую систему сердца. Сердечные гликозиды угнетают проводимость атриовентрикулярного узла, уменьшают скорость проведения возбуждения от синусового узла («водителя ритма») к миокарду. В токсических дозах сердечные гликозиды могут вызвать полный атриовентрикулярный блок.
В больших дозах сердечные гликозиды повышают автоматизм кардиомиоцитов (повышается автоматизм в волокнах Пуркинье), что может привести к образованию эктопических (дополнительных) очагов возбуждения и появлению дополнительных внеочередных сокращений (экстрасистол).
В небольших дозах сердечные гликозиды снижают порог возбудимости миокарда в ответ на стимулы (увеличивают возбудимость миокарда – положительный батмотропный эффект, от греч. eathmos — порог). В больших дозах сердечные гликозиды понижают возбудимость.
Препараты сердечных гликозидов получают из растительного сырья. В медицинской практике применяют индивидуальные сердечные гликозиды и их полусинтетические производные, а также галеновые и новогаленовые препараты (порошки, настои, настойки, экстракты).
Сердечные гликозиды различаются не только по их биологической активности, но и по фармакокинетическим свойствам (скорости и степени всасывания, характеру элиминации), а также по способности к кумуляции при повторном введении. Различаются они по скорости развития эффекта и продолжительности действия.
Дигитоксин – гликозид, содержащийся в листьях наперстянки пурпуровой
Назначают дигитоксин внутрь в виде таблеток при хронической сердечной недостаточности и наджелудочковых тахиаритмиях. Препарат начинает действовать через 2—4 ч (латентный период) после приема, максимальный эффект отмечается через 8—12 ч, продолжительность действия после однократно введенной дозы составляет 14-21 день. Так как дигитоксин в значительной степени связывается с белками, медленно инактивируется и выводится из организма, он обладает выраженной способностью к материальной кумуляции.
Дигоксин — гликозид наперстянки шерстистой
различными. Биодоступность дигоксина при введении внутрь составляет 60-85%. Дигоксин в меньшей степени, чем дигитоксин связывается с белками плазмы крови (на 25-30%). Метаболизируется дигоксин только в небольшой степени и в неизмененном виде (70—80% от принятой дозы) выводится почками; t — 32-48 ч. У больных с хронической почечной недостаточностью почечный клиренс дигоксина снижается, что требует уменьшения дозы.
Дигоксин — основной препарат сердечных гликозидов в клинической практике. Дигоксин применяется при наджелудочковых тахиаритмиях (мерцательная аритмия предсердий, пароксизмальная тахикардия). Антиаритмическое действие препарата связано с угнетением атриовентрикулярной проводимости, вследствие чего уменьшается количество импульсов, поступающих от предсердий к желудочкам и нормализуется ритм сокращений желудочков. При этом не происходит устранения аритмии предсердий. Назначают дигоксин внутрь и внутривенно. Дигоксин применяют при хронической и острой (вводят внутривенно) сердечной недостаточности. При хронической сердечной недостаточности препарат назначают внутрь в виде таблеток. Кардиотонический эффект при приеме внутрь развивается через 1—2 ч и достигает максимума в течение 8 ч. При внутривенном введении действие наступает через 20—30 мин и достигает максимума через 3 ч. Действие после прекращения приема препарата при ненарушенной функции почек продолжается от 2 до 7 дней. В связи с меньшей способностью связываться с белками и более быстрым по сравнению с дигитоксином выведением из организма дигоксин меньше кумулирует.
Для лечения хронической сердечной недостаточности дигоксин применяют в дозах, обеспечивающих стабильную терапевтическую концентрацию в крови (0,8-2 нг/мл). При этом вначале назначают нагрузочную («насыщающую») дозу, а затем малые поддерживающие дозы. Индивидуальная «насыщающая» суточная доза сердечных гликозидов — доза, при которой достигается оптимальный эффект без признаков интоксикации. Эта доза достигается эмпирически и может не совпадать со средней «насыщающей» суточной дозой, рассчитанной по массе тела для большинства больных. При достижении «насыщения» (уменьшение частоты сердечных сокращений до 60—70 уд./мин, уменьшение отеков и одышки) используются индивидуальные поддерживающие дозы. Определение концентраций дигоксина в крови (мониторинг) позволяет оптимизировать дозирование препарата и предупредить появление токсических эффектов.
При невозможности проведения мониторинга достижение «насыщения» проводится с использованием специальных схем дигитализации (быстрая и медленная дигитализация) при постоянном ЭКГ-контроле. Наиболее безопасна и поэтому более распространена медленная схема дигитализации (малыми дозами в течение 7-14 дней).
Ланатозид С- первичный (генуинный) гликозид из листьев наперстянки шерстистой (Digitalis lanata), по химической структуре, физико-химическим и фармакокинетическим свойствам сходен с дигоксином. При введении внутрь всасывается несколько в меньшей степени (биодоступность составляет 30-40%). Связывается с белками плазмы крови на 20—25%. Метаболизируется с образованием дигоксина и метаболитов. Выводится почками в неизмененном виде, в виде дигоксина и метаболитов, t — 28-36 ч. Показания к применению такие же, как у дигоксина. Оказывает более «мягкий» эффект (лучше переносится пожилыми больными).
Строфантин – сердечный гликозид, выделенный из семян строфанта гладкого (Strophantus gratus) и строфанта Комбе (Strophantus Kombe) является полярным соединением, практически не всасывается из желудочно-кишечного тракта. Поэтому препарат вводят внутривенно. Действие строфантина начинается через 5—10 мин, достигая максимума через 15—30 мин. Выводится почками в неизмененном виде. Полностью выводится из организма в течение 24 ч. Строфантин практически не связывается с белками плазмы крови и не кумулирует в организме. Препарат оказывает быстрое и короткое действие, превосходит по активности препараты наперстянки. Применяют при острой сердечной недостаточности, вводят внутривенно медленно в растворе глюкозы.
Коргликон – препарат, содержащий сумму гликозидов из листьев ландыша (Convallaria majalis). По характеру действия и фармакокинетическим свойствам близок к строфантину. Оказывает несколько более продолжительное действие. Применяют при острой сердечной недостаточности. Вводят внутривенно медленно (в растворе глюкозы).
Сердечные гликозиды обладают небольшой широтой терапевтического действия, поэтому токсическое действие сердечных гликозидов (гликозидная интоксикация) проявляется довольно часто.
При передозировке сердечных гликозидов возникают как кардиальные, так и экстракардиальные нарушения. Основные кардиальные эффекты гликозидной интоксикации:
Наиболее частой причиной смерти при интоксикации сердечными гликозидами является фибрилляция (мерцание) желудочков. При этом возникают беспорядочные несинхронные сокращения отдельных пучков мышечных волокон с частотой 450—600 в минуту, вследствие чего сердце перестает функционировать.
Основные некардиальные эффекты гликозидной интоксикации:
Кроме того, отмечаются утомляемость, мышечная слабость, головная боль,
кожные высыпания.
Факторами, повышающими риск возникновения интоксикации, являются гипокалиемия и гипомагнийемия.
Для устранения токсических эффектов сердечных гликозидов применяют:
В качестве антидота при интоксикации препаратами наперстянки (дигоксин, дигитоксин) используют препарат антител к дигоксину (Дигибинд).
18.2. КАРДИОТОНИЧЕСКИЕ СРЕДСТВА НЕГЛИКОЗИДНОЙ СТРУКТУРЫ
Препараты негликозидной структуры появились в клинической практике в 80-е гг. Надежды на то, что эти кардиотонические средства заменят сердечные гликозиды при хронической сердечной недостаточности не оправдались, так как их длительное применение сопровождалось повышением летальности. Поэтому в настоящее время они в основном применяются кратковременно при острой сердечной недостаточности.
К кардиотоническим средствам негликозидной структуры относятся:
а) стимуляторы р^адренорецепторов сердца (рх-адреномиметики)
Добутамин (Добутрекс), допамин (Дофамин, Допмин);
б) ингибиторы фосфодиэстеразы
Милринон.
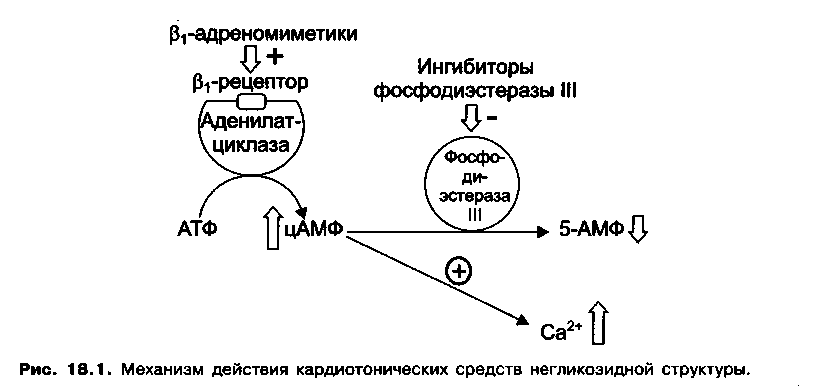
Добутамин – относительно избирательно стимулирует β1-адренорецепторы миокарда (рис. 18.1), вследствие чего повышает силу и частоту сердечных сокращений (при этом частота сокращений повышается в меньшей степени). Препарат вводят внутривенно (капельно) при острой сердечной недостаточности. Из побочных эффектов возможны: тахикардия, аритмия.
Допамин — препарат дофамина, который является предшественником норадреналина. Допамин стимулирует β1-адренорецепторы сердца и повышает силу и частоту сердечных сокращений. Кроме того, стимулирует дофаминовые рецепторы, что приводит к расширению сосудов почек, сосудов внутренних органов. Это действие допамина проявляется уже в небольших дозах. В высоких дозах допамин стимулирует α1-адренорецепторы, вызывает сужение периферических сосудов и повышение артериального давления.
Применяют допамин при кардиогенном шоке, септическом шоке. Вводят внутривенно капельно. Препарат может вызвать тошноту, рвоту, сужение периферических сосудов, тахикардию, при превышении дозы – аритмии.
Милринон – ингибитор фосфодиэстеразы III (фосфодиэстеразы цАМФ) вызывает увеличение внутриклеточной концентрации цАМФ, предотвращая его превращение в 5-АМФ (рис. 18.1). Это приводит к повышению концентрации ионов Са 2+ в кардиомиоцитах и усилению сокращений миокарда. Оказывает сосудорасширяющее действие. Показанием к применению является острая сердечная недостаточность. Вследствие выраженных побочных эффектов, в том числе способности вызывать аритмии (аритмогенное действие), препарат используют редко.
Взаимодействие кардиотонических средств с другими лекарственными средствами
Витамины для сердца: список лучших
Витамины для сердца (кардиотрофические препараты) одна из наиболее распространенных групп препаратов в детской и взрослой кардиологии. Механизм действия данных препаратов очень разнообразен и направлен на различные этапы развития болезни.
Метаболические препараты, они же витамины для сердца, применяются при различных заболеваниях, таких как: ревматизм, кардиты, кардиомиопатии, ИБС, миокардиодистрофии или вторичные кардиопатии. Они также используются при лечении нарушений ритма сердца, таких как: наджелудочковые и желудочковые экстрасистолии, блокады ножек пучка Гисса, пароксизмальные тахикардии, нарушения реполяризации и прочее.
Данная группа препаратов применяется также и в спорте с целью коррекции нарушений сердечно-сосудистой системы, вызванных интенсивной физической нагрузкой. Эти нарушения зачастую имеют и свое название – «спортивное сердце».
Название данных заболеваний могут вам показаться незнакомыми, но они вас могут знать вас. По распространенности заболевания сердечно-сосудистой системы занимают первое место. Отсюда становится понятно, что и распространенность препаратов для лечения сердца и сосудов очень велика. Прежде чем перейти к списку лучших витаминов для сердца, необходимо разобраться на что они влияют и как оказывают благоприятный эффект для сердца.

Как витамины влияют на сердце
Механизм действия витаминов для сердца:
Препараты для сердца, которые можно считать лучшими
А теперь можно ознакомиться с лучшими кардиотрофическими препаратами (витаминах для сердца):
Данные препараты назначаются курсом, чаще всего, не менее 1 месяца. В ряде случаев используется ступенчатая терапия ( переход с внутривенного или внутримышечного пути введения лекарственного средства на обычный прием в виде таблеток). Режим дозирования и длительность терапии в каждом случае индивидуальны и назначаются лечащим врачом с учетом данных обследований.
Данные препараты назначаются курсом, чаще всего, не менее 1 месяца. Перед применением проконсультируйтесь у специалиста.
Берегите сердце
Человек представляет собой организм, который состоит из различных систем. Одной из самых уязвимых является сердечно-сосудистая система. Появление таких симптомов, как усталость, вялость, сердцебиение, одышка, колющие боли в грудной клетке, бледность или синюшность кожи может указывать на патологию со стороны сердечно-сосудистой системы и требует незамедлительной консультации врача-кардиолога.
Только после проведения дополнительных лабораторных и инструментальных методов исследования (ЭКГ, ЭхоКГ, Холтер ЭКГ, АД; тредмилл-тест, тилт-тест и т.д.) выставляется окончательный диагноз и назначается лечение. Витамины для сердца являются лишь частью лечения и применяются в составе комплексной терапии для лечения заболеваний.
Усиление кардиотонического эффекта это что
О недостаточности того или иного органа мы обычно говорим, когда он не в состоянии в полном объеме выполнять свои функции. Функция сердца заключается в выбросе в аорту количества крови, адекватного потребностям организма. Таким образом, сердечная недостаточность (СН) может быть определена как нарушение структуры и функции сердечной мышцы, ведущее к неспособности переносить кислород в том количестве, которое необходимо для тканевого метаболизма [12].
Основной причиной является повреждение миокарда, ведущее к патологическому ремоделированию желудочка вследствие расширения камеры и нарушения сократимости. Эти изменения приводят к снижению сердечного выброса, уменьшению перфузии органов и активации компенсаторных нейрогормональных систем [39].
Главными проявлениями сердечной недостаточности являются одышка и утомляемость. Эти симптомы могут ухудшить функциональные возможности и качество жизни пациентов [8].
Если объем поражения достаточно велик, то в первый момент произойдет падение выброса крови из левого желудочка и снижение ее давления на стенки аорты и крупных сосудов. Это приведет к активации расположенных там барорецепторов. Ответом будет немедленная активация симпато-адреналовой системы (САС). Стимуляция находящихся в сердце β-рецепторов ведет к увеличению ЧСС и повышению сократимости миокарда. Стимуляция находящихся в стенке сосудов рецепторов катехоламинами вызывает реакцию централизации кровотока, а за счет спазма вен увеличивается возврат крови к сердцу во время диастолы [39].
Активация САС ведет к активации ренин-ангиотензин-альдостероновой системы (РААС) [3, 12].
Ренин является ферментом превращающим физиологически неактивный ангиотензиноген в ангиотензин-1. Последний под влиянием ангиотензинпревращающего фермента превращается в одно из наиболее биологически активных веществ – ангиотензин-2. Его образование существенно усиливает спазм сосудов, обусловленный реакцией централизации кровотока. Помимо вазоконстрикции ангиотензин-2 вызывает рост клеток, способствует апоптозу и,что важно в данном случае, увеличивает синтез альдостерона. Альдостерон способствует реабсорбции жидкости в дистальных отделах нефрона. Таким образом, возникающая в ответ на повреждение миокарда активация САС и РААС приводит к постепенному накоплению избытка жидкости в организме. Этот процесс требует времени и достигает клинически значимого эффекта только спустя несколько суток после острой сердечной катастрофы [12].
Несмотря на серьезные достижения в лечении хронической сердечной недостаточности, терапия острой сердечной недостаточности остается практически неизменной. В частности, лечение острой сердечной недостаточности во многом основывается не на доказательной медицине, а на эмпирических данных [15].
Острая сердечная недостаточность (ОСН) – синдром, характеризующийся застойными явлениями по малому и/или большому кругу кровообращения вследствие увеличения давления наполнения левого желудочка с или без уменьшения сердечного выброса. Риск смерти и повторной госпитализации больных ОСН после выписки из стационара остаётся высоким и составляет от 10 до 20%, и от 20 до 30% – в течение180 дней, соответственно [15].
Если отбросить все остальное, то все, что требует организм от сердца, это поддержать кровоток на должном уровне. Сердечный выброс (СВ) – это производное частоты сердечных сокращений (ЧСС) и ударного объема (УО) сердца (объема крови, выталкиваемого из желудочков в ходе каждого сокращения). Увеличение ЧСС является важным ранним компенсаторным механизмом, нормальным ответом сердца на снижение СВ. У здоровых молодых людей СВ возрастает при росте ЧСС до 170–180 уд./мин, а затем начинает снижаться (так как продолжительность диастолы становится слишком короткой для того, чтобы обеспечить достаточное наполнение желудочков). У пожилых пациентов с дисфункцией сердца падение СВ наблюдается при ЧСС менее 150 уд./мин. Имеется три основных фактора, определяющих УО желудочков: преднагрузка, постнагрузка и сократимость миокарда [10, 34].
Преднагрузка характеризует напряжение стенки желудочка в конце диастолы (при максимальном наполнении сердца перед сокращением). Это напряжение трудно измерить, а в качестве «суррогата» (или максимально приближенного показателя) обычно используется конечно-диастолическое давление (КДД). Эта величина определяется венозным возвратом и дает представление о давлении заполнения желудочков [7].
Сократимость — работа, производимая сердцем на данном уровне преднагрузки и постнагрузки. Определяется максимальной скоростью, с которой желудочек может генерировать изменение давления за единицу времени. Понятие «инотропизм» используется для объяснения усиления работы, выполняемой сердцем, независимо от ЧСС, преднагрузки и постнагрузки [7].
Постнагрузка — это напряжение, которое должно быть сгенерировано в стенке желудочка для того, чтобы выбросить кровь во время систолы в артериальную систему. Этот показатель находится под сильным влиянием сопротивления артерий — системного сосудистого сопротивления [7].
В интактном сердце длина мышечных волокон пропорциональна конечному диастолическому объему (КДО) желудочков. Поэтому увеличение наполнения желудочков во время диастолы (или рост преднагрузки) вызывает рост силы последующего сокращения и увеличение УО и СВ. Вот почему факторы, способствующие увеличению объема внутрисосудистой жидкости (а именно – задержка натрия и воды) являются одними из основных компенсаторных механизмов СН. В этом случае увеличение объема внутрисосудистой жидкости приводит к росту венозного возврата к обоим желудочкам, увеличению их КДО и, в конце концов, к повышению УО. Исходя из того, что увеличение преднагрузки способствует росту УО и СВ, можно было бы предположить, что лечение, направленное на повышение объема внутрисосудистой жидкости, было бы полезным в тех случаях, когда функция желудочков угнетена. Но основная проблема такого «лечения» заключается в том, какой именно объем внутрисосудистой жидкости необходим для оптимальной преднагрузки и как его определить у конкретного пациента [10].
В начальной стадии СН снижение сократимости желудочка компенсируется повышением преднагрузки (КДО и КДД), что приводит к нарастанию ударного объема; кроме того, увеличивается частота сердечных сокращений (ЧСС). По мере прогрессирования СН повышение КДД в желудочке все меньше сказывается на ударном объеме; вместе с тем растет давление в венах малого и большого круга кровообращения, вызывая симптомы застоя. Повышается напряжение в стенке желудочка и снижается коронарный кровоток в диастолу, вследствие ухудшается энергетический баланс миокарда [2].
Сопряжение возбуждения и сокращения в миокарде
Когда мембранный потенциал достигает уровня –65 мВ, открываются потенциалзависимые кальциевые каналы L-типа, обеспечивающие формирование входящего кальциевого тока, который ускоряет деполяризацию кардиомиоцитов. В результате активируются потенциалзависимые кальциевые ионные каналы мембраны T-трубочек и рианодиновые рецепторы саркоплазматического ретикулума. Резкое повышение концентрации ионов кальция в саркоплазме устраняет тропомиозиновую блокаду взаимодействия актина и миозина и запускает процесс сокращения кардиомиоцитов. Следовательно, сократимость сердечной мышцы непосредственно зависит от силы входящего кальциевого тока [3, 5]. Существует и другой механизм поступления больших количеств ионов кальция в цитоплазму рабочего кардиомиоцита при его возбуждении. Он обеспечивается сопряженным транспортом ионов кальция и натрия через мембрану, то есть натрий-кальциевым обменом. Во время диастолы натрий-кальциевая помпа активно удаляет из клетки ионы кальция в обмен на ионы натрия. При возбуждении кардиомиоцита направление натрий-кальциевого обмена меняется на противоположное: ионы кальция активно переносятся в клетку, тогда как ионы натрия, напротив, удаляются, и в результате концентрация ионов кальция в цитоплазме кардиомиоцита возрастает [5, 26].
Комплекс актина и тропонина
Несмотря на то, что ионы кальция, соединяясь с ТрС (тропонин С), дают сигнал к запуску цикла поперечных мостиков, есть доказательства, что начинается не только сигнальный процесс включения-выключения. Чтобы понять роль кальция, нужно описать молекулярную структуру комплекса актина и тропонина. Тонкие филаменты состоят из двух актиновых частей, сплетенных в спираль; обе части находятся на более тяжелой молекуле тропомиозина, которая играет роль стержня. С равными интервалами к этим закручивающимся структурам прикреплены три регуляторных белка, называемых тропониновым комплексом. ТрС состоит из короткого N-концевого домена и четырех кальций?связывающих EF-рук, объединенных попарно в глобулярный N-концевой и С-концевой домены [6, 20].
Распространение потенциала действия по мышечному волокну в начале систолы приводит к выходу ионов кальция из саркоплазматического ретикулума и повышению концентрации свободного кальция в цитоплазме. Присоединение кальция ко второй EF-руке ТрС приводит к изменению конформации всего N-концевого домена белка. При этом появление на поверхности N-концевого домена ТрС гидрофобной области, с которой связывается регуляторный домен ТрI (тропонин I). Он перемещается на новое место на тонком филаменте, ослабляя таким образом взаимодействие между ТрТ (тропонин Т) и тропомиозином. В результате тропомиозин перемещается по тонкому филаменту, и устраняется торможение, оказываемое тропомиозином на взаимодействие актина и миозина [6, 20].
АТФ как источник энергии для сокращения
Сокращение сердечной мышцы происходит благодаря скольжению тонких актиновых филаментов относительно толстых миозиновых. Данный процесс обеспечивается за счет циклического АТФ-зависимого взаимодействия миозина и актина. Миозин связывает и гидролизует АТФ до АДФ и неорганического фосфата, но при этом практически не способен избавляться от накопившихся в активном центре продуктов АТФазной реакции. Головка миозина, содержащая в своем составе АДФ и фосфат, способна слабо взаимодействовать с актином, что активирует процесс освобождения фосфата из активного центра миозина. Освобождение неорганического фосфата (а вслед за этим и АДФ) из активного центра миозина сопровождается изменением ориентации «шейки» головки миозина, протягиванием нити актина относительно головки миозина и развитием натяжения. Связывание новой молекулы АТФ приводит к диссоциации миозина от актина и после гидролиза АТФ происходит очередное циклическое присоединение головки миозина к актину и осуществляется новый «шаг» миозина по актину [3].
В цикле поперечных мостиков АТФ выполняет две разные роли:
1) гидролиз АТФ поставляет энергию для движения поперечного мостика;
2) связывание (но не гидролиз) АТФ с миозином сопровождается отделением миозина от актина и создает возможность повторения цикла поперечных мостиков [1].
Миозиновая АТФазная активность реагирует на воздействие кальция следующим образом: во время цикла сокращения сердца концентрация кальция повышается, что ведет к повышению миозиновой АТФазной активности в несколько раз, а также к повышению присоединения кальция к ТрС [3].
Подходы к лечению сердечной недостаточности
Подходы к лечению сердечной недостаточности менялись неоднократно. В 50-60 годах 20 века основной терапией считали инотропную стимуляцию сердца, в 70-х упор делался на борьбу с задержкой жидкости, в 80-е надежды связывали с уменьшением нагрузки на сердце за счет использования вазодилататоров, в 80-х годах синтезировала ингибитор фосфодиэстеразы III (ФДЭ III), за двойной эффект – инотропное и вазодилатирующее, названное инодилататорами. Начиная с 90-х основой лечения стало подавление избыточной активации нейрогуморальных систем [12].
Механизм действия инотропных препаратов
Препараты, обычно используемые для достижения положительного иноторопного эффекта, включают катехоламины, напр. добутамин, и ингибиторы ФДЭ III, напр. милринон. У этих веществ разные точки приложения, но они, в конечном счете, запускают каскад событий, приводящих к улучшению сократимости путем увеличения концентрации внутриклеточного кальция. Взаимодействие катехоламинов с β1-адренорецепторами на поверхности кардиомиоцитов активирует аденилатциклазу, катализирующую превращение АТФ в цАМФ. цАМФ активирует протеинкиназу А, которая, в свою очередь, фосфорилирует внутриклеточные субстраты, включая потенциалзависимые кальциевые каналы L-типа, фосфоламбан, ТрI. Фосфорилирование потенциалзависимых кальциевые каналов L-типа стимулирует поступление кальция в цитозоль. Это является триггером для открытия рианодиновых рецепторов саркоплазматического ретикулума и мышечного сокращения (положительное инотропное действие катехоламинов и ингибиторов ФДЭ III). В то же время фосфорилирование фосфоламбана активирует SERCA2, что приводит к обратному захвату кальция саркоплазматическим ретикулумом во время диастолы. Это обусловливает люзитропный эффект катехоламинов и ингибиторов ФДЭ III. Также фосфорилирование ТрI уменьшает сродство миофиламентов к кальцию и способствует релаксации. Сердечные гликозиды, напр. дигоксин, селективно и обратимо ингибируют сарколеммальную натрий-калиевую АТФазу кардиомиоцитов, повышая т.о. концентрацию натрия внутри клетки, что, в свою очередь, ингибирует выкачивание кальция из клетки натрий-кальциевой помпой. Омекатив мекарбил – новый препарат – активатор миозина. Активирует миозиновую АТФазу [26, 32, 33].
За исключением дигоксина, не оказывающего эффекта на общую смертность, имеющиеся препараты с положительным инотропным действием, включая агонисты β1-адренорецепторов, ингибиторы ФДЭ III, оказались вредны для долгосрочного лечения СН, т.к. они могут способствовать развитию злокачественных желудочковых тахиаритмий и увеличить риск внезапной сердечной смерти. Также короткосрочное применение ингибиторов ФДЭ III ассоциируется с частым возникновением таких осложнений, как фибрилляция предсердий, гипотензия, особенно если у пациента имеется ишемия миокарда ввиду ишемической кардиомиопатии. Причины столь разочаровывающих открытий кроются в том, что, несмотря на различные точки приложения, все эти препараты усиливают сократимость миокарда путем увеличения внутриклеточного уровня цАМФ в кардиомиоцитах или благодаря его усиленному синтезу (при приеме агонистов β1-адренорецепторов), или снижению скорости его деградации (при приеме ингибиторов ФДЭ III), что усиливает высвобождение кальция из саркоплазматического ретикулума в цитозоль. Увеличение внутриклеточного кальция, в свою очередь, ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [17].
Инотропные препараты существенно увеличивают энергетические затраты кардиомиоцитов. Увеличение внутриклеточного кальция ведет к временному улучшению сократимости миокарда ценой увеличения потребления миокардом энергии и потребности в кислороде, что в итоге ведет к клеточной смерти. Более того, увеличение концентрации цАМФ и изменение обмена кальция кардиотоксичны и могут привести к нарушениям ритма [19].
Было проведено значительное количество исследований, направленных на поиск нового инотропного препарата, действие которого не имеет под собой увеличения кальция в клетке. В теории такой препарат должен был усиливать сократимость без увеличения потребности миокарда в кислороде и без риска возникновения аритмий. Т.к. связь между уровнем внутриклеточного кальция и взаимодействием миофиламентов может быть нарушена ввиду таких патофизиологических состояний, как ишемия, ацидоз, сепсис или гипотермия, разрабатываемый препарат должен был укреплять эту связь, но не изменять внутриклеточную концентрацию кальция. Все «сенситизаторы кальция», включая левосимендан, пимобендан, EMD 57033, ORG 30029, MCI-154 и другие, имеют способность усиливать сократимость миокарда путем увеличения чувствительности миофиламентов к кальцию с различной интенсивностью, с помощью различных механизмов и точек приложения и различной степенью одновременного ингибирования фосфодиэстеразы III. Среди этих препаратов левосимендан наиболее эффективен в лечении хронической и острой левожелудочковой недостаточности [20].
Регистрационное свидетельство препарату левосимендан впервые было предоставлено в 2000 году в Швеции. В настоящее время левосимендан обладает
регистрационным свидетельством в более чем 50 странах по всему миру, при
этом установлено, что на декабрь 2014 года более 800 000 пациентов получили
инфузию препарата в рамках рутинной клинической практики [14].
Левосимендан – сенситизатор кальция, инодилататор, разработанный для внутривенного применения у пациентов, госпитализированных с острой декомпенсированной сердечной недостаточностью (ОДСН). Фармакологические действия левосимендана включают:
а) повышение сократимости сердца благодаря сенситизации тропонина С к кальцию;
б) вазодилатацию вследствие открытия калиевых каналов саркоплазматической мембраны в гладкомышечных клетках сосудов;
в) кардиопротекцию благодаря открытию митохондриальных калиевых каналов в кардиомиоцитах [25, 26, 31].