Урикозурическое действие что это такое
Урикозурическая активность лозартана: значение для клиники
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Урикозурическая активность означает способность лекарственного средства понижать уровень мочевой кислоты или уратов в сыворотке, увеличивая ее экскрецию почками. Хотя существуют противоречивые мнения [1], но умеренная урикозурическая активность может быть выгодна при лечении больных с гипертензией, поскольку гиперурикемия может быть независимым фактором риска сердечно–сосудистых событий (некоторые авторы считают ее лишь маркером сосудистых и почечных заболеваний) [2]. Если же урикозурическая активность препарата слишком велика, это может привести к неблагоприятным последствиям в виде острой уратной нефропатии или подагры. Лозартан – антагонист ангиотензина II (АIIА) – обладает умеренной урикозурической активностью, что может быть полезно для пациентов с гипертонией. Урикозурическая активность лозартана Несколько исследований показали, что урикозурическая активность лозартана связана преимущественно с самим лозартаном, а не с его активным метаболитом E–3174, так как E–3174 не влияет на выведение мочевой кислоты [3]. Таким образом, урикозурическая активность лозартана – следствие особенностей молекулярной структуры исходной молекулы, а не механизма его действия (блокады АТ1–рецептора). На урикозурическую активность лозартана не влияют сдвиги в балансе натрия, и поэтому она не опосредуется изменениями в ренин–ангиотензиновой системе [4]. Механизм урикозурического действия лозартана изучали на препаратах мембраны человеческой почки [5]. Были идентифицированы механизмы тубулярной реабсорбции урата (уратно–анионный обмен) и секреции урата (потенциал–чувствительная транспортная система) [6]. Хотя исходная молекула может оказывать достаточно сильный урикозурический эффект, но только 4% от введенной дозы фактически выделяется через почки. Таким образом, только малая часть исходного лекарственного средства достигает места своего действия в почках, что может объяснять небольшую урикозурическую активность лозартана. Кроме того, урикозурическое действие лозартан является уникальным, не характерным для целого класса препаратов (остальные AIIA не обладают таким действием) [7]. Клинические исследования Урикозурическая активность лозартана впервые была описана Nakashima et al. у здоровых людей [8]. Они сообщили о небольшом (двукратном), преходящем и дозозависимом урикозурическом действии лозартана, которое начинается через 4 часа после приема лозартана и сохраняется в течение 1 недели. Затем Burnier et al. [9] показали, что назначение лозартана (100 мг) нормотензивным добровольцам, находящимся на диете с высоким или низким содержанием соли, увеличивает выделение мочевой кислоты и понижает ее уровень в сыворотке. серологический мочевых кислот. Лозартан увеличивал экскрецию фракции мочевой кислоты приблизительно втрое [4] – почти настолько же, как и тикринафен [10]. Однако абсолютное выделение уратов после приема лозартана [9] было относительно небольшим (11,1 мкM/л), тогда как после лечения тикринафеном [10] – значительно выше (47,5 мкM/л). A. Ribeiro et al. изучали урикозурическое действие лозартана у больных гипертензией. Через 12 часов после последнего приема пищи им назначали водную нагрузку (10 мл/кг). Две группы по 7 пациентов в каждой получали одну дозу лозартана (50 или 100 мг в зависимости от группы). Измерялись исходные уровни мочевой кислоты в крови и моче, а также pH мочи. Анализы мочи собирали каждый час в течение 6–часового периода для определения pH и уровня мочевой кислоты. В конце исследования определяли уровень мочевой кислоты в крови. Обе дозы лозартана увеличивали экскрецию мочевой кислоты и уменьшали ее уровень в плазме (рис. 1 и 2). Увеличение экскреции мочевой кислоты начиналось через 1 час после приема лозартана. После приема 100 мг лозартана выделение мочевой кислоты достигало максимального уровня через 2–3 часа, а затем снижалось. Хотя увеличение экскреции мочевой кислоты было более выраженным после приема 100 мг лозартана, оно также наблюдалось и после приема 50 мг лозартана. Уровни мочевой кислоты в плазме снизились через 6 часов после приема лозартан. Этот эффект также был выраженнее в группе 100 мг лозартана. При использовании обеих доз произошло увеличение pH мочи, которое начиналось через 1 час и сохранялось в течение 6–часового периода наблюдения (рис. 3). Это увеличение pH представляется важным, поскольку оно может предотвращать осаждение мочевой кислоты с образованием камней в почках и мочевых путях. Данное исследование показало, что урикозурическое действие лозартана длится не более 6 часов, подтверждая отсутствие подобного действия у активного метаболита лозартана E–3174. Таким образом, урикозурическое действие лозартана, в отличие от его гипотензивного эффекта, не продолжается 24 часа, будучи связанным с выделением лозартана через почки. Эти результаты согласуются с предыдущими данными [3,4].
Рис. 3. Динамика pH мочи после приема лозартана
Безопасность и переносимость
Умеренная урикозурическая активность лозартана изучалась при анализе данных двойных слепых и открытых исследований о безопасности лозартана у пациентов с гипертензией. Эти исследования показали, что длительное лечение лозартаном приводит к очень небольшому снижению сывороточного уровня мочевой кислоты на 0,2–0,4 мг/дл (то есть, на 3–6%) [11]. Исследование безопасности (S. Shahinfar et al.) было выполнено у гипертоников с бессимптомной гиперурикемией, получавших гидрохлоротиазид (ГХТ). Результаты не выявили увеличения дигидроурата (первичного фактора риска кристаллообразования) при лечении лозартаном в монотерапии или в комбинации с ГХТ [12]. Это исследование показало, что увеличение экскреции мочевой кислоты сочеталось с ростом pH мочи. Авторы предлагают этот факт в качестве объяснения для уменьшения дигидроурата и риска кристаллообразования.
Лозартан и гидрохлоротиазид
В США приблизительно 20–30% больных гипертонией получают ГХТ, который в умеренных дозах может приводить к гиперурикемии. Поэтому для клинической практики представляется интересным сочетание лозартана с мочегонными средствами. В мультицентровом исследовании пациентам, у кого ГХТ в дозе 25 мг в течение 4 недель не приводил к адекватному контролю артериального давления (АД), двойным слепым методом дополнительно назначали: лозартан в дозе 25, 50 или 100 мг, или плацебо 1 раз в день в течение 12 недель [13]. Снижение диастолического АД во всех группах, получавших лозартан, было больше, чем в группе плацебо. Кроме того, нивелировалось уменьшение калия в сыворотке, обычно связываемое с приемом ГХТ. У получавших лозартан пациентов произошло умеренное, но статистически значимое, тогда как в группе ГХТ наблюдалось его увеличение. Таким образом, урикозурическое действие лозартана может полностью нивелировать вызванное диуретиками увеличение сывороточного уровня мочевой кислоты.
Гиперурикемия наблюдается у 25–50% больных с нелеченной гипертонией. Этот фактор риска независимо и значимо ассоциирован с развитием гипертонии [14–17], коронарной болезни сердца и инфаркта миокарда [18,19], нарушением толерантности к глюкозе [20], дислипидемиями и общей смертностью. Хотя в заключении Coronary Drug Project [22] значится, что причинно–следственные отношения здесь не могут быть установлены из–за связей гиперурикемии с несколькими другими факторами риска сердечно–сосудистых событий, однако гиперурикемия может быть отражением гипертензионного поражения сосудов и раннего вовлечения сосудов почек [2]. В целом, роль мочевой кислоты, как фактора риска сердечно–сосудистых заболеваний, не вызывает сомнений. Влияет ли благоприятно снижение уровня мочевой кислоты в крови на сердечно–сосудистую заболеваемость и смертность, еще предстоит выяснить. Однако обсуждавшиеся данные свидетельствуют в пользу того, что гипотензивный препарат с умеренным урикозурическим действием может обеспечить дополнительный благоприятный эффект при гипертонии.
Лозартан является единственным антагонистом ангиотензина II, обладающим умеренной урикозурической активностью. Этот факт имел бы особую значимость, если мочевая кислота действительно служит независимым фактором риска сердечно–сосудистых заболеваний, но пока это остается гипотезой. С клинической точки зрения, урикозурическая активность лозартана важна, поскольку она корригирует частое среди гипертоников патологическое состояние и помогает избежать развития подагры. Кроме того, можно ожидать некоторую выгоду от этого действия лозартана у пациентов, кототрые получают гидрохлоротиазид и поэтому могут иметь гиперурикемию. И, наконец, урикозурическая активность лозартана может сделать его привлекательным средством для лечения застойной сердечной недостаточности, часто связываемой с увеличением уровня мочевой кислоты в крови.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Подготовил к.м.н. А.Н. Николаев
по материалам Artur B. Ribeiro, M.D., Ph.D. Uricosuric Activity of Losartan: What is the Clinical Benefit? // Receptors in cardiovascular disease, vol. 5: № 3.
1. Foley RJ, Weiman EJ. Urate nephropathy. Review. AM J Med Sci, 1984; 288(5):208-211.
2. Messerli FH, Frohlich E, Dreslinski GR et al. Serum uric acid in essential hypertension: An indicator of renal vascular involvement. Ann Intern Med, 1980; 93(6):817-821.
3. Sweet CS, Bradstreet DC, Berman RS et al. Pharmacodynamic activity of intravenous E-3174, an angiotensin II antagonist, in patients with essential hypertension. Am J Hypertens 1994; 7(12):1035-1040.
4. Burnier M, Waeber B, Brunner HR. Clinical pharmacology of the angiotensin II receptor antagonist losartan potassium in healthy subjects. J Hypertens 1995; 13(suppll):S23-S28.
5. Burnier M, Roch-Ramel F, Brunner HR. Renal effects of angiotensin II receptor blockade in normotensive subjects. Kidney Int, 1996; 49(6):1787-1790.
6. Roch-Ramel F, Werner D, Guisan B. Urate transport in brush-border membrane of human kidney. Am J Physiol, 1994; 266(5 Pt 2):F797-F805.
7. Burnier M, Hagmann M, Nussberger I et al. Short-term and sustained renal effects of angiotensin II receptor blockade in healthy subjects. Hypertension, 1995; 25(4p 1):602-609.
8. Nakashima M, Uematsu T, Kosuge K. Pilot study of the uricosuric effect of DuP-753, a new angiotensin II receptor antagonist, in healthy subjects. Eur J Clin Phamacol, 1992; 42(3):333-335.
9. Burnier M, Rutschmann B, Nussberger J et al. Salt-dependent renal effects of an angiotensin II antagonist in healthy subjects. Hypertension, 1993; 22(3): 339-347.
10. Lau K, Stote RM, Goldberg M, Agus ZS. Mechanisms of the uricosuric effect of the diuretic tienilic acid (ticrynafen) in man. Clin Sci Mol Med, 1977; 53(4): 379-386.
11. Данные компании MSD.
12. Shahinfar S, Simpson R, Carides A et al. Safety of losartan in hypertensive patients with asymptomatic hyperuricemia. (abstract) JASN, 1997; 8:322.
13. Softer BA, Wright IT Ir, Pratt JH et al. Effects of losartan on a background of hydrochlorothiazide in patients with hypertension. Hypertension 1995; 26(1):112-117.
14. Klein R, Klein BE, Comon IC et al: Serum uric acid. Its relationship to coronary heart disease risk factors and cardiovascular disease in Evans County, Georgia. Arch Intern Med, 1973;132(3):401-410.
15. Kobel F, Gregorova I, Sonka J.: Hyperuricaemia in hypertension. Lancet, 1965; 1:519-520.
16. Kinsey D, Walther R, Sise HS et al. Incidence of hyperuricaemia in 400 hypertensive patients. Circulation, 1961; 24:972-973.
17. Kahn HA, Medalie IH, Neufeld HN et al. The incidence of hypertension and associated factors: The Israeli ischemic heart disease study. Am Heart J 1972; 84(2):171-182.
18. Mortality findings for stepped-care and referred-care participants in the hypertension detection and follow-up program, stratified by other risk factors. The Hypertension Detection and Follow-up Program Cooperative Research Group. Prev Med, 1985; 14(3):312-335.
19. Bengtsson C, Lapidus L, Stendahl C et al. Hyperuricaemia and risk of cardiovascular disease and overall death. A 12 year follow-up of participants in the population study of women in Gothenburg, Sweden. Acta Med Scand 1988; 224(6):549-555.
20. Reaven GM. Syndrome X: 6 years later. J Intern Med Suppl 1994; 736:13-22.
21. Marinoff SC, Lempert P, Mandel EE. Association of hypercholesterolemia with hyperuricaemia. A review of the literature. Chicago Med Quart 1962; 22:135-148.
22. The Coronary Drug Project Research Group. Serum uric acid: Its association with other risk factors and with mortality in coronary heart disease. J Chron Dis 1976; 29:557-569.
Диагностика и лечение подагрического артрита
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислот
Подагра — хроническое прогрессирующее заболевание, связанное с нарушением пуринового обмена, которое характеризуется повышением мочевой кислоты в крови и отложением в тканях опорно-двигательного аппарата и внутренних органах натриевой соли мочевой кислоты (уратов) с развитием рецидивирующего острого артрита и образованием подагрических узелков (тофусов).
Подагра относится к «старым» болезням и известна со времен глубокой древности. Термин «подагра» происходит от греческих слов pus, что означает стопа, и agra — захват. Таким образом, уже в названии заболевания подчеркивается одно из кардинальных проявлений подагрического артрита. Подагра рассматривается не только как недуг, при котором патологический процесс локализуется в опорно-двигательном аппарате, но и как системное заболевание, характеризующееся поражением жизненно важных органов, и прежде всего почек. Распространенность подагры в различных регионах варьирует в широких пределах и во многом связана с особенностями питания населения, составляя в среднем 0,1%. В США этот показатель равен 0,84% (возможно, эта цифра завышена).
Подагрой болеют преимущественно мужчины (отношение мужчины/женщины составляет 9:1). У мужчин и в норме наблюдается более высокий уровень мочевой кислоты. У женщин репродуктивного возраста повышенное содержание эстрогенов способствует увеличению почечного клиренса уратов. В постменопаузальном периоде уровень мочевой кислоты у них такой же, как и у мужчин соответствующего возраста. Поэтому, если пик заболеваемости у мужчин падает на возраст 35–50 лет, то у женщин — на 55–70 лет. Однако подагра может развиваться и в более молодом возрасте и отмечается даже у детей.
Как известно, мочевая кислота является конечным продуктом расщепления пуринов и выделяется из организма почками. У здоровых лиц за 24 ч выделяется с мочой 400–600 мг мочевой кислоты. Для понимания патогенеза подагры следует остановиться на клиренсе мочевой кислоты. Он характеризует объем крови, способный очиститься в почках от мочевой кислоты за 1 мин. В норме этот показатель равен 9 мл/мин. Источником образования мочевой кислоты в организме являются пуриновые соединения, которые поступают с пищей или образуются в организме в процессе обмена нуклеотидов. В плазме крови мочевая кислота находится в виде свободного урата натрия. В норме верхняя граница этого показателя для мужчин составляет 0,42 ммоль/л (7 мг%) и для женщин — 0,36 ммоль/л (6 мг%). Содержание мочевой кислоты выше этих цифр расценивается как гиперурикемия и рассматривается в качестве фактора высокого риска развития подагры. Так, по данным Фремингемского исследования, развитие подагрического артрита наблюдается у 17% мужчин и женщин с урикемией 7,0–7,9 мг%, у 25% — с 8–8,9 мг% и у 90% — при уровне мочевой кислоты выше 9,0 мг%.
При наличии стойкого повышения мочевой кислоты в сыворотке крови выше для данного индивидуума уровня она начинает откладываться в тканях в виде свободного урата натрия, который в мочевых путях переходит в мочевую кислоту.
Выделяются следующие клинические варианты подагры:
Гиперурикемия может длительное время протекать без каких-либо субъективных и объективных симптомов и лишь случайно диагностироваться при обследовании больного. Однако она не столь безобидна, как это может показаться на первый взгляд, и нередко ассоциируется с нарушениями жирового и углеводного обмена, а также, что еще более серьезно, приводит к уратной нефропатии. Следует отметить условность дефиниции «асимтоматическая подагра». Для ее выявления необходимо повторно исследовать уровень мочевой кислоты, особенно у «подагрической личности», т. е. у мужчин молодого возраста с пристрастием к алкоголю, ожирением и артериальной гипертонией. В некоторых случаях период асимптоматической (химической) гиперурикемии длится несколько лет и только после этого происходит клиническая презентация подагры. Следует иметь в виду, что гиперурикемии обычно предшествует гиперурикозурия. Поэтому у больных с мочекислым диатезом нужно повторно исследовать уровень мочевой кислоты не только в крови, но и в моче с целью своевременного выявления подагры.
Содержание мочевой кислоты в крови может повышаться под влиянием различных факторов, как внутренних, так и внешних. Эти факторы способствуют либо увеличению образования эндогенных пуринов, либо замедлению их выделения почками. С этих позиций выделяют два типа гиперурикемии — метаболический и почечный. Метаболический тип характеризуется повышением синтеза эндогенных пуринов при наличии высокой урикозурии и нормальном клиренсе мочевой кислоты. Напротив, при почечном типе наблюдается низкий клиренс мочевой кислоты и, следовательно, нарушение выделения мочевой кислоты почками. Представленные типы гиперурикемии имеют первостепенное значение в выборе противоподагрических модифицирующих болезнь препаратов, используемых в терапии этого заболевания.
Причины повышенного биосинтеза пуринов
Нозологические формы и клинические синдромы:
Лекарства, диета и хронические интоксикации:
Причины замедления выведения мочевой кислоты почками
Нозологические формы и клинические синдромы:
Лекарства и хронические интоксикации:
Выделяют также первичную и вторичную подагру. При первичной подагре какое-либо фоновое заболевание, предшествующее ее развитию, отсутствует. В основе такой подагры лежит семейно-генетическая аномалия пуринового обмена, детерминированная несколькими генами, или так называемый «конституциональный диспуризм». Исследования уратного гомеостаза показали аутосомно-доминантный тип наследования таких аномалий. В частности, это наблюдается при врожденных нарушениях в содержании энзимов, занимающих ключевое положение в метаболизме пуринов. Так, при снижении активности гипоксантин-гуанин-фосфорибозилтрансферазы происходит увеличение ресинтеза пуринов из нуклеотидов, что способствует развитию синдрома Леша-Найхана. Этот синдром встречается только у детей и у лиц молодого возраста и обычно заканчивается уратной нефропатией с летальным исходом. При высоком содержании фосфорибозилпирофосфата также наблюдается метаболический тип гиперурикемии, так как этот фермент участвует в синтезе предшественников мочевой кислоты. Что касается вторичной подагры, то она является одним из синдромов другого заболевания, «второй болезнью», развивающейся при многих патологических процессах и чаще всего при хронической почечной недостаточности.
Большое значение в распознавании подагры, особенно ее ранней стадии, имеет клиническая картина острого подагрического артрита. Она хорошо известна, однако частота диагностических ошибок в первый год заболевания достигает 90%, а через 5–7 лет правильный диагноз ставится только в половине случаев. Поздняя диагностика связана с недооценкой классических ранних признаков заболевания, а также с многообразием дебюта и течения подагры. Ее диагностика строится на особенностях клинической картины заболевания, повышенного содержания мочевой кислоты в крови и обнаружения кристаллов урата натрия в тканях. На практике широко применяются следующие так называемые Римские диагностические критерии подагры:
Диагноз подагры считается достоверным при наличии любых двух из четырех критериев.
Менее распространены диагностические критерии подагры, предложенные Американской коллегией ревматологов (АСК) в 1977 г., которые скорее характеризуют острый воспалительный артрит или его рецидивирующие атаки, нежели подагру в целом. Согласно этим критериям, достоверный диагноз ставится при наличии 6 из 12 признаков:
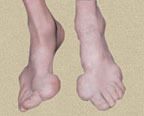
В первые 3–4 года подагра протекает по типу рецидивирующего острого воспалительного моноартрита с полным обратным развитием и восстановлением функции суставов, при этом межприступный период продолжается от нескольких месяцев до 1–2 лет. В дальнейшем этот период укорачивается, в процесс вовлекаются все новые и новые суставы и воспалительные явления локализуются не только в суставах стоп, но распространяются на суставы верхних конечностей, что обычно совпадает с образованием тофусов. Тофусы представляют собой депозиты кристаллов мочевой кислоты. Они появляются в среднем спустя 6 лет после первого приступа подагры, но иногда и через 2–3 года. Ураты чаще всего откладываются на поверхности суставного хряща, в синовиальной оболочке, синовиальных влагалищах, сухожилиях, а также в субкортикальной области эпифизов костей. Наиболее часто они располагаются на ушных раковинах и на задней поверхности локтевых суставов. Тофусы подразделяются на единичные и множественные, а также классифицируются в соответствии с их размерами, при этом к мелким относят тофусы до 1 см в диаметре, к средним — от 1 до 2,5 см и к крупным — более 2,5 см. Подагрические узлы с локализацией в опорно-двигательном аппарате являются основным элементом формирования хронического подагрического артрита. Тофусы могут располагаться в почках и других висцеральных органах.
Хроническое течение подагры не ограничивается только вовлеченностью суставов и формированием тофусов, но и характеризуется поражением внутренних органов. Подагрическая нефропатия является наиболее важным с прогностической точки зрения проявлением подагры и самой распространенной причиной летальных исходов при этом заболевании. Среди отдельных вариантов подагрической нефропатии выделяют острую мочекислую блокаду канальцев почек, мочекислый нефролитиаз, обусловленный отложением солей мочевой кислоты в чашечках и лоханках почек, хроническую уратную нефропатию и диффузный гломерулонефрит. Острая мочекислая блокада канальцев почек происходит, например, при распаде опухоли вследствие массивной медикаментозной или рентгенотерапии. Хроническая уратная нефропатия связана с отложением уратов в интерстиции почек, а развитие диффузного гломерулонефрита — с иммунными нарушениями у лиц с дисрегуляцией пуринового обмена. Такой гломерулонефрит по своей иммуноморфологии чаще всего является мезангиопролиферативным и при нем выявляют депозиты IgG и комплемента. Следует иметь в виду, что подагра часто ассоциируется с такими патологическими состояниями, как артериальная гипертония, ожирение, гиперлипидемия, жировая дистрофия печени, атеросклероз, нарушения мозгового кровообращения, алкогольная зависимость.
Течение подагры характеризуется разнообразием темпов развития болезни. Возможно относительно доброкачественное течение с редкими приступами, небольшой гиперурикемией и урикозурией и длительным сохранением функциональной недостаточности опорно-двигательного аппарата. В других случаях, напротив, с самого начала заболевания наблюдаются частые атаки острого артрита с сильными болями или непрерывные атаки с множественным поражением суставов на протяжении нескольких недель или месяцев (подагрический статус). Рефрактерное к проводимой терапии течение подагры приводит к быстрому развитию функциональной недостаточности суставов и почек.
В основе выделения вариантов течения подагры лежат: количество приступов артрита в течение года, число пораженных суставов, выраженность костно-хрящевой деструкции, наличие тофусов, патология почек и ее характер.
Варианты течения подагры
Легкое: приступы артрита 1–2 раза в год и захватывают не более 2 суставов, нет поражения почек и деструкции суставов, тофусы отсутствуют или они единичные и не превышают 1 см в диаметре.
Средней тяжести: 3–5 приступов в год, поражение 2–4 суставов, умеренно выраженная костно-суставная деструкция, множественные мелкие тофусы, поражение почек ограничено почечно-каменной болезнью.
Тяжелое: частота приступов более 5 в год, множественное поражение суставов, множественные тофусы крупных размеров, выраженная нефропатия.
Основными задачами терапии подагрического артрита являются:
Купирование острого подагрического артрита проводится противовоспалительными средствами. Для этих целей используются: колхицин — колхицин, колхикум-дисперт; нестероидные противовоспалительные препараты (НПВП) — вольтарен, дикловит, диклоран, целебрекс, мовалис); кортикостероиды — полькортолон, преднизолон, метилпреднизолон; или комбинация НПВП и кортикостероидов — амбене. Как колхицин, так и НПВП способствуют обратному развитию острого артрита в течение нескольких часов, в то время как у не прошедших лечение больных он может длиться несколько недель. До недавнего времени полагали, что лучшим препаратом для купирования приступа острого артрита при подагре является колхицин. Ярко выраженный и быстрый (в течение 48 ч) эффект колхицина рассматривался как один из диагностических признаков этого заболевания. Колхицин способен предупредить дальнейшее развитие острого приступа подагры при его назначении в первые 30–60 мин атаки. Его лечебное действие обусловлено угнетением фагоцитарной активности нейтрофилов. При остром приступе подагры мононатриевые соли уратов, фагоцитированные нейтрофилами, приводят вследствие мембранолитического их действия к гибели этих клеток и высвобождению лизосомальных ферментов, которые отвечают за развитие острого воспаления.
Из НПВП предпочтение отдают индометацину (индотард, метиндол) и диклофенаку (вольтарен, диклоран, диклофен). Эти препараты назначают в дозе 200–250 мг/сут, причем в первые часы приступа применяют большую часть суточной дозы. Проведенные контролированные исследования не выявили более высокой эффективности традиционных НПВП по сравнению с селективными ингибиторами ЦОГ-2 (нимесил, нимулид, целебрекс), например целекоксибами (коксиб, целебрекс). Однако окончательное суждение о сравнительной эффективности этих препаратов можно вынести только в ходе дальнейших исследований. Суточная доза колхицина составляет 4–6 мг/сут, причем 2/3 этой дозы больной принимает до 12 ч дня в первый день приступа. Обычно разовая доза составляет 0,6 мг и ее принимают каждый час до явного снижения подагрического воспаления. После значительного уменьшения воспаления дозу колхицина начинают снижать по 0,6 мг 2 раза в день, вплоть до полной отмены. Нередко у больных не удается наращивать суточную дозу до оптимальной из-за появления побочных реакций. Основными побочными эффектами колхицина являются тошнота, рвота, понос, возможны также геморрагический гастроэнтерит, лейкопения, нейропатия. При подагрическом статусе, характеризующемся непрерывными атаками острого артрита, рефрактерными к терапии НПВП, возможно внутривенное введение колхицина.
Противоподагрическая терапия (базисная, модифицирующая болезнь) направлена на профилактику рецидивов острого артрита, снижение содержания мочевой кислоты в крови, предупреждение дальнейшего формирования тофусов и их обратное развитие. Все противоподагрические препараты делятся на две большие группы: урикодепрессоры (урикостатики) и урикозурики. Урикодепрессоры тормозят синтез мочевой кислоты путем ингибирования фермента ксантиноксидазы, превращающего гипоксантин в ксантин, а ксантин в мочевую кислоту. Урикозурики повышают экскрецию мочевой кислоты, подавляя обратную реабсорбцию уратов почечными канальцами.
К препаратам первой группы относится аллопуринол (аллопуринол, аллопуринол-эгис, аллупол, пуринол, ремид, тиопуринол, милурит), который занимает лидирующее положение среди дру-гих противоподагрических средств. Показанием к применению аллопуринола являются метаболическая подагра, высокая гиперурикемия, частые острые атаки артрита, мочекислая болезнь, генетически обусловленный дефицит гипоксантин-гуанин-фосфорибозилтрансферазы. Применение аллопуринола возможно и у больных с подагрической нефропатией с начальными проявлениями хронической почечной недостаточности и небольшой азотемии. Начальная доза аллопуринола составляет 300 мг/сут. В случае неэффективности такой дозы ее увеличивают до 400–600 мг/сут, а при достижении клинического эффекта постепенно снижают. Поддерживающая доза определяется уровнем гиперурикемии и обычно составляет 100–300 мг/сут.
Аллопуринол способствует исчезновению атак острого артрита или их заметному ослаблению, обратному развитию тофусов и отчетливому их размягчению, снижению уровня мочевой кислоты до субнормальных цифр, нормализации показателей мочевого синдрома, урежению почечных колик и выделительной функции почек. У некоторых больных он поначалу вызывает повышение уровня мочевой кислоты и обострение подагрического артрита, поэтому на первом этапе терапии его комбинируют с противовоспалительными препаратами, в частности с низкими дозами колхицина или НПВП. По этой причине его не следует принимать при остром подагрическом артрите. При лечении аллопуринолом нередко развиваются побочные реакции, которые проявляются желудочно-кишечной токсичностью, аллергическими реакциями (кожная сыпь, эозинофилия), гепатотоксичностью с повышением сывороточных аминотрансфераз.
Урикозурические препараты, представляющие собой слабые органические кислоты, имеют меньшее значение в терапии подагры, чем урикостатики. Их не следует назначать при высоком содержании мочевой кислоты в крови, а также при нефропатии даже с начальными проявлениями почечной недостаточности. Из урикозурических препаратов сульфинпиразон и пробенецид особенно широко используются в США. Сульфинпиразон (сульфинпиразон, апо-сульфинпиразон, антуран) назначают по 200–400 мг/сут в два приема. Его, как и другие урикозурические средства, принимают с большим количеством жидкости, которую для профилактики нефролитиаза следует ощелачивать. Побочные реакции встречаются относительно часто и проявляются желудочной и кишечной диспепсией, лейкопенией, аллергическими реакциями. Противопоказанием к назначению сульфинпиразона является язвенная болезнь желудка и, конечно, подагрическая нефропатия.
Пробенецид (бенемид) является производным бензойной кислоты. Препарат назначается по 1,5–2,0 г/сут. Бензойная кислота содержится в клюкве, а также в ягодах и листьях брусники. Поэтому отвары и морсы из ягод и листьев этих растений показаны больным подагрой и в большей степени больным с подагрической нефропатией, тем более что помимо бензойной кислоты они содержат гиппуровую кислоту, обладающую урикосептическими свойствами. Урикозурическая активность присуща блокатору рецептора ангиотензина II и фенофибрату (грофибрат, нофибал). Наиболее эффективны производные бензбромарона, которые обладают не только урикозурическими свойствами, но и урикодепрессорными. Они используются в качестве монотерапии или в сочетании с аллопуринолом. Таким комбинированным препаратом является алломарон. Алломарон содержит 20 мг бензбромарона и 100 мг аллопуринола, его обычно принимают по 1 таблетке 2 раза в день.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и ощелачивающие растворы, которые способны снизить риск развития нефропатии и, в частности, мочекаменной болезни. К этим препаратам относятся магурлит, блемарен и уралит. Их применение должно регулярно контролироваться показателем рН мочи. Помимо этих средств, можно принимать питьевую соду 2–4 г в день или щелочные минеральные воды.
При выраженных симптомах артрита необходимо также проводить местное лечение (долобене, финалгон, диклоран плюс, долгит крем, немулид гель, бишофит-гель).
Диете при подагре придают наибольшее значение по сравнению с другими ревматическими болезнями. Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела. Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров. Жиры снижают экскрецию мочевой кислоты почками. Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино. Исключают из пищевого рациона печенку, почки, жирные сорта мяса, мясные бульоны, копчености, горох, бобы, чечевицу, шпинат, цветную капусту, шпроты, сельдь. Следует ограничить потребление мяса до 2–3 раз в неделю, при этом лучше употреблять его в отварном виде.
Сочетание строгой диеты с длительным применением противоподагрических препаратов, а также активное воздействие на заболевания, которые повышают содержание мочевой кислоты в крови, способны существенно замедлить темпы прогрессирования костно-хрящевой деструкции, предупредить дальнейшее формирование тофусов и сохранить функциональное состояние опорно-двигательного аппарата и почек.
В. В. Бадокин, доктор медицинских наук, профессор
РМАПО, Москва