Уплощенный эпителий что это
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Клинико-гистологическая характеристика доброкачественных образований яичников
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований.
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований. В течение нескольких десятилетий для дифференциации опухолей матки и придатков с успехом применяется ультразвуковая диагностика [1]. Однако не всегда при трансвагинальной эхографии можно определить характер опухоли, особенно на ранних стадиях развития опухоли яичника [2]. Возможность дифференциации доброкачественных и злокачественных образований яичников появилась с применением цветного доплеровского картирования [1, 3].
Длительность существования доброкачественной опухоли яичника и ее способность к малигнизации имеют самый различный диапазон и частоту. Так, известно, что малигнизации подвергается каждая третья серозная кистома яичника [2, 3, 4, 5]. Вместе с тем не исключено и длительное существование этих опухолей без каких-либо пролиферативных изменений в капсуле.
Известно, что образования яичников небольших размеров часто принимаются за опухолевидные образования и подвергаются консервативной противовоспалительной терапии. Отсутствие же эффекта от лечения рассматривают как показание для оперативного вмешательства. Однако распознать грань перехода пролиферации эпителия капсулы в атипический эпителий и своевременно предотвратить опасное для жизни заболевание является довольно сложной задачей. Окончательный диагноз о характере образования яичника устанавливается путем гистологического исследования удаленной капсулы.
Целью исследования явилось изучение клинических проявлений и морфологических особенностей доброкачественных опухолей яичников для своевременного решения вопроса о необходимости их оперативного лечения. Материал и методы исследования. Нами изучено клиническое течение доброкачественных образований яичников у 170 больных, поступивших в гинекологическое отделение акушерского комплекса № 9 г. Ташкента по поводу объемного образования яичника на оперативное лечение.
Возраст обследованных женщин колебался от 25 до 45 лет. Наиболее частым возрастом выявления опухолей яичников у наших пациенток является 20–29 лет (около половины), затем возрастная группа 30–39 лет. Меньше всего среди больных было пациенток в возрасте до 20 лет (около 5%).
Дооперационное обследование включало ультразвуковое исследование с цветовым доплеровским картированием сосудов яичника и определение в крови онкомаркера СА-125. Онкомаркер СА-125 является антигеном, определяемым с помощью моноклональных антител к клеткам рака яичников, и наиболее специфичным маркером при опухолях яичников, особенно в постклимактерическом периоде [5, 6]. Интерпретация результатов определения величины онкомаркера СА-125 проводилась в соответствии с результатами гистологического исследования.
При резко повышенных показателях проводилось повторное исследование в послеоперационном периоде и после реабилитационного лечения. Верификация диагноза проводилась в послеоперационном периоде гистологическим исследованием капсулы кистомы.
Для гистологического исследования из резецированных стенок кист готовили гистологические препараты по общепринятой методике. Результаты исследования и их обсуждение. Наиболее частой жалобой пациенток было бесплодие. Из 77 (45,3%) больных с нарушением репродуктивной функции у 46 (60,0%) пациенток наблюдалось первичное бесплодие длительностью от двух до шести лет, у 31 (40%) — вторичное бесплодие длительностью от двух до четырех лет.
Второй по частоте жалобой были ноющие боли внизу живота и альгоменорея (у 71 больной — 41,8%). Около одной трети больных (55 пациенток — 32,4%) до поступления в стационар получали консервативную противовоспалительную терапию без особого успеха.
Нарушения менструаций были отмечены чаще у больных с опухолевидными образованиями воспалительного характера, что было подтверждено результатами гистологического анализа удаленной капсулы образования. Из нарушений менструально-овариального цикла, кроме альгоменореи, были выявлены гиперменорея (12,3%), гипоолигоменорея (16,8%), в некоторых случаях — дисфункциональные кровотечения в анамнезе (у 9,2%).
Доплерометрические исследования кровотока характеризовались низкой скоростью кровотока в маточных и яичниковых сосудах и повышенными значениями индекса резистентности. Определение онкомаркера СА-125, проведенное до операции, показало, что, несмотря на разброс цифр (от 8,3 до 60,3), средняя цифра не превышала принятую норму 35 Ед/мл. Оперативное лечение проведено практически всем женщинам путем лапароскопии. Послеоперационное реабилитационное лечение зависело от результатов гистологического исследования и величины онкомаркера.
Интерес представляет также полиморфизм гистологических изменений в капсуле удаленных образований. Большую часть (33%) составили опухолевидные образования (фолликулярные и лютеиновые кисты). Доброкачественные эпителиальные опухоли составили 25% случаев, из них в 11,7% случаев — серозные и в 13,3% случаев — эндометриоидные. В 5% случаев наблюдали герминогенную опухоль в виде зрелой тератомы. Вместе с тем в двух случаях гистологическое исследование выявило аденокарциному яичника. Значительная часть кистозных образований (31,7%) не имела эпителиальной выстилки, что затрудняло установление гистогенеза и характера новообразования яичника.
Фолликулярные кисты были представлены чаще как одностороннее однокамерное и тонкостенное образование с гладкой внутренней стенкой. Гистологически соединительнотканная стенка была выстлана многорядным фолликулярным эпителием, под которым располагаются клетки theca interna, в некоторых случаях наблюдалась ее гиперплазия и лютеинизация.
Лютеиновые кисты чаще выявлялись в виде двусторонних и одиночных образований. Внутренняя поверхность стенки кисты выстлана слоем текалютеиновых клеток, под которыми расположена гранулеза без лютеинизации.
Среди эпителиальных опухолей чаще встречались серозные и муцинозные. Серозные опухоли были представлены серозной цистоаденомой, обычно крупных размеров. Капсула опухоли в основном была грубоволокнистой, выстилающий стенку эпителий был однорядным кубическим или уплощенным, в некоторых случаях обнаруживался цилиндрический эпителий.
Муцинозные опухоли были представлены муцинозной цистоаденомой (или сецернирующая муцинозная кистома), обычно многокамерной и крупных размеров. Внутренняя поверхность стенки выстлана однорядным высоким призматическим эпителием, цитоплазма которых содержала слизь.
Эндометриоидные опухоли яичников были схожи с опухолями эндометрия и характеризовались выстилкой стенки кисты однорядным низким цилиндрическим эпителием эндометриального типа. Вокруг стенки часто наблюдались кровоизлияния и накопление гемосидерина.
Зрелая кистозная тератома (или дермоидная киста) яичника была обычно однокамерной и заполнена салом и волосами. Гистологически обнаруживались кожа, волосяные фолликулы, сальные и потовые железы, редко — хрящ.
Аденокарциномы яичников были представлены серозной папиллярной цистоаденокарциномой. Нами выявлены две больные с аденокарциномой, у которых онкомаркер СА-125 был соответственно в 11 и 15 раз выше нормы.
Таким образом, исследования показали, что доброкачественные опухоли и опухолевидные образования яичников чаще встречаются среди женщин активного репродуктивного возраста — от 20 до 39 лет, что несколько отличается от данных литературы [4, 5]. Клиническая картина доброкачественных опухолей неспецифична и проявляется в некоторых случаях нарушениями менструального цикла, бесплодием. Наши исследования показали, что определение онкомаркера СА-125 позволяет в предоперационном периоде с высокой степенью вероятности прогнозировать характер образования яичника и определить хирургическую тактику, что подтверждается результатами других исследователей [6].
Выводы:
Литература
Л. М. Абдуллаева, кандидат медицинских наук Ташкентская медицинская академия, Ташкент
Гинекологический мазок «на флору»: на что смотреть, и как понять
Большинству женщин мазок «на флору» знаком, как самый «простой» гинекологический анализ. Однако исследование куда «полезнее», чем может казаться. И всего несколько (а то и одно) отклонений способны подсветить значимые проблемы, еще до появления каких-либо симптомов. Так как же понять полученные результаты? Рассказываем по пунктам.
1. Эпителий
Как известно, любой живой объект в природе имеет ограниченный срок жизни, по истечении которого он погибает «от старости».
Эпителий в гинекологическом мазке – это и есть слущенные «старые» клетки слизистой оболочки влагалища, цервикального или уретры (в зависимости от оцениваемого локуса). Которые могут присутствовать в материале в умеренных количествах.
Превышение нормативных пределов («много» или «обильно») может указывать на:
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
Кроме того, ввиду зависимости эпителия от уровня половых гормонов, его количество в материале может сильно меняться в зависимости от дня цикла, начиная с единичного «в поле зрения» в самом начале – до умеренного и даже большого количества ближе к овуляции и во время нее.
А появление в мазке так называемых «ключевых клеток» (эпителий, «облепленный» мелкими кокковыми бактериями) – является маркером бактериального вагиноза.
2. Лейкоциты
«Норма» лейкоцитов в мазке также сильно зависит от стадии цикла и уровня половых гормонов, а также исследуемого локуса.
Так, за «максимум» для:
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Результат «отсутствует», «мало» или «умеренно» для этого показателя является нормой, что тоже связано с индивидуальными особенностями гормонального фона и циклом.
А вот «много» слизи в мазке – может свидетельствовать о том, что мазок взят в середине цикла, дисбиотических изменениях или избытке эстрогенов. Поэтому требует внимания специалиста или, как минимум, контроля в динамике.
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Выявление в мазке «смешанной, преимущественно палочковой» флоры – также является вариантом нормой. Правда, если эти самые палочки – «мелкие, полиморфные», то есть морфологически соответствуют лактобактериям.
Преобладание в мазке кокковой флоры, и, особенно, если ее количество «обильно» – признак выраженных дисбиотических нарушений. Что требует более детальной оценки качества микрофлоры и, что важно, соотношения ее представителей между собой (к примеру, анализ «Фемофлор-16». Поскольку ассоциировано со множеством репродуктивных патологий (в том числе и скрытого характера).
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.
Опасная дисплазия железистого эпителия шейки матки лечится только методом ФДТ
Дисплазия железистого эпителия шейки матки
Д.м.н., профессор Сеченовского университета, онколог, хирург, онкогинеколог, гинеколог-иммунолог, эксперт по лечению дисплазии, предраковых и опухолевых заболеваний шейки матки.
Если говорить совсем коротко, то железистая дисплазия – это предраковое заболевание шейки матки. Из-за особенности своего расположения оно практически не поддается лечению классическими хирургическими методами. Фотодинамическая терапия в этом случае – пожалуй, единственный эффективный способ лечения, который защищает от рецидивов и раковой трансформации.
А теперь обо всем по порядку.
Чтобы лучше понять, что такое железистая дисплазия шейки матки, мы немного погрузимся в теорию и изучим строение шейки матки.
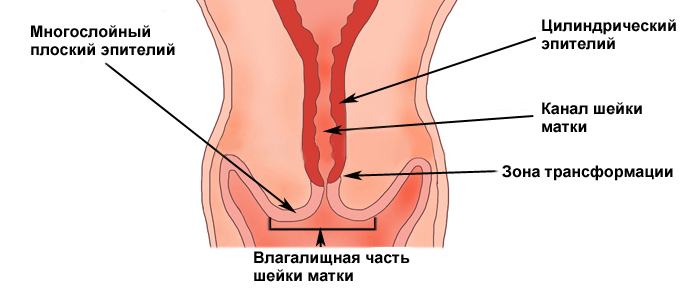
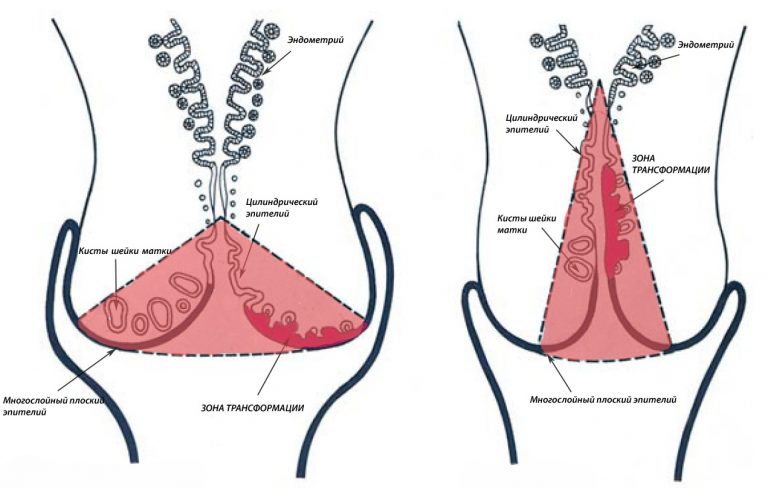
Строение шейки матки: эктоцервикс, эндоцервикс. зона трансформации.
Участок шейки матки, который погружен во влагалище (синий прямоугольник) называется эктоцервиксом. Он покрыт многослойным плоским эпителием.
Участок шейки матки от наружного зева по направлению к матке называется цервикальным каналом шейки матки (оранжевый прямоугольник). Он покрыт эндоцервиксом, или железистым (цилиндрическим) эпителием.
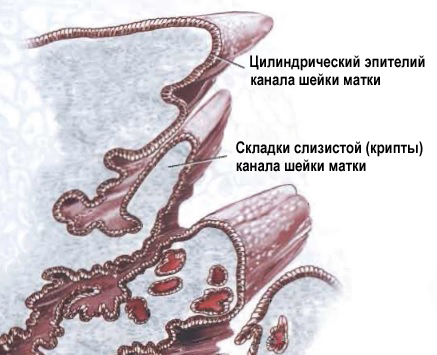
Цервикальный канал не ровный, а складчатый. На медицинском языке эти складки называются криптами. Железы цилиндрического эпителия секретирует слизь, которая составляет основной объём нормальных выделений.
Так выглядят крипты шейки матки. Всю поверхность крипты выстилает цилиндрический эпителий.
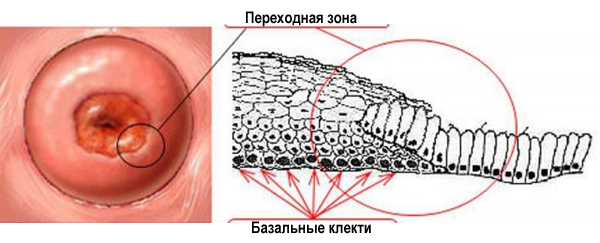
Зона, в которой многослойный плоский эпителий переходит в железистый эпителий называется переходной зоной, или зоной трансформации. Обычно дисплазия начинает свое развитие в зоне трансформации – в ней идет непрерывное клеточное деление, и вирусу папилломы легче всего проникнуть сквозь слабую защиту незрелых клеток в необходимые для его выживания базальные клетки.
Переходная зона или зона трансформации.
Дисплазия представляет собой скопление измененных вирусом клеток. Такие клетки называются атипическими, а само заболевание чаще всего относится к предраковым.
Что такое «дисплазия метаплазированного эпителия»?
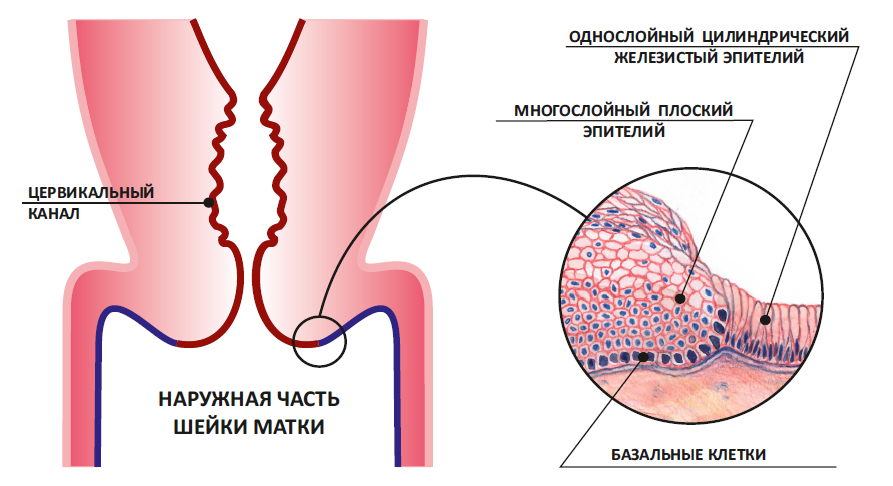
Мы уже выяснили: зона, в которой сходится плоский и цилиндрический эпителий, называется зоной трансформации. Втрое ее название – переходная зона.
Но это только на схеме она представляет собой ровную линию. На самом деле, в этой зоне один эпителий заходит на другой, как морские волны на песчаный берег. Молодой плоский эпителий перекрывает молодой цилиндрический. Такой незрелый плоский эпителий и называется метаплазированным.
Незрелый метаплазированный эпителий.
Само словосочетание «метаплазированный эпителий» вызывает много вопросов. Не скрывается ли за этой формулировкой рак? – Нет, не скрывается.
Хуже, если в вашей цитологии ничего про метаплазированный эпителий не написано. Это значит, что он отсутствует в мазке, и анализ взят неправильно (помните, я писал о том, что правильная цитология начинается в кабинете врача, а не в лаборатории?).
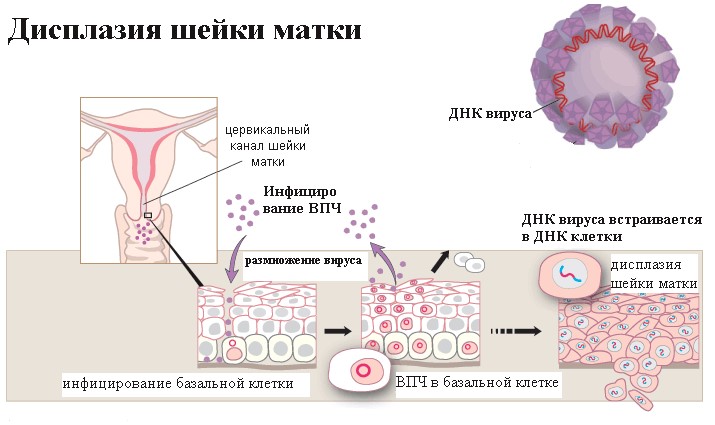
А теперь давайте обратим внимание на то, что написано в заключении. Если в заключении написано «на фоне метаплазии очаги дисплазии», перед нами дисплазия переходного эпителия. Так как в зоне трансформации идет непрерывный процесс интенсивного деления клеток, незрелые клетки менее защищены от заражения, и вирусу папилломы (причина дисплазии) как раз в области метаплазированного эпителия легче проникнуть в глубокий базальный слой и встроиться в ДНК клетки.
Именно поэтому шейку матку так тщательно осматривают и берут с нее анализ на цитологию – дисплазия обычно начинается в переходной зоне.
А теперь поговорим о том, что означает диагноз «интраэпителиальная дисплазия железистого эпителия шейки матки».
Что такое дисплазия цервикального канала и чем она опасна
«Интраэпителиальная дисплазия железистого эпителия шейки матки» – это так называемый «цитологический» или «гистологический» диагноз. Такое заключение пишет специалист в лаборатории после изучения вашего цитологического мазка или биопсии.
Он видит в микроскоп, что в клетках железистого эпителия происходит предраковая трансформация клеток.
Формулируя таким образом свое заключение, врач-морфолог подчеркивает, что процесс происходит не в зоне трансформации, а В ЦЕРВИКАЛЬНОМ КАНАЛЕ ШЕЙКИ МАТКИ.
Поэтому заболевание еще называют «цервикальная дисплазия», или «дисплазия канала».
Такой диагноз говорит о том, что при лечении его классическими методами вероятность рецидива заболевания приближается к 80%.
Классический метод лечения дисплазии называется конизацией шейки матки. Это операция, в ходе которой хирург удаляет кусочек эктоцервикса и эндоцервикса в форме конуса. Задача хирурга – удалить участок вместе с дисплазией.
Низкая (слева) и высокая (справа) конизация шейки матки.
Но такой способ лечения для диагноза «дисплазии цилиндрического эпителия» изначально порочен.
Дело в том, что при работе с цервикальным каналом хирург действует фактически вслепую. Он не видит зоны поражения, не может оценить ее размера, глубины и по факту удаляет ткани «на ощупь». Практика показывает, что после такого лечения частота рецидива дисплазии приближается к 80%.
Фактически, когда врач-морфолог в заключении описывает наличие проблемы в области железистого эпителия, он таким образом подчеркивает сложный характер расположения дисплазии и бесперспективность хирургической тактики лечения.
Этим недостатки хирургического метода не ограничиваются.
Во-первых, радикальность и как следствие, эффективность конизации – всегда сомнительна. Объясню почему. Крипты эндоцервикса достигают глубины 5 мм. У всех разная физиология, и хирург никак не может проверить, убрал ли он достаточно цилиндрического эпителия.
У нерожавших женщин глубокое удаление тканей чревато развитием осложнений, которые могут препятствовать зачатию, вынашиванию и родам (на эту тему читайте мою статью «Беременность после конизации шейки матки»). Хирурги знают об этом, и стараются проводить операцию максимально щадящим образом.
Определение границ изменённого дисплазией эпителия носит всегда субъективный характер. А при проведении конизации глубина конуса определяется хирургом «на глазок», здесь доказательная медицина не подсказывает хирургу как действовать. Глубина обычно определяется длиной электрода – «паруса», а не тяжестью диспластического процесса.
Недостаточно радикальная конизация, как следствие, вызывает закономерный рецидив.
Во-вторых, любое лечебное воздействие само по себе является для вируса провоцирующим фактором.
После лечения вирус начинает вести себя более агрессивно и приводит к быстрому рецидиву, который развивается по негативному сценарию: дисплазия 2 степени переходит в 3, а дисплазия 3 степени и рака ин ситу могут трансформироваться в инвазивный рак шейки матки.
В-третьих, хирургия делает вирус резистентным (устойчивым) К ЛЮБОМУ лечению, даже к фотодинамической терапии. Увы, и я, и коллеги часто наблюдаем это в своей практике.
При таком развитии событий рано или поздно возникнет необходимость в удалении матки. Именно поэтому при диагнозе «дисплазия эндоцервикса» я настоятельно не рекомендую делать конизацию, так как она не устраняет причину болезни.
Как избежать рецидива?
Избежать рецидива можно единственным способом – устранить измененные клетки вместе с причиной заболевания – вирусом папилломы человека.
К сожалению, механическое удаление в процессе конизации атипических клеток не приводит к выздоровлению. ВПЧ остается в цервикальном канале. В теории, вместе с очагами дисплазии удаляются и все зараженные ВПЧ клетки. Но на практике так не происходит.
Единственный метод, который позволяет убрать из цервикального канала ВПЧ и атипичные клетки, – это правильно и в полном объеме выполненная фотодинамическая терапия с соблюдением протокола проведения.
Цервикальная дисплазия шейки матки хорошо лечится методом фотодинамической терапии
Я не буду рассказывать о самой: фотодинамической терапии – об этом очень хорошо рассказывает это видео:
Фундаментальные исследования доказали, что лазерный свет глубоко проникает в ткани и запускает фотохимические реакции на глубине минимум 7 мм. Крипты (складки) цервикального канала имеют максимальную глубину 5 мм, поэтому даже самые глубоко залегающие атипические клетки попадают под лечебное воздействие.
При соблюдении протокола проведения ФДТ в ходе фотохимических реакций образуются активные токсичные формы кислорода, которые увеличивают реальную глубину лечебного воздействия до 1,5 см! Соответственно, фотодинамическое воздействие в полной мере оказывает необходимый лечебный эффект, и даже с запасом.
Положительный терапевтический результат процедуры достигается только при неукоснительном соблюдении протокола ФДТ, который включает в себя обязательное облучение и зоны эктоцервикса, и цервикального канала специальным цилиндрическим диффузором.
Этот диффузор вводится в полость цервикального канала на всю его глубину, и по периметру облучает все поле железистого эпителия.
Только такой подход позволяет полностью уничтожить патологические клетки и содержащийся в них вирус папилломы человека (ВПЧ) на всех участках шейки матки и говорить о качественно выполненном лечении.
При такой адекватно проведённой ФДТ ВПЧ уничтожаются в 93% случаев.
Хочу отметить, что до сих пор даже очень уважаемые мои коллеги допускают ошибки в обучении специалистов-гинекологов и не показывают им необходимость облучения цервикального канала при лечении дисплазии шейки матки.
В этом случае ФДТ не оказывает нужного лечебного воздействия. Воздействие осуществляется только в области эктоцервикса, а вся полость цервикального канала шейки матки остается не задействованной в лечении. Такой «урезанный» протокол ФДТ зачастую приводит к тем же печальным последствиям, что и конизация.
Я горжусь, что могу менять медицинскую практику вокруг себя в лучшую сторону. Так, методическое пособие для врачей ГНЦ лазерной медицины МЗ РФ «Фотодинамическая терапия фоновых и предраковых заболеваний шейки матки» от 2004 года не включало в себя важный этап обработки цервикального канала.
После моего выступления на конференции StatusPraesens «Перинатальная медицина: от прегравидарной подготовки к здоровому материнству и детству», 18–20 февраля 2016 года, отель «Санкт-Петербург», методические рекомендации подверглись пересмотру и теперь включают в себя обработку цервикального при лечении дисплазии канала шейки матки как обязательный этап.
Многие теперь стали использовать диффузор для облучения цервикального канала. Однако даже после этой революции многие используют его, не понимая, какая интенсивность света выходит из этого диффузора. А это важный параметр, от которого зависит эффективность проведённой фотодинамической терапии.
Многие также используют диффузоры многократно, хотя уже после одного облучения мощность инструмента падает, и необходимое лечебное воздействие не достигается. Но никто об этом не задумывается!
Прием ведет Афанасьев Максим Станиславович, акушер-гинеколог, онкогинеколог, онколог, иммунолог, доктор медицинских наук, профессор и член ученого совета Первого МГМУ им. И.М. Сеченова МЗ РФ, эксперт по лечению дисплазии шейки матки.
После лечения я поддерживаю обратную связь со всеми пациентками и решаю все возникающие вопросы. Гепатит и положительный ВИЧ статус не является противопоказаниями для лечения методом ФДТ.