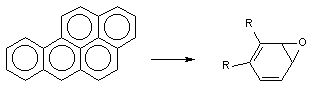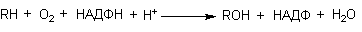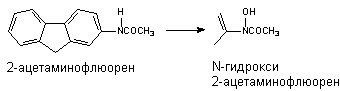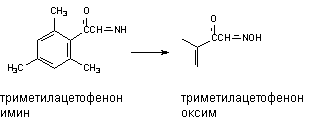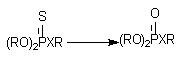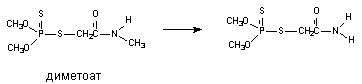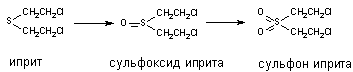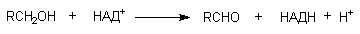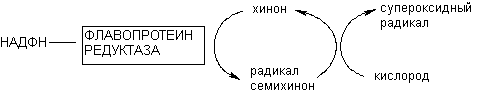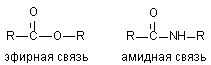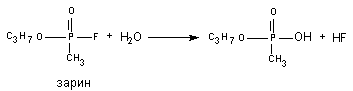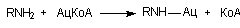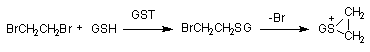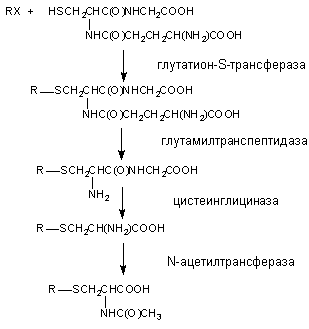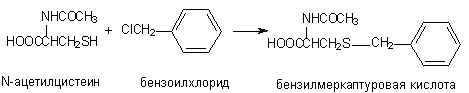Укажите в чем принципиальные механизмы снижения токсичности молекулы при микросомальном окислении
Микросомальное окисление повышает реакционную способность молекул
Микросомальное окисление – это последовательность реакций с участием оксигеназ и НАДФН, приводящих к внедрению атома кислорода в состав неполярной молекулы и появлению у нее гидрофильности, что повышает ее реакционную способность..
Реакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткие цепи, которые заканчиваются цитохромом P450.
Реакции микросомального окисления относятся к реакциям фазы 1 и предназначены для придания гидрофобной молекуле полярных свойств и/или для повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях 2 фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые и являются гидрофильными.
Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами).
Цитохром P450
Основным белком микросомального окисления является гемопротеин – цитохром Р 450. В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. Соотношение разных изоформ цитохрома Р 450 различается в силу генетических особенностей. Считается, что одни изоформы участвуют в биотрансформации ксенобиотиков, другие – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.).
Цитохром Р 450 взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способствуя появлению (усилению) у нее гидрофильности, а другой – в молекулу воды. Основными его реакциями являются:
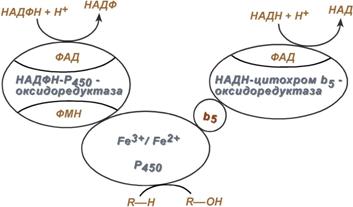
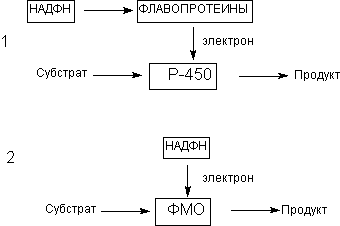
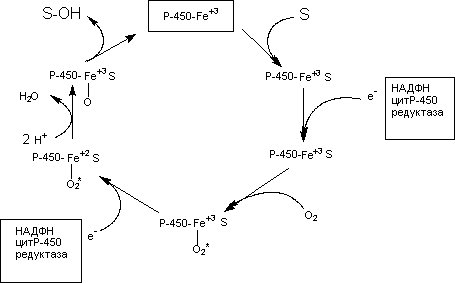
Работа цитохрома Р450 обеспечивается двумя ферментами:
Схема взаиморасположения ферментов микросомального
окисления и их функции
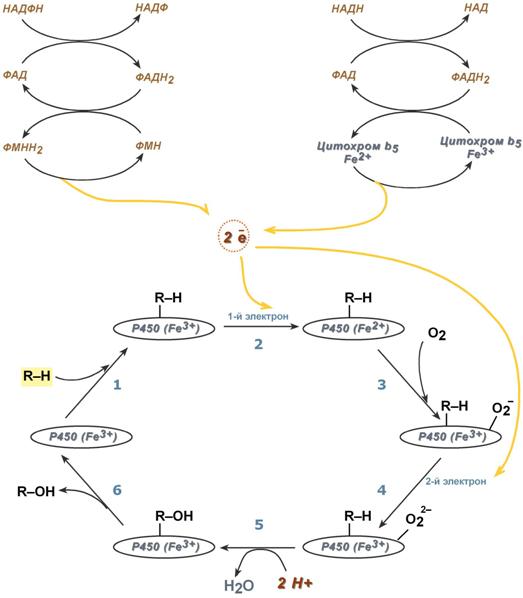
Обе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды.
Последовательность реакций гидроксилирования субстратов
с участием цитохрома Р 450
Существенной особенностью микросомального окисления является способность к индукции или ингибированию, т.е. к изменению мощности процесса.
Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Они бывают
1. Широкого спектра действия, которые обладают способностью стимулировать синтез цитохрома Р450, НАДФН-цитохром Р450-оксидоредуктазы и глюкуронилтрансферазы. Классическим представителем являются производные барбитуровой кислоты – барбитураты, также в эту группу входят диазепам, карбамазепин, рифампицин и др.
2. Узкого спектра действия, т.е. стимулируют одну из форм цитохрома Р450 – ароматические полициклические углеводороды (метилхолантрен, спиронолактон), этанол.
Ингибиторы микросомального окисления связываются с белковой частью цитохрома или с железом гема. Они делятся на:
1. Обратимые
2. Необратимые ингибиторы – аллопуринол, аминазин, прогестерон, оральные контрацептивы, тетурам, фторурацил,
Оценка реакций 1-й фазы
Оценку микросомального окисления можно проводить следующими способами:
Антипириновая проба
Обследуемый принимает утром натощак амидопирин из расчета 6 мг/кг веса. Собирается 4 порции мочи в интервале соответственно от 1 до 6 часов, 6-12, 12-24 и 45-48 часов. Объем мочи измеряется. Не позже, чем через 24 часа моча центрифугируется или фильтруется. Далее исследуется концентрация 4-аминоантипирина и его метаболита N-ацетил-4-аминоантипирина в моче.
Метаболизм ксенобиотиков
Метаболизм ксенобиотиков проходит в две фазы (рисунок 1).
Рисунок 1. Фазы метаболизма чужеродных соединений
В ходе первой фазы окислительно-восстановительного или гидролитического превращения молекула вещества обогащается полярными функциональными группами, что делает ее реакционно-способной и более растворимой в воде. Во второй фазе проходят синтетические процессы конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, в результате чего образуются полярные соединения, которые выводятся из организма с помощью специальных механизмов экскреции.
Разнообразие каталитических свойств энзимов биотрансформации и их низкая субстратная специфичность позволяет организму метаболизировать вещества самого разного строения. Вместе с тем, у животных разных видов и человека метаболизм ксенобиотиков проходит далеко не одинаково, поскольку энзимы, участвующие в превращениях чужеродных веществ, часто видоспецифичны.
Следствием химической модификации молекулы ксенобиотика могут стать:
3. Изменение характера токсического действия;
4. Инициация токсического процесса.
Метаболизм многих ксенобиотиков сопровождается образованием продуктов существенно уступающих по токсичности исходным веществам. Так, роданиды, образующиеся в процессе биопревращения цианидов, в несколько сот раз менее токсичны, чем исходные ксенобиотики. Гидролитическое отщепление от молекул зарина, зомана, диизопропилфторфосфата иона фтора, приводит к утрате этими веществами способности угнетать активность ацетилхолинэстеразы и существенному понижению их токсичности. Процесс утраты токсикантом токсичности в результате биотрансформации обозначается как «метаболическая детоксикация».
В процессе метаболизма других веществ образуются более токсичные соединения. Примером такого рода превращений является, в частности, образование в организме фторуксусной кислоты при интоксикации фторэтанолом.
В ряде случаев в ходе биотрансформации ксенобиотиков образуются вещества, способные совершенно иначе действовать на организм, чем исходные агенты. Так, некоторые спирты (этиленгликоль), действуя целой молекулой, вызывают седативно-гипнотический эффект (опьянение, наркоз). В ходе их биопревращения образуются соответствующие альдегиды и органические кислоты (щавелевая кислота), способные повреждать паренхиматозные органы и, в частности, почки. Многие низкомолекулярные вещества, являющиеся факультативными аллергенами, подвергаются в организме метаболическим превращениям с образованием реакционноспособных промежуточных продуктов. Так, соединения, содержащие в молекуле амино- или нитрогруппу в ходе метаболизма превращаются в гидроксиламины, активно взаимодействующие с протеинами крови и тканей, формируя полные антигены. При повторном поступлении таких веществ в организм помимо специфического действия развиваются аллергические реакции.
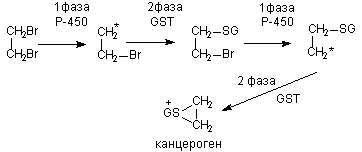
Порой сам процесс метаболизма ксенобиотика является пусковым звеном в развитии интоксикации. Например, в ходе биологического окисления ароматических углеводородов инициируются свободно-радикальные процессы в клетках, образуются ареноксиды, формирующие ковалентные связи с нуклеофильными структурами клеток (белками, сульфгидрильными группами, нуклеиновыми кислотами и т.д), активирующие перекисное окисление липидов биологических мембран (рисунок 2). В итоге инициируется мутагенное, канцерогенное, цитотоксическое действие токсикантов.
Рисунок 2. Образование ареноксидов в процессе метаболизма ароматических полициклических углеводородов при участии оксидаз смешанных функций (ОСФ)
Аналогично ареноксидам на клетки действуют N-оксиды, нитрозамины, гидроксиламины, также являющиеся канцерогенами и мутагенами. В опытах на собаках установлена прямая зависимость между канцерогенной активностью (рак мочевого пузыря) и концентрацией в моче продуктов N-окисления веществ в ряду: 1-нафтиламин, 2-нафтиламин, 4-аминодифенил.
По такому же механизму действуют на организм галогенированный бензол, нафтанол и многие другие ксенобиотики.
Биоактивация далеко не всегда сопровождается повреждением биосубстрата, поскольку одновременно в организме протекают процессы детоксикации и репарации. Интенсивность этих процессов может быть достаточной для компенсации ущерба, связанного с образованием реактивных метаболитов. Тем не менее при введении высоких доз токсиканта, повторном воздействии защитные механизмы могут оказаться несостоятельными, что и приведет к развитию токсического процесса.
1. Концепция l и ll фазы метаболизма ксенобиотиков
l фаза метаболизма в широком смысле может быть определена, как этап биотрансформации, в ходе которого к молекуле соединения либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме. Это достигается либо путем окисления или (значительно реже) восстановления молекул с помощью оксидо-редуктаз, либо путем их гидролиза эстеразами и амидазами.
В ходе биопревращений липофильный и, следовательно, трудновыводимый ксенобиотик становиться гидрофильным продуктом, что обусловливает возможность его быстрой экскреции.
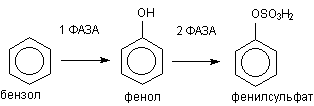
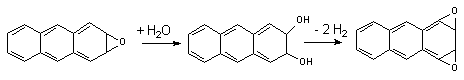
Классическим примером биотрансформации ксенобиотиков является метаболизм бензола в организме (рисунок 3)
Рисунок 3. Метаболизм бензола
В ходе l фазы метаболизма обеспечивается превращение жирорастворимого субстрата в полярный продукт путем включения в молекулу гидроксильной группы. В ходе ll фазы образовавшийся фенол взаимодействует с эндогенным сульфатом, в результате полярность образующегося продукта еще более возрастает. Фенилсульфат прекрасно растворяется в воде и легко выделяется из организма.
Далеко не всегда преобразования молекулы представляет собой простое чередование 1 и 11 фаз метаболизма. Возможна и более сложная последовательность реакций биопревращений (рисунок 4).
2. Локализация процессов биотрансформации
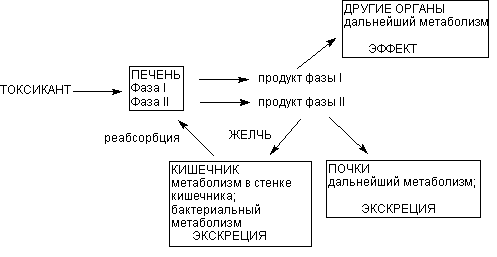
Основным органом метаболизма ксенобиотиков в организме человека и млекопитающих является печень, главным образом благодаря разнообразию и высокой активности здесь ферментов биотрансформации. Кроме того, портальная система обеспечивает прохождение всех веществ, поступивших в желудочно-кишечный тракт, именно через печень, до того, как они проникнут в общий кровоток. Это также определяет функциональное предназначение органа. Тончайшая сеть печеночных капилляров, огромная площадь контакта между кровью и поверхностью гепатоцитов, обеспечивающаяся микроворсинками базальной поверхности печеночных клеток, обусловливают высокую эффективность печеночной элиминации токсиканта на клеточном уровне (рисунок 5).
Рисунок 5. Локализация этапов метаболических превращений ксенобиотиков в организме
Продукты l фазы метаболизма поступают в общий кровоток и могут оказывать действие на органы и системы. Печень выбрасывает в кровь и продукты ll фазы метаболизма. Из крови продукты превращения могут захватываться почками, легкими, другими органами, повторно печенью для экскреции с желчью. С желчью метаболиты поступают в кишечник, где частично реабсорбируются и повторно поступать в печень (цикл печеночной рециркуляции).
Энзимы, участвующие в метаболизме ксенобиотиков, локализованы в основном внутриклеточно. Небольшое их количество определяется в растворимой фракции циотозоля, митохондриях, большинство же связаны с гладким эндоплазматическим ретикулумом (таблица 1). Методом ультрацентрфугирования гладкий эндоплазматический ретикулум выделяется из исследуемых клеток в виде фрагментов мембранных структур, называемых микросомами. Поэтому основная группа ферментов, участвующих в метаболизме ксенобиотиков, получила название «микросомальные энзимы».
Таблица 1. Энзиматические реакции метаболизма ксенобиотиков и локализация энзимов внутри гепатоцита.
1. Окисление:
Гидроксилирование
Декарбоксилирование
Образование оксидов
Десульфурирование
Дегалогенирование
Окисление спиртов
Окисление альдегидов
2. Восстановление:
Восстановление альдегидов
Азо-восстановление
Восстановление нитросоединений
3. Гидролиз:
Расщепление эфиров
Расщепление амидных связей
микросомы
микросомы
микросомы
микросомы
микросомы
микросомы, цитозоль
цитозоль
цитозоль
микросомы
микросомы, цитозоль
микросомы, цитозоль
микросомы, цитозоль
Конъюгация с глюкуроновой кислотой
Конъюгация с сульфатом
Ацилирование
Конъюгация с глутатионом
Метилирование
микросомы
цитозоль
микросомы, цитозоль
цитозоль
цитозоль
Часть ферментных систем метаболизма ксенобиотиков локализуются в жидкостях организма. Прежде всего, это эстеразы плазмы крови, участвующие в гидролизе целого ряда чужеродных веществ, таких как ФОС, некоторые алкалоиды (атропин), лекарства (суксаметоний, прокаин) и др.
3. Первая фаза метаболизма
Разнообразие чужеродных химических веществ, способных подвергаться в организме метаболическим превращениям, является следствием многообразия энзимов, участвующих в l фазе биотрансформации и их низкой субстратной специфичности. Многие из энзимов существуют в нескольких формах (изоферменты), различающихся по своим физико-химическим свойствам (молекулярная масса, электрофоретическая подвижность, абсорбцией света с разними длинами волн), отношению к индукторам и ингибиторам (см. ниже) и активностью в отношении субстратов различного строения.
Энзимы l фазы, участвующие в процессе биотрансформации ксенобиотиков, можно классифицировать в соответствии с типом активируемой ими реакции:
1. Оксидазы смешанной функции: цитохромР-450 (Р-450) и флавинсодержащие монооксигеназы (ФМО);
3. Алкогольдегидрогеназы и альдегиддегидрогеназы;
6. Эстеразы и амидазы.
Примеры веществ, подвергающихся метаболизму при участии указанных энзимов, приведены в таблице 2.
Таблица 2. Примеры веществ, подвергающихся биотрансформации при участии энзимов l фазы
1. ЦитохромР-450
-эпоксид/гидроксилирование
-N,O,S-деалкилирование
-N,S,P-окисление
-десульфурация
-дегалогенирование
-нитро-восстановление
-азо-восстановление
2. ФМО
-N,S,P-окисление
-десульфурация
3. Простогландинсинтетаза
-дегидрирование
-N-деалкилирование
-эпоксид/гидроксилирование
-окисление
4. Алкогольдегидрогеназа
-окисление
-восстановление
5. Альдегиддегидрогеназа
-окисление
6. Эстеразы, амидазы
-гидролиз
7. Эпоксидгидролазы
-гидролиз
Ацетаминофен
Диметиланилин
Бенз(а)пирен
Билирубин
Метанол, этанол, гликоли
Альдегиды, кетоны
Особое значение для биотрансформации ксенобиотиков имеют микросомальные энзимы. Как уже указывалось, морфологическим эквивалентом микросом в интактных клетках является гладкий эндоплазматический ретикулум. Ферменты микросом не принимают участие в окислении большинства эндогенных соединений, таких как аминокислоты, нуклеотиды, сахара и т.д., для которых существуют специфические пути превращения. Однако в метаболизме некоторых эндогенных соединений (например, стероидов) микросомальные оксидазы принимают участие наряду со специфическими ферментными комплексами. Под влиянием этих энзимов могут метаболизировать некоторые жирные кислоты, простогландины и т.д. Кофакторы микросомальных монооксигеназ, принимающих участие в метаболических превращения ксенобиотиков, представлены на рисунке 6.
Рисунок 6. Кофакторы энзимов l фазы метаболизма ксенобиотиков: (1) цитохромР-450 зависимые оксидазы (Р-450); (2) флавинсодержащие монооксигеназы (ФМО)
В ходе микросомального окисления часто образуются реакционноспособные промежуточные продукты. Некоторые из них нестабильны и подвергаются дальнейшему превращению, другие достаточно устойчивы.
В таблице 3 представлены некоторые примеры биопревращений, приводящих к образованию реактивных продуктов.
Таблица 3. Примеры биотрансформации ксенобиотиков с образованием активных промежуточных продуктов в ходе l фазы метаболизма
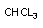
хлороформ
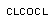
фосген
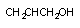
аллиловый спирт
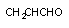
акролеин
ненасыщенный альдегид
алкоголь
дегидрогеназа
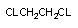
дихлорэтан
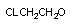
хлорацетальдегид
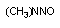
диметил
нитрозамин
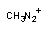
ион метилдиазониума
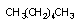
гексан
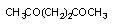
гександион
Р-450
алкоголь
дегидрогеназа
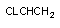
винилхлорид

хлорэтиленэпоксид
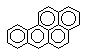
бенз(а)пирен
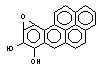
бензпирендиолэпоксид
Р-450
эпоксидгидролаза
пероксидаза

бензол
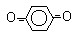
бензохинол
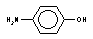
р-аминофенол
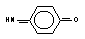
р-бензохинонимин
3.1.1. Оксидазы смешанной функции
3.1.1.1. ЦитохромР-450-зависимая монооксигеназная система
Р-450 представляют собой семейство энзимов, локализующихся в эндоплазматическом ретикулуме, которые могут быть разделены с помощью иммунологических и иных методов на несколько подсемейств. Отдельные ткани содержат несколько различных изоформ Р-450. Встречаются тканеспецифичные формы энзимов. Изоферменты Р-450 часто проявляют перекрестную субстратную специфичность, таким образом, как правило, более чем один изофермент принимает участие в метаболизме ксенобиотика. Наличие специфических форм энзимов обусловлено генетическими механизмами, а повышение содержания в тканях различных изоферментов индуцируется действием на организм различных ксенобиотиков: лекарств, ядов, экотоксикантов. Р-450 подвержены не только активации, но и инактивации, как исходными ксенобиотиками, так и их реактивными метаболитами.
Реакции микросомального окисления, протекающие при участии Р-450, как правило, зависят от содержания O 2 и НАДФН в среде. Молекулярный кислород активируется цитохромомР-450 (или другими цитохормами, например, Р-448). Активация осуществляется с помощью НАДФН при участии флавин-содержащего энзима НАДФН-цитохромР-450 редуктазы. Поскольку донором электронов в превращениях субстратов, катализируемых этими энзимами, является НАДФН, суммарное уравнение реакции может быть записано следующим образом:
ЦитохромР-450, НАДФН-цитохромР-450 редуктаза и фосфолипиды биологических мембран, в которые встроены оба энзима, образуют микросомальный монооксигеназный комплекс. Несмотря на то, что энзимы комплекса связаны с биологическими мембранами, их свойства могут быть изучены in vitro.
Установлены основные закономерности протекания ферментативных процессов с участием микросомального монооксигеназного комплекса (рисунок 7).
Рисунок 7. Упрощенная схема превращения субстрата при участии Р-450
Метаболизируемое вещество не связывается непосредственно с геминовой группой цитохромаР-450. Оно присоединяется к белковой части цитохрома. Процесс превращения ксенобиотиков чувствителен к СО, поскольку это вещество вытесняет кислород из связи с железом геминовой группы цитохромаР-450. Некоторые оксидазы резистентны к СО (образование N-оксидов).
3.1.1.1.1. Реакции, катализируемые цитохромомР-450
Эпоксидирование и гидроксилирование ароматических соединений.
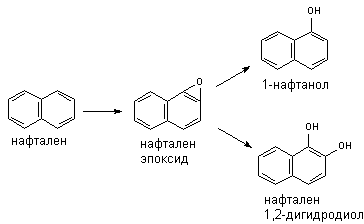
Метаболизм полициклических и ароматических углеводородов сопровождается образованием реакционно-способных промежуточных продуктов метаболизма, в частности ареноксидов, способных вызывать некроз клеток и являющихся канцерогенами. Таким образом осуществляется, в частности, превращение бенз(а)пирена (см. выше) или нафталена:
Эпоксид, возникающий в процессе метаболизма, может подвергаться неэнзиматическому гидролизу с образованием нафтанола, либо, взаимодействуя с эпоксидгидролазой, превращаться в дигидродиол, а также образовывать конъюгаты с глутатионом, которые выделяются из организма в виде производных меркаптуровой кислоты.
Эпоксидирование алифатических и алициклических соединений.
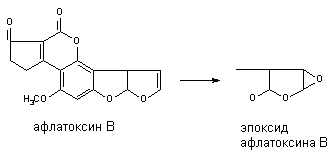
Многие алифитические и алициклические соединения, содержащие в молекуле непредельные связи метаболизируют с образованием чрезвычайно стабильных эпоксидов (превращение алдрина в диалдрин). Это же превращение лежит в основе образования канцерогенных продуктов метаболизма афлатоксинов:
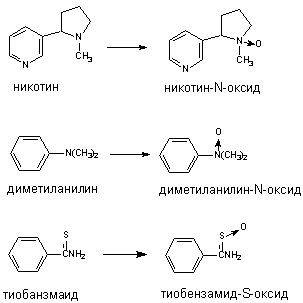
Превращению могут подвергаться такие вещества, как анилин и его производные, ацетаминофлюорен и др. В результате окисления атома азота могут образовываться гидроксиламины, оксимы и N-оксиды:
Оксимы образуются в процессе гидроксилирования иминов или первичных аминов:
Десульфурирование и расщепление эфиров.
Фосфоротиоаты (1) и фосфородитиоаты (2), являющиеся представителями большой группы инсектицидов, приобретают способность угнетать активность ацетилхолинэстеразы (за счет этого реализуется их биологическая активность) в результате ферментативного преобразования соединений:
Процесс разрушения эфирных связей при атоме фосфора ФОС также во многом обусловлен действием Р-450, хотя процесс может идти и при участии гидролитических энзимов.
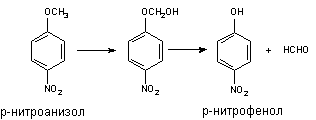
Классическим примером превращения данного типа является О-деалкилирование р-нитроанизола. Поскольку продукт превращения легко определяется, реакцию нередко используют для оценки активности Р-450:
Другим примером может служить метаболизм инсектицида этоксихлора:
В результате деятельности монооксигеназ возможно и N-деалкилирование ксенобитиков:
При участии цитохромаР-450 и других монооксигеназ происходит окисление тиоэфирных связей, в молекулах таких ксенобиотиков как хлорпромазин, альдикарб, метиокарб и др. Этот вид превращения характерен также для метаболизма сернистого иприта:
Установлено, что при этом токсичность вещества возрастает (сульфон иприта токсичнее исходного вещества).
3.1.1.2. Флавинсодержащие монооксигеназы (ФМО)
Флавинсодержащие монооксигеназы (ФМО) также локализуются в эндоплазматическом ретикулуме. В отличии от Р-450, ФМО встречается в тканях в форме одного, свойственного виду, энзима, не подвергающегося индукции. ФМО, получая электрон непосредственно от НАДФН, окисляет ксенобиотики лишь определенного строения, главным образом азотсодержащие вещества основного характера (гидразины, ариламины) и тиокарбамильные соединения (тиоацетамид и т.д.). Примеры некоторых превращений представлены на рисунке 8. Многие из субстратов ФМО одновременно являются субстратами и Р-450.
Рисунок 8. Превращение ксенобиотиков при участии флавинмонооксигеназ
3.1.2. Простогландинсинтетаза-гидропероксидаза и другие пероксидазы
Обширная группа пероксидаз участвует в разрушении перекиси водорода и других перекисей, превращая их в воду и спирты. В ходе этих реакций возникают побочные продукты, обладающие окислительными свойствами, способные взаимодействовать с различными химическими веществами, такими как ароматические амины, фенолы, гидрохиноны, алкены, полициклические ароматические углеводороды:
Например, лейкоцитарная пероксидаза, пероксидаза эозинофилов разрушают перекись водорода, продуцируемую в легких клетками крови при их контакте с кислородом. Поэтому эти энзимы могут участвовать в биопревращении чужеродных веществ в легких.
Простогландинсинтетаза активирует образование простогландинов (гидроперекисей жирных кислот) из арахидоновой кислоты. В ходе последующего восстановления гидроперекисей окисляются другие субстраты и среди них ксенобиотики, содержащиеся в тканях. Такой механизм окисления веществ называется кооксидация. В ходе процесса потребляется арахидоновая кислота и ксенобиотики, а продуцируются простогландины и окисленные формы этих ксенобиотиков. Широкое распространение ПГС в тканях млекопитающих позволяет предположить, что этот механизм может лежать в основе целого ряда реакций биопревращения чужеродных соединений, особенно в тканях с низкой активностью Р-450, например, мозговом слое почек, эндотелии мочевого пузыря и т.д.
НАД-зависимая алкогольдегидрогеназа печени обладает невысокой субстратной специфичностью. Так, под влиянием этого энзима метаболизируют не только первичные и вторичные алифатические спирты, но и ароматические спирты, а также такие соединения, как р-нитробензиловый спирт и т.д. В результате окисления образуются соответствующие альдегиды:
Алкогольдегидрогеназа существует в множественной форме с перекрестной субстратной специфичностью. Ее активность индуцируется этанолом и угнетается альдегидами.
В превращении альдегидов в соответствующие кислоты принимает участие НАД-зависимые альдегиддегидрогеназы. Специфическая формальдегиддегидрогеназа в качестве кофактора использует еще и восстановленный глутатион. В организме грызунов (мыши, крысы, кролики) метаболизм некоторых альдегидов (например, превращение хлоралгидрата в трихлоруксусную кислоту) проходит при участии альдегиддегидрогеназ с иными свойствами.
Среди веществ, метаболизируемых при участии рассматриваемых энзимов наибольшее токсикологическое значение имеют метанол, этиленгликоль, аллиловый спирт. В процессе метаболизма этих веществ образуются высоко токсичные промежуточные (формальдегид, гликолиевый альдегид) и конечные (муравьиная кислота, оксалат) продукты.
Процесс дегидрирования лежит в основе превращений целого ряда ароматических соединений. Так, в ходе метаболизма бензойной кислоты образуется гиппуровая кислота. Участвующие в превращении энзимы локализуются в митохондриях.
Рисунок 9. Образование кислородных радикалов в результате окислительно-восстановительного цикла хинона, катализируемого флавопротеинредуктазой
Активируемое таким образом превращение субстратов, дающее начало образованию кислородных радикалов, обозначается как «окислительно-восстановительный цикл». Помимо хинона по такому механизму метаболизируют нитроароматические соединения, биспиридины и т.д. К числу токсикантов, активирующих свободнорадикальные процессы в клетке в процессе метаболизма при участии флавопротеинредуктаз, относятся в частности пестицид паракват, противоопухолевое средство адриамицин, антибиотик нитрофурантион, комплексные соединения железа и меди (см. раздел «Механизмы цитотоксичности»).
В тканях человека и животных, а также в жидкостях организма, например крови, содержатся энзимы, обладающие эстеразной активностью. Их низкая специфичность обеспечивает гидролиз эфиров различного строения. Так, в плазме крови содержатся эстеразы, разрушающие эфиры холина, прокаина, производных прокаина и др. Среди наиболее изученных: карбоксилэстераза и арилэстераза. Эфиры фосфорной кислоты в крови и тканях также расщепляются эстеразами. Гидролиз эфиров изменяет биологическую активность веществ.
3.2.2. Расщепление амидов кислот
Токсиканты, содержащие эфирные связи расщепляются в организме с большой скоростью (см. выше). Результатом такого расщепления является изменение токсичности ксенобиотиков. При синтезе новых токсикантов (пестицидов) для повышения их стабильности в организме в молекулу вместо эфирной, вводят амидную связь.
Некоторые ткани содержат энзимы, разрушающие и амидные группировки (печень: дезаминидазы). Однако активность ферментов, разрушающих амидные связи в тканях млекопитающих, низка и потому процесс метаболизма таких соединений проходит медленно.
Эпоксидгидролазы активируют превращение эпоксидов в трансдигидродиолы. Описаны микросомальная и цитозольная фракции энзима. Для осуществления превращения ксенобиотиков не требуется присутствие в среде кофакторов. Под влиянием энзима осуществляется гидролиз моноэпоксидов полициклических ароматических углеводородов. Образующиеся при этом дигидродиолы являются субстратами Р-450, которые превращают их в диэпоксиды:
Диэпоксиды являются более активными канцерогенами, чем исходные моноэпоксиды.
В 1955 году Mounter et al. обнаружили в разных тканях и крови млекопитающих энзим (флюорогидролаза), активирующий отщепление от атома фосфора высокотоксичных фосфорорганических соединений (ДФФ, зарин, зоман и т.д.) атом фтора. Токсичность веществ, в процессе такого превращения, резко снижается (рисунок 10).
Рисунок 10. Гидролиз зарина при участии флюорогидролазы
4. Вторая фаза метаболизма. Конъюгация
Превращение молекул в первой фазе биотрансформации усиливает их полярность, уменьшает способность растворяться в липидах. Уже только благодаря этому целый ряд чужеродных соединений лучше выделяется с мочой. Эффект еще более усиливается, когда к образовавшимся в ходе 1 фазы метаболизма продуктам присоединяются такие эндогенные вещества, как ацетат, сульфат, глюкуроновая кислота, глутатион и т.д. Как и энзимы l фазы метаболизма ксенобиотиков, энзимы ll фазы обладают слабой субстратной специфичностью и участвуют в превращениях большой группы химических веществ.
Рассматриваемую группу энзимов можно классифицировать следующим образом:
1. Энзимы, формирующие эфирные или амидные связи с промежуточными метаболитами:
— ацетил КоА: амин N-ацетилтрансфераза;
2. Энзимы, активирующие конъюгацию веществ с глутатионом:
3. Энзимы, активирующие конъюгацию веществ с цистеином:
— цистеин-конъюгирующие 
Общая характеристика реакций конъюгации ксенобиотиков представлена в таблице 4.
Таблица 4. Характеристика основных реакций конъюгации ксенобиотиков
Присоединяемый агент
Функциональная группа ксенобиотика
А. Реакции, протекающие при участии активированных форм присоединяемых агентов
Конъюгация с глюкуроновой кислотой
УДФ-глюкуроновая кислота
Конъюгация с глюкозой
Детоксикация цианида
Б. Реакции, протекающие при участии активированных форм ксенобиотиков
Конъюгация с глутатионом
Ареноксиды; эпоксиды; галогенированные алкильные и арильные углеводороды
Конъюгация с аминокислотами
Глицин; глутамин; орнитин; таурин; цистеин
В ряде случаев, в ходе метаболизма ксенобиотиков во ll фазе также образуются токсичные продукты (токсификация).
Ацетилированию могут подвергаться ариламингруппы, сульфамидные группы, алифатические амины, группы гидразина. У людей выражены генетически обусловленные различия в способности к реакции N-ацетилирования. Замедленное ацетилирование отмечается у гомозиготных по рецессивному аллелю индивидов. Высокая активность ацетилирования отмечается у гетерозиготных индивидов или людей, гомозиготных по доминантному аллелю.
4.2. Другие реакции ацилирования
Не только уксусная кислота, но и другие органические кислоты способны превращаться в организме в активную форму, вступая во взаимодействие с КоА (жирные кислоты, карболовая кислота, бензойная кислота, фенилуксусная кислота и др.). В этой форме вещества вступают в реакцию взаимодействия с соединениями, содержащими аминогруппу (глицином, глутаматом), с образованием конъюгатов. Так, известно, что при поступлении в организм бензойной кислоты с мочой выделяется гиппуровая кислота. Гиппуровая кислота представляет собой конъюгат бензойной кислоты с глицином. В данном случае эндогенная молекула глицина выступает в качестве акцептора, с которым связывается бензойная кислота, активированная КоА. В организме человека активированная форма фенилуксусной кислоты связывается с глутаматом.
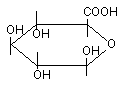
4.3. Конъюгация с глюкуроновой кислотой
Глюкуроновая кислота (рисунок 11) имеет большое значение в механизме биотрансформации ксенобиотиков.
Рисунок 11. Глюкуроновая кислота
В реакцию конъюгации глюкуроновая кислота вступает в активной форме уридиндифосфоглюкуроновой кислоты (УДФГК) и переносится на молекулу-акцептор с помощью соответствующей трансферазы: УДФ-глюкуронозилтрансферазы (УДФ-ГТ). Энзим идентифицирован в микросомальной фракции клеток печени, почек, других органов. УДФГК образуется в процессе взаимодействия глюкозо-1-фосфата с уридинтрифосфорной кислотой (УТФ) в растворимой фракции цитозоля клеток. УДФ-ГТ индуцируется при поступлении в организм таких веществ, как фенобарбитал, ПАУ, диоксины, полигалогенированные бифенилы.
Примеры типов реакции глюкуронидирования представлены на рисунке 12.
Рисунок 12. Некоторые реакции глюкуронидирования ксенобиотиков
С помощью конъюгации с глюкуроновой кислотой метаболизируют и некоторые эндогенные вещества, например стероиды и билирубин.
В кишечнике под влиянием глюкуронидазы, энзима кишечной микрофлоры, глюкурониды могут расщепляться с образованием веществ, способных к реабсорбции и обратному поступлению в кровь (явление кишечно-печеночной циркуляции ксенобиотика).
4.4. Конъюгация с сульфатом
4.5. Конъюгация с глутатионом и цистеином
Органические вещества, содержащие в молекуле лабильные атомы водорода, галогенов и др., в организме могут взаимодействовать с SH-содержащими эндогенными соединениями: цистеином, ацетилцистеином, глутатионом и т.д.
Рисунок 13. Биоактивация дибромэтана при участии глутатион-S-трансферазы
Глутатион, вступивший в реакцию конъюгации с веществом подвергается расщеплению (рисунок 14). В результате из организма выделяется метаболит в связанной с N-ацетилцистеином форме (меркаптуровые кислоты).
Рисунок 14. Взаимодействие ксенобиотика с глутатионом и последующее превращение комплекса
Аналогичным образом происходит взаимодействие ксенобиотиков с цистеином и ацетилцистеином:
Для многих веществ, процесс превращения завершается этапом метилирования молекулы.
Метилированию могут подвергаться молекулы, содержащие гидроксильные, сульфгидрильные и аминогруппы в структуре. В качестве донора метильной группы выступает метионин в форме S-аденозилметионина (SАМ). Перенос радикала осуществляют соответствующие O-, S-, N-метилтрансферазы:
Среди эндогенных веществ, таким образом, при участии фермента катехол-О-метилтрансферазы (КОМТ) метаболизируют адреналин, норадреналин, дофамин. При этом образуются малоактивные 3-метоксипроизводные катехоламинов.
5. Энзимы кишечной флоры
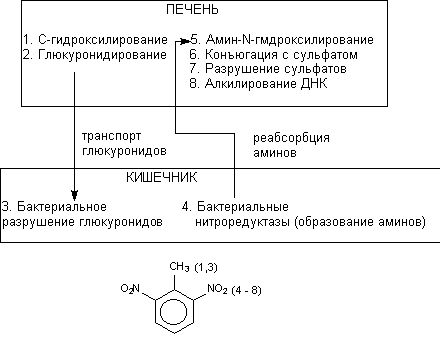
При участии кишечной флоры также возможен метаболизм химических соединений. Действие бактериальных энзимов сопровождается расщеплением продуктов ll фазы метаболизма, поступающих в кишечник с желчью, и образованием исходных метаболитов. Этот процесс проходит при участии гидролаз, разрушающих глюкурониды и сульфаты. Реабсорбция образовавшихся веществ замыкает цикл внутрипеченочной рециркуляции ксенобиотиков. Кроме того, анаэробная среда кишечника обеспечивает возможность восстановления некоторых химических веществ бактериями. Например, восстановление нитроароматических соединений сопровождается образованием аминов, которые, поступая в печень, вновь подвергается метаболизму. Бактериальная 
Рисунок 15. Взаимодействие печеночных энзимов и энзимов флоры кишечника в процессе биоактивации канцерогена 2,4-динитротолуола
6. Факторы, влияющие на метаболизм ксенобиотиков
Способность органов и тканей метаболизировать ксенобиотики зависит от набора и активности энзимов, участвующих в процессе. В значительной степени активность энзимов является внутренней характеристикой конкретной ткани, определяется генетическими особенностями организма и зависит от пола и возраста. Дополнительными факторами, порой существенным образом влияющими на содержание и активность энзимов, являются условия окружающей среды. Это прежде всего химические вещества, выступающие в качестве индукторов или ингибиторов энзимов, питание и действие патогенных факторов (таблица 5).
Таблица 5. Факторы, влияющие на метаболизм ксенобиотиков
вид, пол, возраст, питание
Барбитураты, полициклические углеводороды, андрогенные стероиды, анаболические стероиды, глюкокортикоиды и др.
Метирапон, 7,8-бензофлавон, кобальт, SKF-525 и др.
ПОВРЕЖДЕНИЯ СТРУКТУРЫ ОРГАНА :
Особи одного и того же вида живых существ порой значительно различаются по способности метаболизировать ксенобиотики. Это во многом детерминировано генетически. Так, в популяции людей выявляются лица, обладающие пониженной активностью цитохромР-450 зависимых оксидаз. «Слабые метаболизанты» могут отличаться отсутствием некоторых изоэнзимов, необходимых для катализа ряда превращений ксенобиотиков.
Полиморфизм метаболизма ксенобиотиков отмечен для процессов ацетилирования ароматических веществ, содержащих амино-, сульфо-, амидную группу. Лица со слабым напряжением процессов ацетилирования более подвержены некоторым аллергическим реакциям, вызываемым химическими веществами. С другой стороны, излишне напряженный процесс ацетилирования ксенобиотиков может иметь пагубные последствия в результате биоактивации арилгидразинов.
В опытах на лабораторных животных, в основном грызунах, показано, что половые гормоны принимают участие в регуляции активности энзимов метаболизма ксенобиотиков и прежде всего монооксигеназ. Так, взрослые самцы крыс быстрее метаболизируют такие вещества, как гексабарбитал, аминопирин, аминофенол и т.д. Вместе с тем анилин и его аналоги подвергаются биопревращению в организме самцов и самок с одинаковой скоростью. Кастрация нередко сопровождается снижением скорость метаболизма ксенобиотиков. У человека половые различия выражены не столь существенно.
Отличия метаболизма ксенобиотиков, обусловленные возрастом, наиболее отчетливо проявляются у новорожденных и лиц пожилого возраста. Хорошо известно, что недостаточно развитая система метаболизма ксенобиотиков у новорожденных делает их особенно чувствительными к ряду токсикантов. Токсический процесс может стать следствием как накапливающихся в организме исходных продуктов, так и промежуточных метаболитов, не подвергающихся дальнейшей биотрансформации.
В старческом возрасте наблюдается снижение клиаренса ксенобиотиков отчасти обусловленное понижением интенсивности метаболизма. Нарушение метаболизма ксенобиотиков печенью в старческом возрасте может являться следствием уменьшения интенсивности печеночного кровотока, хронических патологических процессов в печени, связанного с возрастом снижения активности ферментов.
6.3. Влияние химических веществ
Ксенобиотики, поступающие в организм, могут оказывать влияние на процессы метаболизма как самих этих веществ, так и других соединений, поступающих в организм одновременно или вслед за ними. Теоретически можно выделить три группы химических соединений, по-разному влияющих на метаболизм чужеродных веществ:
1. Практически не влияющие на активность энзимов метаболизма;
Многочисленные индукторы монооксигеназных систем можно отнести к одному из двух классов. Представителем первого класса является фенобарбитал, другие барбитураты, некоторые лекарства и инсектициды. Ко второму классу индукторов относятся в основном полициклические углеводороды: ТХДД, 3-метилхолантрен, бенз(а)пирен и т.д. Самым сильным из известных индукторов монооксигеназ является 2,3,7,8-тетрахлордибензо-р-диоксин (ТХДД). Его эффективная доза составляет 1 мкг/кг массы. В подавляющем большинстве случаев ксенобиотики проявляют свойства индукторов, действуя в значительно больших дозах (более 10 мг/кг).
Фенобарбитал вызывает выраженную пролиферацию гладкого эндоплазматического ретикулума в гепатоцитах и увеличение активности Р-450. В результате возрастает мощность таких процессов, как деметилирование ксенобиотиков (нитроанизол), гидроксилирование (барбитураты), эпоксидирование (альдрин).
Индукция, вызываемая полициклическими углеводородами не сопровождается пролиферацией гладкого эндоплазматического ретикулума, но при этом существенно возрастает активность Р-450, УДФГ-трансферазы, гидроксиолаз.
Поскольку ксенобиотики, как правило, вызывают индукцию более чем одной ферментативной системы (барбитураты, полигалогенированные бифенилы одновременно вызывают индукцию Р-450, УДФГТ, GST и др.), предсказать влияние индукторов на токсикокинетику и токсикодинамику ксенобиотика практически не возможно. Эффект может быть определен только экспериментально. Задача усложняется еще и тем, что индукция того или иного энзима, вызванная разными индукторами, не одинаково сказывается на скорости метаболизма разных ксенобиотиков (таблица 6).
Активность УДФ-ГТ (нмол/мин/мг белка)
Фенобарбитал (100 мг/кг/сут)
3-метилхолантрен (40 мг/кг)
Арохлор 1254 (80 мг/кг)
Индукция предполагает синтез дополнительного количества того или иного энзима в органах и тканях de novo. Ингибиторы синтеза белка (пуромицин, этионин, циклогексимид), а также ингибиторы синтеза РНК (актиномицин Д) блокируют индукцию микросомальных энзимов. Поскольку блокаторы синтеза ДНК (гидроксимочевина) не эффективны, можно сделать вывод, что феномен индукции энзимов биотрансформации ксенобиотиков реализуется на уровне транскрипции генетической информации.
Механизм феномена полностью не изучен. Одна из первых гипотез была предложена S. Granick в 1966 году для объяснения индукторных свойств стероидов. Автор полагал, что индукция эндоплазматического ретикулума гепатоцитов, содержащего цитохромы, регулируется концентрацией в клетке свободного гема, высвобождающегося в ходе обменных процессов в эндоплазматическом ретикулуме. Гем взаимодействует с внутриядерным апорепрессором. При этом образуется репрессор, который в свою очередь угнетает ген-оператор. В тот момент, когда ген-оператор находится в неактивной форме, на соответствующем участке ДНК не осуществляется синтез мРНК, необходимой для синтеза энзиматических белков, входящих в структуру эндоплазматического ретикулума. При отсутствии свободного гема или в тех случаях, когда гем не может присоединиться к апорепрессору, происходит активация синтеза мРНК и выраженная пролиферация эндоплазматического ретикулума. Естественными ингибиторами образования репрессора и являются стероиды, активно взаимодействующие с апорепрессором. В соответствии с этой моделью около 300 ксенобиотиков (далеко не все структурные аналоги стероидов) способны избирательно взаимодействовать с апорепрессором и блокировать тем самым образование репрессора. Эти вещества проявляют свойства индукторов микросомальных ферментов. Кроме того, так как большинство индукторов являются, как и стероиды, жирорастворимыми веществами они активно захватываются мембранными структурами цитоплазмы гепатоцитов, вытесняя при этом из соответствующих сайтов связывания «депонированные» стероиды. Концентрация последних повышается в цитоплазме, а затем и в ядре клеток. Связывание с апорепрессором усиливается, активируется процесс синтеза энзимов метаболизма ксенобиотиков.
в соответствие с более поздними представлениями механизм действия стероидных гормонов, полициклических ароматических углеводородов, 2,3,7,8,-тетрахлордибензо-п-диоксина, состоит во взаимодействии с цитозольными рецепторными белками. Образующиеся комплексы мигрирует в ядро клетки, где вызывают дерепрессию регуляторных генов и, тем самым, активирует синтез того или иного энзима. В случае ТХДД такой рецепторный цитоплазматический протеин идентифицирован, по крайней мере, в гепатоцитах лини мышей, чувствительных к ароматическим углеводородам. Установлено, что синтез гидроксилазы ароматических улеводородов (aryl hydrocarbon hydroxylase) регулируется локусом единственного доминантного гена, Ah, и может быть усилен при введении ТХДД. Цитозольный белок-регулятор гена получил название Ah-рецепторный протеин.
Другие индукторы, такие как барбитураты, вероятно действуют с помощью иного механизма. Хотя известно, что в основе процесса также лежит индукция синтеза белка, до конца не выяснено каким образом клетка распознает индуктор и как осуществляется воздействие на процесс транскрипции. Индукторы класса фенобарбитала относятся к числу малоактивных соединений. Для реализации эффекта нужны дозы препаратов на несколько порядков превышающие эффективные дозы ТХДД. Рецепторный белок для фенобарбитала пока не идентифицирован.
Помимо усиления синтеза энзимов дополнительным механизмом индукции является стабилизация информационной РНК и белковых молекул в клетке.
6.3.1.3. Влияние индукторов на токсичность ксенобиотиков
Достаточно часто усиление метаболизма ксенобиотиков приводит к снижению их токсичности. Так, повторное введение фенобарбитала белым крысам самцам приводит к увеличению резистентности животных примерно в полтора раза к таким высоко токсичным ФОС, как зарин, зоман, ДФФ и др. Понижается чувствительность экспериментальных животных к цианидам. Вместе с тем токсичность других веществ, при этом, существенно возрастает. Например, усиливается гепаттоксическое действие алкалоида монокротолина и циклофосфамида, канцерогенная активность 2-нафтиламина. Вследствие индукции усиливается также токсичность четыреххлористого углерода, бромбензола, иприта и др.
Другим последствием индукции может быть изменение соотношения интенсивности метаболизма ксенобиотиков в разных органах и тканях, в результате чего основным органом биопревращения ксенобиотика у экспериментального животного, получавшего индукторы, становится иной орган, чем у интактных животных. Так, после введения крысам 3-метилхолантрена (индуктор) основным органом метаболизма 4-ипомеанола (токсичный дериват фурана) становятся не легкие (как в норме), а печень.
Индукторы из группы производных барбитуровой кислоты способны одновременно активировать синтез одних изоферментов (например, цитохромР-450 зависимых оксидаз) и угнетать активность других. В этой связи a priori трудно предсказать последствия влияния индукторов на токсичность ксенобиотиков.
У человека индукция микросомальных ферментов нередко становится следствием различных привычек (курение, прием алкоголя и т.д.), профессионального и экологического контакта с веществами (ПАУ, органические растворители, диоксины, галогенированные инсектициды и т.д.), длительного приема некоторых лекарств (барбитураты, антибиотики типа рифампицин и т.д.).
6.3.2. Угнетение активности энзимов
Многие вещества способны угнетать активность ферментов, катализирующих метаболизм ксенобиотиков.
Группа ингибиторов метаболизма включает:
— реакционноспособные промежуточные метаболиты, ингибирующие активность энзимов нескольких типов в месте их образования: метаболиты четыреххлористого углерода, дихлорэтана и т.д.;
— ингибиторы синтеза кофакторов и простетических групп энзимов. К числу таких относятся, например, Со, блокирующий синтез гема, являющегося простетической группой цитохромР-450 зависимых оксидаз; вещества истощающие запасы глутатиона в клетках.
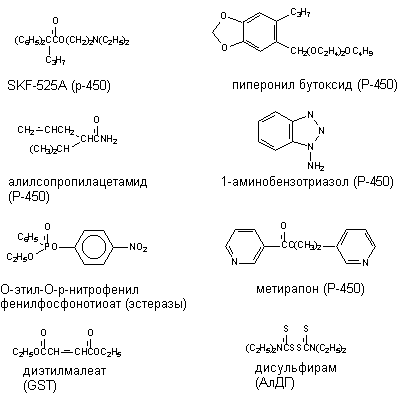
Ингибиторы ферментов метаболизма не нашли в настоящее время практического применения. Однако в условиях лаборатории для исследовательских целей некоторые из них используются достаточно часто (рисунок 16).
Рисунок 16. Некоторые ингибиторы метаболизма ксенобиотиков. В скобках указаны ингибируемые энзимы
Коканцерогенное действие некоторых соединений обусловлена их способностью угнетать процессы детоксикации канцерогенов. Так, пиперонилбутоксид (ингибитор Р-450) является коканцерогеном фреонов 112 и 113.
6.3.3. Двухфазный эффект: угнетение и индукция
7. Активные метаболиты и их роль в инициации токсического процесса
Многие ткани являются мишенью для повреждающего действия продуктов метаболизма некоторых ксенобиотиков. Как правило, чем менее токсично вещество, то есть, чем большее его количество вызывает интоксикацию, тем выше вероятность того, что в основе инициации различных форм токсического процесса может лежать действие реактивных промежуточных продуктов метаболизма (рисунок 17).
 |
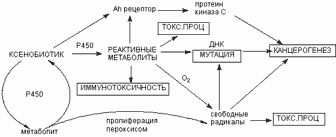 + Щелкните для загрузки увеличенной копии (4,53кб, 560×228 GIF) |
| Рисунок 17. Роль метаболических превращений ксенобиотика в развитии различных форм токсического процесса |
 |
Некоторые вещества активируются уже в ходе однократного превращения, другие в результате многоэтапных превращений, локализующихся порой в разных органах и тканях. Одни метаболиты проявляют свое пагубное действие непосредственно в месте образования, другие способны мигрировать, производя эффект в других органах. Обычно рассматривают три модели механизмов, связывающих явление метаболизма ксенобиотиков и процессы формирования повреждения органов и систем.
Рисунок 18. Модель N1
Таблица 7. Классификация ксенобиотиков по способу их биотрансформации (модель N1)