У кота запор после антибиотиков что делать
Шесть причин «красной диареи»
Как известно, нормальный здоровый стул оформлен, однороден, мягок и имеет буро-коричневый цвет. Диарея, или понос, – состояние само по себе неприятное, но обычно оно не является симптомом чего-то клинически серьезного. Другое дело, если отмечается диарея «красная» или кровавая, – это признак тревожный, а возможно, и угрожающий.
Диарея возникает в том случае, когда пищевые продукты и жидкости продвигаются по кишечнику слишком быстро. Не успевая оформиться в однородную массу, продукты пищеварения выводятся в жидкой форме.
Диарея с примесью крови – в любом случае серьезный симптом, и оттенок стула может помочь установить причину явления. В данной статье рассматриваются наиболее вероятные причины и диагностическое значение некоторых специфических оттенков каловых масс.
Причины
2. Красная пища. Пищевые продукты, от природы имеющие красный цвет или содержащие красные пищевые красители, особенно если они к тому же токсичны или способны оказывать раздражающее действие. К наиболее распространенным продуктам такого рода относятся свекла, клюква, красные конфеты или красная глазурь, лакрица, помидоры и томатный соус.
3. Желудочно-кишечное кровотечение. Может возникать при ряде патологических состояний и условий, включая толстокишечные полипы, язвенный колит, рак желудка и т.д. В таких случаях кровопотеря может быть весьма значительной, что и приводит к появлению красной диареи.
4. Геморрой. Аномальное расширение и набухание кровеносных сосудов внутри прямой кишки и ануса может становиться причиной ректального кровотечения и красной диареи.
5. Прием медикаментов. Стул с примесью крови может быть побочным эффектом некоторых лекарств, которые раздражают желудок и в этом случае становятся причиной кровавого поноса. Примером выступают жидкие лекарственные формы антибиотиков.
6. Анальная трещина. В некоторых случаях незаживающая язва в ректально-анальной зоне также начинает кровоточить, что приводит к появлению в стуле небольших объемов ярко-алой крови.
Другие необычные оттенки стула
Аномальная окраска экскрементов может быть обусловлена различными причинами.
1. Черный оттенок. Дегтеобразный черный стул или стул с консистенцией кофейной гущи может свидетельствовать о выраженном гастроинтестинальном кровотечении. Характерный вид и цвет кровавая диарея приобретает в связи с более продолжительным пассажем масс из верхних отделов ЖКТ. Кроме того, аналогичный эффект может вызываться потреблением лакричного сиропа или виноградного сока в больших количествах.
2. Зеленый оттенок. Возникает из-за присутствия желчи в каловых массах, или же при приеме железосодержащих пищевых продуктов/добавок (в этом случае кал приобретает темно-зеленый оттенок).
3. Бесцветный стул. Напоминающий глину слабоокрашенный стул нередко наблюдается при желчнокаменной болезни. Если одновременно отмечается темная моча, это еще одно указание на возможные проблемы с печенью или желчным пузырем. Кроме того, к «выцветанию» стула может приводить прием некоторых антацидных препаратов, содержащих гидроксид алюминия, а также отдельные формы вирусного гепатита.
4. Желтоватый маслянисто-жирный стул с примесью слизи является частым симптомом кишечной инфекции или серьезных нарушений всасывающей функции кишечника (синдром мальабсорбции), например, при целиакии.
Когда обращаться за помощью
Поскольку красная диарея может оказаться одним из ранних симптомов (или первым проявлением) жизнеугрожающего состояния, обратиться к врачу следует как можно скорее.
В особенности это необходимо сделать в тех случаях, когда дополнительно к красной диарее наблюдается следующее:
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
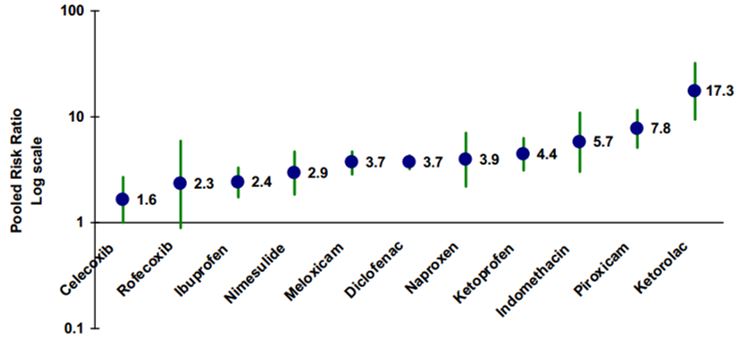
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Современные представления о грибковой патологии пищеварительного тракта
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
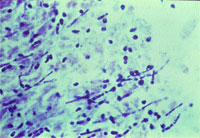 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
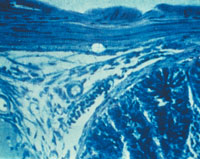 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
II. Кандидозный эзофагит.
III. Кандидоз желудка.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
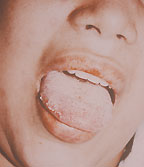 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
Ларингофарингеальный рефлюкс
Чекалдина Елена Владимировна
оториноларинголог, к.м.н.
Ларингофарингеальный рефлюкс (ЛФР) — это заброс желудочного содержимого (кислоты и таких ферментов, как пепсин) в гортань, приводящий к появлению охриплости, ощущению кома в горле, затруднению глотания, кашлю, ощущению слизи в гортаноглотке.
Рефлюкс, как причина вышеописанных симптомов без гастроэзофагеальной рефлюксной болезни (ГЭРБ), постоянно ставится под сомнение. Руководства, выпущенные специализированными обществами в области ларингологии и гастроэнтерологии, представляют разные точки зрения. Обе группы признают, что интерпретация существующих исследований затрудняется из-за неопределенных диагностических критериев ЛФР, различных показателей ответа на лечение и значительного эффекта плацебо при проводимом лечении.
Имеются относительно ограниченные данные о распространенности ЛФР: примерно у 30% здоровых людей могут фиксироваться эпизоды рефлюкса на суточной pH-метрии или обнаруживаться характерные изменения в гортани.
ЛФР может прямо или косвенно вызывать гортанные симптомы. Прямой механизм включает раздражение слизистой оболочки гортани едкими веществами — рефлюксатами (кислота, пепсин). Косвенный механизм включает раздражение пищевода, что приводит к гортанным рефлексам и появлению симптомов.
Инфекция Helicobacter pylori также может вносить свой вклад. Распространенность H. pylori среди пациентов с ЛФР составляет около 44%.
Ларингофангеальный рефлюкс и ГЭРБ
Хотя кислота желудка является общей как для ЛФР, так и для ГЭРБ, существует много различий, что делает ЛФР отдельным клиническим объектом.
Между слизистой оболочкой пищевода и гортани есть существенные различия.
Симптомы ларингофарингеального рефлюкса
Некоторые исследователи считают, что хроническое раздражение гортани может приводить к развитию карциномы у пациентов, не употребляющих алкоголь или не курящих, хотя данных, подтверждающих это, нет.
Симптомы, характерные для ЛФР, также могут быть обусловлены следующими состояниями:
Диагностика
Существуют значительные разногласия по поводу подходящего способа диагностики ЛФР.
Большинству пациентов диагноз ставится клинически — на основании симптомов, связанных с ЛФР.
При ларингоскопии (осмотре гортани) отмечается отечность и гиперемия (краснота) различной степени. Однако относительно слабая корреляция между симптомами и эндоскопическими данными является аргументом против использования эндоскопических методов диагностики.
Шкала рефлюксных признаков и индекс рефлюксных симптомов хорошо подходят как для диагностики, так и для мониторинга ответа на терапию.
Суточная Ph-метрия зондом с двойным сенсором, несмотря на превосходную чувствительность и специфичность, ставится под сомнение, так как результаты этого диагностического метода зачастую не коррелируют с тяжестью симптомов.
Еще одним вариантом диагностики может быть эмпирическое назначение терапии ИПП.
Лечение ларингофарингеального рефлюкса
Изменение образа жизни и диета являются основным подходом при лечении ЛФР и ГЭРБ. Роль медикаментозной терапии более противоречива. Нуждаются ли в лечении пациенты без симптомов заболевания, со случайно выявленными признаками ЛФР, неизвестно. Существуют теоретические опасения, что ЛФР может увеличить риск злокачественных новообразований, но это пока не доказано. В любом случае, пациентам с бессимптомный ЛФР рекомендуется соблюдение диеты.
Пациентам рекомендуется отказаться от курения, алкоголя, исключить продукты и напитки, содержащие кофеин, шоколад, мяту. К запрещенным продуктам также относятся большинство фруктов (особенно цитрусовых), помидоры, джемы и желе, соусы для барбекю и большинство заправок для салатов, острая пища. Питание рекомендуется дробное.
Следует избегать физических упражнений в течение как минимум двух часов после еды, воздерживаться от еды и питья за три часа до сна.
Медикаментозная терапия обычно включает ингибиторы протонной помпы (ИПП), блокаторы H2 и антациды. ИПП рекомендуется принимать в течение шести месяцев для большинства пациентов с ЛФР. Данная цифра основана на результатах эндоскопических исследований (именно это время необходимо для уменьшения отека гортани), а также высоком проценте рецидива в случае трехмесячного курса терапии. Прекращение терапии следует проводить постепенно.
Если терапия ИПП и блокаторами Н2 оказалась безуспешна, следует рассмотреть вариант лечения трициклическими антидепрессантами, габапентином и прегабалином, так как один из возможных механизмов развития рефлюкса — повышенная чувствительность гортани.
Как проходит лечение ларингофарингеального рефлюкса в клинике Рассвет?
Все пациенты с жалобами на охриплость, ощущение кома в горле, затруднение глотания, кашель, ощущение слизи в гортаноглотке осматриваются оториноларингологом и гастроэнтерологом.
Проводится эндоскопическое исследование полости носа, носоглотки и гортани для исключения других заболеваний, которые, помимо ЛФР, могут провоцировать эти симптомы. Гастроэнтеролог также назначает весь необходимый спектр обследований, в том числе исключает инфекцию H. Pylori.
Залог успешной терапии — совместное ведение пациента оториноларингологом, гастроэнтерологом, в ряде случаев психиатром и психотерапевтом.