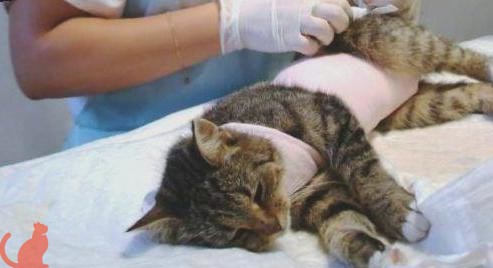
У кошки разошелся шов после операции что делать
Кошка после стерилизации разлизала шов и он разошёлся, что делать?
Оперативное вмешательство для животного – это стресс, который нужно сглаживать любым доступным способом, иначе это приведёт к развитию вторичных патологических процессов. Кроме того, операция подразумевает нарушение цельности кожного покрова и мышечной ткани, а это требует длительного и внимательного ухода, долгого периода реабилитации и тщательной обработки операционного шва.
Методы наложения шва после стерилизации кошки
Весомое значение имеет метод наложения шва.
Способ наложения шва после стерилизации имеет большое значение.
Их существует два – внутренний шов и внешний.
Ряд правил после операции
После операции кошке нужно обеспечить покой.
Существует свод правил, которых необходимо придерживаться в послеоперационный период.
От профессионализма хирурга во многом зависит то, насколько прочными они окажутся.
Почему может разойтись шов
Несмотря на старания доктора, все же существует ряд причин, из-за которых может произойти расхождение места сечения.
Шов может разойтись из-за слишком тугой повязки.
А также причинами могут служить дополнительные факторы:
Симптомы того, что разошёлся шов
Расхождение может произойти до снятия швов, если был применён наружный метод, и после снятия.
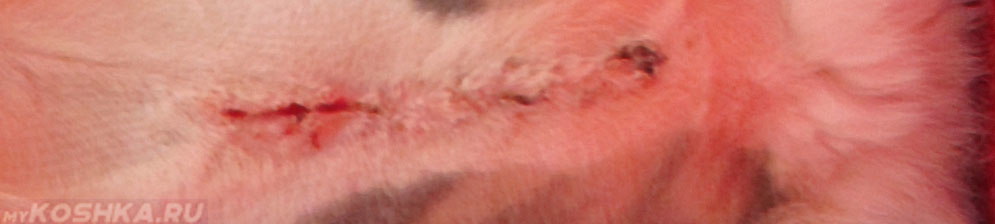
Расхождение шва у кошки.
Боль у кошки
Проявление боли у кошки – основной признак расхождения шва.
Покраснение места разреза
Покраснение места разреза после операции — это симптом что шов может разойтись.
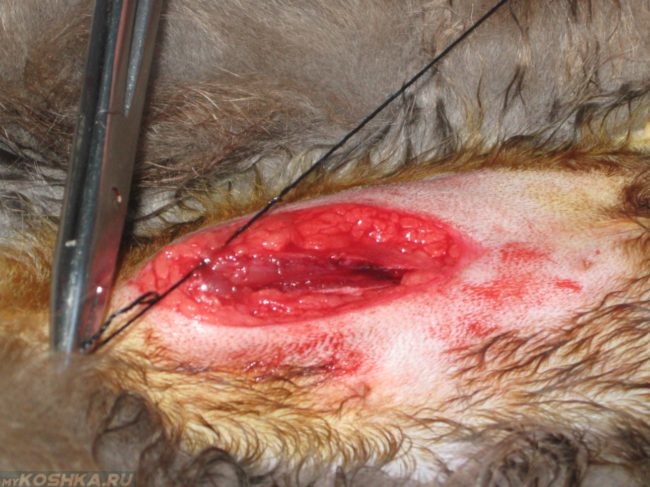
Следующим симптомом выступает покраснение места разреза, возможно отекание окружающих тканей. При пальпации кожа будет горячей. Края места сечения могут отходить друг от друга, возможно выделение кровянистой жидкости, так называемой сукровицы. Опасным симптомом будет выделение гноя через края раны. Такое явление может свидетельствовать о сильном воспалительном процессе.
Кошка разлизала шов
Если у кошки сняли попону, от она может разлизать шов.
Если у кошки сняли попону, от она может разлизать шов. Это инстинкт. Необходимо следить за качеством затяжки попоны и не допускать её ослабления.
Что делать, если разошёлся шов после стерилизации?
При подозрении расхождения швов, необходимо размочить прилипшую повязку перекисью водорода и аккуратно снять её.
Чтобы снять прилипшую повязку, следует ее размочить перекисью водорода.
Видео о том, как обрабатывать швы после стерилизации кошки
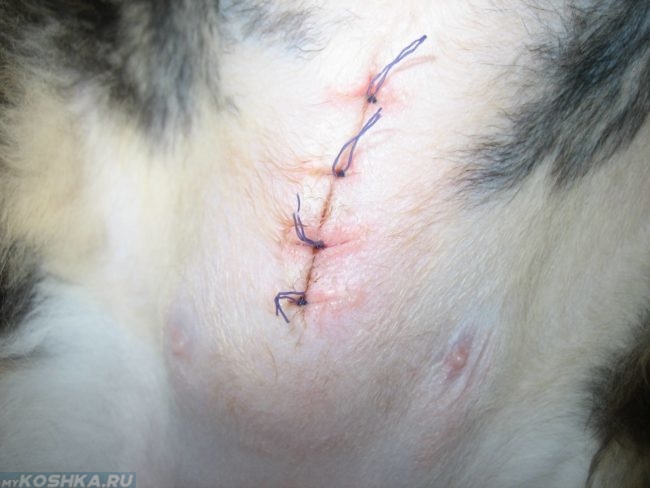
Шов после стерилизации кошки
Шов при стерилизации кошек может быть достаточно большим при проведении оперативного вмешательства по белой линии живота, небольшим (не более 1 см) при проведении стерилизации методом бокового разреза и практические незаметным, при осуществлении стерилизации методом лапароскопии. Какой должен быть шов после стерилизации кошки объяснит ветеринарный специалист, проводивший оперативное вмешательство.
В зависимости от выбранной методики проведения операции, величина шва будет отличаться. Как правило, швы накладывают при рассечении мышечных слоев и кожного покрова при стерилизации по белой линии живота.
Данная методика широко применяется при удалении матки и яичников (овариогистероэктомия). При удалении только яичников, используют более щадящие методики, не требующие большого количества швов, или же вообще отсутствуют (при лапароскопии).
Внутренние швы накладывают на мышечные слои с применением само рассасывающегося шовного материала, а наружные зашивают хирургическими нитями, которые в дальнейшем необходимо снимать.
В зависимости от того, какой шов после стерилизации у кошки, будет зависеть скорость регенерации тканей. Важно отметить, что во время всего послеоперационного периода шов должен оставаться чистым и максимально сухим.
При обнаружении любых патологических изменений – нагноения, воспалительных процессов или же кровянистых выделений, необходимо обратиться в ветеринарную клинику, во избежание серьезных осложнений.
Шов у кошек после проведения стерилизации
Как упоминалось ранее, где шов после стерилизации кошки будет находиться, зависит от метода проведения и вида хирургического вмешательства по удалению репродуктивных органов у самок.
Важный момент – правильная обработка и уход за швом после стерилизации. До момента, когда ветеринар разрешит снимать швы, необходимо проводить ежедневную обработку специальными антисептическими средствами, не содержащими спирт (во избежание ожогов кожного покрова).
Заживает шов после стерилизации у кошки в зависимости от рассечения и проводимого метода операции. В подавляющем большинстве швы снимают на 7-10 день. Не снятые вовремя швы на 12 день начинают врастать в кожу.
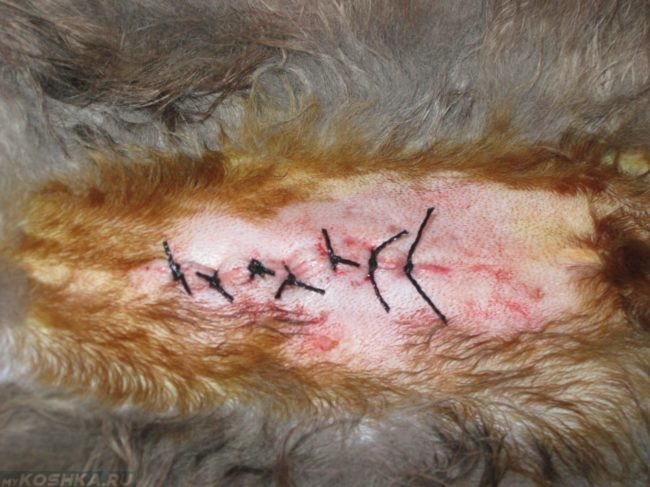
Шов после стерилизации кошки должен выглядеть аккуратно, без сильных припухлостей и сильного изменения цвета кожного покрова. Накладывают швы при стерилизации двумя основными способами:
Первый вид шва выглядит в виде нескольких ниток, завязанных на узелки через равные промежутки расстояний. Непрерывный шов имеет начало и проходит через всю рану, фиксируясь на другом конце.
В ветеринарной практике все чаще используют скрепочный шов. Так как при возникновении экссудата под кожным покровом в области наложения шовного материала, можно снять несколько нитей, не распуская остальные края раны, чего нельзя сделать при непрерывном шве.
При проведении стерилизации методикой через боковой разрез, шов будет не большим (не более 1 см) и располагаться сбоку, а не посередине живота. Шов на боку не требует обязательного ношения послеоперационного бандажа и уход за ним намного проще.
Особое внимание необходимо уделить рассасывающимся швам, так как они набирают большую популярность среди ветеринаров.
Связано это с тем, что при наложении косметического шва после стерилизации кошки, не требуется тщательного послеоперационного ухода за швами.
Риск послеоперационных осложнений сводиться к минимуму. Кроме того, само рассасывающиеся швы у кошки после стерилизации намного удобнее как для владельца, так и для самого питомца. Нет необходимости срочно ехать в ветеринарную клинику, подвергая кошку очередному стрессу, для снятия послеоперационных швов.
Основными преимуществами внутреннего шва по сравнению с накожным, являются:
Стоит помнить, что наложение косметического внутреннего шва не всегда возможно по ряду медицинских причин. Именно поэтому чаще используются наружные швы, требующие дальнейшего правильного ухода за ними.
Как и чем нужно обрабатывать швы кошке после стерилизации, должен рассказать ветеринарный специалист, проводивший манипуляцию. Ведь только хирург, проводивший операцию, сможет точно указать возможные изъяны и осложнения в восстановительный период.
Прежде чем приступать к обработке шва, необходимо дать питомцу обезболивающее средство и выждать минимум 60 минут. После обезболивания, необходимо очистить раневую поверхность от ворсинок, подсохшей крови или сукровицы при помощи ватного диска, смоченного предварительно в растворе хлоргексидина. Важно помнить, что обработка самого шва должна производиться не ранее, чем через 2 дня после стерилизации. После очистки на рану наносят мазь с антибиотиком, смазывая все складочки (это необходимо для предотвращения попадания и дальнейшего размножения патогенной бактериальной микрофлоры в рану).
Если у животного операция проведена методом бокового разреза, то в таком случае уход за раной еще проще. Боковой шов обрабатывают специальными средствами – Алюминиум-спрей или Чеми-спрей. Обработка производиться один раз в день или же один раз в 2-3 дня до полного заживления раны.
Возможные осложнения у кошки после операции стерилизация в области шва
Возникновение осложнений у кошек после стерилизации при правильно организованном после операционном уходе достаточно редки. Но в некоторых случаях осложнения возникают и чаще всего в области шва. Если у кошки разошелся шов после стерилизации, то причин может быть несколько:
Выпуклый шов у кошки после стерилизации повод немедленно обратиться к ветеринарному специалисту. Уплотнение или припухлость шва могут быть свидетельством послеоперационного отека, являясь вариантом нормы, разрастание грануляционных тканевых структур, проходящие самостоятельно или же возникновение процессов патологического характера. Причинами того, что опух шов у кошки после стерилизации, могут быть:
Случается так, что у кошки не заживает шов после стерилизации в результате ожирения, сахарного диабета, нарушения рациона питания, злокачественных опухолевых новообразований, заболеваний почечных структур и при кашле.
Особо важно отметить, что если после стерилизации у кошки кровит шов, необходимо срочно обратиться к ветеринару за помощью. Связано это с открытием кровотечения в брюшной полости, возникающим в результате недостаточной коагуляции крупных сосудов, снабжающих матку и яичники. В некоторых случаях образовываются спайки и сгустки крови, которые необходимо удалять хирургическим путем.
При нарушении правил асептики и ухода за раневой поверхностью, может воспалиться шов. Если гноиться шов после стерилизации у кошки, причиной, как правило, является проникновение в открытую рану пыли, грязи и чужеродной патогенной микрофлоры.
В таких случаях назначают тщательную обработку шва с применением специальных антисептических растворов и использование противобактериальных мазей. При запущенных процессах, когда шов загноился давно, и не были предприняты срочные меры, животному необходимо проведение еще одного оперативного вмешательства с целью удалению под общим наркозом пораженных участков кожного покрова.
Снятие швов кошке после стерилизации
В случае, если процесс заживления проходит нормально, снимать швы после стерилизации кошки нужно на 7-10 день после манипуляции. Это касается оперативного вмешательства, проводимого методом рассечения тканей по белой линии живота.
Если же стерилизация проводилась посредством бокового разреза, то накладываются косметические швы, которые снимать не нужно. Обычно после стерилизации кошки шов заживает через 10 дней.
Полное восстановление тканей зависит от вида операции и метода наложения швов. Процесс заживления всегда сопровождается зудом у питомца, поэтому необходимо позаботиться о специальной защитной попоне, которая поможет предотвратить разлизывание или же инфицирование раневой поверхности.
По истечении времени, владелец животного при нормальном заживлении послеоперационного шва, может самостоятельно снять швы.
Важно помнить, что удалению подлежит исключительно тот шовный материал, который видно на поверхности кожи. Лезть в рану и убирать внутренние швы у кошки после стерилизации категорически запрещено. Лучше, конечно же обратиться в ветеринарную клинику, так как там смогут нормально зафиксировать животное, оценить состояние заживления шва и убрать шовный материал.
Как ухаживать за швом после стерилизации кошки
Стерилизация кошки, находящейся не в разведении, положительно влияет на ее самочувствие и поведение, помогая снизить риск возникновения онкологии молочных желез, опухолей и гнойных поражений матки. Процедура удаления яичников несложная, но это все же полостная операция со всеми ее рисками. Поэтому владельцам животного необходимо с ответственностью и вниманием подойти к уходу за любимцем в постоперационный период. Нужно знать, как в норме выглядит шов после стерилизации кошки, как ухаживать за ним, чтобы избежать осложнений.
Уход за кошкой сразу после стерилизации
После процедуры животное оставляют под присмотром врачей в клинике, чтобы убедиться в отсутствии кровотечения. Если через полчаса-час состояние пациента остается удовлетворительным, его можно забрать домой. Не стоит оставлять подопечного в лечебнице надолго, это усиливает стресс и замедляет восстановление.
По приезду домой положите любимца на подстилку (обязательно на пол, чтобы избежать падения) и внимательно наблюдайте за его состоянием. Отход от наркоза может затянуться на несколько часов в зависимости от использованных препаратов. Если у питомца открыты глаза, требуется регулярно смыкать веки либо закапывать капли во избежание иссушения слизистой.
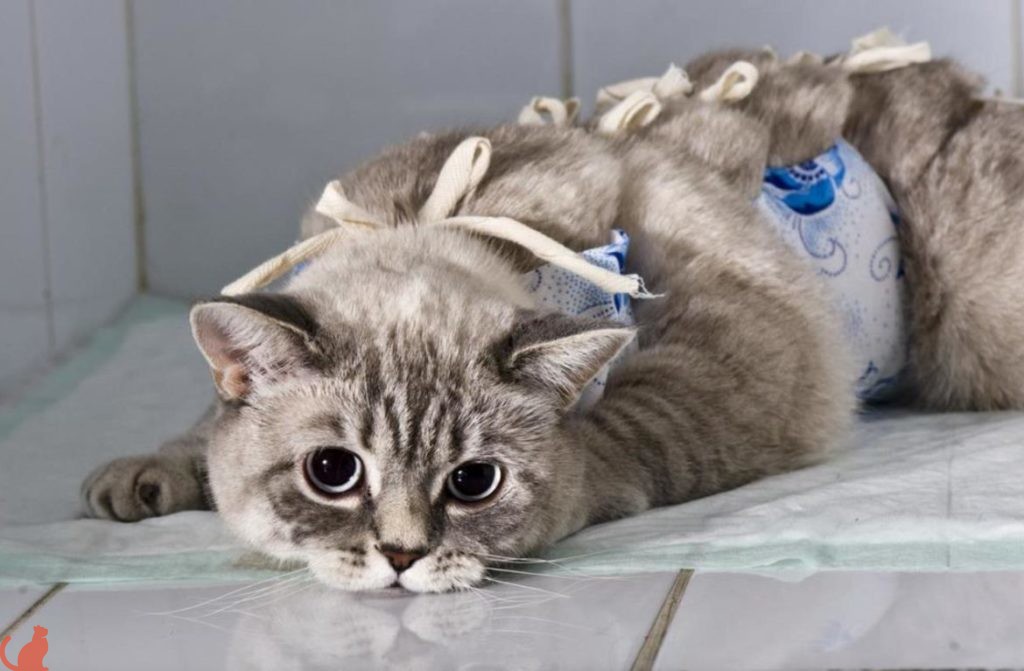
Чтобы кошка не зализывала рану, в клинике на нее надевают попону (бандаж) из хлопчатобумажной ткани. Хозяева должны следить, чтобы попона полностью закрывала прооперированную область, а также менять ее при загрязнении. Животное испытывает дискомфорт от такой «одежды» и пытается снять ее, но через пару дней привыкает к неудобствам.
Сам шов не требует ухода сразу после операции. Но на второй день нужно начать обрабатывать эту область дезинфицирующими средствами, не содержащими спирт. Процедуру производят ежедневно по 2 раза в сутки. Иногда в клиниках после операции на разрез наносят обволакивающие составы, препятствующие попаданию инфекции на срок до 7 дней. В этом случае врач должен дать отдельные рекомендации о необходимости и частоте ухода за швом.
В зависимости от способа проведения операции, разрез длиной 3-4 см располагается на брюшине спереди или сбоку. Если операция производилась лапароскопическим методом, разреза не будет, а останутся дырочки, которые также обрабатывают дезинфицирующими составами.
Препараты, не содержащие спирта, разрешенные к применению:
Обрабатывать разрез лучше вдвоем, когда один человек аккуратно удерживает кошку за передние и задние лапы (питомец лежит на спине), а второй снимает попону и обильно смачивает рану ватным диском с раствором, убирая засохшие остатки сукровицы, либо орошает спреем. Процедуру следует проводить до полного заживления (10-14 дней).
При снятии попоны обратите внимание на то, как выглядит шов после кастрации кошки. Он должен быть сухим и чистым без кровянистых и гнойных выделений. До 5 дней допускается припухлость и небольшая краснота. Если разрез мокнет, появляется кровь или гной, животное нужно доставить в клинику для обследования.
Владельцев должны насторожить шишки и опухоли в прооперированной области. Это может быть как безобидное разрастание грануляционной ткани, не требующее вмешательства и проходящее само, так и абсцесс, который нужно вскрывать, или грыжа.
Следите за состоянием подопечного по его температуре, активности, аппетиту (сразу после стерилизации кормить не рекомендуется, разрешается только поить, а впоследствии использовать корм для кастратов в порциях, уменьшенных на четверть от ежедневного объема).
Что нельзя делать после стерилизации
После операции врач дает рекомендации по уходу за животным, но ошибки все-таки случаются. Что нельзя делать после операции:
Не закармливайте кошку, не разрешайте лежать на горячей батарее (на теплой можно), следите за наличием нормального стула и мочеиспускания (на 2-3 день после операции) и обращайтесь за консультацией к ветеринару при любом подозрении на осложнение.
Осложнения после стерилизации кошки
При несоблюдении рекомендаций врача, либо исходя из возраста и состояния здоровья пациента, могут возникнуть осложнения:
Ответственность за послеоперационный уход целиком возлагается на владельца. Заботьтесь о своем подопечном, внимательно следите за его состоянием и это поможет избежать тяжелых последствий и осложнений.
Снятие швов
Решение о том, через сколько снимают швы после кастрации кошки, принимает ветеринар, основываясь на особенностях операции, использованных материалов и способности тканей к регенерации у животного. По протоколу это происходит на 7-10 день (на 12 день нитки врастают в кожу, если не обрабатывались специальным составом).
Снимать нитки можно только при полной уверенности в заживлении шва. Не должно быть ни одного участка, выглядящего недостаточно сросшимся, с расходящимися срезами или засохшей сукровицей.
Мышцы скрепляют саморассасывающимися ниткам, а кожу — стандартным шовным материалом. Если кожа скреплялась саморассасывающимися нитками, нужно следить за разрезом особенно внимательно, поскольку случается преждевременное рассасывание до полного заживления.
Чтобы снять швы у кошки после стерилизации, срезают узелки в начале и конце шва, а затем тянут за нить в середине, если разрез закреплялся непрерывным способом. Когда закрепление осуществляется с помощью нескольких отдельных узелков, разрезают каждый из них.
Если после процедуры любимец проявляет повышенное внимание к этой области, постоянно вылизывает ее, лучше надеть попону еще на несколько дней, чтобы избежать разлизывания только что сросшейся раны.
Что делать, если кошка сама сняла швы
Раннее удаление швов чревато воспалением и даже выпадением внутренних органов из брюшины. Следите, чтобы попона целиком закрывала прооперированную область и не позволяйте животному лизать шов.
Если все же кошка сняла нитки самостоятельно, как можно скорее доставьте ее к хирургу, выполнявшему операцию, для оценки состояния разреза. При неудовлетворительной картине потребуется наложить швы заново.
Обработка швов кошке после стерилизации
Вся информация размещенная на сайте предоставляется в соответствии с Пользовательским соглашением и не является прямым указанием к действию. Мы настоятельно рекомендуем перед применением тех или иных средств обязательно получить очную консультацию в аккредитованной ветеринарной клинике.
У кошки разошелся шов после операции
Кошка беспородная, 16 лет, вес на момент операции 5.7 кг, сейчас чуть меньше 5 кг.
После операции:
— обработка швов 1 раз в день 3% раствором ПЕРЕКИСИ ВОДОРОДА
— смазывание швов БОРНЫМ СПИРТОМ
— КОБАКТАН 2.5% в дозировке 0.3 один раз в день в течение 5 дней.
Ношение попоны было невозможным из-за неудобного расположения шва подмышкой.
Все рекомендации выполняли. Через неделю кошка уже чувствовала себя хорошо: нормально кушала, ходила в туалет, мурчала, когда ее гладили. Швы были сухими и чистыми.
14 мая снимали швы. На пузике от стерилизации швы снялись без проблем, а вот подмышкой они немножко вросли в кожу и пришлось чуть-чуть прокалывать ножницами, там образовались совсем маленькие ранки (точки около 1 мм).
15 мая утром я обнаружила, что шов подмышкой в середине разошелся примерно на 1.5 сантиметра. Срочно отвезли кошку в клинику, там доктор, который делал операцию сказал, что в повторном накладывании швов нет смысла, потому что натяжение очень большое, рану промыли ПЕРЕКИСЬЮ и побрызгали АЛЮМИНИУМ-СПРЕЕМ и рекомендовали мне делать то же самое в течение 10 дней.
Когда пришла домой, обнаружила, что шов подмышкой разошелся полностью. Снова в панике повезла кошу к врачу. Там нас принял другой доктор, который наложил всего 3 шва мононитью (примерно на одинаковом расстоянии друг от друга, специально оставив дырки между ними) под местной анестезией и сказал, что срастаться будет по вторичному натяжению, иначе опять вероятен разрыв. Рекомендации на этот раз:
— 3 раза в день промывать рану ПЕРЕКИСЬЮ
— 3 раза в день закладывать внутрь и на рану СЕПТОГЕЛЬ
— 2 раза в день по краям раны мазать СОЛКОСЕРИЛом
— снова КОБАКТАН 2.5% в дозировке 0.3 один раз в день в течение 5 дней.
Сказал, что закрывать рану повязкой, обрабатывать спреем и т.д. не нужно.
Поведение кошки изменилось слегка: немного уменьшился аппетит и стала больше лежать. Постоянно слежу, чтобы она не лизала рану, ночью тоже стараюсь часто просыпаться, но боюсь не уследить.
Вопросы:
1. Все ли сделали правильно? Не стоит ли настоять на повторном полном наложении швов?
2. Стот ли что-то добавить к данным рекомендациям (напр, накладывать салфетки Бранолинд-Н или что-то подобное, брызгать спреем «Вторая кожа», или все-таки заказать «Алюминиум-спрей»), чтобы стимулировать процесс регенерации тканей, ведь кошка уже в возрасте.
3. Не опасен ли для здоровья кошки второй курс антибиотиков по той же причине возраста кисы?
4. Сколько по времени в норме будет заживать такая рана?
5. Может быть, надеть кошке защитный воротник, чтобы она не могла дотянуться до ранки? Или пусть вылизывается?
6. Может быть, не стоит оставлять рану открытой? Кошка ходит в туалет в наполнитель CATSAN комкующийся (он очень мелкий, а кошка любить покопаться в тазике), боюсь как бы гранулы или какая другая грязь не попали в открытую рану.
Послеоперационные нарушения функции пищеварительного тракта
Рассматриваются патогенетические и клинические аспекты состояния пищеварительной системы в раннем послеоперационном периоде.
Нарушение перистальтики в ближайшем послеоперационном периоде является стандартной ситуацией для абдоминальной хирургии и возникает не менее чем у 90% больных. Несмотря на это ряд авторов сообщает о том, что на фоне мультимодального подхода к ведению больных в послеоперационном периоде собственно илеус (динамическая кишечная непроходимость) возникает не более чем у 5% пациентов. Дисфункция пищеварительного тракта является более широким понятием, чем послеоперационный парез, и включает в себя широкий диапазон изменений, зависящих степени хирургической агрессии. Относительно небольшое число иследований включает пациентов с нарушениями функции пищеварительной трубки после экстраабдоминальных оперативных вмешательств. Тем не менее в ряде рандомизированных исследований было продемонстрировано, что экстраабдоминальные оперативные вмешательства сопровождались нарушениями функции пищеварительного тракта, что проявлялось невозможностью полного энтерального питания на протяжении 7 суток у 42 – 51% пациентов. При этом именно нарушение функции пищеварительного тракта являлось основным статистически значимым фактором развития послеоперационных осложнений, пролонгирования и значительного увеличения стоимости госпитализации. Было установлено, что стоимость лечения пациентов с послеоперационными осложнениями, связанными с дисфункцией пищеварительного тракта (14% от исследуемой группы), составила примерно 50% от всей стоимости лечения всех пациентов исследуемой группы.
Патогенез послеоперационной дисфункции пищеварительного тракта представляет собой целый комплекс различных факторов. Синдром энтеральной недостаточности объединяет в себе несколько взаимосвязанных и протекающих последовательно или параллельно патологических процессов в пищеварительном тракте, а именно: нарушение моторики пищеварительной трубки, нарушение внутрипросветного и пристеночного пищеварения, нарушение абсорбции питательных веществ, возникновение феномена бактериальной транслокации. Указанные патологические процессы являются закономерным следствием изменений нейрогуморальной регуляции, системной дисциркуляции и воспаления, развивающихся в ходе ответной реакции на операционную травму. Заметим однако, что дискуссия о патогенезе послеоперационной дисфункции пищеварительного тракта продолжается и в настоящее время, что подтверждается в первую очередь отсутствием четкой доказательной базы в отношении тех или иных лечебных мероприятий.
Традиционно в качестве ведущей составляющей синдрома энтеральной недостаточности у оперированных пациентов рассматривается нарушение моторно-эвакуаторной функции пищеварительного тракта. Исследования, посвященные изучению механизмов возникновения послеоперационного пареза пищеварительной трубки имеют длительную историю. Впервые угнетающее влияние спинальных рефлексов на деятельность кишечника в эксперименте установил еще в 1872 году F. Goltz. В 1899 году в своем классическом труде «The movements and innervation of the small intestine» W. Bayliss и E. Starling показали, что абляция nn. splanchnici может повышать моторную активность кишечника, угнетенную после лапаротомии. Авторы установили данную связь, используя так называемый энтерограф, позволивший им исследовать моторику интактной и поврежденной тонкой кишки в эксперименте. В последующие десятилетия ряд работ подтвердил влияние симпатической нервной системы на возникновение послеоперационного пареза пищеварительной трубки.
С точки зрения современной физиологии нормальная перистальтика является результатом комплекса взаимодействий нервных сплетений пищеварительной трубки, центральной нервной системы, гормональных влияний, локальных факторов, влияющих на гладкомышечную активность. Известно, что перистальтика желудка и тонкой кишки зависит от фазы пищеварения. По сравнению с периодом голодания перистальтика после приема пищи представляет собой набор низкочастотных, с вариабельной амплитудой, несгруппированных сокращений, чьи число, интенсивность и продолжительность зависят от физического состояния и химического состава пищи. Тем не менее и в межпищеварительный период (время голода) так называемый мигрирующий моторный комплекс, впервые описанный J. Szurszewski в 1969году, определяет возникновение периодических сокращений кишечной трубки и тем самым обеспечивает продвижение содержимого просвета кишечника длительное время после приема пищи. У человека подобные сокращения возникают примерно один раз каждые 1 – 2 часа. Мигрирующий моторный комплекс в межпищеварительный период включает в себя четыре фазы. Первая фаза заключается в изменении мембранного потенциала гладкомышечных клеток без мышечного сокращения. Появление перемежающихся мышечных сокращений знаменует переход ко второй фазе. В течение третьей фазы отмечаются максимальные по своей частоте сокращения, следующие за медленными волнами перистальтики (примерно 3 сокращения в минуту для желудка, 11 сокращений в минуту для двенадцатиперстной кишки). Четвертая фаза характеризуется снижением частоты перистальтических волн и возникновением относительного покоя кишечной трубки. Прием пищи нарушает функционирование мигрирующего моторного комплекса с возникновением нерегулярных, различных по частоте и силе сокращений гладкой мускулатуры.
Как известно мышечная оболочка желудка и тонкой кишки представлена тесно ассоциированным клеточным массивом, предполагающим возможность реализации электрофизиологических отправлений. Различают три разновидности электропотенциала мышечной оболочки: потенциал покоя, медленноволновой потенциал и пиковый потенциал, вызывающий гладкомышечные сокращения. При этом пиковый потенциал может возникнуть только при фоновом наличии медленноволнового потенциала, обусловленного активностью кишечного пейсмекера. Мнение об основополагающем и определяющем влиянии гастроинтестинальных гормонов на моторную активность пищеварительной трубки в последние годы подверглось серьезному пересмотру. В настоящее время принято считать, что моторная активность желудка и тонкой кишки определяется комплексом взаимодействий локальных электрофизиологических процессов, нисходящих нервных влияний и действия гастроинтестинальных гормонов.
Толстая кишка, чья основная роль заключается в абсорбции воды и формировании кала, по своей структуре и функционированию от других отделов кишечника. Измерение электрической активности толстой кишки показало наличие нерегулярных импульсов с различной амплитудой. Гладкая мускулатура толстой кишки не содержит достаточного числа специфических межклеточных контактов и поэтому не функционирует как единое целое. В толстой кишке также различают три вида электрической активности: собственно мембранный потенциал, дискретную электрическую активность, представляющую собой периодически возникающие пиковые потенциалы, накладывающиеся на осцилляции мембранного потенциала, и продолжительную электрическую активность, не относящуюся к осцилляциям мембранного потенциала, но определяющую возникновение мышечных сокращений и пассаж пищевых масс.
Хирургические манипуляции на пищеварительной трубке сопровождаются нарушением нормальной базальной электрической активности гладкомышечных клеток желудка и тонкой кишки. В частности в желудке отмечается нерегулярность возникновения пиковой активности и медленноволновой активности. Единственным стимулом перистальтических сокращений кишечника в послеоперационном периоде у пациентов, не получающих энтерально пищевые субстанции, остается мигрирующий моторный комплекс. Поэтому голодание в послеоперационном периоде уже само по себе закономерно влечет наличие минимальной перистальтической активности кишечника.
Установлено, что многие фармакологические агенты, например средства для наркоза, могут оказывать весьма вариабельное воздействие на активность мигрирующего моторного комплекса. Так галотан ингибирует активность мигрирующего моторного комплекса, в то время как энфлюран, напротив — возбуждает. Рассечение париетальной брюшины также уменьшает активность мигрирующего моторного комплекса, а длительное угнетение его активности наблюдается при любых механических воздействиях на кишечник в ходе операции. Вследствие операционной травмы также нарушаются и все три вида электрической активности толстой кишки. При этом восстановление продолжительной электрической активности, определяющей возникновение мышечных сокращений, занимает значительный период времени (около 72 часов после операции) и знаменуется началом отхождения газов и появлением стула. Несмотря на то, что очевидной причиной послеоперационного пареза является сниженная электрическая активность пищеварительной трубки, восстановление электрической активности гладкомышечных клеток не всегда совпадает с разрешением пареза.
В настоящее время известно, что серотонин играет важную роль в регуляции функций желудочно-кишечного тракта. Наибольший запас серотонина в организме находится в желудочно-кишечном тракте, составляя более чем 95 % от серотонина во всем организме. Основная часть серотонина содержится в энтерохроматофинных клетках кишечного эпителия, в пределах которого серотонин синтезируется из L-триптофана и хранится в секреторных гранулах. Серотонин действует как медиатор межнейрональных связей в мышечной оболочке тонкой кишки. Серотонин, выделяемый из энтерохроматофинных клеток, в ответ на химическую или механическую стимуляцию, воздействует на желудочно-кишечную моторику и кишечный транспорт электролитов. Перистальтика различных отделов кишечника координируется нейронами тонкокишечной нервной системы, которые после активации серотониновых механизмов продуцируют другие медиаторы. Помимо этого серотонин, находящийся в энтерохроматофинных клетках, регулирует рост соседних эпителиоцитов и может замедлять кишечное поглощение сахара и L-альфа-аминоизокапроновой кислоты (И.А. Соловьев, 2013).
В 2003 году А.П. Симоненков и соавт. представили патогенетическую концепцию серотониновой недостаточности как ключевого фактора развития синдрома энтеральной недостаточности, в том числе и в послеоперационном периоде. Согласно данной концепции, дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. На основании экспериментальных и клинических исследований установлено, что при патологических состояниях в организме увеличивается количество лигандов серотониновых рецепторов. Антагонисты серотонина при взаимодействии с серотониновыми рецепторами вызывают паралич гладкой мускулатуры. Агонисты напротив вызывают спазм гладкой мускулатуры. Согласно данной концепции дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. В дальнейшем миоциты оказываются неспособными к восприятию нервных импульсов ввиду выраженных метаболических сдвигов и внутриклеточных электролитных нарушений. Всё это ведёт к растяжению кишечных петель и повышению внутриполостного давления, приводя к повреждению, как всей пищеварительной системы, так и других функциональных систем гомеостаза.
Оксид азота (NO) в настояще время рассматривается как наиболее значимый нехолинергический и неадренергический ингибитор мышечной активности пищеварительной трубки. Считается, что свое ингибирующее действие NO оказывает внутри кишечных нейронов вследствие активизации NO-синтетазы. В экспериментах показано, что антагонист вазоактивного интестинального пептида, субстанция Р, и ингибиторы NO-синтетазы, достоверно усиливают кишечную перистальтику. Кальцитонин ген-связанный пептид присутствует в афферентных нейронах пищеварительного тракта, а также в интерстициальных рецепторах. Показана роль кальцитонин ген-связанного пептида в замедлении перистальтики и, в частности, в задержке эвакуации из желудка. Предполагается, что высвобождение кальцитонин ген-связанного пептида стимулируется операционной травмой и реализуется в замедлении перистальтики, что подтверждается влиянием антагонистов рецепторов данного медиатора или специфических моноклональных тел к нему на активизацию моторной активности пищеварительной трубки.
Эндогенные опиоиды, в большом количестве высвобождаемые в ответ на операционную травму, также рассматриваются как фактор возникновения послеоперационного пареза. Их тормозящий эффект на моторную активность желудка и кишечника реализуется посредством активации мю-опиоидных рецепторов. Так энкефалин вызывает угнетение желудочной и кишечной перистальтики и считается одним из факторов возникновения послеоперационного пареза.
Как обсуждалось выше кортикотропин-релизинг фактор (КРФ) является одним из ключевых медиаторов любой стрессовой реакции организма. Установлено, что КРФ и КРФ-связанный пептид индуцируют задержку эвакуации из желудка и ингибируют кишечную перистальтику, создавая картину, аналогичную послеоперационному парезу. При этом замедление перистальтики не зависит от приема питательных субстанций как энтерально, так и парентерально. В эксперименте было показано, что введение антагонистов КРФ-рецепторов перед оперативным вмешательством исключает возникновение пареза даже в случае механического воздействия на кишечник как минимум в течение 3 часов после операции. Отмечено повышение плазменного уровня КРФ в ответ на операционную травму, однако место синтеза данного медиатора до настоящего времени не установлено. Известно лишь, что данный пептид имеется в мозговом слое надпочечников, а активность чревных нервов и гормональная стимуляция катехоламинами является триггером к его высвобождению в кровоток. Отмечено также, что вазопрессин, выделяемый в ответ на физический стресс, может способствовать высвобождению КРФ.
В 2001 году N. Schwarz в эксперименте установил факт увеличения экспрессии циклооксигеназы 2 типа (ЦОГ-2) в тканевых макрофагах и нейронах кишечной стенки после механических манипуляций на кишечной трубке, что сопровождается увеличением концентрации простагландинов в перитонеальной жидкости и в плазме. При этом повышение концентрации простагландинов коррелирует со степенью снижения моторной активности кишечника, а ингибиторы ЦОГ-2 восстанавливают моторику кишечной трубки.
Как указывалось выше целый ряд средств анестезиологического пособия оказывают выраженное влияние на послеоперационные изменения моторики пищеварительного тракта. Известно, что средства для наркоза оказывают наибольшее ингибирующее влияние на моторику толстой кишки, что связано с особенностями ее автономной иннервации, а именно — с отсутствием плотных интрацеллюлярных контактов в гладкомышечном слое. Задержка эвакуации из желудка наиболее часто наблюдается при длительном воздействии препаратов, используемых при проведении нароза, таких как атропин, галотан, энфлюран.
Нарушение моторики пищеварительной трубки, а именно – возникновение ее пареза, определяет нарушение пассажа химуса, возникновение внутрипросветного дисбаланса его жидкой и газовой фаз, влекущего за собой, помимо нарушения всасывания, изменение микробной флоры кишки и проницаемости кишечной стенки.
Согласно патогенетической концепции, изложенной И.П. Колесник (2007), непосредственно после возникновения пареза пищеварительной трубки, несмотря на глубокое угнетение ее моторной функции, вследствие сохранности гемоциркуляции в кишечной стенке скопления газов и жидкости в просвете кишки не происходит. При этом процессы всасывания, моррфологическая структура эпителиоцитов слизистой оболочки тонкой кишки и микроциркуляции в кишечной стенке не нарушены. При сохранении пареза нарушение абсорбции начинается с угнетения всасывания сначала газов, а затем воды, электролитов и мономеров основных питательных веществ. Происходит растяжение кишечных петель и скопление в просвете кишки больших объемов газа и жидкости. Морфологические исследования выявляют выраженные изменения со стороны эпителия ворсинок и сосудов микроциркуляции, что проявляется нарушением оттока из ворсин по венам и лимфатическим сосудам, что при сохранности артериального притока ведет к увеличению фильтрационной секреции в просвет кишечной трубки и нарушению всасывания. Данный процесс принято обозначать термином «внутрипросветная секвестрация жидкости». В дальнейшем прогрессирование нарушения моторной и эвакуаторной функции приводит к нарушению всасывания газов и дальнейшему повышению внутрикишечного давления. Когда величина последнего достигает уровня диастолического давления, прекращается всасывание жидкости, что в свою очередь обуславливает дальнейшее растяжение кишечных петель и нарушение артериальной перфузии кишечной стенки.
Возникновение ишемии пищеварительной трубки в послеоперационном периоде является закономерным следствием системной дисциркуляции и по мнению целого ряда авторов играет решающую роль в развитии синдрома энтеральной недостаточности. К основным причинам ишемизации стенки кишечника (вообще и в послеоперационном периоде — в частности) относят системное токсическое влияние медиаторов воспаления (цитокины, активированные нейтрофилы, свободные кислородные радикалы), нарушение микроциркуляции и периферического шунтирования крови (нарушение реологии, чрезмерный выброс цитокинов и вазоактивных веществ, активация эластиназы), системные нарушения кровоснабжения кишечника (централизация кровообращения, артериальная гипотония, снижение сердечного выброса), анатомические особенности кровоснабжения слизистой кишечника («феномен шпилькообразной петли и сепарации плазмы»), открытие артериоло-венулярных шунтов и выключение из кровообращения части микрососудистой сети, перивазальные изменения в виде отека тканей, лейкоцитарной инфильтрации и микрогеморрагий.
Очевидно, что перфузия кишечной стенки ухудшается по мере повышения внутриполостного кишечного давления. А.А. Курыгин и совт. (2007) указывают на то, что критическое давление в просвете кишки составляет 30 мм рт. ст. При повышении давления до 40-60 мм рт. ст. почти вся кровь минует интрамуральную капиллярную сеть и шунтируется в венозное русло. При этом нарушения регионарного кровообращения и микроциркуляции ведут к недостаточной доставке кислорода и энергетических субстратов к тканям стенки кишки, в результате чего развиваются вторичная тканевая гипоксия и глубокие нарушения метаболических процессов. Ишемия приводит к анаэробному метаболизму, ацидозу, исчерпанию энергетических запасов клетки и необратимым её изменениям. Снижается активность дыхательных ферментов клетки, уменьшается образование макроэргов. Активизируются распад тканевых липидов, катаболизм белков, дезаминирование и переаминирование аминокислот. Нарушение процесса окислительного фосфорилирования, который происходит в митохондриях, может приводить к переходу клетки на анаэробный метаболизм даже в присутствии кислорода. На сегодняшний день общепризнанной является точка зрения, согласно которой максимальное повреждающее действие на ткани оказывает не столько ишемия, сколько феномен реперфузии. В условиях восстановленного кровотока в присутствии кислорода фермент ксантиноксидаза преобразует гипоксантин в ураты и кислородные радикалы (О2‾, ОН+), запускающие процесс перекисного окисления тканей. Причем, это явление происходит не только при абсолютной, но и на фоне относительной гипероксии. Происходят активация перекисного окисления липидов, приводищее, в первую очередь, к повреждению клеточных мембран, состоящих из фосфолипидов. Перекисное окисление белков вызывает инактивацию ферментов; углеводов — деполимеризацию полисахаридов, составляющих основу межклеточного вещества. Кроме того, при реперфузии повреждающим механизмом является перемещение ионов кальция внутрь клетки. При этом разрушаются рибосомы с последующим нарушением синтеза белка и АТФ, развивается вазоспазм, активируется метаболизм арахидоновой кислоты, что приводит в результате к усилению расстройств микроциркуляции и нарушению проницаемости мембран. По А.П. Зильберу (1995) возросшая в условиях ишемии осмолярность тканей (на 40—50 мосм) после восстановления кровотока способствует привлечению воды в чрезмерно большом количестве, что неизбежно приводит к развитию отека тканей.
Морфологическими проявлениями нарушения гемоперфузии кишечной стенки является разрушение микроворсинок щеточной каймы, гликокаликса и самой цитоплазматической мембраны с выходом в просвет кишки цитоплазматических органелл и включений, а также к расширение межклеточных контактов и разрыхлению самой плазмоллемы. При длительной гипоксии кишечной стенки выявляются некроз и слущивание энтероцитов в просвет кишки, в глубокие дистрофические изменения структуры миоцитов и клеток серозной оболочки. При этом возникает утрата эпителиальной целостности слизистой оболочки с формированием эрозий и язв.
Следствием гипоксии кишечной стенки и дистрофических изменений в ее мышечном слое является нарушение проводимости в интрамуральных нервных сплетениях и резкое снижение сократительной способности гладкомышечных клеток. Данная ситуация в еще большей степени усугубляет парез пищеварительной трубки и тем самым усиливает нарушение ее гемоперфузии, замыкая circulus vitiosus.
Нарушение пассажа кишечного содержимого практически сразу же влечет за собой нарушение микробного пейзажа кишечника. При этом имеет место восходящая миграция толстокишечной микрофлоры и избыточная (от 10 4 до 10 12 КОЕ/мл) бактериальное обсеменение тонкой кишки, обозначаемая в литературе как синдром избыточной бактериальной колонизации. Гиперпролиферация условно-патогенных бактерий сопровождается усилением бродильных процессов и повышением газообразования, что определяет дальнейшее повышение внутрипросветного давления с растяжением кишечной стенки. Происходит избыточное образование высокотоксичных веществ: индола, скатола, кадаверина. Дополнительное повреждающее действие на кишечную стенку оказывают и образующиеся в процессе микробного метаболизма аммиак и сероводород. Вследствие гипоксии и нарушения кровообращения подавляется биосинтез муцина и эпителий слизистой повреждается ферментами. Прогрессирующие деструктивные процессы слизистой оболочки, а именно — разрушение слоя слизи и гликокаликса, щеточной каймы и самих энтероцитов, деструкция базальной мембраны и собственной пластинки слизистой, приводят к утрате кишечной трубкой барьерной функции и возникновению феномена бактериальной транслокации. Лимфоидная ткань пищеварительной трубки в норме предотвращает внедрение инфекционных агентов во внутреннюю среду организма. В экспериментах установлено, что при стимуляции моторики усиливается синтез IL-4 и IL-10 собственной оболочкой тонкого кишечника, что увеличивает продукцию IgA на поверхности слизистой и ингибирует внутриклеточную молекулу адгезии — 1 (ICAM-1) сосудистого эндотелия и последующие нейтрофил-ассоциированное воспаление и повреждение. При возникновении пареза кишечной трубки утрачивается антагонистическая активность эпителия по отношению к патогенным микроорганизмам. Усиленное их размножение и активное функционирование нарушают транспорт электролитов и усиливают секрецию в просвет кишки. Происходит адгезия микробов к кишечному эпителию с последующим внедрением в энтероциты, под базальную мембрану и собственную пластинку. При этом экзо- и эндотоксины микробных клеток, сами бактерии и токсичные продукты их метаболизма проникают в лимфатическое русло и кровоток, определяя резкое усугубление системной воспалительной реакции. Нарушение барьерной функции кишечника принято рассматривать как принципиально важное звено в патогенезе синдрома системного воспалительного ответа и полиорганной недостаточности, индуцированных воспалительными цитокинами. В настоящее время именно бактериальной транслокации придаётся ведущая роль в насыщении организма эндотоксином (с включением липополисахаридного комплекса), являющимся основным индуктором развития синдрома системного воспалительного ответа, абдоминального сепсиса и полиорганной недостаточности. Считается, что с интенсивностью бактериальной транслокации связаны характер и выраженность эндогенной интоксикации, развитие и прогрессирование синдрома полиорганной дисфункции.
В результате сочетанного действия вышеуказанных факторов энтеральной недостаточности развиваются имеющие принципиальное значение в нарушении системного метаболизма нарушение полостного и пристеночного пищеварения и нарушение всасывания питательных веществ. Динамическое исследование амилолитической активности слизистой оболочки всех отделов тонкой кишки в ранние сроки после операций большого объема позволило выявить функциональные нарушения процессов полостного, пристеночного и внутриклеточного пищеварения и структурные изменения в стенке органа, обусловленные тяжелыми послеоперационными расстройствами микроциркуляции. При этом первоначально отмечается повышение ферментативной активности слизистой, что многие авторы склонны расценивать как компенсаторно-приспособительный механизм, обеспечивающий усиление переваривания поступающих в пищеварительный тракт нутриентов и всасывания мономеров в критических состояниях. А. М. Уголевым и соавт. (1995) в эксперименте было доказано, что имеет место отрицательная корреляция между повышением активности полостной фракции фермента и одновременным снижением активности фракций фермента щеточной каймы слизистой оболочки тонкой кишки, и наоборот. У больных после резекции желудка увеличивается содержание энтерокиназы и щелочной фосфатазы в кишечном содержимом, а после гастрэктомии активность этих ферментов в тощей кишке в 6-8 раз превышает показатели у здоровых людей. Данные компенсаторные возможности ферментовыделительной функции тонкой кишки зависят от состояния питания организма. У истощенных субъектов с исходными нарушениями деятельности пищеварительной системы значительного увеличения активности ферментов не наступает. Согласно данным, полученным Л.О. Барской и соавт. (2013), уже через 6 часов после операции большого объема выявляется значительное повышение активности полостной фракции амилазы во всех отделах тонкой кишки на фоне явного снижения активности десорбируемых фракций щеточной каймы дистальных отделов органа. По мнению исследователей это следует расценивать как компенсаторно-приспособительную реакцию слизистой оболочки тонкой кишки в ответ на чрезмерное поступление панкреатического сока в полость двенадцатиперстной кишки, тем более что на данном сроке послеоперационного периода структурных изменений в стенке тонкой кишки выявлено не было. Однако к 12 часам послеоперационного периода в двенадцатиперстной кишке на фоне повышенной активности полостной амилазы выявляется значтельное повышение внутриклеточной фракции фермента, что свидетельствует о нарушении прочности связей фермента с мембраной энтероцитов и поступлении его в полость кишки, суммируя эффект нарастания активности поджелудочной фракции амилазы. Кроме этого, нарушаются процессы адсорбции в щеточной кайме, обусловленные ее гипоксическим, ишемическим и реперфузионным повреждением. Однако уже спустя сутки после операции на фоне высокой активности полостной амилазы возрастает активность всех фракций фермента тонкой и подвздошной кишок, а морфологические проявления нарушений микроциркуляции носят неравномерный характер и приходятся на зоны максимального скопления сосудов. Они выражаются деструктивными изменениями слизистой оболочки в местах максимальной плотности микрососудов и нарастанием отека периваскулярных образований собственной пластинки и подслизистого слоя тонкой кишки. Все эти структурные изменения отражаются и на функциональном состоянии щеточной каймы: вследствие резкого уменьшения площади пищеварения снижается адсорбционная способность и угнетаются процессы пристеночного гидролиза полисахаридов. В последующие сутки послеоперационного периода на фоне достаточно высокой активности панкреатической фракции амилазы прогрессирует повышение активности всех фракций щеточной каймы тонкой кишки, что свидетельствует о снижении адсорбционной способности и угнетении процессов пристеночного пищеварения. Данные функциональные изменения имеют структурную основу: в эти сроки наблюдаются деструктивные изменения всех отделов тонкой кишки, а именно поверхностные эрозии слизистой оболочки с отсутствием в них ворсин. К 7-м суткам отчетливо выражены процессы репаративной регенерации кишечных ворсин. Однако данный эпителий морфологически незрел, а значит, и неспособен выполнять свою специфическую пищеварительную функцию в условиях послеоперационного периода. А.А. Курыгин и совт. (2003) считают, что, благодаря компенсаторным процессам, максимальный уровень снижения амилолитической активности в первые дни после операций на проксимальном отделе пищеварительной трубки не превышает 50 %. В течение 10 сут после операции полного восстановления функций энтероцитов проксимального отдела тощей кишки не происходит, однако уровень амилолитической активности позволяет проводить энтеральное зондовое питание не только моно- и олигосахаридами, но и полисахаридами.
Большинство современных исследователей, рассматривая проблему послеоперационной мальдигестии, акцентируют внимание на высокой чувствительности самой тонкой кишки к белково-энергетической недостаточности питания, связанной с ежедневными специфическими потерями питательных веществ из-за необходимости перманентного обновления кишечного эпителия (период полного обновления составляет в среднем 2-3 дня). Известно, что тонкая кишка получает питание не только из системы кровообращения, но и непосредственно из собственного просвета не менее чем на 50%, а толстая — не менее чем на 70%. Энтероциты страдают без поступления важнейших веществ, содержащихся обычно в химусе, при сбалансированной диете, включающей основные нутриенты, а также витамины, витаминоподобные вещества, микроэлементы и антиоксиданты. При отсутствии поступления и расщепления пищевых субстанций в прсвете кишечной трубки формируется еще один порочный круг. Патологический процесс в тонкой кишке при недостаточном поступлении нутриентов в энтероциты характеризуется истончением слизистой оболочки, потерей дисахаридаз щеточной каймы, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишке, заселением верхних отделов тонкой кишки бактериями, что приводит к еще более выраженным трофическим нарушениям в самой слизистой. Клинические наблюдения свидетельствуют о том, что при длительном парентеральном питании возникает выраженная атрофия секреторных желез слизистой, появляется прогрессирующая ферментная недостаточность, нарушается экскреция желчи. При этом помимо слизистой оболочки страдает ассоциированная с кишечником лимфоидная ткань, нарушается биоценоз и усиливается бактериальная транслокация.
Параллельно в патогенез синдрома энтеральной недостаточности включается угнетение резорбции жидкости из просвета кишки, полностью прекращающаяся при повышении внутрикишечного давления примерно до уровня диастолического давления крови. В просвет кишки поступают значительные объемы жидкости. Помимо транссудации, большую роль играет усиленная, так называемая «паралитическая», секреция кишечных желез. В гастродуоденальной зоне она возрастает до 120 мл/час (норма 30-35 мл/час), в тонкой кишке – до 65 мл/час (норма 1,5 мл/час). Вместе с жидкостью в просвет кишки поступает значительное количество электролитов и белка, прежде всего калия и альбуминов из-за относительно небольшого размера их молекул. Принято считать, что снижение абсорбционной способности кишечной трубки связано с цитоплазматической перегрузкой кальцием и истощение запасов АТФ в эпителиоцитах, со сниженной активностью ферментов щеточной каймы, с уменьшением всасывательной поверхности эпителия, а также с гипоальбуминемией. Введение в просвет кишки легкоусваиваемых питательных веществ (олиго- и мономеров) сохраняет запасы АТФ в энтероцитах, защищает от повреждения слизистую и улучшает ее абсорбирующую способность. С другой стороны вследствие повреждения структуры слизистой оболочки тонкой кишки изменяется ее пассивная проницаемость, благодаря чему крупные макромолекулы могут проникать в субэпителиальные ткани, повышается вероятность функционального повреждения межклеточных связей.
Во многом нарушение пищеварения при синдроме энтеральной недостаточности связаны с избыточной бактериальной колонизацией тонкой кишки. При этом бактериальная флора действует как конкурент макроорганизма в метаболизации пищевых субстратов и секрета кишки, нарушая таким образом процессы полостного пищеварения и переваривания пищевых веществ. Кроме того, имеются данные о поражении микробами щеточной каймы и гликокаликса энтероцитов, в результате чего нарушаются процессы мембранного пищеварения и всасывания. Посредством гидролитических ферментов кишечных бактерий происходит замена собственного пищеварения симбионтным и интенсивное образование биологически активных среднемолекулярных пептидов. В свою очередь низкомолекулярные фракции этих соединений, поступая через нарушенный кишечный барьер в кровь и лимфу, оказывают системный провоспалительный эффект и локальное воздействие, провоцируя вазодилатацию и повышение проницаемости капиллярной стенки. Таким образом избыточная бактериальная колонизация значительно усугубляет и без того имеющиеся нарушения полостного пищеварения, переваривания в слоях слизи, мембранного пищеварения и всасывания, которые в свою очередь способствуют прогрессированию гиперпролиферации бактериальной флоры. Следует отметить, что помимо нарушения пищеварительной функции избыточная бактериальная колонизация имеет отношение и к нарушению процесса абсорбции питательных веществ. Нарушение всасывания белков при гиперколонизации возникает вследствие собственно утилизации пищевых белков бактериями, вызванных микробной инвазией функциональных расстройств слизистой оболочки со значительным уменьшением всасывания аминокислот, а также вследствие потери белков при усиленной транссудации. Мальабсорбция углеводов при этом также относится к многофакторным процессам, включающим внутриполостной бактериальный катаболизм и нарушение всасывания. Доказано, что некоторые виды бактерий, особенно В. fragilis, С. perfringens и S.faecalis, содержат протеазы, способные удалять мальтазу из щеточной каймы, а некоторые виды бактероидов образуют протеазы, разрушающие дисахаридазы щеточной каймы энтероцитов человека. Наиболее частым проявлением избыточной бактериальной колонизации тонкой кишки является мальабсорбция жиров, которая клинически проявляется стеатореей, когда с фекалиями выделяется больше жиров, чем поступает с пищей. При наличии способных к деконъюгации бактерий концентрация связанных желчных солей снижается, что собственно и приводит к недостаточному образованию мицелл, мальабсорбции жиров и стеаторее. Нарушение метаболизма жирных кислот в свою очередь определяет нарушение всасывания жирорастворимых витаминов A, D, Е, К.
Очевидно, что в наибольшей степени выраженные нарушения пищеварения отмечаются у пациентов после операций на структурах пищеварительного тракта. Из курса нормальной физиологии нам известно, что кишечное переваривание и всасывание белков, углеводов, жиров и других нутриентов начинается в двенадцатиперстной кишке и почти заканчивается в пределах первых 120–150 см тощей кишки. Тонкая кишка получает дополнительно 6–8 л жидкости ежедневно, 80% которой всасывается в дистальной части подвздошной кишки. Подвздошная кишка является единственным местом всасывания витамина В12 и солей желчных кислот. Только от 1,5 до 2 л жидкости входит в толстую кишку, где все, за исключением 150 мл, реабсорбируется. Данные факты объясняют возникновение умеренной диареи после обширной резекции тощей кишки. И напротив, полная резекция подвздошной кишки приводит к большим расстройствам всасывания, и диарея зависит не от повышенного объема жидкости, входящей в толстую кишку, а и от солей желчных кислот и невсосавшихся жирных кислот, достигающих толстой кишки и вызывающих диарею и стеаторею со значительной потерей жирорастворимых витаминов. Сохранение толстой кишки способствует ферментации растворимых пищевых волокон до короткоцепочечных жирных кислот, таким образом повышая всасывание энергетических субстратов на 5%.
После обширной резекции тонкой кишки возникает значительный дефицит всасывающей поверхности, снижается стимуляция функций поджелудочной железы секретином и холецистокинином, синтез которых в оставшейся после резекции кишке снижается. При резекции дистальных отделов подвздошной кишки с удалением или выключением илеоцекальной области бактериальная флора из толстой кишки легко проникает в тонкую, в результате чего может развиться синдром избыточной бактериальной колонизации тонкой кишки со свойственным ему синдромом мальабсорбции и мальдигестии. Развитию энтеральной недостаточности после резекции тонкой кишки способствует ускорение транзита химуса по укороченной кишке, как было сказано выше, наиболее выраженное после резекции подвздошной кишки.
Безусловно, на функционирование пищеварительного тракта влияют резекция его анатомических образований и те или иные варианты реконструкции пищеварительной трубки. Так M. Chang et al. (2013), анализируя изменения функционирования пищеварительного тракта после гастропанкреатодуоденальной резеции, отметил, что дуоденэктомия не только разрушает согласованную работу мигрирующего моторного комплекса желудка и кишечника, но и нарушает взаимосвязь пищеварительной моторики и панкреатической секреции, циклические колебания уровня гастроинтестинальных гормонов в плазме крови в межпищеварительном периоде. С другой стороны А.А. Курыгин и соавт. (2003) на основании анализа функциональных результатов операций на гастродуоденальной зоне пришли к выводу о том, что действительно как в ранние, так и в отдаленные сроки после резекции желудка всегда имеются те или иные функциональные расстройства тонкой кишки. Эти изменения у разных больных могут касаться различных функций (в первую очередь тех, нарушения которых уже имелись до операции), могут быть выражены в различной степени (нередко на субклиническом уровне), но в большинстве случаев не вызывают значительных диспепсических расстройств благодаря компенсаторным механизмам органов пищеварительной системы.
Таким образом послеоперационные нарушения функции пищеварительного тракта, являясь закономерным следствием нейро-гуморальных составляющих системного ответа на операционную травму, с одной стороны определяют возникновение дефицита экзогенных питательных субстанций, что в свою очередь, усугубляет процессы катаболизма с расходованием эндогенных источников энергии и пластического материала, а с другой стороны — возникновением бактериальной транслокации, продукцией цитокинов и эйкозаноидов способствуют прогрессированию системной воспалительной реакции.
Статья добавлена 27 января 2016 г.