У гемоглобина сродство к кислороду выше чем у миоглобина
У гемоглобина сродство к кислороду выше чем у миоглобина
Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов.
Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц.
Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН.
Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани.
Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей.
У гемоглобина сродство к кислороду выше чем у миоглобина
Кривая диссоциации гемоглобина – S-образной формы 4 константы равновесия =>форма сложнее, не такая, как у миоглобина (Mb+O2-MbO2).
Интерпретация кривой диссоциации гемоглобина:
1. В области высоких напряжений – почти горизонт. =>даже при знач.снижении РО2 насыщение Hb изменяется слабо.
2. В середине графика – более вертик. =>при возросших потребностях =>vPO2 в венозной крови =>насыщение падает очень сильно =>О2 насыщает ткани лучше. Артерио-венозная разница [O2] =0,05 (0,2 – в арт.крови, 0,15 – в венозной =>использ-ся только 25%).
Факторы, влияющие на кривую диссоциации гемоглобина:
1. Температура. увеличение температуры =>кривая – вправо, снижеается угол наклона (снижение сродства);
2. Влияние рН (эффект Бора): снижение рН =>уменьшение угла наклона (снижение сродства). увеличивается РСО2 = снижается рН +собств.эффект на гемоглобин.
Эффект Бора.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани.
Биологический смысл кривой диссоциации гемоглобина:
1. В легких – поглощение О2 => снижение O2 => снижение сродства. Но одновременно – выводится СО2 => повышается сродство.
2. В ткани – выделение из тканей СО2 => кривая вправо => снижение сродства => лучшее насыщение тканей О2.
Миоглобин — дыхательный пигмент, служащий для запасания О2 в мышцах позвоночных,- эквивалентен одной субъединице гемоглобина. Атом двухвалентного железа, включенный в порфириновое кольцо тема, образует координационные связи с четырьмя атомами азота, входящими в состав пиррольных группировок. Оставшиеся две координационные связи используются для присоединения тема к имидазольному кольцу глобина и для связывания кислорода.
Гемоглобин, присоединивший О2, называется оксигемоглобином, а свободный от кислорода — дезоксигемоглобином. Свойства разных видов гемоглобина в процессе связывания кислорода различны и зависят от особенностей структуры молекулы глобина. Когда кислород соединяется с гемоглобином и образует оксигемоглобин, железо не окисляется. В том случае, если железо в группе тема все же становится трехвалентным, образуется метгемоглобин, не способный связывать кислород и, следовательно, не может участвовать в его переносе. Метгемоглобин образуется в организме в естественных условиях, однако в эритроцитах содержится фермент метгемоглобинредуктаза, восстанавливающий его до «нормального» гемоглобина с двухвалентным железом. Некоторые вещества (нитриты и хлораты) способны либо окислять гемоглобин, либо инактивировать метгемоглобинредуктазу. При этом увеличивается содержание в крови метгемоглобина и нарушается перенос кислорода.
Сродство гемоглобина к окиси углерода (угарному газу, СО) примерно в 200 раз выше, чем к кислороду. В связи с этим даже при очень низких парциальных давлениях угарного газа он может вытеснять кислород из соединения с гемоглобином и полностью насыщать последний. Это приводит к резкому снижению поступления кислорода к тканям.
Гемоглобин, насыщенный окисью углерода, называется карбоксигемоглобином. При связывании гемоглобина с угарным газом окислительные обменные процессы страдают в такой же степени, как и при отсутствии кислорода.
У гемоглобина сродство к кислороду выше чем у миоглобина
а) Факторы, сдвигающие кривую диссоциации оксигемоглобина. Их значение для транспорта кислорода. Кривые диссоциации оксигемоглобина (для облегчения понимания просим вас изучить рисунки ниже) справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
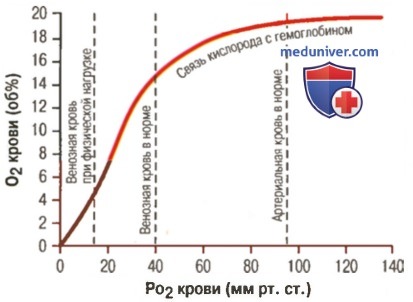
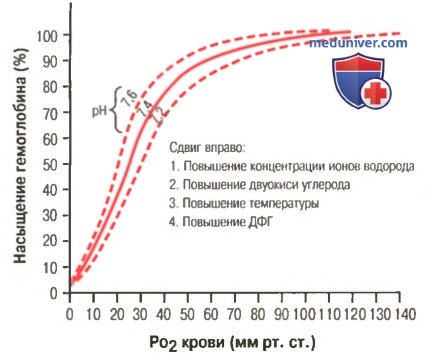
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
б) Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается PO2, а затем концентрации угольной кислоты (H2CO3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз (для облегчения понимания просим вас изучить рисунок выше), уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются PCO2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного PO2, что увеличивает транспорт кислорода к тканям.
в) Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при PO2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
г) Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне PO2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Тема «ОБМЕН ХРОМОПРОТЕИДОВ».



Лекция № 9.
1.Хромопротеины. Гемоглобин и миоглобин. Строение, функции, биологическое значение для организма, отличия.
2.Оксигенирование гемоглобина и миоглобина.
3.Синтез гема.
4.Распад гемоглобина в организме.
5.Клиническое значение исследования пигментов. Лабораторные показатели желтух.
К хромопротеинам относятся гемоглобин, миоглобин, хлорофилл.
Гемоглобин и миоглобин – сложные белки класса хромопротеинов подгруппы гемопротеинов, так как небелковой их частью является гемм.
Уникальным свойством этих белков является обратимое связывание с молекулами кислорода без изменения степени окисления иона железа
Отличаются эти белки локализацией и функциями.
1.Гемоглобин находится в эритроцитах, транспортирует кислород из лёгких к тканям, а из тканей в лёгкие переносит углекислый газ и протоны водорода. Эта его функция тесно связана с регуляцией кислотно-основного состояния в организме.
2.Миоглобин локализуется в цитоплазме мышечных клеток (красные мышцы), особенно много его в миокарде, сохраняет запас кислорода для анаэробного митохондриального окисления при интенсивной мышечной работе и транспортирует кислород внутриклеточно к митохондриям.
3.Сродство миоглобина к кислороду выше, чем у гемоглобина.
Различия в функциях этих белков обусловлены разной структурной организацией их молекул.
1.Миоглобин состоит из одной полипептидной цепи, содержащей 153 остатка аминокислот.
2.Гемоглобин имеет четыре попарно идентичные полипептидные цепи. У основного гемоглобина взрослых HbA комбинируются 2 альфа цепи, состоящие из 141 остатка аминокислот, и 2 вета-цепи, содержащие по 146 остатков.
3.Третичная конформация этих цепей очень похожа на аналогичную в молекуле миоглобина с той разницей, что в альфа цепи имеется семь спирализованных участков.
Каждая полипептидная цепь, соединённая с молекулой гема, образует субъединицу. Четыре субъединицы, взаимодействуя между собой нековалентными связями, укладываются в форме тетраэдра, образуя глобулярную четвертичную структуру.
Присоединение молекулярного кислорода к гемоглобину и миоглобину осуществляется через ион железа гема. Этот процесс называют оксигенированием(не окислением, так как он не приводит к изменению степени окисления железа!). Оксигенированные белки называют оксигемоглобинами (HbO 2) и оксимиоглобинами (MyoHbO 2).
На процесс оксигенирования гемоглобина влияют:
1.парциальное давление кислорода, углекислого газа,
2.концентрация протонов водорода (pH)
3.концентрация 2,3 – дифосфоглицерата (2,3- ДФГ) – промежуточного метаболита гликолиза в эритроцитах.
Четвертичная структура гемоглобина наделяет гемоглобин уникальной способностью насыщаться кислородом постепенно, достигая максимума при высоком парциальном давлении, и отдавать часть кислорода в ткани при снижении pO 2.
Пусковым механизмом изменения конформации гемоглобина при взаимодействии с О 2 при его высоком давлении служит перемещение иона железа в плоскость порфиринового кольца.
Максимальное насыщение кислородом ( на 96%) происходит в эритроцитах лёгочных капилляров при pO 2 = 100 мм рт.ст. В венозной крови гемоглобин насыщен кислородом только на 64%, следовательно 32% кіслорода переходит в ткани. Другими словами, на уровне периферических тканей происходит снижение сродства гемоглобина к кислороду и частичное дезоксигенирование.
Этому способствуют следующие условия:
1.низкое парциальное давление кислорода в периферических тканях (40 мм рт.ст.), а в работающих мышцах 20 мм рт. ст., так как в тканях кислород быстро используется на окислительное фосфорилирование для получения АТФ и некоторые другие процессы;
2.высокое pCO 2 образующееся в тканях в результате декарбоксилирования альфа- кетокислот, аминокислот, других карбоновых кислот в процессе метаболизма.
3. увеличение концентрации 2,3 – ДФГ, стимулируемое высоким рCO 2 Молекула оксігемоглобіна связывается определённым центром с молекулой 2, 3- дифосфоглицерата, что приводит к изменению конформации и освобождению части О 2.
Таким образом, оксигемоглобин снабжает ткани кислородом.
Оксигенирование миоглобина в мышцах и быстро и при низком парциальном давлении О 2 (20мм рт. ст.). Сродство миоглобина к кислороду выше, чем у гемоглобина. При интенсивной мышечной работе, приводящей к быстрому кислородному голоданию (рО 2 снижается до 5 мм рт. ст.) в клетке, оксимиоглобин переносит О 2, к митохондриям и отдаёт его в матрикс, где находится фермент цитохромоксидаза, имеющий более высокое сродство
к О 2, чем гемоглобин., и использующий кислород в качестве акцептора электронов.
У гемоглобина сродство к кислороду выше чем у миоглобина
Особые свойства молекулы гемоглобина, которые делают его столь эффективным переносчиком кислорода в крови, легче всего уяснить из сравнения миоглобина и гемоглобина в отношении их сродства к кислороду. На рис. 8-16 показаны кривые насыщения кислородом для гемоглобина и миоглобина, характеризующие степень насыщения этих белков кислородом (т.е. отношение числа участков молекулы, связывающих кислород, к общему числу участков, способных к такому связыванию) в зависимости от парциального давления газообразного кислорода, находящегося в равновесии с раствором белка.
Рис. 8-15. Фоток рафия нормальных эритроцитов человека, полученная при помощи сканирующего электронного микроскопа.
Прежде всего из графика ясно, что миоглобин имеет очень высокое сродство к кислороду: при парциальном давлении кислорода, равном всего лишь 1-2 мм рт. ст., он уже на 50% насыщен кислородом. Кроме того, мы видим, что кривая насыщения миоглобина кислородом имеет вид простой гиперболы, как и следует ожидать из закона действующих масс применительно к равновесной реакции:
При парциальном давлении кислорода, равном 20 мм рт. ст., миоглобин оказывается насыщенным кислородом более чем на 95%. В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду; кроме того, кривая насыщения гемоглобина кислородом имеет сигмоидную, т.е. S-образную, форму (рис. 8-16). Это означает, что при связывании первой молекулы кислорода (нижняя часть S-образной кривой, соответствующая парциальным давлениям кислорода ниже 10 мм рт. ст.), гемоглобин имеет очень низкое сродство к кислороду, тогда как при связывании следующих молекул кислорода его сродство к ним становится намного выше, о чем свидетельствует крутая часть 
Фактически после связывания первой молекулы кислорода сродство повышается почти в 500 раз. Таким образом, четыре гемсодержащие полипептидные субъединицы гемоглобина различаются по степени их сродства к кислороду и зависят друг от друга в процессе его связывания.
Как только первая гемсодержащая полипептидная субъединица свяжет молекулу кислорода, она передает информацию об этом остальным субъединицам, у которых сразу же резко повышается сродство к кислороду. Такой обмен информацией между четырьмя гемсодержащими полипептидными субъединицами гемоглобина обусловлен кооперативным взаимодействием между субъединицами. Поскольку связывание первой молекулы кислорода одной из субъединиц гемоглобина увеличивает вероятность связывания следующих молекул кислорода остальными субъединицами, мы говорим, что гемоглобин имеет положительную кооперативностъ. Для положительной кооперативности характерны сигмоидные кривые связывания, подобные кривой насыщения гемоглобина кислородом. При связывании кислорода миоглобином, содержащим одну гемогруппу, молекула белка может присоединить только одну молекулу кислорода; в этом случае кооперативного связывания не наблюдается и кривая насыщения имеет вид простой гиперболы. Теперь мы понимаем. почему миоглобин и гемоглобин столь сильно различаются между собой по кислород-связывающей способности.
Мы будем использовать термин лиганд для обозначения специфической молекулы, связывающейся с белком; это может быть, например, молекула кислорода, если речь идет о гемоглобине (слово «лиганд» происходит от латинского слова, которое переводится как «связывать», «присоединять» и буквально означает «то, что присоединяется»). Многие другие олигомерные белки тоже имеют по нескольку лиганд-связывающих центров и, подобно гемоглобину, проявляют положительную кооперативность. Однако есть олигомерные белки, проявляющие отрицательную кооперативность: в этом случае связывание одной молекулы лиганда уменьшает вероятность связывания других молекул лиганда.








