раствор аммиака в воде можно обнаружить
Раствор аммиака в воде можно обнаружить
§ 24. Аммиачная вода
Водородные соединения уже изученных нами неметаллов растворяясь в воде, реагируют с нею с образованием ионов гидроксония. Реагирует с водой при растворении в ней и аммиак, но иначе.
Опустим в кристаллизатор с водой сосуд, наполненный аммиаком, отверстием вниз. Вода быстро заполнит сосуд доверху, то показывает, что аммиак очень хорошо растворяется в воде. В 1 объеме воды ПРИ обычной температуре растворяется до 700 объемов аммиака. Водный раствор аммиака называется аммиачной водой.
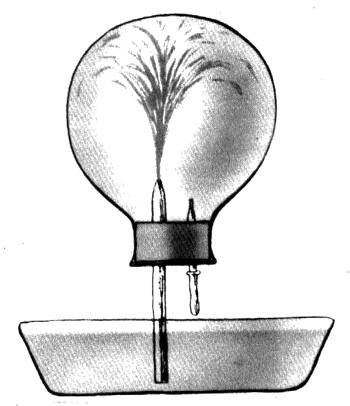
Водородные соединения изученных вами неметаллов диссоциируют в растворе, как кислоты. Исследуем и аммиачную воду при помощи прибора для обнаружения электропроводности растворов (рис. 1). При погружении в нее электродов лампочка засветится. Следовательно, в растворе содержатся ионы
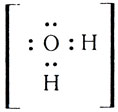
Одна электронная пара при атоме азота остается свободной, не участвующей в образовании химической связи. Молекулу же воды мы уже рассматривали как ион кислорода 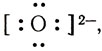
Не участвуют в образовании связей у атома кислорода две электронные пары. Атомы неметаллов в таких водородных соединениях могут за счет свободных электронных пар связывать дополнительные ионы Н + (вспомните ион гидроксония).
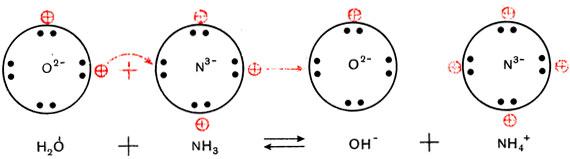
Трехзарядный ион азота в молекуле аммиака сильнее удерживает связанные с ним протоны и сильнее притягивает добавочный протон, чем двухзарядный ион кислорода в молекуле воды. Поэтому при взаимодействии аммиака с водой происходит перемещение протонов из молекул воды в молекулы аммиака:
Образуются ионы гидроксила ОН
Упрощенно реакция между аммиаком и водой изображается так:
Эта реакция обратимая. Лишь малая доля растворенного аммиака присутствует в растворе в виде ионов аммония, большая часть его содержится в виде молекул NH3. Потому аммиачная вода пахнет аммиаком и при стоянии на открытом воздухе или при нагревании выделяет весь растворенный в ней аммиак.
В медицине и в быту разбавленный раствор аммиака называется аммиачной водой или нашатырным спиртом. Его дают нюхать при обмороке для приведения в сознание. В домашнем хозяйстве он применяется в качестве слабой щелочи при стирке белья и выведении пятен.
В сельском хозяйстве концентрированную аммиачную воду используют в качестве жидкого удобрения.
Аммиак и аммоний в воде. Важность контроля аммиака
Что такое аммиак?
Аммиак образуется естественным образом как продукт микробиологического разложения азотистых органических веществ (животных и растительных белков). Он также производится для использования в удобрениях в сельскохозяйственном сегменте или для использования в производстве пластмасс, фармацевтических препаратов и прочих химикатов.
Аммиачная вода (водный аммиак)
Для различных применений аммиак растворяют в воде для получения «водного аммиака». Водные растворы аммиака (водный аммиак) довольно нестабильны — концентрация аммиака может снизиться во время транспортировки или во время хранения.
Что такое аммоний?
Химическое уравнение, определяющее отношение между аммиаком и аммонием:
Важность контроля аммиака
Аммиак используется и как реагент, и как один из основных параметров при контроле качества очистки воды и сточных вод.
Хотя в целом аммиак безвреден при низких концентрациях, высокие концентрации могут причинить вред и представлять опасность для здоровья. Следовательно, уровень аммиака необходимо надлежащим образом контролировать и поддерживать в рамках установленных законодательством.
Приборы и реагенты Hach для мониторинга аммиака и аммония в воде
В ассортименте Hach вы найдете испытательное промышленное и лабораторное оборудование, реагенты и программное обеспечение, необходимое для точного контроля и управления уровнями аммиака в любом технологическом процессе.
Компания АкваАналитикс® 💧 является официальными представителем Hach Lange на территории России и стран СНГ. Для получения консультации или подбора лабораторного / промышленного оборудования для контроля аммиака на вашем предприятии или в лаборатории, свяжитесь с нами удобным для вас способом.
Тест по химии на тему «Азот.Аммиак»(9 класс)
Ищем педагогов в команду «Инфоурок»
Тест по теме «Азот. Аммиак».
1. Укажите число электронов на внешнем уровне атома азота
2. Высшая и низшая степень окисления азота в соединениях равна соответственно
3. Связь в молекуле азота
А) одинарная Б) двойная В) тройная Г) полярная
4. Связь в молекуле азота
А) ковалентная неполярная
В) ковалентная полярная
5. Связь в молекуле аммиака
А) ковалентная неполярная
Б) ковалентная полярная
6. Укажите металл который реагирует при комнатной температуре с азотом
А) Li Б) Na В) K Г) Ca
7. Раствор аммиака в воде можно обнаружить
А) по вкусу В) по цвету
Б) по запаху Г) по наличию осадка
8. Аммиак может проявлять свойства
А) только окислительные
Б) только восстановительные
В) и окислительные и восстановительные
Г) не имеет таких свойств
10.Какая схема отражает процесс промышленного получения азота
А) воздух 
Б) Са + HN О3(разб) → Г) NH 4 N 03
11. Формула высшего оксида азота
12. Аммиак можно распознать
А) тлеющей лучинкой В) известковой водой
Б) влажной лакмусовой бумажкой Г) по цвету
13. При горении на воздухе аммиака, помимо воды, образуется
14. Нашатырный спирт – это
А) раствор аммиака в воде
Б) раствор аммиака в спирте
Г) медицинский спирт
15. Продукты каталитического окисления аммиака кислородом
Тест по теме «Азот. Аммиак».
1. Укажите число электронов на внешнем уровне атома азота
2. Высшая и низшая степень окисления азота в соединениях равна соответственно
3. Связь в молекуле азота
А) одинарная Б) двойная В) тройная Г) полярная
4. Связь в молекуле азота
А) ковалентная неполярная
В) ковалентная полярная
5. Связь в молекуле аммиака
А) ковалентная неполярная
Б) ковалентная полярная
6. Укажите металл который реагирует при комнатной температуре с азотом
А) Li Б) Na В) K Г) Ca
7. Раствор аммиака в воде можно обнаружить
А) по вкусу В) по цвету
Б) по запаху Г) по наличию осадка
8. Аммиак может проявлять свойства
А) только окислительные
Б) только восстановительные
В) и окислительные и восстановительные
Г) не имеет таких свойств
10.Какая схема отражает процесс промышленного получения азота
А) воздух 
Б) Са + HN О3(разб) → Г) NH 4 N 03
11. Формула высшего оксида азота
12. Аммиак можно распознать
А) тлеющей лучинкой В) известковой водой
Б) влажной лакмусовой бумажкой Г) по цвету
13. При горении на воздухе аммиака, помимо воды, образуется
14. Нашатырный спирт – это
А) раствор аммиака в воде
Б) раствор аммиака в спирте
Г) медицинский спирт
15. Продукты каталитического окисления аммиака кислородом
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Международная дистанционная олимпиада Осень 2021
Похожие материалы
Тест по теме «Алюминий, железо и их соединения».
Рабочая программа по химии 8-9 класс (ФГОС) к учебнику О,С. Габриеляна изд. Просвещение
Конспект урока по химии на тему «Кремний и его соединения»
Конспект урока химии по теме «Каучук и резина»
Презентация по химии на тему «Названия и знаки химических элементов»
Презентация «Щелочные металлы и их соединения
Конспект урока по химии «Практическая работа 1. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов».(9 класс)
Применение игровых технологии на уроках химии с целью повышения повешения качества знаний.
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5299432 материала.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Путин попросил привлекать родителей к капремонту школ на всех этапах
Время чтения: 1 минута
СК предложил обучать педагогов выявлять деструктивное поведение учащихся
Время чтения: 1 минута
Минпросвещения разработало проект новых правил русского языка
Время чтения: 2 минуты
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
Заболеваемость ковидом среди студентов и преподавателей снизилась на 33%
Время чтения: 4 минуты
Шойгу предложил включить географию в число вступительных экзаменов в вузы
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Аммиак и аммоний
Что такое аммиак?
Аммиак — это соединение водорода и азота (один атом азота и три атома водорода, NH 3), которое представляет собой бесцветный газ с резким запахом и хорошо растворяется в воде.
Аммиак образуется естественным образом в результате микробиологического распада азотсодержащих веществ (животного и растительного белка). Также его производят для добавления в удобрения или для изготовления пластика, фармацевтических препаратов и других химических веществ.
Наличие аммиака в грунтовой воде является нормальным явлением, которое объясняется микробиологическими процессами. Однако присутствие аммиачного азота в поверхностной воде обычно указывает на загрязнение бытовыми отходами. Избыток аммиака может навредить растительности и является чрезвычайно токсичным для водных организмов, особенно при повышенном уровне pH и температуры.
Водный раствор аммиака
В различных областях применения аммиак растворяют в воде для производства водного раствора аммиака. Нерасфасованный водный раствор аммиака нестабилен, и концентрация аммиака может снизиться во время транспортировки или хранения. В связи с этим плату за доставленные растворы назначают в соответствии с концентрацией аммиака, поставленного на предприятие или конечному пользователю.
Что такое аммоний?
Аммоний — это соединение, содержащее один атом азота и четыре атома водорода (NH 4 + ). Хотя аммиак представляет собой нейтральную неионизированную молекулу (слабое основание), аммоний — это ион с положительным зарядом. Кроме того, аммиак имеет сильный запах, а у аммония запах совсем отсутствует.
Быстрые ссылки
Почему нужно выполнять мониторинг аммиака?
Рекомендуемая продукция
Связанные процессы
Методы мониторинга
Вопросы и ответы
Почему нужно выполнять мониторинг аммиака?
Аммиак используется как реагент и как параметр измерения в нескольких областях очистки воды и сточных вод.
Несмотря на что низкие концентрации аммиака неопасны, высокие концентрации аммиака могут привести к повреждениям и создать опасность для здоровья. По этой причине необходимо надлежащим образом контролировать и поддерживать ПДК аммонийного азота.
Компания Hach® предлагает аналитическое оборудование, информационные ресурсы, обучение и программное обеспечение для успешного мониторинга и контроля аммиака в необходимой области применения.
Рекомендуемая продукция для мониторинга аммонийного азота
Простые в использовании и надежные портативные приборы Hach созданы для работы с уникальными нагрузками, которые возникают в полевых условиях.
Лабораторный мультипараметрический измеритель Hach HQ440D — это современный лабораторный измерительный прибор, который позволяет исключить догадки из рабочего процесса.
The HQ Series is for water quality professionals who want to perform electrochemical analysis for field and lab environments.
Онлайн-анализатор Hach Amtax sc с газоселективным электродом предназначен для высокоточного определения содержания аммония непосредственно во время очистки (на установках на открытом воздухе).
Анализатор монохлорамина 5500sc обеспечивает непрерывный мониторинг, предоставляя информацию для управления хлораммонизацией.
Онлайн-анализаторы серии EZ оснащены множеством опций для мониторинга аммония в воде.
Цифровой ион-селективный датчик Hach AISE sc предназначен для определения содержания аммония непосредственно в среде.
Цифровой комбинированный датчик аммония и нитрата Hach AN-ISE sc выполняет непрерывные измерения с помощью ион-селективного электрода.
Для каких процессов необходим мониторинг аммиака?
Производство питьевой воды
Газообразный аммиак и его концентрированные растворы требуют осторожного обращения, а также при работе с ними необходимо соблюдать требования OSHA (или других соответствующих регулирующих органов). Это связано с высококоррозионными свойствами, которые в зависимости от концентрации представляют серьезную опасность для здоровья, начиная от легкого раздражения глаз или кожи до химического ожога. Кроме того, выделяющийся аммиак может стать причиной неприятного вкуса или запаха.
Если аммиак не используется для дезинфекции, его присутствие в системе распределения может указывать на то, что повреждение системы привело к загрязнению воды или к выщелачиванию из материалов в трубопроводных конструкциях. Когда лишний аммиак смешивается с хлором, он снижает эффективность дезинфекции при хлорировании.
Хлораммонизация
В некоторых процессах дезинфекции аммиак специально используют вместе с хлором для образования монохлорамина. Несмотря на то, что свободный хлор является более мощным дезинфицирующим средством, монохлорамин имеет большую остаточную концентрацию, поэтому он дольше остается в системе распределения, обеспечивая полную дезинфекцию на всем пути до конечного пользователя. Кроме того, хлорамины менее интенсивно вступают в реакцию с загрязнениями в исходной воде, особенно это относится к органическим веществам. Таким образом, сводится к минимуму образование канцерогенных побочных продуктов дезинфекции. Для оптимизации хлораммонизации важно контролировать образование целевого дезинфицирующего средства, предотвращая образование нежелательного дихлорамина или трихлорамина (трихлорид азота). Анализ монохлорамина выполняют совместно с определением свободного аммиака, чтобы обеспечить образование нужного дезинфицирующего средства и снизить затраты на сырье за счет предотвращения избыточного дозирования хлора и/или аммиака.
Узнать больше о хлораммонизации.
Свободный аммиак
Общий аммиак
Общий аммиак — это суммарное количество всего аммиачного азота, который присутствует в виде монохлорамина (NH 2Cl), других хлораминов, иона аммония (NH 4 + ), и молекулярного аммиака (NH 3). Этот параметр можно использовать для первичной или вторичной проверки, чтобы держать хлорирование с аммонизацией под контролем.

Очистка поверхностной и грунтовой воды
Аммиак образуется как побочный продукт, когда бактерии разрушают натуральные вещества в почве. К высокой концентрации аммиака могут привести высокое содержание железа в почве, близкое расположение к лесу, а также загрязнение удобрениями или фекалиями.
Очистка сточных вод
Во время очистки сточных вод уровень аммиака может достигать очень высоких концентраций из-за воздействия бактерий. Сначала через нитрификацию аммиак преобразуется в нитрат, который затем в процессе денитрификации восстанавливается до атмосферного азота (N 2). Узнайте больше об очистке муниципальных сточных вод. При высоких концентрациях и высоком уровне pH аммиак может быть токсичным для микробов гидролиза осадка. Кроме того, во избежание вреда для водных организмов крайне важно отслеживать и удалять аммиак из очищенных сточных вод до того, как он попадет в природные водоемы.
Аквакультура
Являясь продуктом жизнедеятельности водных организмов, аммиак при уровне всего 0,5 мг/л может быть токсичным для рыб и водных растений. В искусственных аквариумах аммиак можно быстро преобразовать в нитрит и в конечном итоге в нитрат. Для большинства аквариумов сотрудники стремятся обеспечить отсутствие аммиака.
В природных водных средах высокий уровень аммиака может привести к чрезмерному росту водорослей, которые блокируют поступление солнечного света, нарушая прозрачность и затрудняя фотосинтез.
Сельское хозяйство
Поскольку растения не могут получать азот непосредственно из атмосферы, они используют азотфиксирующие бактерии для преобразования азота в аммиак. Азот в аммиаке затем могут использовать растения для создания других важных органических молекул, необходимых для сложных организмов. Чтобы упростить или усовершенствовать этот естественный процесс, который входит в круговорот азота, в удобрения часто добавляют аммиак. Например, питательные растворы для гидропоники вводят азот в составе соли аммония. Аммиак также может присутствовать в почве из-за попадания мочевины и ее последующего разложения.
Фармацевтическое производство
В фармацевтической промышленности аммиак используется для контроля pH, а раствор аммиака используется для регенерации слабых ионообменных смол и для регулировки pH.
Как осуществляется мониторинг аммиака?
Методика с использованием салицилата
Методика с использованием салицилата — это разновидность широко известной методики с применением фенолята, однако без солей ртути и фенола. Этот метод наиболее удобен для определения аммиачного азота в низком диапазоне. Несмотря на то что до получения конечного зеленого цвета нужно выполнить несколько этапов, все реагенты содержатся в удобных пакетиках с порошком (салицилат и щелочное производное циануровой кислоты) или в пакетиках с порошком и пробирках TNT.
Раствор аммиака в воде можно обнаружить
И. Ильин
Химия и Жизнь №12, 1985 г., с. 24-28
Когда человек познакомился с аммиаком?
Если следовать формальной логике построения истории веществ и элементов, то за точку отсчета нужно брать опыт великого английского химика XVIII в. Дж. Пристли, который первым получил чистый аммиак, нагревая нашатырь NH3Cl с гашеной известью Са(ОН)2. Выделявшийся «щелочной воздух» Пристли собирал над ртутью. Спустя 11 лет, в 1784 г., знаменитый К. Бертолле установил элементный состав этого газа, который в 1787 г. получил официальное название «аммониак». Это название сохраняется и ныне в большинстве западно-европейских языков (нем. Ammoniak, англ, ammonia, фр. ammoniaque); сокращенное название «аммиак», которым мы пользуемся, ввел в обиход русский химик Я. Д. Захаров в 1801 г.
К началу прошлого века аммиачную воду получали уже в значительных количествах в качестве побочного продукта при производстве осветительного газа из каменного угля. Однако для промышленности получаемого таким способом аммиака явно нехватало, поэтому были разработаны чисто химические методы его синтеза, например из цианамида кальция:
или из цианида натрия:
Как видим, в первых промышленных процессах аммиак, подобно ацетилену, получался при непосредственном участии воды. Эти методы долгое время считались перспективными, поскольку исходные вещества получали из доступного сырья.
В 1901 г. французский химик Ле Шателье взял патент на способ получения аммиака из азота и водорода в присутствии катализатора. Однако до промышленного использования этого процесса было еще далеко: лишь в 1913 г. заработала первая промышленная установка, созданная немецкими химиками Ф. Габером и К. Бошем. Впоследствии оба они (хотя и с интервалом в 13 лет) были удостоены Нобелевской премии по химии.
ГАЗООБРАЗНЫЙ АММИАК И ЕГО ВОДНЫЕ РАСТВОРЫ
Аммиак химически довольно активен; в чистом кислороде он сгорает бледно-желтым пламенем, превращаясь в основном в азот и воду. В присутствии катализаторов при окислении аммиака образуются оксиды азота. Если в смесь аммиака с воздухом ввести свечу, то она продолжает гореть, пламя даже увеличивается.
Известно, что вода обладает аномально высокими (для гидридов элементов VI группы) температурами плавления и кипения.
Среди прочих газов аммиак выделяется огромной растворимостью в воде: при нормальных условиях миллилитр воды способен поглотить больше литра аммиака! Поэтому водные растворы аммиака обладают уникальным среди всех щелочей свойством: их плотность снижается с увеличением концентрации раствора (от 0,99 г/см 3 для 1 %-ного раствора до 0,89 г/см 3 для 30 %-ного). В то же время «выгнать» аммиак из водного раствора довольно легко. При одном условии: над раствором не должно быть избыточного давления самого же аммиака. Поэтому даже разбавленные растворы имеют отчетливый резкий запах «нашатырного спирта», а при хранении в неплотно закупоренной посуде достаточно быстро «выдыхаются». Полностью удалить аммиак из воды можно даже непродолжительным кипячением.
АММИАК В КОМПЛЕКСАХ
Рассказывая об аммиаке, нельзя не упомянуть о его роли в комплексных соединениях, которых известно огромное множество. В отличие от классических амино-соединений R-NH2 в этих комплексах с азотом всегда связаны три атома водорода, и в их названии удваивается «м» (аммино-комплексы или аммиакаты).
НЕОБЫЧНЫЕ СВОЙСТВА ЖИДКОГО АММИАКА
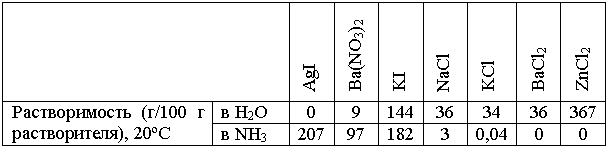
В то же время многие реакции с участием солей идут в жидком аммиаке совсем не так, как в воде. Прежде всего, потому, что разные соли по-разному растворяются в аммиаке и в воде (см. таблицу):
Из этих данных следует, например, что в жидком аммиаке ничего не стоит провести некоторые обменные реакции, немыслимые в водных растворах:
Много ли металла может растворить жидкий аммиак? Это зависит в основном от температуры. При температуре кипения моль аммиака способен растворить примерно 0,15 моль щелочного металла. С ростом температуры растворимость быстро увеличивается и становится бесконечно большой при температуре плавления металла (для цезия это происходит уже при 28°С). Аммиак из таких растворов испаряется слабо, так как давление его насыщенных паров над раствором при увеличении концентрации металла стремится к нулю. Общепринятой теории, которая объясняла бы все особенности поведения растворов металлов в жидком аммиаке, пока нет. Экспериментаторы же обнаруживают все новые факты. Оказалось, например, что сопротивление замороженного раствора натрия в жидком аммиаке крайне мало. Растворы металлов в аммиаке использовали для получения сверхпроводящих систем. Не удивительно поэтому, что и в наши дни растворами металлов в аммиаке с большим интересом занимаются как химики, так и физики. И те и другие находят в аммиаке и его растворах предмет для размышлений и приложения рук.
Что вы знаете и чего не знаете об аммиаке
АММИАК В АТМОСФЕРЕ
Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе, поскольку аммиак непрерывно образуется при разложении белков. На некоторых планетах Солнечной системы ситуация иная: астрономы считают, что значительная часть масс Юпитера и Сатурна приходится на твердый аммиак.
Уголь состоит главным образом, конечно, из углерода, но и другие элементы, в том числе водород и азот, в нем тоже есть. Они взаимодействуют в процессах пиролиза. Поэтому и получали когда-то аммиак из угля. Не много по нынешним меркам. В прошлом веке на газовых заводах при нагревании без доступа воздуха тонны хорошего каменного угля получали до 700 кг кокса и около 200 кг (300 тысяч литров) газообразных продуктов пиролиза. Их охлаждали и пропускали через воду. При этом получали примерно 50 кг дегтя и 40 кг аммиачной воды. Оставшийся светильный газ состоял в основном из окиси углерода (8%), водорода (45%) и метана (35%) с небольшими примесями других углеводородов, азота и углекислого газа.
КАК СДЕЛАТЬ «РЕЗИНОВОЕ» ДЕРЕВО
1. Аммиак Химическая энциклопедия, Т. 1. стр. 149-151