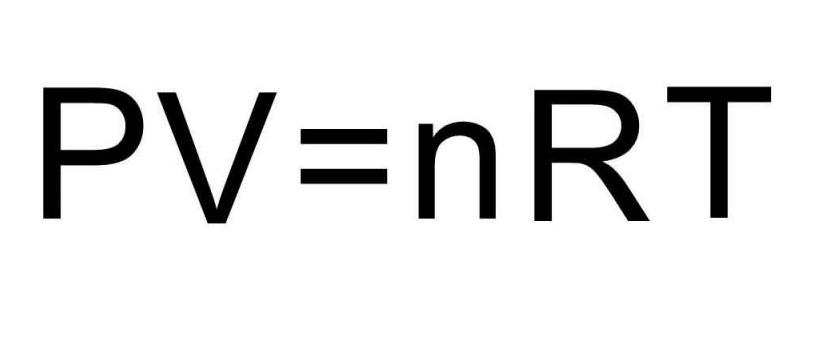по какой формуле можно вычислить внутреннюю энергию одноатомного идеального газа
Термодинамика. Внутренняя энергия.
Внутреннюю энергию тела составляют кинетическая энергия всех его молекул и потенциальная энергия их взаимодействия.
Внутренняя энергия входит в баланс энергетических превращений в природе. После открытия внутренней энергии был сформулирован закон сохранения и превращения энергии. Рассмотрим взаимное превращение механической и внутренней энергий. Пусть на свинцовой плите лежит свинцовый шар. Поднимем его вверх и отпустим. Когда мы подняли шар, то сообщили ему потенциальную энергию. При падении шара она уменьшается, т. к. шар опускается все ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия шара. Происходит превращение потенциальной энергии шара в кинетическую. Но вот шар ударился о свинцовую плиту и остановился. И кинетическая, и потенциальная энергии его относительно плиты стали равными нулю. Рассматривая шар и плиту после удара, мы увидим, что их состояние изменилось: шар немного сплющился, и на плите образовалась небольшая вмятина; измерив же их температуру, мы обнаружим, что они нагрелись.
Нагрев означает увеличение средней кинетической энергии молекул тела. При деформации изменяется взаимное расположение частиц тела, поэтому изменяется и их потенциальная энергия.
Таким образом, можно утверждать, что в результате удара шара о плиту происходит превращение механической энергии, которой обладал в начале опыта шар, во внутреннюю энергию тела.
Нетрудно наблюдать и обратный переход внутренней энергии в механическую.
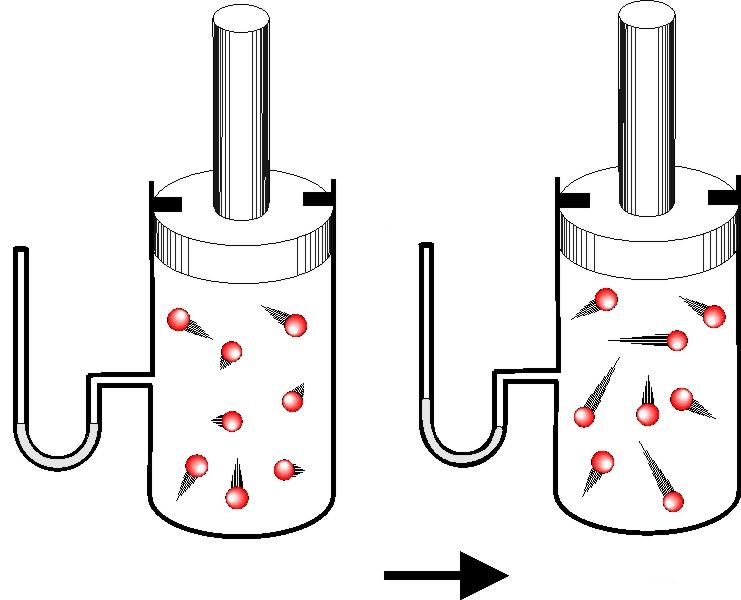
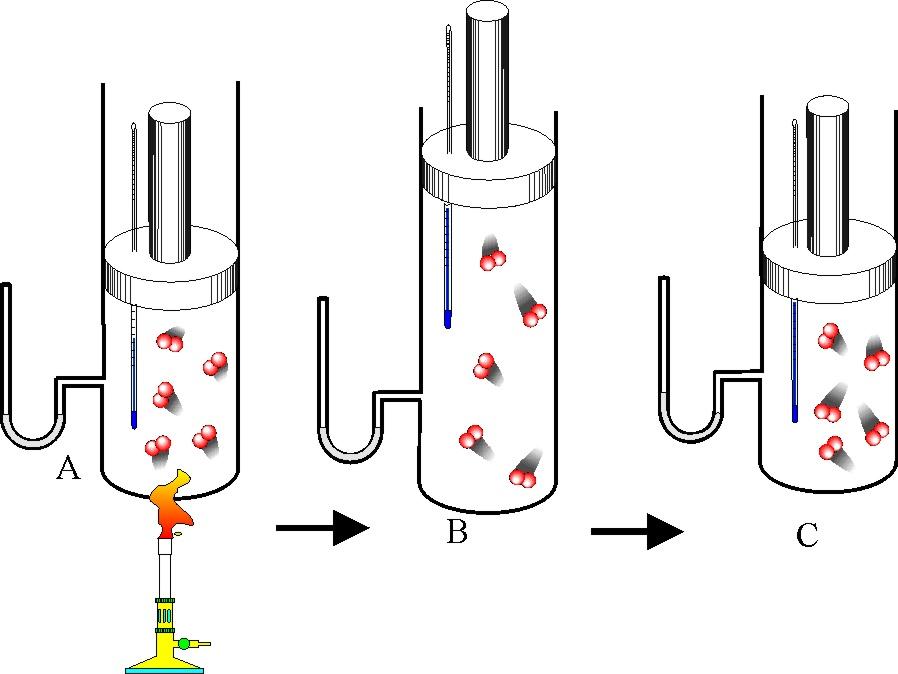
Например, если взять толстостенный стеклянный сосуд и накачать в него воздух через отверстие в пробке, то спустя какое-то время пробка из сосуда вылетит. В этот момент в сосуде образуется туман. Появление тумана означает, что воздух в сосуде стал холоднее и, следовательно, его внутренняя энергия уменьшилась. Объясняется это тем, что находившийся в сосуде сжатый воздух, выталкивая пробку (т. е. расширяясь), совершил работу за счет уменьшения своей внутренней энергии. Кинетическая энергия пробки увеличилась за счет внутренней энергии сжатого воздуха.
Таким образом, одним из способов изменения внутренней энергии тела является работа, совершаемая молекулами тела (или другими телами) над данным телом. Способом изменения внутренней энергии без совершения работы является теплопередача.
Поскольку молекулы идеального газа не взаимодействуют друг с другом, их потенциальная энергия считается равной нулю. Внутренняя энергия идеального газа определяется только кинетической энергией беспорядочного поступательного движения его молекул. Для ее вычисления нужно умножить среднюю кинетическую энергию одного атома 


Внутренняя энергия идеального одноатомного газа прямо пропорциональна его температуре. Если воспользоваться уравнением Клапейрона-Менделеева, то выражение для внутренней энергии идеального газа можно представить в виде:

Следует отметить, что, согласно выражению для средней кинетической энергии одного атома 

Число степеней свободы — это число возможных независимых направлений движения молекулы.
Газ, каждая молекула которого состоит из двух атомов, называется двухатомным. Каждый атом может двигаться по трем направлениям, поэтому общее число возможных направлений движения — 6. За счет связи между молекулами число степеней свободы уменьшается на одну, поэтому число степеней свободы для двухатомной молекулы равно пяти.
Средняя кинетическая энергия двухатомной молекулы равна 

Формулы для внутренней энергии идеального газа можно обобщить:

где i — число степеней свободы молекул газа (i = 3 для одноатомного и i = 5 для двухатомного газа).
Для идеальных газов внутренняя энергия зависит только от одного макроскопического параметра — температуры и не зависит от объема, т. к. потенциальная энергия равна нулю (объем определяет среднее расстояние между молекулами).
Для реальных газов потенциальная энергия не равна нулю. Поэтому внутренняя энергия в термодинамике в общем случае однозначно определяется параметрами, характеризующими состояние этих тел: объемом (V) и температурой (T).
Физика. 10 класс
§ 11. Термодинамическая система. Внутренняя энергия. Внутренняя энергия идеального одноатомного газа
Полную энергию физической системы можно представить как алгебраическую сумму её механической энергии и внутренних энергий тел, образующих систему. Убыль механической энергии системы в ряде случаев происходит при самопроизвольном переходе её части во внутреннюю энергию тел системы. Так, например, режущие инструменты заметно нагреваются при заточке. При скольжении конькобежца под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность теплового движения их молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
Термодинамическая система. В термодинамике физические тела и их модели называют термодинамическими системами. Для их описания используют параметры системы, такие, как давление, объём, температура (макропараметры), а не физические характеристики молекул (микропараметры). Макропараметры можно непосредственно измерить, используя приборы, или выразить через другие величины, которые можно измерить на опыте. Мы рассмотрим простейшие термодинамические системы, состояние которых определяют, используя только давление, объём и температуру.
Тела, образующие термодинамическую систему, могут обмениваться с окружающей средой энергией, а также веществом. Если этого не происходит, то термодинамическую систему называют замкнутой или изолированной.
В одном случае газ находится в герметично закрытом теплонепроницаемом сосуде, а в другом — в стеклянной колбе. В каком случае газ как термодинамическая система является изолированным?
* Выводы термодинамики основаны на фундаментальных законах, называемых началами термодинамики. Эти законы установлены в результате обобщения многочисленных экспериментальных фактов. Опираясь на них, термодинамика позволяет делать определённые выводы о свойствах исследуемых систем, которые подтверждаются экспериментально. ↑
Идеальный одноатомный газ. Формула внутренней энергии. Решение задач
Изучение свойств и поведения идеального газа является ключевым моментом для понимания физики этого направления в целом. Рассмотрим в данной статье, что включает в себя концепция идеального одноатомного газа, какими уравнениями описываются его состояние и внутренняя энергия. А также решим пару задач по этой теме.
Общее понятие
Концепция идеального газа тесно связана с молекулярно-кинетической теорией (МКТ). В соответствии с ней частицы газовой системы движутся хаотически во всех направлениях. Их скорости подчиняются распределению Максвелла. Частицы не взаимодействуют друг с другом, и расстояния между ними намного превышают их размеры. Если все перечисленные условия соблюдаются с определенной точностью, то газ можно считать идеальным.
Любые реальные среды близки по своему поведению к идеальным, если они имеют невысокие плотности и высокие абсолютные температуры. Кроме того, они должны состоять из химически неактивных молекул или атомов. Так, водяной пар из-за присутствия между молекулами H2O сильных водородных взаимодействий не считается идеальным газом, а воздух, состоящий из неполярных молекул, является им.
Закон Клапейрона-Менделеева
Во время анализа, с точки зрения МКТ, поведения газа в равновесии можно получить следующее уравнение, которое связывает основные термодинамические параметры системы:
Записанное равенство называется универсальным уравнением состояния Клапейрона-Менделеева. Почему? Названо оно так в честь французского физика Эмиля Клапейрона, который в 30-е годы XIX века, изучая установленные до этого экспериментальные газовые законы, записал его в общем виде. Впоследствии Дмитрий Менделеев привел его к современной форме, введя константу R.
Внутренняя энергия одноатомной среды
Одноатомный идеальный газ отличается от многоатомного тем, что его частицы обладают всего тремя степенями свободы (поступательное движение вдоль трех осей пространства). Этот факт приводит к следующей формуле средней кинетической энергии одного атома:
m * v2 / 2 = 3 / 2 * kB * T.
Скорость v называется средней квадратичной. Масса атома и постоянная Больцмана обозначена как m и kB соответственно.
Примеры по теме
Задача №1. Идеальный одноатомный газ переходит из состояния 1 в состояние 2. Масса газа при этом остается постоянной (закрытая система). Необходимо определить изменение внутренней энергии среды, если переход является изобарным при давлении, равном одной атмосфере. Дельта объема сосуда с газом составила три литра.
Выпишем формулу для изменения внутренней энергии U:
ΔU = 3 / 2 * n * R * ΔT.
Воспользовавшись уравнением Клапейрона-Менделеева, это выражение можно переписать в виде:
Давление и изменение объема нам известно из условия задачи, поэтому остается перевести их значения в СИ и подставить в формулу:
ΔU = 3 / 2 * 101325 * 0,003 ≈ 456 Дж.
Таким образом, когда одноатомный идеальный газ переходит из состояния 1 в состояние 2, его внутренняя энергия возрастает на 456 Дж.
Задача №2. Идеальный одноатомный газ в количестве 2 моль находился в сосуде. После изохорного нагрева его энергия возросла на 500 Дж. Как изменилась при этом температура системы?
Снова выпишем формулу для изменения величины U:
ΔU = 3 / 2 * n * R * ΔT.
Из нее несложно выразить величину изменения абсолютной температуры ΔT, имеем:
ΔT = 2 * ΔU / ( 3 * n * R ).
Подставляя данные для ΔU и n из условия, получаем ответ: ΔT = +20 К.
Важно понимать, что все приведенные расчеты справедливы только для одноатомного идеального газа. Если система образована многоатомными молекулами, то формула для U уже будет не верна. Закон Клапейрона-Менделеева справедлив для любого идеального газа.
Формула внутренней энергии идеального газа. Изменение внутренней энергии газа: формула
Изучая поведение газов в физике, часто возникают задачи на определение запасенной в них энергии, которую теоретически можно использовать для совершения некоторой полезной работы. В данной статье рассмотрим вопрос, по каким формулам внутренняя энергия идеального газа может быть рассчитана.
Понятие о газе идеальном
Четкое понимание концепции идеального газа важно при решении задач с системами, находящимися в этом агрегатном состоянии. Любой газ принимает форму и объем сосуда, в который его помещают, однако, не всякий газ является идеальным. Например, воздух можно считать смесью идеальных газов, в то же время водяной пар не является таковым. В чем же заключается принципиальная разница между реальными газами и их идеальной моделью?

Ответом на поставленный вопрос будут две следующие особенности:
Газ считается идеальным только в том случае, когда средняя кинетическая энергия его частиц несоизмеримо больше энергии связи между ними. Разница между этими энергиями такова, что можно считать, что взаимодействие между частицами полностью отсутствует. Также для идеального газа характерно отсутствие размеров у его частиц, вернее эти размеры можно не учитывать, поскольку они намного меньше средних межчастичных расстояний.

Хорошими эмпирическими критериями, позволяющими определить идеальность газовой системы, являются такие ее термодинамические характеристики, как температура и давление. Если первая больше 300 К, и второе меньше 1 атмосферы, то любой газ может полагаться идеальным.
Что это внутренняя энергия газа?
Прежде чем записать формулу внутренней энергии газа идеального, необходимо познакомится с этой характеристикой ближе.
В термодинамике внутреннюю энергию, как правило, обозначают латинской буквой U. Определяется в общем случае она по следующей формуле:
Вывод формулы внутренней энергии
Выше мы установили, что для ее определения у системы с идеальным газом необходимо рассчитать его кинетическую энергию. Из курса общей физики известно, что энергия частицы массой m, которая поступательно движется в некотором направлении со скоростью v, определяется по формуле:
Ее также можно применить для газовых частиц (атомов и молекул), однако, необходимо сделать некоторые замечания.
Во-первых, под скоростью v следует понимать некоторую среднюю величину. Дело в том, что газовые частицы движутся с разными скоростями согласно распределению Максвелла-Больцмана. Последнее позволяет определить среднюю скорость, которая с течением времени не изменяется, если отсутствуют внешние воздействия на систему.
Во-вторых, формула для Ek1 предполагает энергию на одну степень свободы. Газовые частицы могут двигаться во всех трех направлениях, а также вращаться в зависимости от их строения. Чтобы учесть величину степени свободы z, следует ее умножить на Ek1, то есть:
Согласно этой формуле, изменение внутренней энергии газа возможно только в том случае, если поменять число частиц N в системе, либо их среднюю скорость v.
Внутренняя энергия и температура
Применяя положения молекулярно-кинетической теории идеального газа, можно получить следующую формулу связи между средней кинетической энергией одной частицы и абсолютной температурой:
Данное выражение можно переписать через количество вещества n и газовую постоянную R в следующем виде:
В соответствии с этой формулой, изменение внутренней энергии газа возможно, если поменять его температуру. Величины U и T зависят друг от друга линейно, то есть график функции U(T) представляет собой прямую линию.
Как строение газовой частицы влияет на внутреннюю энергию системы?
Под строением частицы газа (молекулы) имеется в виду количество атомов, которое ее составляет. Оно играет определяющую роль при подстановке соответствующей степени свободы z в формулу для U. Если газ является одноатомным, формула внутренней энергии газа принимает такой вид:
Откуда взялась величина z=3? Ее появление связано всего с тремя степенями свободы, которыми обладает атом, поскольку он может двигаться только в одном из трех пространственных направлений.
Если рассматривается двухатомная молекула газа, то внутреннюю энергию следует вычислять по такой формуле:
Как видим, двухатомная молекула уже имеет 5 степеней свободы, 3 из которых являются поступательными и 2 вращательными (в соответствии с геометрией молекулы, она может вращаться вокруг двух взаимно перпендикулярных осей).
Наконец, если газ является трех- и более атомным, то справедливо следующее выражение для U:
Сложные молекулы имеют 3 поступательных и 3 вращательных степени свободы.
Пример задачи
Под поршнем находится одноатомный газ при давлении 1 атмосфера. В результате нагрева газ расширился так, что его объем увеличился от 2-х литров до 3-х. Как при этом изменилась внутренняя энергия газовой системы, если процесс расширения был изобарным.
Чтобы решить эту задачу, недостаточно приведенных в статье формул. Необходимо вспомнить об уравнении состояния идеального газа. Оно имеет вид, представленный ниже.
Поскольку поршень закрывает цилиндр с газом, то в процессе расширения количество вещества n остается постоянным. Во время изобарного процесса температура изменяется прямо пропорционально объему системы (закон Шарля). Это означает, что формула выше запишется так:
Тогда выражение для внутренней энергии одноатомного газа примет форму:
Подставляя в это равенство значения давления и изменения объема в единицах СИ, получаем ответ: ΔU ≈ 152 Дж.
Внутренняя энергия идеального газа

Всего получено оценок: 131.
Всего получено оценок: 131.
С помощью понятия внутренней энергии в физике объясняются процессы, когда работа может совершаться покоящимся телом за счет энергии отдельных частиц, из которых состоит это тело. В большинстве случаев величина внутренней энергии тела представляет собой сумму потенциальной энергии взаимодействия молекул, составляющих тело, и кинетической энергии их хаотического теплового движения. Для описания тепловых явлений в веществах, находящихся в газообразном состоянии, используется модель идеального газа, которая позволяет получить достаточно простые формулы для величины внутренней энергии идеального газа.
Что такое идеальный газ
Газ – это агрегатное состояние вещества, для которого характерна большая подвижность его частиц (большие длины пробега) и очень слабая связь между молекулами и атомами. В газообразном состоянии вещество не имеет определенной формы и объема. Любое вещество может быть переведено в газообразное состояние с помощью подбора необходимых параметров давления и температуры.
Идеальным называется газ, имеющий следующий набор свойств:
Определение внутренней энергии
Внутренняя энергия вещества U — это сумма потенциальной энергии взаимодействия молекул Eп, составляющих тело, и кинетической энергии их хаотического теплового движения Ek:
Для вычисления внутренней энергии газа Uг в формуле (1) можно пренебречь потенциальной составляющей энергии, то есть:
Полная кинетическая энергия вещества Е п к получается сложением энергий всех отдельных частиц:
где N — общее число частиц в газе.
Частица массой m, движущаяся со скоростью v, обладает кинетической энергии Ек, которую можно вычислить с помощью формулы, полученной в разделе механики:
Кинетическая энергия и температура
Эксперименты показывали, что чем горячее вещество, тем с большими скоростями (“энергичнее”) двигаются частицы вещества. Изобретение термометра и введение величины температуры T, позволило ученым не только наблюдать за тепловыми явлениями, связанными с изменением температуры (нагревом и охлаждением), но и проводить измерения, накапливать результаты экспериментов в таблицах, анализируя полученные данные для разных веществ.
Во всех приборах, придуманных в ХVIII веке, измерение температуры сводилось к измерению длины столбика ртути, спирта или воды. Но оказалось, что самыми точными оказались газовые термометры. Дело в том, что жидкостные термометры работали только в ограниченном интервале температур. Наполняющие их вещества замерзали и кипели, и поэтому нельзя было измерять очень высокие и очень низкие температуры. Поэтому газовый термометр до сих пор используется как эталонный для всех температур, достижимых в лабораториях.
Ранее было получено уравнение состояния идеального газа — соотношение между давлением p, объемом V и абсолютной температурой (по шкале Кельвина) T, названное в честь его авторов уравнением Клапейрона-Менделеева:
μ — молярная масса газа, R = 8,3157 джоуль/моль/градус — универсальная газовая постоянная.
Газовая постоянная R равна:
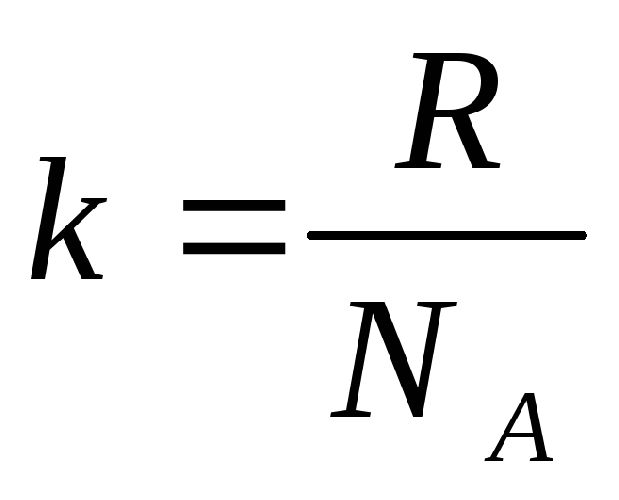
Тогда, из уравнений (4) и (5) получим выражение для давления идеального газа в виде:
В 1860 г. немецкий физик Рудольф Клаузиус получил для давления p одноатомного идеального газа следующую формулу, которую называют основным уравнением молекулярно-кинетической теории:
где: v 2 c = 2 >ср — среднее арифметическое квадратов скоростей молекул.
Из двух формул (6) и (7) для величины давления p получаем:
Разделив части уравнения (7) на n, и умножив обе части на 3/2, получим:
Левая часть уравнения (8) представляет собой величину средней кинетической энергии хаотического движения молекул (формула (3)). Таким образом:
Последняя формула (9) демонстрирует, что средняя кинетической энергия хаотического движения молекул идеального газа, а значит и его внутренняя энергия, пропорциональна его температуре T.
Что мы узнали?
Итак, мы узнали какие условия должны выполняться для того, чтобы газ был идеальным. Внутренняя энергия идеального газа равна сумме кинетических энергий всех молекул газа. Средняя кинетическая энергия молекул одноатомного идеального газа прямо пропорциональна абсолютной температуре T. На основании уравнений Менделеева-Клапейрона (4) и Клаузиуса (7) получена формула зависимости средней кинетической энергии (9) от температуры T газа.